Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


Ионофоры — хелатарующие агенты для щелочных металлов 253»
гическое определение способности к комплексообразованию в рас-
творителях с умеренной полярностью показало уменьшение селек-
тивности K
+
: Na+ у более высоких гомологов макротетралидных
!ктино'в (табл. 6.1) (ср. митохондриальный критерий в предыду-
цем разделе).
3.2. Энниатин
Энниатины относятся к группе циклических гексадепсипепти-
IOB, содержащих кольца из 18 атомов; их получают из некоторых
птаммов Fusarium [37, 38]. Входящая в их состав D-оксиизовале-
>иановая кислота чередуется с N-метил-L-аминокислотой. В со-
став энниатинов А, В и С входят аминокислоты изолейцин, валин
\ лейцин соответственно. Структура энниатина В показана на
зис. 6.1,5. Еще одна разновидность энниатина— боварицин, в со-
став которого входит аминокислота N-метилфснилаланин [39].
Так как энниатин содержит кольца небольшого размера, то
1ля его комплексов возможно лишь ограниченное число конфор-
маций. Пространственные модели показывают, что, когда карбо-
гильные труппы направлены внутрь, наблюдается хорошее соот-
ветствие между ионом K
+
и полостью, и такая структура для
комплекса с KI подтверждена рентгеноструктурным анализом
[40]. Шесть образующих связи атомов кислорода находятся на
расстоянии 2,6—2,8 А от K
+
и подразделяются на две триады, од-
ia из которых на 1,5 А выше, а вторая соответственно ниже сред-
гей плоскости кольца. «Верх и низ» этого дискообразного ком-
1лакса более четко выражены, чем в комплексах макротетралид-
шх актинов или валиномицина, но не настолько, чтобы был
юзможен тесный контакт между катионом и его противоионом.
'Ложно полагать, что анионы не дискретно расположены в крис-
таллической решетке.
Конформация энниатинов в растворе изучена более детально
летодами дисперсии оптического вращения, кругового дихроизма
I ядерного магнитного резонанса [41, 42]. Энниатин В постепенно
раскрывается, и его карбонильные группы выворачиваются нару-
ку по мере увеличения размеров катионов, входящих в ком-
1лекс. В этом отношении он обладает меньшей селективностью,
1ем более жесткая молекула валиномицина, хотя порядок селек-
ивности K
+
>Rb+>Cs+>Na+>>Li+, определенный разными ме-
юдами, остается таким же, как и для других типичных нейтраль-
1ых ионофоров [43, 44]*.
Одним из интересных представителей энниатинового ряда яв-
шется синтетический энантиоморф энниатина В. Это соединение
* Здесь речь идет, по-видимому, только о природных ионофорах. — Прим.
>ед.

254
i лава 2
обладает такой же активностью по отношению к бактериям и ми
тохондриям, как природное соединение [43, 45]. Это свидетель
ствует о том, что при взаимодействии этого ионофора с мембран
ной системой селективный рецептор может не включаться. При
родные рецепторы главным образом должны содержать оптическ
активные белковые компоненты, которые, как можно ожидать, от
личают компетентный триггер от его энантиоморфа.
3.3. Валиномицин
Брокманн [3] правильно определил, что валиномицин постра
ен из остатков D- и ь-валина, i.-лактата и О-изовалерата; однак
оп считал, что эта последовательность повторяется только дваж
ды. Впоследствии Шемякин и сотрудники показали, что эта после
довательность повторяется три раза с образованием додекадепеп
пептида [4] (рис. 6.1, В) и подтвердили это синтезом [5]. On
синтезировали обширный ряд аналогов валиномицина и показала
что даже небольшие изменения молекулы приводят к потере б но
логической активности, измеренной по интенсивности процеесог
происходящих в митохондриях, либо по их антибиотической а
к
тивности [5, 6, 9]. И увеличение, и уменьшение повторяющейс:
последовательности из четырех остатков приводит к потере ак
тивности, так же как и инверсия любого оптически активной
центра. Для того чтобы активность сохранилась, можно либ-i
только один оптически неактивный глицин заменить на валин, ли
б о произвести инверсию всех оптически 'активных центров. Рас-
крытие цикла приводит к потере активности, если даже концевьг
группы защищены формильной (свободный аминный конец) н.;п
этаноламидной (свободный карбоксильный конец) группами.
Исследование химических сдвигов в спектре ЯМР показалс
что каждой катионной комплексной частице .присуща своя уни
кальная конформация валиномицина, причем наибольшие изме
нения в спектре ЯМР наблюдаются в области поглощения коль
цевого остова [42, 46—50]. На основании соотношения межд;
константами спин-спинового взаимодействия протонов амидпы
групп с а-протонами валина и двугранным углом при амиджн
связи получено представление о трехмерной конформашш связан
ного в комплекс валиномицина. Методом ИК-спектроскопии по
казано, что карбонильные атомы кислорода сложноэфирных груш
связываются водородными связями с амидными протонами, пред
ставляя свободным карбонильным кислородам амидных груш
возможность образовывать координационные связи с катионом
Водородные связи создают упорядоченную вторичную структуру
в которой валиномициновый остов делает петлю и образует «брас
лет» высотой 4 А и диаметром 8 А [48]. Алкильные боковые цеш
направлены от граней «браслета», которые становятся аснммет

Ионофоры — хелатарующие агенты для щелочных металлов
255»
ич'ными из-за того, что все остатки молочной кислоты группиру-
)тся с одного конца «браслета». В комплексной структуре амид-
ые карбонилы обращены внутрь «браслета», но три на каждой
рани, дополняя ячейку вокруг находящегося в ней катиона. В не-
акомплексованной форме карбонилы обращены наружу от грани
ротивоположно остаткам молочной кислоты, открывая таким об-
|азом катиону путь внутрь ячейки. Часть водородных связей сво-
юдного валиномицина может разрываться, что приводит к по-
[влению некоторого количества молекул с еще более открытой
труктурой [42, 45]. Это заключение было подтверждено после-
дующим ЯМР-псследованием на спектрометре с еще более высо-
ким разрешением (220 МГц); зависящие от температуры химиче-
:кие сдвиги амидных протонов в слабое поле и их медленный
|бмен с D
2
O подтверждают образование водородных связей [49,
>0]. Результаты дальнейшего исследования методом ЯМР валино-
мицина, а также макролидных актинов энниатина В и дицикло-
ексил-18-короны-б приведены в диссертации Хайнеса [51].
По существу, такую же структуру ячейки получили независимо
уентгеноструктурным анализом комплекса валиномицина с хло-
>ауратом калия (KAuCl
4
) [52]. Это снова подтвердило справедли-
!ость положения о сохранении в растворе конформации, обнару-
кенной в твердом состоянии. Положение аниона внутри решетки
(етко установлено; следовательно, анион строго ориентирован от-
юсительно комплекса ионофора (ср. нонактин). Основные
'частвующие в связывании карбонильные атомы кислорода нахо-
[ятся на расстоянии 2,7—2,8 А от катиона (от центра до центра),
s то !Время как карбонильные атомы кислорода, связанные водо-
юдными связями, находятся иногда значительно дальше от ка-
:иова.
Метод ядерного магнитного резонанса дает также информацию
> динамике комплексообразования. Дублетный сигнал метальных
•рупп молочной кислоты валиномицина особенно отчетлив и иде-
1льно подходит для измерения химических сдвигов и анализа
|зорм линий в процессе титрования катиона, на основании чего
ложно получить данные о скорости обмена катион — ионофор.
3 растворителе с низкой диэлектрической проницаемостью, CDCl
3
,
скорость обмена лишь едва измерима; это указывает, по-видимо-
лу, на отсутствие диссоциации комплекса внутри липидной мем-
браны, которая характеризуется низкой диэлектрической нрони-
!аемостью. Повышение диэлектрической проницаемости посредст-
юм постепенного добавления CD
3
OD приводит к измеримому уве-
шченшо скорости обмена, что согласуется с легкой диссоциацией
комплекса на внешней стороне мембраны в областях с высокой
шэлектрической проницаемостью [46]. Так как внутрпмолеку-
шрные водородные связи придают жесткость ячейке валиноми-
шиа, специально приспособленной для K
+
, ее трудно сжать до

256
i лава 2
размера Na+. Поэтому К+ : ^-^-избирательность валиномицина п
всем критериям является самой большой среди всех известны
ионофоров [8—15, 41—44].
3.4. Грамицидин
Грамицидины — это линейные пентадекапептиды, продуцируе
мые штаммом В. brevis [53]. Возможны структурные варианты
в начале цепи — валин или изолейцин, а фенилаланин, тирози
или триптофан на двенадцатом месте в цепи, состоящей из 15 ос
татков [29]. Наблюдается также типичное для многих ионофоро
чередование D- и Ь-конфигураций, концевые группы блокируют^
H О
I Il
формильной (R—N—CH
2
OH) или зтаноламидной (R—С—NIl-
—CH
2
—CH
2
OH) группами. Точная конформация молекулы не ус
тановлена, хотя известна ее склонность к димеризации [29]. Хот
грамицидин похож на описанные выше ионофоры по структуре
влиянию на мембраны, он не образует легко обнаруживаемы
липидорастворимых комплексов и может и не выполнять функци:
истинного подвижного «ионофороподобного» носителя. Осущест
влен синтез грамицидинов [29].
Иногда возникает путаница между выше описанными грами
цидинами «Дюбо» [53] и грамицидином S [54], который являете:
циклическим основным декапептидом, продуцируемым друпп
штаммом В. brevis. Грамицидин S, который по структуре такж<
родствен тироцидину [55], нарушает окислительное фосфорилиро
ванне в митохондриях, так же как и другие ионофоры, хотя это
эффект не зависит от ионов. В грамицидине S внутри молекул!
образуется большое число водородных связей, так что не происхо
дит раскрытие цикла, необходимое для полилигандного комплек
сообразования [50]. Грамицидин содержит также основные орни
тиновые остатки, которые придают молекуле положительный за
ряд, тем самым препятствуя комллексообразованию с катионо?
вследствие электростатического отталкивания. Таким образом
нарушающие обмен в митохондриях свойства этой молекулы, по
видимому, обусловлены ее поверхностной активностью. Тироциди
ны А, В и С, очищенные методом противоточного диализа, не толь
ко не вызывают вхождения иона в митохондрии, а даже наруша
ют этот процесс. Однако промышленный тироцидин не обладае
ионофорной активностью, главным образом из-за загрязнения гра
мицидином, который одновременно продуцируется теми же самы
ми организмами. Возможно, этим объясняются сообщения об ин
дуцируемом тироцидином транспорте'через мембраны [56].
Ионофоры — хелатирующие агенты для щелочных металлов 257
3.5. Полициклические эфиры
Ионофоры этого ряда получены Педерсеном конденсацией
шоксиэтилена с резорцином и его производными с последующим
кипячением со щелочью [30, 57, 58]. Наиболее доступный предста-
штель этого 'ряда, дибензо-18-корона-6, получается с высоким вы-
;одом при проведении конденсации в присутствии КОН; если вме-
сто едкого кали использовать NaOH, получают много побочных про-
ектов. Ароматические короны (краун-эфиры) умеренно раствори-
мы как в водных, так и в органических растворителях и их эффектив-
ность как ионофоров увеличивается при гидрировании ненасыщен-
ных колец. При этом образуется ряд геометрических изомеров,
iea из которых составляют основную часть неочищенной дицнк-
Ю'гексил-18-короны-Б (рис. 6.1, Г). Полиэфиры типа корон наибо-
тее интересны тем, что у химика появляется возможность синте-
шровать различные полиэфиры, размер кольца у которых систе-
матически изменяется. Таким образом, ионную селективность
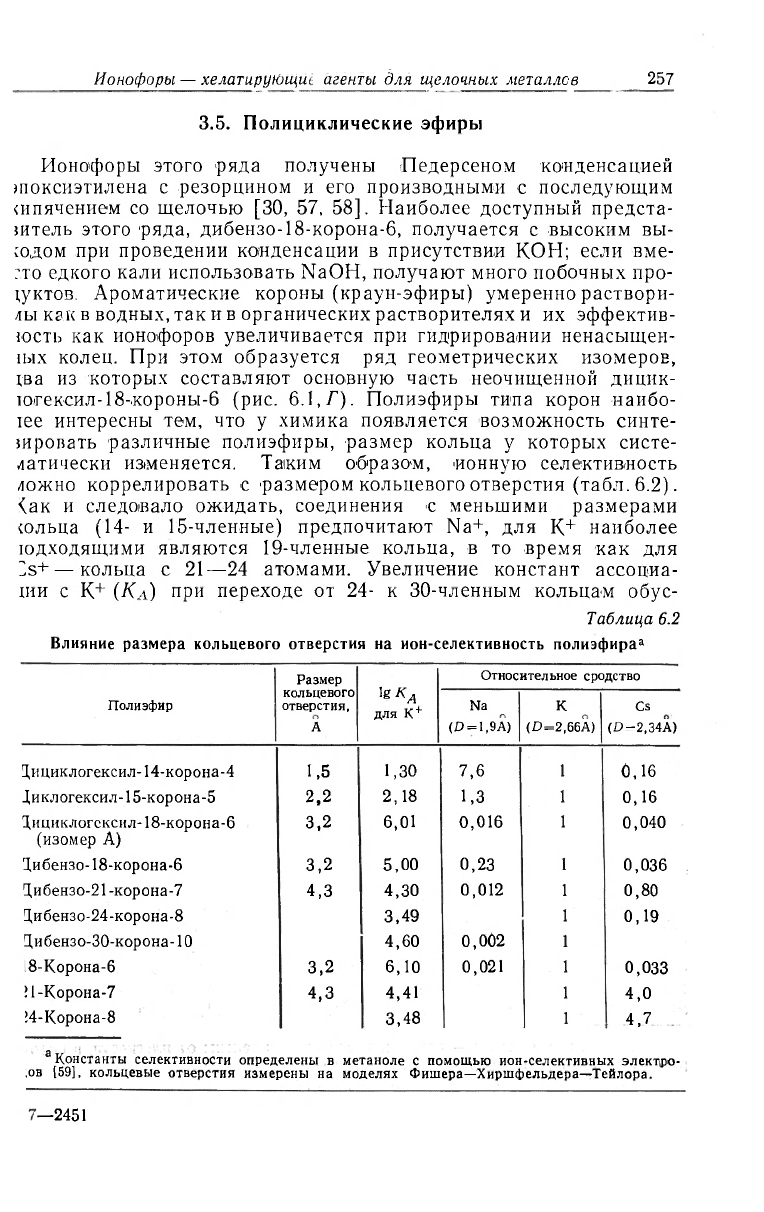
ложно коррелировать с размером кольцевого отверстия (табл. 6.2).
<нк и следовало ожидать, соединения с меньшими размерами
сольца (14- и 15-членные) предпочитают Na+, для К+ наиболее
юдходящими являются 19-членные кольца, в то время как для
^s+ — кольца с 21—24 атомами. Увеличение констант ассоциа-
ции с К+ (Кл) при переходе от 24- к 30-членным кольцам обус-
Таблица 6.2
Влияние размера кольцевого отверстия на ион-селективность полиэфира
а
Размер
Ig K
a
для K
+
"
Относительное сродство
Полиэфир
кольцевого
отверстия,
Ig K
a
для K
+
"
Na
К
Cs
А
Ig K
a
для K
+
"
(£> = 1,9А)
(D=2,66A)
(D—2.34A)
3,ициклогексил- 14-корона-4
1,5
1,30
7,6
1
0,16
Диклогексил-15-корона-5
2,2 2,18
1,3
1
0,16
Дициклогсксил-18-корона-6
(изомер А)
3,2
6,01 0,016
1
0,040
Дибензо-18-корона-6
3,2
5,00
0,23
1
0,036
1ибензо-21 -корона-7
4,3
4,30
0,012
1
0,80
3,ибензо-24-корона-8
3,49
1
0,19
Цибензо-30-корона-Ю 4,60
0,002
1
8-Корона-6
3,2
6,10
0,021 1
0,033
!1-Корона-7
4,3
4,41 1
4,0
!4-Корона-8
3,48 1
4,7
а
Константы селективности определены в метаноле с помощью ион-селективных электро-
,ов (59], кольцевые отверстия измерены на моделях Фишера—Хиршфельдера—Тейлора.
8—2451

258
i лава 2
ловлено главным образом тем, что последние скручиваются и ил
легче принять более сферическую конформацию [59].
Дициклогексил-18-корона-6 достаточно растворима в воде дл5
того, чтобы комплексообразование можно было исследовать ли б с
с помощью ион-селективных электродов [59], либо калориметр,и
чески [60]. При прочих равных условиях комплексообразование i
10 000 раз эффективнее в метаноле, чем в воде, по-видимому
вследствие того, что ионофору трудно вытеснить воду из гидрат
ной оболочки катиона [60]. Дициклогексил-18-корона-6 образуе-
комплексы состава 2 : 1 и 3 : 2 с Cs+ и Rb+ [58].
Проведен рентгеноструктурный анализ кристаллических ком
плексов дибензо- 18-короны-б с Rb+ и Na+, а также свободиоп
ионофора. Катионы находятся в одной плоскости с атомами кис
лорода* (ср. с энниатином). Расстояния Rb—О и Na—О состав
ляют 2,86—2,93 и 2,74—2,89 А соответственно. Открытая структур;
этих ионофорных комплексов становится очевидной на оспоианш
того, что анион SCN
-
находится на расстоянии вандерваальсов;
радиуса от Rb (расстояние Rb—N 2,94 А), т. е. образует ионнук
пару, в то время как расстояние Na—-N заметно больше 3,32 А
Конформация свободного ионофора в решетке менее симметрична
чем конформация связанного в комплекс ионофора [61, 62]
Спектр протонного магнитного резонанса раствора, по крайне!
мере при 60 МГц, недостаточно разрешен для того, чтобы на еп
основании можно было провести простой информационный ана
лиз [51].
Криптанды** относятся к синтетическим полиэфирам, содержа
щим азот, например N(—С—С—О—С—С—О—С—C)
3
N [63]. Эт<
довольно широкий набор 'комплексующих агентов, однако, по
скольку их полярность слишком велика, чтобы они могли входит
в липиды, их нельзя полностью отождествлять с мембранным]
ионофорами. Рентгеноструктурный анализ комплекса RbSCN
упомянутым выше соединением показывает, что расстояние Rb—С
составляет 2,9 А и что атомы азота также находятся в контакт-
со связанным в комплекс катионом (Rb—N 3,00 А) [64].
3.6. Другие соединения
Циклический декапептид антаманид, выделенный из гриб;
Amanita phalloid.es [65], действует как антидот против сопутству
ющего ему токсического олигопептида фаллоидина. Антамани,
образует липидорастворимые комплексы с катионами щелочны
металлов (причем предпочитает натрий калию) и промотируе
активный перенос К+ в митохондриях [11, 66]. Он весь состой
* Это не совсем точно — катионы несколько отклонены от плоскости, в коте
рой лежат атомы кислорода короны. — Прим. ред.
** Автор называет их «dentates». — Прим. ред.

Ионофоры — хелатирцющие агенты для щелочных металлов 259
з остатков с L-конфигурациями; однако четыре пролиновых
•татка могут значительно искривить кольцо, оптимально фоку-
1руя карбонильные группы для участия в ком и лексо о б
р
а з о в а нии,
из-за этого отпадает потребность в D-конфигурации.
Аламетицин — другой полностью состоящий из ь-конфигура-
ий циклический полипептид, продуцируемый Trichoderma [67].
емь из 17 его остатков состоят из необычной аминокислоты —
-аминоизомасляной кислоты. Семнадцать остатков образуют
эльцо, а один остаток глутаминовой кислоты со свободной кар-
оксильной группой подвешен к кольцу [68]. Хотя по способности
гимулировать вхождение ионов в 'митохондрии аламетицин ведет
гбя подобно типичным ионофорам и образует липидораствори-
ые катионные комплексы [18], он имеет отличительные электро-
етрические свойства. Аламетицин, как и другие антибиотики ти-
а валиномицина, индуцирует катионный ток в двухслойных ли-
идных мембранах. Однако в том случае, когда потенциал превы-
1ает критический пороговый уровень, начальное сопротивление
[смбраны падает до более низкого значения; это явление анало-
ично поведению возбудимых мембран нервов и -мускулов [69,
0]. Аналогичным образом ведет себя моназомицин, но в этом
лучае сопротивление мембраны возрастает с повышением транС-
•ембранного потенциала [69, 70]. Моназомицин также стимулиру-
т транспорт ионов в митохондриях [16], однако он не солюби-
;изирует ионы щелочных металлов в толуоле [71] и поэтому его
[ельзя классифицировать как истинный ионофор. Молекулярная
iacca моназомицина 1050—1200, он содержит 20 атомов кислоро-
Ia и один основной атом азота; его точная структура в настоящее
фемя не известна. Но, возможно, он относится к антибиотикам
юлиенового ряда [72]. Антибиотик LL-491 (мол. масса 1500)
72а] по активности похож на моназомицин, но по отношению к
/штохондриям его активность составляет всего около 20% от ш-
-ивности моназомицина [71].
Монамицины [73] — группа циклических октадекапептидов с
!ередующимися D- и L-конфигурациями в кольце. Несколько ами-
юкислот являются производными пиперидазина или хлорпипе-
зидазина [74]. Они образуют комплексы с K
+
[75] и переносят
-юны через липидные двойные слои, следовательно, являются на-
стоящими ионофорами. Как и в случае аламетицина и моназоми-
дина, вольт-амперные характеристики проводимости липидных
двойных слоев не линейны и резко изменяются с изменением по-
тенциала [75].
3.7. Катионная селективность
Для оценки катионной селективности ионофоров типа валино-
мицина было использовано несколько критериев, например:
1) зависимость нарушения окислительного фосфорилирования в
17*

260
i лава 2
митохондриях от катиона; 2) проводимость двойных липидны
слоев; 3) биионные потенциалы, возникающие в двойном лини;
ном слое при разделении различных катионных частиц; 4) OIK
собность образовывать липидорастворимые комплексы в двухфа:
ных системах органический растворитель — вода; 5) прямое TIR
рование ионофора в одном !растворителе, используя некоторы
Cs Rb К Na Ll
6
Ul
Ut
Ul
и
ПП
Рис. 6.2. Селективность валиномицина, измере!
ная различными методами [461.
Шкалы рис. 6.2 и 6.3 логарифмические, значение с
лективности для наиболее предпочитаемого иона обозп
чено значением 2, так что различие между двумя кати
нами на I означает, что их селективности отличают)
в 10 раз. а — анализ дыхания; о — биионный потенции
в — электропроводность; г — комплексообразованис.
S
физические измерения в качестве индикатора. Как ранее указыва
лось, комплвксообразование с грамицидином и моназомиципок
трудно обнаружить, так как, например, критерий (4) для этих ее
единений применить нельзя. Критерий (4) можно оценить двум
способами: прямым измерением миграции комплексообразующсг
катиона в органическую фазу [1, 10, 18, 46] и косвенно — измерс
нием концентрации анионов, сопутствующих катиону, наприме
SCN
-
[10] или пикрат-аниона [76]. Некоторые методы использс
вались для титрования ионофоров с катионами в однофазной си
стеме с применением ион-селективных электродов [59], осмомет
рии [44], электропроводности [41, 42, 51] и ЯМР [33, 42, 51]
Ионная селективность валино-мицина, оцененная по нескольки!
критериям, показана на рис. 6.2. Можно видеть, что все метод1
обнаруживают очень сходную картину разделения ионов.
Нейтральные ионофоры, согласно всем критериям, обнаружи
вают обычный ряд селективности: K
+
-Rb
+
>Cs+>Na+>Li
4
Степень избирательности весьма различна; биологическая оцени
по соответствующему отношению K
+
: Na+ изменяется от 10 000 :
для валиномицина, 25 : 1 для актинов и энниатинов и близка к
для грамицидина [критерий (1)] [43]. Внутри каждого ряда ионе
форов-аналогов наблюдаются заметные отклонения, которые за
висят от природы растворителя.
Так как карбоксилсодержащие ионофоры обычно электрическ!
никак себя не проявляют, критерии (2) и (3) нельзя использоват

Ионофоры — хелатарующие агенты для щелочных металлов
261»
цля их оценки. Они вызывают эндогенное выделение K
+
в обмен
на H
+
в митохондриях, что можно использовать для измерения
их динамической способности переносить K
+
через мембраны; од-
нако такого рода измерения нельзя просто распространить на дру-
гие ионы. Вместо нарушения процессов в митохондриях, как это
делают ионофоры типа валиномицина, «арбоксилсодержащие
К
ъ
для
комплексообразо-
Cs RB К NQ Li вония с K
+
мМ
2,8
U9
0,80
0,09
38
В.З
Рис. 6.3. Селективность различных ионофоров, изученная методом двухфазной
экстракции [18].
ионофоры ингибируют дыхание в (Митохондриях, очевидно, косвен-
ным образом препятствуя вхождению субстрата. Ингибирование
можно предотвратить, обеспечив !Высокий экстрамитохондриаль-
ный уровень K
+
[23]. Равновесие комплексообразования с этими
ионофорами можно изучать методом двухфазной экстракции. Ре-
зультаты такого исследования (рис. 6.3) показывают, что, несмот-
ря на структурное сходство, карбоксилсодержащие ионофоры про-
являют гораздо более широкий диапазон селективностей по срав-
нению с родственными им ионофорами типа валиномицина [10,
18, 46].
Ионофоры могут образовывать комплексы и с другими ионами
подходящего диаметра и заряда, однако имеющиеся о них дан-
ные отрывочны. Согласно критерию митохоядриальяого взаимо-
действия, NH4 связывается валиномицином и энниатином яесколь-
Ионный радиус, А
2
Х-537Д
(589)
О
Валиномицин
2
(1110)
0
X-206
2
(841)
О
Нигерицин
2
(736)
О
Моненсин
2
(670)
О
Дианмицин
2
(956)
1Л6 0,95
1,69 1,33 0,60
Illi]
^Fl •,
kll.
лЬ
-•I
Utl

262
i лава 2
•ко менее эффективно, чем Cs+, а актинами иногда более эффек-
тивно, чем К+ [76]. Возможно, это обусловлено наличием других
мостиковых атомов кислорода, образующих водородные связи с
NH4; такого взаимодействия с ионами металлов нет. О комплек-
сообразовании Tl+ [76] и Ag+ [59] с актинами и полиэфирам*
также сообщалось, и это не удивительно с точки зрения близости
их атомных* радиусов и зарядов к зарядам и радиусам ионов ще-
лочных металлов.
4. КАРБОКСИЛАТНЫЕ ИОНОФОРЫ
Хотя нейтральные ионофоры подразделяются на «ссколькс
различных групп, известные структуры карбоксильных ионофороЕ
близки по характеру. Ковалентные структуры моненсина, пигери-
цина, Х-537А и гризориксина характеризуются наличием цепей
содержащих эфирные атомы кислорода в пяти- или шестнчлсн
ных гетероциклических кольцах; в остове бывают и дополнитель-
ные атомы кислорода. Единственная карбоксильная группа с од-
ного конца цепи посредством водородной связи образует кольце
с одной или двумя гидроксильньгми группами на противополож-
ном конце молекулы.
Первым карбоксильным ионофором, структура которого была
установлена, был моненсин (рис. 6.1,Д), выделенный из штамме
Streptomyces [77]. Рентгеноструктурный анализ его серебряно!
соли показал, что шесть атомов кислорода связаны ион-диполь-
ным взаимодействием с .катионом и находятся от него на расстоя
ниях 2,40—2,68 А. Однако карбоксилатные атомы кислорода не
являются сильными лигандными группами, так как они находятся
от катиона на расстоянии 3,8 А. Кольцо, состоящее из 22 атомов
вокруг катиона уложено нерегулярно, но с приблизительным со
блюдением плоского расположения [78, 79]. Моненсин обладает
умеренной селективностью, предпочитая ионы Na+ ионам К+ в от-
ношении 10 : 1 [10, 18].
Серебряная соль нигерицина (рис. 6.1, E) [20] содержит
24-членное кольцо. Два атома кислорода, соответствующие ион
дипольным лигандным группам моненсина, заменены карбокси-
латным атомом кислорода, который теперь входит в координа-
ционную сферу катиона (Ag—О 2,25 А) и образует сильную ион-
ную связь. Четыре лиганда, образующих ион-дипольные СВЯЗЕ
(Ag—О 2,45—2,69 А), и карбоксилатный кислород образуют пятн-
членную координационную ячейку иона серебра [80, 81]. Сродст
во нигерицина к К+ в 400 раз сильнее, чем моненсина, хотя изве-
стно, что их структуры почти идентичны. Структура гризориксина
* Точнее ионных радиусов. — Прим. ред.
