Есин О.А., Гельд П.В. Физическая химия пирометаллургических процессов. Часть 2
Подождите немного. Документ загружается.


ве]1ичинь|
в!{а мо)кно
вь1числить
и3 термодинамическ|{х
дан-
}!ых'
условно
приняв
в3 3а
нуль. Результатьт
таких
расчетов
[41]
для
ряда
металлов
приведень|
в
та6л. 47.,[|,ля
оценки по-
тенциала
е3
использовано
вь1рах(ение
для
константь!
равно-
весия
реакции
обессеривания.
| аблцца'
47
оР1ентировочннй
Рлд
н!пРя'(.н'я
дл'
шп!:сов прх
{500о с х
е]
_о
''\:::"'
0м{
.
электродный
процесс
Реакцяя
2(а|62:)(6@
2&9{Фд:2/т19Ф
1/аА1+о2:2/3А12о3
т!+о,:т1о2
51+о2:5!о2
4
/
311\Ф2:2
/
3\;/ 2Ф3
2}1п{Ф':!$д9
'/3€г{Ф':а/3€г2@3
2Ре
-|Ф':2р69
\
,(}{п@1Ф':2мп'9,
4РеФфФ2:!|'6'@'
о15"1*52_:9:-45(ге)
са2**2е:са
/т192+-р2е:м9
д1з*.г3е:А1
11+*-р4е:1|
51+*4+е__5!
у3*.13е:!
!!1п2+12е:мп
613*-р3е:€г
Ре2*+2е:Ре
цд3*19:щп2*
р93*.19:ре2*
51г"1*2е:52_
*206070
*181490
-178956
*144098
*130845
-128948
-121210
--105356
-72829
-30570
-28956
-8345
-2,23
-1,98
-1
,94
-1
,56
-1
,41
-1
,40
-1
,31
-1,14
-0,79
-0,33
-0,31
-0,18
6
помощью этой таблиць: мо}кно
предска3ать
3начения
электродвижущих
сил
элементов' основаннь1х
на
протекании
тех
или
иных
металлургических
реа,кций.
Ёапример,
для
$|++€г2Ф':з1о!+*-.,
2,|\4п
*
}сг'о':
2.]!1пФ
*
*-',
находим
2Ре*3сг'Ф':2РеФ+{с.
Ё3,;".: е3.
_
е3:
*
_
1,14
+
1
'4!
-0,2,7
в,
-0оо
Ёйп,сг
:
8ёг
_
0й':
-
1,14
:0,|7
в,
Ё|"тс,
-
'3,
_-
в$"
:
-
1,14
1
0,79
:0,35
в,
11о
что
удовлетворительно
сог''|асуется
с
рениями
[42],
согласно
которь]м
:
0,145
в и
Ё3":с,
:
-0,34
в.
непосредственнь1ми
изме-
Ё3,"'^:
0,27
в;
Ё&',/с,
:
3то
позволяет'
измеряя
электродвих(ущие
силь1
соответст_
"уйй'
ц.пей,
нахойи
"',
^2"
и
константь1
гав191-9111
рега#1ий'
Б частности'
для
прямого
восстановления
)кидкой
Рб9
[{3]
-
сств:
*
РбФсх<)
:
Рб<ж)
$
6Ф1газт
измеренная
при
1150"€
величина
8с,рь:0,81
в,
что
отвечает
^2'
2
_-37
3ф
кал'
в то
'время
как
по
термохимическим
дан_
||ь|ш
'^2о
=
--37
452
кал'
Аналогично
для
процесса
[42.|
6с'"1
*РеФ1*1
:Р€1тв1
{€Ф1"аз)
при
1380'€
опь:тное
3начение
Ёс,ге:0,51
6,.
|'
9'.
^*1'
:
!
эзвуз
кал,
а по
термохимическим
расчетам
А'7
:24086кал
(или €с,
те
:
0,52
6).
'
@тмётим'
что
в
последнее
время-кислоролнъту
ряд
напря-
*.",*
!'"
о*'с'''
бьтл
постр'оен
т.
Реннером
[44]'
|{пшотина
""аътЁ::;г""
петаппа
||релварительньте
3 а
м еч
аъ\ця
|1реимушестваи.оннойтеориивь1ступаютособеннонагляд.
но при
рассмотрен11и
таких
явлений,
которь1е
не
в состоянии
объясни}ь
молейулярная
гипоте3а.
1(
ним
относятся'
например'
хорошая
электропроводшость
>кидких
1шлаков'
электроли3
их'
суйествование
скачка
потенциала
на
границе
металл
_
1шлак'
электрокапиллярнь1е
явления
и специальная
форма
3аконов
равновесия
(зайена
активности
соединения
прои3ведением
!й'""''...й'епо
ионов)'
Аналогичных
явлений
следует
ох{и_
дать
и
в области
кинетики
взаимодействия
металла
со
1пла-
ком.
.
-
йр"
определеннь1х
условиях
интенсивность
взаим:|:1']'""
мо}кет'
как
и3вестно'
лимитироваться
скоростью
какой_либо
'!*'и
и3
его стадий.
Различие
мех(ду
ионной
теорией
и
моле-
кулярной
в
вопросах
кинетики
мо)кно
показать'
например'
для
ёлучая'
когда
определяющим
скор_ость
процессом
являет_
ся переход
границь|
металл
-
шлак
[45]'
Б самом
деле'
по
молекулярной
гийотезе
ме)кду
этими
фа_
3ам|{
происходит'обмён
не3аря)кенными
частицами'
пикакнх
доп,олнительньтх
полей'
кроме
адсорбционного'
на
границе
ме_
А!1

талл
-
1плак
мох(но
при
этом
не
учить1вать.
Более
того.
если
вещества'
участвующие
в
переходе,
образуют
разба''-",,'*
растворь|,
то
скорости
процессов
прямо
пропорйиональны
их
концентрациям
в соответству|Ф1{их
фазах.
папротив'
согласно
ионной
теории'
через
границу
раздела
перемещаются
3аря)|(еннь{е
частицьт.
Ёапример,
прй
."ьшора-
нии
углерода'
кремния
и
фо3ф9ра
и3
тллака
в
металл
пе0ехо-
дят
ионь!
кислорода'
]ри
десульфурации
в
обратном
,'Ёр',-
лении
-
1ионьт
,39!Б1,
[п!:и
раскислени|и
и лепирова'н,ии
_
ио!нь|
:3'тФА}1йФ|:Ф
элемонта
и т.
п.
8о
всех
э'тих
случаях
:н}){{нФ
}ни-
тьт1вать'
что,
в
,металле
и
1!]лаке
:||'ФяБ.|!9}Ф1,€я
йзбьтточнй-''р"-
АБ|'
а
'\1^
гра'нице
фаз
8Ф3:Ё.1{(2ё}
скач,ок
электрического
потенциала.
|1оследний
бьтстро
прекратил
бьт
подобнь:е
переходь1'
если
бьт нар.яду
с
ними
^|!
1|:отёка'й
--йр'ц...,,,
ликвт4д\4ру10щие
дальнейшее
накопление
зарядов.
(
Ёим
относятся'
в
частности'
переходь1
ионов }келе3а
из
шлака
в
металл
и
оора"нБ,
йБЁ.',_
новление
ион|ов
трехвалентного
'(еле3а
до
двухвалентного'
перемещение
ионов
кисл1орода
из
металла
в 11]лаки
другие.
8
результате
эт9г9_ф!"{й,..1й1ф..""',':ци*ёй
макро_
скопический
пр
оцесс
пр едставляет
собой
й".;й;ъ;йй{'й
*'*
стадий.
|1ри
этом
возмох(нь1
следующие
комбинации:
---__1)
одновременньтй
переход
катионов
и
анионов
в
одинако-
вь|х
направлениях'
например'
г.<'*:
*
2е
-,
Р€1мет1
Фй,._
2е
*
Фс"е':.
Р.с',*:
*
о&":
-+
Р€1мет1{
Ф1мет),
же'
анионов
в
ра3личнь1х
направлениях:
51*".1
*
2е
_*
5|[,1
Фйл
*Ф1"''1$
2з
51"."1*
Ф&_,л
*
5&;:
+
Ф1мет1,
(у'
56)
3)
то х(е'
катионов
в
противополо)кнь]х
направлениях:
}1[смет)
-
2е
-,
}'!,,',*,
Р.,'',1,
*
2е
_.'Р€1мет1
}111(мет)
*
Ре|,*,:_*
!!1п|,*1
{
Ре1мет1.
(у'
55)
2)
то
|д2
(у'
57)
д!|
4) оонетание актов
восстановления
трехвалентн'ого
х(елеза
переходом
анионов:
2Ре[$,1
*
2е
-'
2Ре12,}1
о&",
-
2е
-->
06ет,1
2Ре13"|1
*
2е*2геЁ]">
}1!1мет1
-
2е
*!!1'|*,
2Ре13*л
{
}1|11мет)
_'
2Ре12$1
*]!1п&*л,
(у'
59)
6)
реакция
вь1горания
углерода:
€1"е')
*
о&":
-
)е
+
(Ф6аз,1
г.,'*,
*
2е
'Р€1мет1
€к.,"')
*
о&;:
+
Р.|,*":
_+
€Ф(,а.)
}
Ре1мет)
и
другие
сло}кнь1е
взаимодействия.
Ёаличие
в
одном
процессе
двух
ука3аннь1х
стадий
и
суше-
ствование
на
границе
ра3дела
фаз
сканка
электрического
по_
тенциала'
ока3ь]вающего
существенное
вл14яну1е на
скорость
протекания
этих
стадий, накладьтвают
особьтй
отпечаток
на
форму
кинетических
уравнений,
делая
ее несколько
отличной
от
таковой
для
перех|ода незарях{еннь|х
частиц.
@становимся
подробнее на
рассмотренп11
лит11ь
одного и3
перечисленнь|х
случаев'
так
как
разбор
остальнь]х
полностью
аналогичен.
Рассмотрим
сочетание
(!,60),1.
€.
несколько
ос-
ло>кненньтй
переход
ионов >1(елеза
и
кислорода.
?акой вьтбор
обусловлен
наличием
экспериментального
материала'
с кото-
рь!м
по3днее
буАет
проведено
сравнение
полученнь|х
3аконо_
мерн|остей.
|1ример,
приводив1пийся
ъ первом
изда|1|4и
этой книги'
а.именно
переход
серь1
и
кислорода в
различнь1х
направлениях
[45.|'
оказался
менее
уда.чнь1м'
так как
более
по3дние
экспери-
менть1
не
подтвердили
(см.
[46]),
нто
реакция
(у,56)
в
мало-
углеродистом
х(еле3е
протекает
в чисто
кинетическом
ре}киме'
5) то
>ке,
с
(у'
58)
(у'
60)
/

Бь:вод
кинетнческого
ур
авнения
|[усть
ионьт
Р#+ переходят
и3
металла
в 1плак'
а
дальней-
!шее
накопление
3арядо,в в
обеих
фазах
и
увеличение
скачка
потенциала
на их границе
устраняется
обратнБ:м
перемещени_
ем
ионов кислорода с
последуюшнм
образованием
€Ф.
1ак
как пр,оцесс
развивается'
то
равн|овеснь|е
потенциаль!
этих
стади\
",,'
'"
8р,
т1:
€;ФФ18етствующие
активностпям
а;
|еа-
гентов в обеих
фазах,
еще не
достигнуть|.
Фни
могут
_
бь:ть
представлень1
уравнениями:
8р'1
:е!'т*#'"*,
8',т]
:
е!,п
*
$
т"
-!в-
,
ос.
ао2_
в
которых
е!'
1
и
е$'::
-
стандартные
потенциаль1.
Б
ках<дь:й
даннй:й
момент
пРоцесса
'на
границе
раздела
фаз устанавливается
какой-то
один потенциай
е. о;
отли_
чается
от
равновеснь|х
(у'
61)
(у'
62)
€:8р'1
_ц1:ер,тт*|]тт
(у.'
63)
на
величинь|
т|1
и т]ц.
||оследние
в3ять1
с
ра3нь]ми
3наками
потому'
что
для
на_
правленного
перехода
ионов'Ре2+
из |шлака
в металл
ну>кЁо
умень!пить
потенциал
по сравнению
с
равновеснь|м.
Ат+аче
говоря'
следует
понизить
плотн|ость
полох{ительного
3аряда
в
металлической
обкладке
двойного
слоя. Ёапротив,
длй
пе-
рехода
ионов
кислор'ода
из ]плака
в
металл
необходимо
по_
вь|1|]ение
потенциала.
над
равновеснь|м'
т.
е.
увеличение
плот_
ности
поло)кительного
заряда
на
металле
!ри
установив1пемся
макроскопическом
процессе
непре_
рь1вное
накопление
3арядов
отсутствует.
14оньт,
двих(ущиеся
бьтстрее,
ускоряют
перемещение
двих{ущ|1хся
медленно,
а
по-
следние
тормозят
двих(ение
первь|х.
|1оэтому
скорости
перехо-
да
и|онов х(елеза
и
кислор,ода
в
ках<дьтй
даннь:й
момент
равнь|
друг
другу:
о
:
о\: о1\.
(у'
64)
/[атематическое
вь1рах{ение
скорости
подобнь:х
переходов
получено
в электрохимии
сравнительно
давно
и
с
успехом
при-
менено
к
анализу
сходнь1х
пр.оцессов'
а
именно'
к
растворению
натрия
из амальгамьт
и вообще
к корро3ии
металлов
и
спла_
вов
воднь|ми
агрессивнь1ми
средамут[47:
!8].
Босп,ользовав1|]ись
этими вь!рах(ениями' получим
для
рас_
сматриваемь|х
процессов:
о
:
!!:
*т,т(Р.'+)
.*р
{-
&#
2Р
'ат'т}_
-
Ёт,э[Ре]
.
ехр
{',';;
.'.
2Р.'х,э\
(у'65)
11
0:о|1:
&тт'э|с](о'?1 *,
{!чР
.2Р .атт,,а}_
_
&тт'т.
Рсо
ехР
{_-=#".)
.
2Р
.
а11'л\.
(у'66)
3десь
[Ре]
и
{с]--
атомнь|е
доли
,{елеза
и
углерода
в
ме-
талле;
(Реэ+;
и
(о2-)
_
концентрации ионов Ре2_|' и
Ф2-
в
!плаке;
Рсо
-
парциальное
давление
€Ф; с'
-
п,остоя1{нь1е ко-
эффишиенть|' 3ависящие от соотно1шения энергий
взаимодейст-
впя
данной
частиць| с о6еими
фазами
(тоннее
формьл
потен-
циаль};ь]х
кривь1х
в точке их
пересечения),
причем согласно
вь1воду
ст,:
*&т,2:1
и
с1,1
*атт,э:|,
(у'
67)
&а,
т
|4
Ёс,э-
константь| скоростей прямой
и
обратной
реакции.
@ни включают
в себя энергию
активации
соответствующе-
го акта
Ёа,]:Ё!,1ехр
{_+}
(у'
68)
||оскольку
переход
осуществляется частицами'
находящи-
мися на
границе
ра3дела фаз,
постольку
он
определяется
пре)кде
всего
их
концентрациями
в адсорбционном
слое.
1ак
как обьтчно,содерх{ание
углерода
и кислорода в
стали
и
ионов
Ф2_ в кисль1х
1плаках не очень
велико'
то мо>|(но
считать'
нто
адсорбционньтй
слой по отно[пению к
ним
далек
от
нась|щения. йначе говоря' концентрации
этих веществ
в
нем
прямо
пропор,циональнь1
объемньтм концентрациям.
(о-
эффициентьт
пропорциональности
включень|
в велининьт
Ё;,
''.
9тобьт
найти
явньтй вид
зависимости
с;
от состава
и
темпе-
ратурь|'
необходцмо в
уравнениях
(!'65)_
и
(!,66)
.искл]очить
8Р,1,
8р,
тт,
1|т
!!
цтт.
||одставим
'сначала
в
формулу
(!,65)
зна-
чение
8р,
1
!|3 вь!ра}кения
(у'61).
|1ри
этом
активности
3аменим

прои3ведениями
концентрац|1|1 ъ|а
коэффициент
активности'
например'
4р92|
-
тве2+
.
(Р"'+).
(у,
69}
1огда,
учить]вая'
91Ф
ц:0
при 0:0,
после
ряда
преобра-
зований
находим
0:!!:
Ёт[Ре]'т,:
.
(Р""'''
х
г с2Р'с1,
)
(
2Р\т
)1
х
[ехр
{
-Ё
.
",',
)-
ехр
{-
Ё
.
"'")].
3десь
Ёт:Ёт,т.
А"|'|}
А:{}.
.*р{
#.'3''}.
||оступая
аналогично
€ 8р,
|т
и
ур,авнением
(!,
66)
о
:о!т:
ьт'р'!62
[с]"''''
(Ф2_1":т':
,,
г с 2Рч',
_.
')
--
-
(
2Рт1тт
) 1
[*р{т#
'
*тт',}_ехр{-т#.
,','').]
,
где
Ёут
:
Ёхт''у
'
в'тт''
;
6:
у"
.у''_.*р{_
#
.3'',}.
Ёайдем
взаимную
свя3ь
ц]
и
цт]
и3
уравнений
(у,61),
(у,62)
и
(\/,63):
"
т|:1
:
_
т31
$
е|,т
_
,!',,
+
#,,
сг-'2]]
дс:-(9-1_:
*
Рсо
.
[Ре]
?""'+'
?"'?':*
(у'
70)
(у'71)
имеем
(у
'72|
(у'
73}
(у
'74'
+
-{1
:п
'2Р
и подставиу3
формулу
(\+/,72)
вместо т]тт
€г0
значение
],13 8Б1'
ражения
(у,74).
1'огда
о
:о\т:
ь''г(э.
(г.'+)
)",,,,
[с]
(Ф2_)
ехр
х
[\
,ц
{Ре| ]
-
{_
#
-",}-(+
.
#)',",,
.
р"'
..*{+
.',,,,}.
'
(у,75}
€истема
и3
двух
уравнений
(у,70)
и
(\+/,75)
в принципе
по-
зволяет исключить
ц1т
и вь|разить
скорость
процесса с'
через
концентрации
и температуру.
|1оскольку'
однако,
01 9Б.[9}Ф1€9
обьтчно
]
правильньтми
дробями'
постольку
сделать
это в об-
щем
виде
нево3мо)|(но.
3адана
ре1пается
ли1пь
для
ка)кдого
частного
случая
при наперед
3аданнь1х
значениях
всех
0'.
Б
качестве
примера
найдем
ответ
для
случая'
когда
и'
следовательно'
0(1
:0с!['1
:с!,1
&а:
&71'2:
&7'2.
(у'
76)
(у
'77)
(у' 78)
[!ри
сделанном
допуч|,ении
приравнивание
вьтра)кений
0,
даннь|х
в
уравнениях
(у'70)
и
(х+/,75)'
по3воляет
сократить
экспоненту'
соде_р)кащую
ц102'
и найти
экспоненту'
включаю-
щу1о
цт.-€е_з
-'о;'
14сключая
эту
последнюю
экспоне}]ту
и3
урав-
нения
(у'70)'
после
ряда
преобразований
находий
иск6*ую
свя3ь скорости
с составом
фаз:
$'''(Ф2*11г9э+1
_
-ь[Рсо
[Ре]
0:&т
{с'.,*1
-
+'"'}"'{г.о+
\'",(о,]г
|!одобньте
>ке
формуль1
могут
бь:ть
получень|
и
для
про-
цессов'
включающих
инь1е
комбинации
ионньтх
переходов.
1ак,
для
реакции
обессеривания
(!,56)
ур'авнение
для
ск'ро-
.
сти
?
мо}{(но
п!олучи-гь'
за_менив
в вь]ра>кении (\/,78)
:
[с]
(@:-;
на
(Ф2_), (ге'*1
на
п[$],
Рсо
на
|Ф]'и
[ге]
на
'1в'_).
Аналогично
мо}кно
поступать
и
в
других
случаях.
}{ео6ходимо
заметить'
что
в
Ряде
случаев
катоднь1е
и анод-
нь1е
стадии'
составляющие
процессь!'
сами
могут
складь|вать-
ся
и3
ряда
отдельнь|х
этапов' например'
€1м''1*
Фй:
*
€1"д.1Ф[].1
€1'д":
*
оБ:
_
2е
+€рдс,1.
Ф(адс)
6("*")
.
Ф1адс1
-+
€Ф(газ)
€1*"'1
{
Ф12.1
,-%'->
€Ф1"аз;
1
Ф
вовможных
3начениях
о
сш.
[48].
4а7
(у'
79)

ге&1>*е-*Р.Ё,",
Р"Ё'.,
*
е
--
Р€(""')
Ре&+':
*
2е
-->
Р€1мет;.
(у'
80)
3то
мох<ет
повести к
усло)кнению
вь]веденнь]х соотно1пе-
ний.
Фдттако
при и3вестньтх
условиях'
например'
когда в
реак-
шии
(!,79)
процессь1
адсорбции и
десор,6:{ии
протекают
весьма
бь:стро,
а
адсорбция
далека
от
нась1щения,
форма
уравнения
(у'78)
останется прех<ней,
но его константь|
приобретут более
сло>кнь:й вид.
Ёекоторь!е
следствия
кинетического
уравнения
Бсли процесс
(!,60)
далек
от
равновесия'
то скоростью
обратной
реакции'
а следовательно, и вь|читаемь|м
в числите-
ле
вь]ра)кения
(!,78)
мох(но пренебрень.
,(3лее,
если констан-
ть1
скоростей
стадии
(у'80)
значительно
больтпе
соответствую-
щих
величин
для
этапа
(у'79)
,
т.
е.
Ёт,:
)
Ё:т,
у
у1
Ёт,э) Ётт,э,
то
отбрась!вая
вторь]е слагаемь1е в
фигурньтх
скобках 3наме-
нателя'
1п,олучим
8
найденной
зависимости только
одна концентрация'
а
именно
(Ре:+;'
имеет
дР'обную
степень
(1
-
'');
остальные
}ке'
в
том
числе
и концентрация
€, входят
в первь1х
степенях.
Б
этом отно1пении
уравнение
(у'в1)
сходно с
вь1веденнь1м
1(. Багнером
[{9]
о:
&\€1
(Ре2*;(:_'';
(у'
82)
в тех
}ке
предполох(ениях: 3амедленность
стад|1||
(у'79)
и
почти
равновесие у
этапа
(у'80).
6
лругой
сторонь1' не
исключена
во3мох(ность' чт!о констан-
ть1 скоростей
Ё65
катодного
и
анодного этапов
не
сли1пком
сильно
отличаются
друг
от
друга'
например' так' что справед-
ливь1
следующие неравенств а
Ёт,
у,(Ре:+;
}
Ётт,
:
.
Рсо
и
&тт,э.
.[с](оз_1
)
Ёт,з
[Ре].
1огда
о:
Ёт[с]"
.
(о2_),'
.
(Ре'+)(|_с:)
.18
(у'
81)
Б этом
случае концентрации не
только ионов
}келеза
в
шла-
ке'
но
и
атомов
углерода
в металле'
а такх{е
и
(Фэ_;
будут-
иметь
дробньте
степени, причем
сумма
степеней
у
(о?-}
и
(Ре:+;
пли
у
[€}
и
(Реэ+)
Аол>кна
равняться
единице.
(ак
будет
видно
из
дальнейтпего
(см.
гл.
!!)'
в
ряде
опь|тов:
найдено
91Ф
ё(ФРФ€ть вь1горания
углерода
пропорциональна
дробнь1м
степеням
концентрации
[€]
и
(Р4+)
'
причем сумм{}
этих
дробей
6лизка
к единице
[14].
,[,ля
того, чтобьт вь1вести
из общей
формуль:
(у,78)
ту ил||
иную частную
[например,
(у'82)
пл|1
(у,83)],
необходимо
сравнивать константь1
скоростей
(Ё;)
катодного
и
анодного
этапов пр,оцесса. 6оотнотпение
мех{ду последними
мо>кно
най-
ти из опь|та, если
измерить так на3ь]ваемь|е
токи обмена
!1
и
!11'
9ти величинь|
прямо
пропорциональнь1
(а
при
одинаковь1х
единицах
и3мерения пр|осто
равньт)
вь|рах(ениям'
стоящим
перед квадратнь|ми
скобками в
уравнениях
(!,70)
и
(\/,72).
Бсли
еще
учесть
соотно1'пения
(1+/,71)
и
(!,73),
то
!х
-
Ёт,,г
,
(
уге
\"',' *
!лт
Ётт,'
\
?г"э+
/.
(тс'?'э-)'тт,:
х
ехр
{+(,,,','"|','_''',''3,,)}.
(у,
в4)
!(А
.(ругими
словами'
отно1пение
токов обмена
пр'опорциональ-
но
отно1шению
констант
скоростей
(Ё1,1
и
Ё1,)
катоднь]х
направлений
обоих
этапов
(у'79)
и
(!'80)
процесса.
Анало-
гичная
3ависимость
получается
п
для
отно1пения
(Ёт,э|Ртт'э),
но
9
другим
коэффициентом
пропорциональности.
Б
этой
связи представляет
существенный
интерес
экспери_
ментальное
0пределение токов
обмена
катоднь1х
и
аноднь|х
этапов
реакший'взаимодействия
металла
со 1плаком.
1(ак
ука-
зь1валось
вь:ше
(см.
стр.
416)'
такие
попь|тки
бьтлтт
сделаньт
[]4;
16]
для
системь1
[Ре
*
4,30/о
€]-
(€ао
-
А12о3
-
5!о2)
и
дань|
3начения
ток0в обмена 15-20 ма| см2
при
температу_
рах
1350-1450"с.
|1о-видимому'
они
характери3уют
величину
|11,
1.
€.
относятся
к этапу
(у'79)
вь|горания
у!ле!ола.
9то
ка_
сается
знанений |1,
соответствующих
стадии
(у'80)'
то они
еще
не
определялись.
|4з
вь:рах<ений (9,81)
и
(9,83)
вь1текает'
что константа
ск|орости
Ё1
прямой
реакции
мо}кет
быть
представлена
с
уче_
том
уравнепий
(9'70),
(у,73)
и
им
аналогичнь]х
в следующем
виде:
Ёт: Ё|!
т
'
Ё\1'
у.
119
(у'
83)
[$
3ак.
1798
(у'
85)

Фтсюда
и и3
вь1ражения
(!,68)
слеАует,
что
ка}кущаяся
энергия
активации
прямой
реакции
складь1вается
из энергий
акт|1вации
перехода
ионов
)|(елеза
(Ёт'')
и кислорода
(Ётт,э)
и3
металла
в
1плак'
или
точнее
!.
Ёт:
с1"эЁ,у,
т
{
в'1Ё1,
'.
(у'
86)
1ак
как
Ёц,2
38Би€|11
:Ф1
прочцости свя3и ионов
Ф2- со
11]лаком'
а она в
свою очередь'
тем
меньше'
чем
больш:е основ-
ность' то мо}кно
ох(идать' что энергия акт\4ваци11
цроцесса
булет
умень1паться
с
р'остом
основности
1плака.
Реакцпя
о6еооеривания
|1ри
вьтплавке чернь1х металлов
с
!пихтовь]ми
-материалами
вносится известн|ое
количество серьт'
ухултшаюшей
качество
вь]пускаемой
продукции.
Ёапример,
в
доменн,ом
процессе
[50]
основнь1м
источником
серь]
слух(ит
кокс'
в
кот0р,ом 6цд
,ц:рис}тствует
в
виде орга,ни-
чеоких
соединений или
сульфидов. ,&[еньтшие
количества
серьт
п|риносят
{руднь]е
материаль1
(пирит)
и
агломерать1
(суль-
фидьт)
Бо
,время
плавки
металл
и
|пихтовь1е
материаль1
в3аимо_
действуют
со 1пла,ко,м и
,печнь1ми
газами'
1в
1результате
чег'о
происходит
обмен
серой
ме)кду
этими
фазами.
Б
ча,стно'сти'
в
доменн|ой
печи
1перерас'пределение
и
цир1ку-
ляция'серьт
ме)кду
1пихтовь1ми
материалами'
металл'ом
и 1шла-
ко'м
,о,сущоствляются
не только
,при
непосредстве1{ном
их
кон_
та1кте'
но
и в 3начительной
мере чере3
га3овую
фазу
[50;
51].
14сс_п^едование
равновесия
между
[Ёе
-
€с*^.>
-5]']
й
1аг
+
*
!$')<ц''>
показало
[52],
нто, нап!имер,
при
0,3о/6
5
в металле
и
1600'€
,в
газе'находятся
вещества
с парциальнь1ми
давле-
ниями (атм.\05):
Ёэ5
-
405; н5
-
12,03;
€5
-
6,45;
3у-2,19
и
5
-6'52.
€огласно
термодинамическим
раснетам
[50],
осно,внь]ми
с0еди'нениями
,в
гор'не
до'менной
печи
являются
€5, €$:
и 5;
п'ри
поних(ении
температурь1'
т. е. при
переходах
к более
вьт-
99к-им
го]ризонтам
концентрации
€5 и
$ падают,
а
Ё5,
€52, $2,
!э5
и €Ф5
растут.
Б
верхйих горизонтах
печи появляется $Ф2.
!рц
этом ос'но|в'нь|ми
]поглотителями
серь1
являются €аФ,
РеФ
и
Ре.
Б мартеновской
печи п,ри
использова,нии
сернистого то|п-
ли'ва
заметнь|е количества
серь1
|переходят
в металл
и
йлак
из
печнь!х газ'ов.
450
451
15*
€огласно
А.
[.
||оволоцкому
[53],
знанительное
количество
серь]
переходит
в
ва,н'ну
из газовой
фазь:
в пери'од
3а|валки
и
плавле1ния'
особенно
,когда
х(идкая окалина
стекает
с метал-
ла
14 оголяет
его.
Фт
на'чала
3авалки
до
по,крь1тия металла
1лла,ко'м
1ва[1на
1погл,ощает
до
250|о'
от всей
€€!Б1
;Б
мазуте. ||ри
этом
наблюдается параллели3м мех{ду
содер}канием серь|
в
ма3уте
и в гото-
вом
металле
(табл.
43).
л. А. [11варшман
и
соавторьт
[54]
так)ке обнару>кили,
что
в
период плав-
ления концентрация
серь1
в
1шлаке
больше
равновесной
с металлом,
что
обусловлено перехо!ом
5'из
атмосфе-
рь1
печи.
Б связи с
образованием сплавов
сульфидов
и окислов х(еле3а на
скрапе
в'о
время
плавления' а так)|{е на
по_
верхности слитков
при их нагревании в атм,осфере,
содерх(а-
щей
сернисть]е га3ь1'
в
лабораторнь1х
условиях
неоднократно
и3учалось
равновесие
1аблица
48
з!виси[ость
содарж!няя
сеРч
в ног!пл6
от коп'че(тва
эо
в яазутэ
Ф&_'л
*
1725э1.'ъ1
:
5|й>
*
1|
ъФ
э{"^",.
(у,87)
|12и
этом отмечалось
{55],
нто металл
поглощает
тем боль-
1ше
серь]' чем ни)ке
окисленн,ость
1шлака; в
частности' это
имеет
место'при
неполном
г0рении.
Б
связи
с
и3ло)кен'нь1м
'представляет
инте,рес
работа
[56],
в которой
экспериме'нтально
пока3ано'
'что
п,ри
установлении
равновесия
(у'в7)
газообра,з'нь1е
1ки,сл'ород
и
сера
могут
пере-
мещаться
чере3
силикатную
мембра'ну против градиента
их
концентраций.
[ейетвительно'
€€;1[
!3Бновесие
определяется
только
реакци9й
(у'в7)
и
,проводимость
мембрань1
чието
ион_
ная'
то
'ра1вновесие
по обе
ее сторонь1
зависит'не от
отдельнь|х
парциаль'нь1х
давлений
5:
и Ф2,
8 Фт
их
отно1пения.
|1,ри этом
мо'(но
реализовать
такие со-ставьт' когда
по одну сторону
мем-
браньт
'величинь]
р;"
и
ро|"
мень1пе' чем
по
другую,
т. е.
р'"<
рв"
и
рь,<Р'[,,
но
отнр1шение
р
',
/р
з,
вь1тпе
равно-
вес,ного,
а
Ф'"!р6,)-ни)ке.
?огда
кислород
и
се,ра булут
перемещаться
чорез мембрану от ме,нь1ших
,парциальнь]х
дав-
лений
,к
больтпим' т'
е.
против
градиента
их
газо|вь1х
концент_
раций.
6ледует
подчеркнуть'
что
до'статочно
окислительная атмос_
фера
пени мФкет
способств,овать
и обессерива,нию
металла.
?ак,
бала,нс
плаво|к
,п'ока3ал
[57],
нто
п'ри исследова,нии
смеси
5'о^
!
.,и
вмазуте
|
вметалле
0,45
1
,85
3
,50
0,021
0,036
0,046

к0ксового
и
доменного
га3,ов
,с
содер)|{анием
2-3 е|
м3 в газо-
вую
фазу
удаляется
около 40% от общего
количества
сФьт'
поступающей
с
тшихтой'и
заправочнь1ми
маториалами.
€оглас_
но
|{.
Ё. |-{ернатки'ну
и
А. А. Бездене}кньтх
[58],
окисление серы
и
ее
удаление
в атмосферу 400-т мартеновской
печи
особенно
интенсивно
развивается
во
]время
заливки чугуна
и
после при_
садки
Р}дьт.
Бведение
в этот период
в чугун изотопа
535
при_
водит
к
бьтстрому
росту радиоактивности'
га3ов. ||ри
этом
в
корольках металла'
диспергированнь1х
Б
!ттддц9'
содерх{ится
серь1 в 1,3-1,5
ра3а
мень1пе' чем
в ванне.
[.
[]енк
и
соавторь|
т[59]
такх<е
ука3ьтвают
на нео,бходи-
мость
учить1вать
лесульфурацию
т1:лака газовой
фазой,
осо_
бенно
в
<<кисло{р,одной>>
металлургии.
Фбессеривание
1плака
осуществляется
не только газооб_
ра3нь]м
кислородом'
но
и окислами }келе3а. Б
частности'
суль-
фатная
сера' например,
€а$Фа бь:стр'9
реагирует
с
Ре2Ф3
до
5Ф2
п!и
1600'€:
€а5Ф.
1_
Ре'Ф':
€аФ
.
Ре'Ф,
*
50,
*||'Ф'.
Аналогично
€а5
и
?!195
не
разлагаются
РеФ,
но легко
окис-
ляются
,Ре:Фз.
@дновременная
десульфурашия
|шлака
и метал_
ла
пр,оисходит
только
тогда' когда в ванне
очень низкий, а
в
газе
достаточно
вь|сокий
окислительнь:й
потенциал.
Б связи
с изло'(еннь1м
представляет
интерес
рассмотреть
взаимодействие
металла |т 1ллака
ме)кду
соб'ой и с
газовой
фа-
зой.
8зашшоде*отвце
'!{еле8а
о га3апп'
оодер|.а.ц'п'
@еру
Реакции
мех{ду газообразньтми
Ёэ5
и 5Ф2
и
>кидким
метал-
лом имеют-не
только
технологическое
значение. йми
тпироко
п|оль3уются
для
изучения
свойств
расплавов
Ре-5,
в част-
ности активности
серь1'
растворенной
в
металле.
Реакция
с сероводородом
€тарь:е
даннь]е
по
равновесию
реакции
5г"
*
Ё:("аз)
:
Ёэ5(газ)
(!'
381
сильн0
расходятся
у
ра3личнь]х
исслед0вателей. Ёекоторь:е
авторь1 не прин!!мали
мер,
устраняющих
термодиффузию, на
влия11ие
которой впервь|е
(1930
г.)
ука3али
э. в. Брицке
и А.
Ф.
(апустттнский.
.{,ополнительнь]е
'ошп6ки
вознйкают
вследствие неод}!ородности
температурного
поля
при
нагрева-
нии
металла
в
индукционной
печи'
и3-3а
у3ости
температурно-
го интервала,
обусловливающей
малую
наде)кн|ость
зависимо_
сти констант.ы
равновесия
от
температурь|'
а
так}ке
пр14
нали-
чии
примесей,
например
кремния,
углерода
и
других'
заметно
меняющих
активность
серь|.
Рял
3чторов
{60]
прийенил
для
и3учения
ра|вновесия
реак-
шии
(!'88)
метод
струи'лринять:й
ран!е
,
работе
3. Б.
БЁицке
и
А. Ф.
(апустинского
[6!].
|1олуненнь:е
при
этом
даннь1е
от_
*9я:':1
преимущественно
к
вь1сокосернисть|м
сплавам
(А,о
о/
%
о/
и
охвать|вают
довольно
широкий
температ}'рнь:й
ин_
тервал
(от
860
ло
!530"
€).
^
!е9}льт31Б1
!;19
нистого
Ре5,
6лизки
к
ранее
найденньтм
3. Б. Бришке
и А.
Ф. 1{апустинским'
причем
предло'(ен
ная
для
этого
состава
температурная
3ависимость
константь1
равн|ове-
сия
имеет
вид:
_$
+
0,873.
(у,
в9)
€ходное
уравнение
1в]цд
:
-+_0,в62
(у,90)
Рн''а5
т
!9у^9 цолунено
.[62]
и
для
более
вь|соких
температур
(1550-
1/50" 9)
для
раствор0в'
содер)кащих
до
5
?о'
5.
'
?6.ласно
Б.
|1.
Бурьтлеву163],
19к:_$+','',
(у,91)
если
за
стандартное
состояние
принять
не
разбавленньтй
рас_
твор'
а
чистую
)кидкую
серу.
||о
данным
[3_0],
при
содерх(ании
в
сплаве
до
4о|о
$ вь:пол_
няется
правило
[енри,
т. е. с5
-
//з.
|{озднее
бьтло
обнару>л(ено
[64],
нто
и в
этом
интервале
со_
ставов
имеются
небольтпие
отклонения
от
этого
правила.
3а-
метнь1е
расхо)кдеция
6ьтли
ко,нстатировань:
[65]
т)кх<е
и лри
изучении
равновесия
Р9акции
(у'88)
для
>кидкой
меди
в
ин-
тервале
температур
1 150-1250"
€:
5с.
*
Ёз(.аз)
:
Ё251.аз1.
г_ Рчч:. .стр'о1ч
т[64]
правило
[енри
соблюдаетс
я
для
никеля
1Ао
ц5*
(ат.)
5.|и кобальта
[ло
1о7.
(ат.)
5].
для
оценки
коэффициента
активности
серьт
(уз)
в
бинар-
нь|х
сплавах
Ре
-
\!;
Ре
-
€о, 1:{|
-
€о
,
р,б''"'цй]
исполь.
!91(
:
18
Рн'з
РЁр
3овал,ось
прибли}кенное
ре1пение
уравнения
[иббса-!,югема:
^2,,
18
у,
сд-';
:
[^
18
тв
кд.:
*
00'
18
т,
кв':
-
1$
'
Б нем
.[д и
!'[в
-
атомнь1е
доли
металлов
в сплаве'
т$(А-в),
}в(д)
и
т$(в)
-
к.о9ффишиентьт
активности 5 в
сплаве
и
в
чисть1х
металлах,
а А,21а_в1-
и3менение
изобарного
потен'
ц\4ала
при
образ,ова:11|1|4
сплава.
|!риведенное
соотношение
тт'2
5
,43
п?г
с
4
/0'?
10-с
!.0
/?,0
20,0
20,0
[7,5]
0
25
'0
75
5'7,(ап)
Рис.
146.
Блияние
темпера_
Рис.
|47.
|{олуколияественная
туры
и содеря<ания
серы
диаграмма
зависимости
актив_
на
равновесный
состав
газо-
ности
серь1
в
желе3е-
от ее
кон_
во#
6азьт
в
системе,
Ре, центрации
(при
1575'€)
5-Ёэ-Ёэ5
справедливо'
когда
19ув1а1
не слишком
отличается
от
19уз1в1
и мо)кет
применяться
в
ряде
других
случаев.
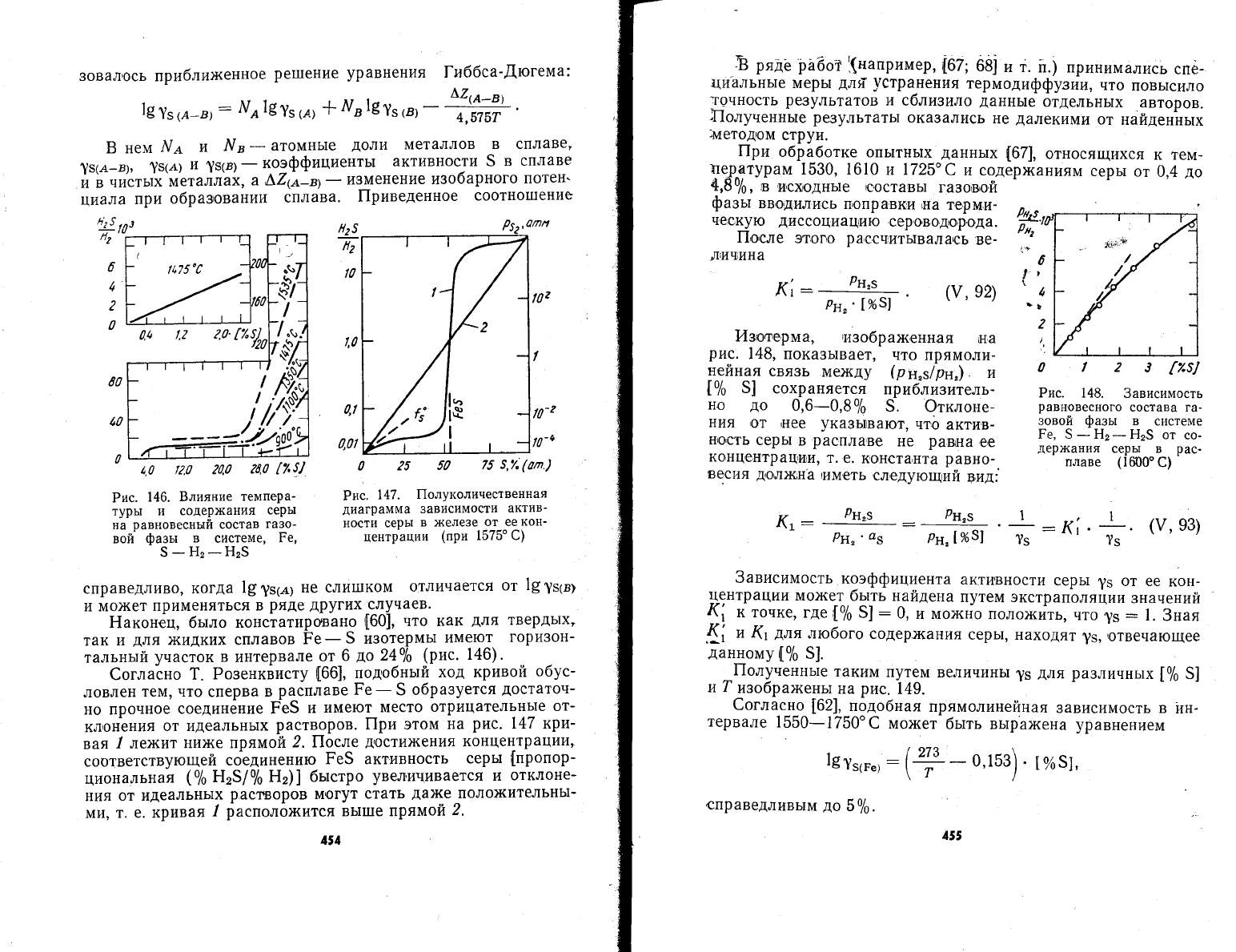
Ёаконец, бь:ло
констатировано
[60],
нто как
для
твердь|х'
"[ак
\1
для
}кидких сплавов
Ре-5
и3отермь1
имеют
гори3он_
тальньтй
участок
в
интервале
от
6
до
240|о
(рис.
146).
6огла!но
1.
РозенкЁисту
1[66],
подобньтй
ход кривой
обус-
ловлен
тем' что
сперва
в
расплаве
Ре-
5
обра3уется
достаточ-
но прочное
соединение Ре5
и
имеют
место
отрицательнце
от-
кл1онения
от идеальнь]х
растворов.
|1ри этом
на
рис.
\47 кри-
вая
1
лен<ит
них(е прямой
2. ||осле
достих(ения
концентрации'
соответствующей
соединению
Ре$ активность
серы'[пропор_
циональная
('/о
Ёэ5/0/о Ё2)]
бь:стро
увеличивается
и
отклоне-
ния
от идеальнь1х
растворов
м'огут
стать
да)ке
полох(ительнь1_
ми'
т. е. кривая
/
располо>кится
вь11пе
прямой
2.
8
р".ь ра6от!(например,
,[67;
63]
и т.
п.) принимались
спё_
циальньте
мерь:
длЁ
устранения
термодиффу3ии'
что
повь1сило
т9чность
ре3ультатов
и сблизило
даннь|е
отдельнь1х
авторов.
|,1олуненнь:е
ре3ультать|
ока3ались
не
далекими
от
найденнь:х
,методом
струи.
||ри
обработке
опь1тнь|х
даннь]х
{67],
относящихся
к тем_
пе_Р3турам
1530, 1610
и \725.
€
и содерх<аниям
серь!
от
0'4
до
4,8%,
:в
и'сходнь1е
'с'оставь|
газов'ой
фазьт
вв'одились
п,опра81(||
;!!8
терм,и-
*!;'зе
л|ич|1на
(?
!(у:
Рн"з
/\/ 0'\
Рд''[%5|'
\у'!'!
йзотерма,
,изо'бра:кенн'ая
на
рис.
146, пока3ь|вает'
что
прямоли-
яейная
свя3ь
ме>кду
(рн,з|
рн")
и
[,|,
5]
сохраняется
при6лйзи1ель_
но
до
0,6-0,в%
5. Фтклоне-
ния
,Ф1
;Ё€8
ука3ь1вают'
что
актив-
н1о'сть
серь|
в
расплаве
не
ра]вна
ее
концентрации'
т.
е.
ко,н'ста'нта
равно_
весия
дол}кна'иметь
следующий
вид:
к
-
Рн,5
Рн,5
1
-.':
-
-
Рн".
а8
Рн,
[%$]
?з
2
0 1 2
3[75]
Рис. 148.
3ависимость
равновесного
состава га-
зовой
фазь:
в
системе
Ре' 5
-
Ё:
-
Ёэ5 от
со-
дер>кания
серь|
в
рас-
плаве
(]600"
с)
1
:
|(1
.
_-.
(у,
93)
'?з
3ависимость
коэффишиента
активности
серь1
т8
от ее
кон-
центрации
мох<е:
бьшь найдена
путем экстраполяции
значений
!({
к тонке,
где
{%
$]
:
0,
и мо)кно полох<йть,
что
т5
:
1.
3ная
1('
и
(:
для
любого
содер.)кания
серь|' находят
у5'
!отвечающее
данному
[%
з1.
-|1олуненнь]е
таким
путем величинь|
т5
для
разлинньтх
[}9
5]
и
7
изо6ра)кень1
на
рис.
149.
€огласно
[62],
подобная
прямолинейная
3ависимость в
йн-
тервале
1550_1750'€
мох<ет
бьтть вьтра>кена
уравнением
18т.с.',
:(+--
0,153)
.
1%5],
справедливьтм
до
50/о.
6ходное
соотно1шение
циента
активности серы'
18
тзсс,)
:
18
т5
ц05
!!/|
5,6
5,4
бьтло
предлох(ено
[65]
и
растворенной
в х<идкой
(-++
0,5).!%5|.
для
коэффи-
меди:
ц/0 1
ц"!
0
Рис.
1
2
3
4[%5]
149. 8лияние
тем.пературы
и
концентрации
серы
на
ее коэффишиент
активности
,
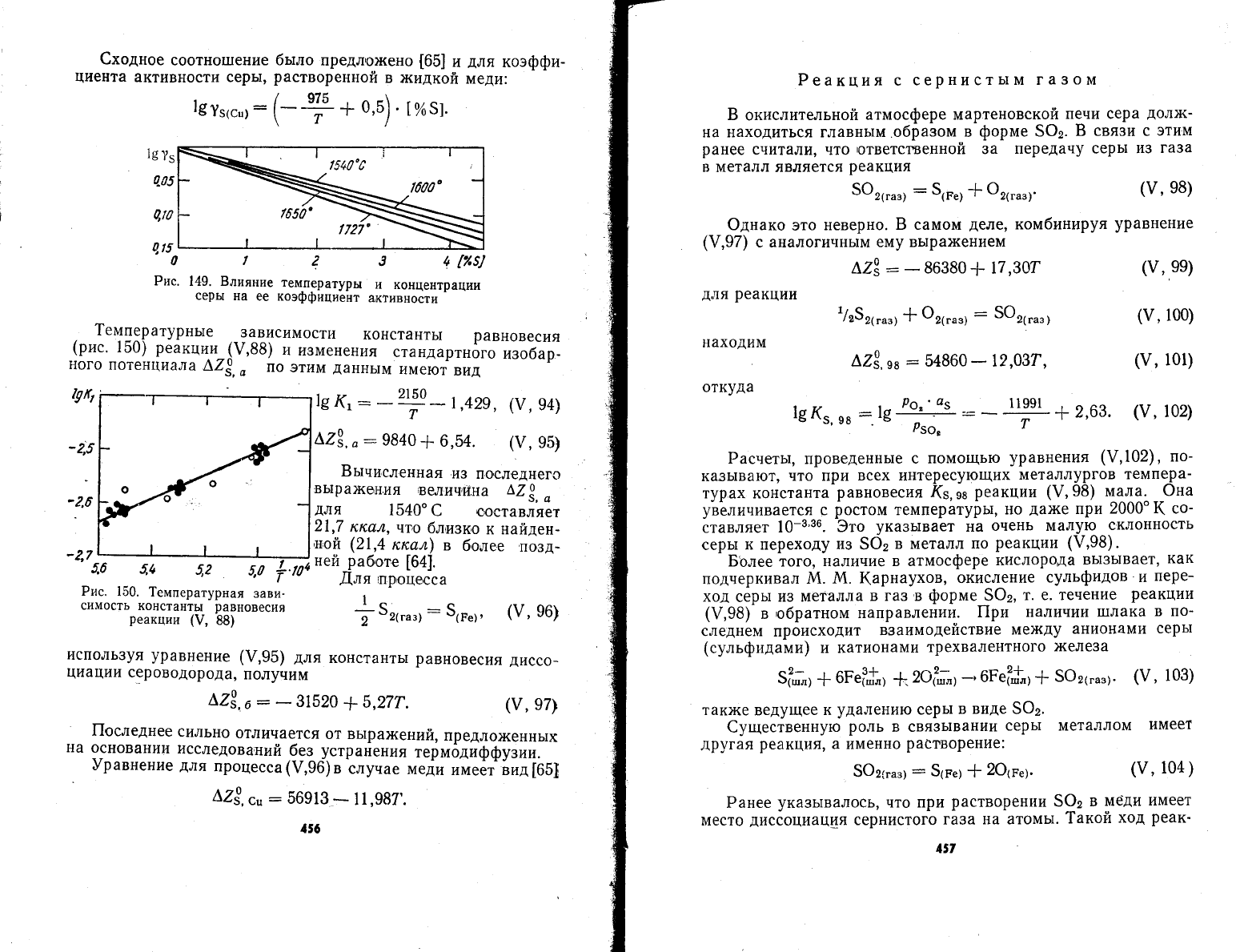
1емпературнь1е
3ависимости
константьт
равновесия
(рис.
150)
реакции-(!,88)
и
и3менения
стандартного
изобар-
ного
потенцпала
А2!''
00Ф
этим
даннь|м имеют
вид
16
1('
:
_'#
_
1
'429
,
(у,
94)
^23'
':
9840
+
6,54.
(у,
95)
Бь:численн
ая
и3
по'следнего
вь1рах(ен'ия ;вел'ич'и'на
^2
3'
'
для
1540'с
с'о,ставляет
2\,7
ккал,
что
близко
к найден_
'тлой
(2\,4
ккал)
в
более
по3д_
ней
работе
[64].
5|
;т,".'/;"'"й:"[9"1;,
Рис.
150.
1емпературная
зави"
}
511",.1
:
5,'",,
(у,
96)
симость
константь[
равновесия
реакции
(у'
88)
}тспользуя
уравнение
(у'95)
для
константь|
равновесия
диссо-
циации
сероводорода,
получим
[23'
о:
_
31520
+
5,27т.
(у,
97}
|1осл еднее
сильно
отл
ич'ается
от вь1р
а'(ений,
пр
едлох<ен
н
ь]х
на
основании
исследова,ний
без_'устранения
термодиффузии.
}равнение
для
процесса(9,96)в
слунае
меди
имеет вид[65}
^
23,
',
:56913 *
11,987'.
156
Реакция с
сернисть|м
га3ом
3
окислительной
атмосфере мартеновской
печи
сера
дол}к-
на находиться главнь1м
образом в
форме
5о2.
в свя3и с
этим
ранее
сч!4тал\4, что
|ответственной
за
передачу серь1
из
га3а
в металл является
реакция
5Фэ(".")
_
$1ге)
*
Фэ("'.).
(у'
98)
Фднако
это
неверно.
Б самом
деле,
комбинируя
(у'97)
с аналогичнь|м ему
вь|рах(ением
^23
_-
_
86380
+
17,30г
для
реакции
1/а5э("'")
*
Ф:("'.)
:
5Фэ(...)
(у,
100)
А23.
,*
:
54860
_
12,03т,
(у,
101)
(у'
102)
уравнение
(у'
99)
находим
откуда
18
/(',
э,
:.
ц
+#
:
__
-11щ]_
+
2,63.
Раснетьт,
проведеннь|е
с помощью
уравнения
(!,
102)
,
по_
казь1вают'
что при
всех
интересующих
металлургов
темпе-ра-
турах константа
равновесия
/(з,эв
!еак1{ии
(!,98)
мала.
-_Фна
увеличивается
с
ростом
температурь1'
но
дах(е
при
2000"
(
со_
ставляет
10-3'36.
3то
указьтвает
на
очень малую
склонность
серь1
к переходу
из
5Фз
в металл по
реакции
(у'9в).
Бблее
того'
наличие
в атмосфере
кислорода
вь1зь|вает'
как
подчеркивал
.&1.
}4. |(арнаухов'
окисление
сульфидов'и
пере-
ход
серь1
и3 металла
в газ в
форме
$Ф:,
т. е. течение
реакции
(у,98)
в обратном
направлении.
|1ри
нал|4ч|4|т 1плака
в по_
следнем
пр'оисходит
в3аимодействие
ме)кду
анионами
серь]
(
сульфила
м и) и катиона
ми тр ехвалентного
>келе3а
$Б;
*
6Ре13,}1
+2о&':*6Ре&*>*
5Фяк"^.).
(у'
103)
такх(е
ведущее
к
удалению
серь|
в
виде
$Фэ.
€ушественную
роль
в свя3ь1вании
серь1 металлом
имеет
другая
реакция'
а именно
растворение:
5Фэ("^")
:
51г"1
{
2Ф1ге).
(у'
104
)
Ранее
указь1валось'
что при
растворении
5Фэ
в
меди
имеет
место
диссоциация
сернистого
газа
на атомь1.
1акой
ход
реак'

ции
п,одтверх(дается
3десь
справедливостью 3акона
кубиче-
ского
корн,
"
--
[%5]
:
&|
р',,.
9то касается
взаимодействия
5@э с
)келе3ом'
то
и3менени9
стандартного изобарного потенциала
и константу
равнове-
сия
(т/,
104) м|о)<но
получить, сочетая
уравнение
(у'101)
с ана-
логичнь1м
для
растворения
кислорода в х<елезе
[70],
3то
дает
Фэ(газ)
:
2Ф1г"1
,
[23,',,:
_55360
_
\,\4т.
А23,
уо':
*
1000
-
\3,|7т,
(у'
105}
(у'
106}
(у'
107}
,
18(.,
,оц
:
]9;#
:
+
+
2,8в' (у,
108}
14з
уравнения
(\/,108)
следует,
что константа
равновесия
реак1{ии
(у'104)
сравнительно
больтпая величина
(при
1800'к
она близка
к 103)' мало
3а'висящая от
температурь1-
3то обстоятельство
указь|вает
на
относительн|о
хоро1шую
рас-
творимость
5Фэ в х(еле3е.
|!озднее
[7\1
для
константь|
(3,19ц
бьтло
предло)кено
не-
сколько иное вь]ра)кение:
18(',,'':#
+2,11,
(у'
109}
которое
при 1600"|(
дает
примерно
то
х(е
3начение
((:
103),
что
и
уравнение
([,108).
Б
работе
[71]
привелень1,
кроме того'
уточненнь|е
зависимо_
сти
для
изменения
изобарного
потенциала
реакции
(!,97):
^23,
в:
_
36320
+
7
,87т ,
(у'
110)
а
также
для
равновеснь|х
парциальнь1х
давлений
Р3о,,
Р5,
и
рв11ад
многокомпонентнь1м
расплавом
Ре,5,
0,
1а;
в частно-
сти
формула
.(||8
!56,
имеет вид
18Рзо,
:
__]981
_
2,|'
*
(#+
1,в5)|%5]
+
1,6|96о]
+
*21в1%о]+)
|вг$,,
+
2>:в
г$,,.
(у,
111)
!|
1аким
образом,
условия
равновесия
(у,104)
благоприят-
ствуют
поглощению серь|
металлом
из $Ф:'
3то
заключение
находит
и3вестное
подтверх{дение
в повь11пенном
содер)кании
серь]
в стали
при
вь!пла'вке
последпей
на сернистом
топливе.
€корости
взаимодействия
'{елеза
с
газами'
с1одер)кащими
серу'
посвящено
весьма
огранич-е'н-ное
число
исследований.
^
богласно
в. и.
карма3ину
[72|,
изуяав[шему
кинетику
по-
тлощения
серь]
твердь1м
}(елез'ом
и3
атмосферьт
5Фэ
и
Ёэ5
при
800-1000"
с,
скорость
п!9цесса
в случае
Ёэ5
примерно
вдвое
больше,
чем при
5Ф2
и
растет
прямо
проп!ор-
ционально
их
парциальному
давлению.
3то
согласуется
с
предполо)кением
о больтпом
значении
лиффузионньтх
про_
цессов
в
период плавления
1пихтьт.
1(
аналогич[]ь1м
вь1водам
притшел
|.
А.
}1олонов
[57]
при
исследовании
кинетики
в3аимодействия
5@э
с
>кидкой
сталью.
Блуцяние
элементов'
раствореннь1
х в >келезе
!глерод,
кремний
и
отчасти
ф9сфор
умень1пают
раств|ори-
мость серь|
в
>келе3е.
€огласно
[73],
примеси
по
характеру_
сво'
его
действия
могут
бьтть
разбить]
на
три
группь1.
1( первой
из
йих относятся
те элементь],
сродство
(т.
е.
А7")
которь1х
к сере
ме1{ь1пе''
чем
у
)келе3а.
|!одобньте
вещест_
ва
(€ш,
€о,,\|,
\[/ и
др.)'
п1о мнению
1[73], не оказь1ваю_т
суще_
ственного
вл|4я*1ия
на
растворимость
серь1
в )келе3е.
€леАует,
впрочем' заметить'
что
упругость
диссоциаци,
9,'5
при
вь1_
соких
температурах
становится
заметно
меньтшей,
нем
у
Ре5,
а вь]1пе
1350ъс
оказьтвается
ни)ке'
чем
дах(е
у
йп5.
Бо вторую
группу входят
металль|'
дающие
более
прочньте
сульфидь:,
чем
Ре5. Фни
пони>кают
растворим_ость
серь|.
-
1ретья
группа
включает
в себя
элементь|
(5!,
с,
Р),
сильно
взаимодействующие
с
)келезом |т
образующие с
ним те или
инь1е
соединения'
Бведение их'
согласно
авторам классифика_
ции'
умень1пает
концентрацию
<<свободного>>
х(еле3а' что
вь|зь]-
вает падение
р.астворимости
серь1.
||оскольку
влияние
элементов
в3аимно,
сера в свою
оче-
редь
пони}кает
растворимость
углерода'
что видно'
например'
из
рис.
151, на котором
предста'вленьт
даннь]е
Ряда
_-?Рторс}в
{74_7в!.
||ри
этом. бьтл'о
установлено'
что
разность
А:!|
ме>к-
лу
атомной
долей
углерода
(ш.)
р
насьтщенном
им
тройном
сйлаве Ре-{-€(нао) и
лолей
(/[!)
в
двойном
сплаве
слабо
зависит от
температурь1 и
является
линейной
функшией
(см.
так}*(е
[771)
от
атомной
лоли
(!'{
3)
третьего
элеме!{та'
если по'
следняя невелика:
^шё:
шс_ш3
:
а!'[х.
159
