Есин О.А., Гельд П.В. Физическая химия пирометаллургических процессов. Часть 2
Подождите немного. Документ загружается.


11ри
этом
плотность эле|{тронов
на
поверхности
цеталла
повь[1|]ается'
в
ре3ультате
чего
на
ней
вознийает
избыточный
отрицательньтй
заряд.
йзбь:ток
поло)кительного
3аряда'
сосредоточенный
в
при-
легающем
к металлу
слое
шлака'
обусловлен'
однако'
не
столько
ионами
Ре2+,
кондентрзция
которь|х
мала'
а
преиму-
ш{ественно
катионами
€а2+
ил14
]$а+,
содерх(ание
чоторь1х
3начительно
вь||ше.
-
3 извостной
мере
это подтвер)!(дается'
:!:-:11_Р*т:з.'п1эиблих(еннь]ми'
и3мерениями
емк'ости
(с)
двоин'ого слоя
[1б.!
на
гранит1е
сплава (Ре-4,50/0
с)
с
различ-
нь|ми
|||лаками
пои
темпеРатурах
1450-1550"с
@аё:л'
42).
Бег:'ичина
6,
,с'оглас'но
форму.,{Ё
!'"
-й'''.*'''
конде,!!сатора
с:
ть
$
*'р/',',
(у'
20)
долх{на
уменьт|]атся
-
с
увеличением
расстоянпя
(г)
ме}кду
обкладками.
Бсли
избьттой
полох{ительного
3аряда
в
двойном
слое
представле|{
катионами'
концентрация
которь]х
в
1шлаке
велика'
то
значение
г
булет
определяться.их
радиусом.
[ействительно'
как
видно
и3
даннь|х
тЁв,''
цу,
емкость
падает
при
переходе
от
магниевь|х
1|]лаков
к
кальциевь|м
и
к
бариевьтм,
т.
е.
с
ростом
радиуса
катиона (''.!+=
о,тв;
/ц42|-
1,06
и
/ва2*_
1,43
;).
Фна
почти
не
меняется
лр|4
за-
мене
€аФ
на }.{а2Ф,
так
как
/цд*
:
0,98
А близок
(
/'5,2{.
1абли
ца
42
11ри6лнжонншэ
!н!чо..'я
€
п
ё
1пя
сплаво;
Рв
-;|Ё%
с в
Р.зп'чнн'
ц'!!..х
прх ||'0-!'ф'
с
46,3
42,6
42,2
51%
4о%
55%
50%
%
.|!1еФ; 49'55,
5|Ф2;
%
€а9; 42'55
$!@2;
%
8аФ; 47'6ч,
51Ф2;
\а29;
49у'
5|о2
!т]ав@;
Ф%
8'Ф"
€аФ;
45% 5|о2-
€аФ;
50и
А12о3
24'2%
А\2ов
15%
А12оз
10%
А!!о3
21
,8
14,3
\0,7
15,9
1б'5
\4,1
14,9
1,9
\,7
\,7
1,8
\,7
1,8
1'8
-
|1рактитеская
неизменность
диэлектрической
постояннбй
(6:
|,7-+|,9) во
всех
и3ученнь|х
1плаках
обусловле}{а'
по-ви_
димому'
тем'
что
она
определяется
главнь1м
образом
аниона-
ми
кислорода' суммарная
концентрация
которь|х
в !1]лаках
велика.
12о
а}1
1'1збьтток
катионов
в полох(ительной
обкладке
двойного
слоя
невелик.
Б
самом
деле,
спло1шному
покрь1тию поверхно-
с.1'и
ионами €а2+
отвечала 6ы
плотность 3аряда:
2Р
1
-о
96500
/у
(2г.^э1-)2
6,6
.
1028
(2
.
10-8)'2
:
8
.
10_3
к/см2
(и 4
.
10_3
кРм2
для
|\а+).
|1оскольку значение е
(см.
та6л.
4|) не
превосходит
6
.
|0ц
к!см2'
избь1точнь|х
катионов
на поверхности
раздела
долх(но
бьтть
не более
нескольких
процентов; остальную мас-
су'
по-видимому' составляют
катионь|
и
анионы'
3аряд
кото_
рых
в3аимокомпенсирован.
€огласно та6л.
42,
увеличение
концентрации
углерода
ил||
фосфора
в
металле
умень1шает
абсолютную
величину
в.
Бе-
роятно'
'это
вь|3вано
усилением
прочности
связи х(елеза
в
сплаве,
в связи с
чем падает
число ионов
Ре2+, переходящих
в 1плак при образовании
двойного
слоя.
Б
обратном
направ-
лении влияет
рост
содер)кания
5!Фэ и А1эФз; количество
ионов
Ре2+ повьттпается и
плотность отрицательного
3аряда
на ме-
талле
увеличивается.
Аналог;тчнь:м
образом
действует
}х[аэФ на
сплаве
Ре
-
€
и
Ре- Р
[19].
Б
связи с этим
при
рассмотрении
влияния состава
фаз
на
ме>кфазное натя}кение
(о)
и
форму
электрокапиллярной
кри-
вой
следует
учить]вать
изменение как
химических
потенциа-
лов
(р;)
компонентов'
так и плотности заряда
(в),
т.е. поль-
зоваться
уравнением
(у,17).
3 частности, сильное сних(ениео
при
замене €аФ
на $аэФ
[15;
20]
обусловлено'
вероятно'
как
капиллярной активностью
ионов ]:'1а+ по сравнению с
са2+
(т.
е.
разностью
членов
2[цд*6рц9*
и
|6"э|],Ёса2*), так и
увеличением
плотности
отрицательного
3аряда. т. е.
слагае_
мьтм
-е79
[19].
й'-,'Ё'*'йу,,подобнь1ми )ке,пр|ич'инами
ну)кно о'бъяснять
падение
о
от
добавки
сао
в опь1тах
Б. Б. |[атрова
[17].
Ёапротив,
сних{ение
ме>кфазного
натях(ения при
увеличе_
нии
содер)кания
углерода
в
х(еле3е
[21]
нельзя
отнести
за счет
слагаемого
*еёр,
так
как
оно
(см.
табл. 41)
мо)кет
да)ке
умень1паться'
поскольку абсолютное
значение
е
при
этом
па-
дает
и
6,р}0.
Более существеннь1м
здесь является,
вероятно'
113менение
слагаемь]х
[
сёрс.
|-|редставляет
интерес
так}ке
вопрос о том'
как
располага_
ется
в
расплавленном
1шлаке избь|ток
катионов'
т.
е. какова

структура
поло)кительной
обкладки
двойного
электрического
поля.
|1риведенная
в
та6л.
42
достаточно больтпая
величина
ем-
кости
исключает
далекое
распространение
избьтточньтх
ка-
тионов
в глубь
расплава'
т.
е. так
назьтваемую
лиффузную
структуру
о6кладки,
характерную
для
очень
разба'в}Ё:нньтх
воднь1х
растворов
солей
электролитов. (азалось
бьт,
9то
в
расплавленньтх
солях
и
!ллаках'
т.
е.
)кидкостях'
состоящих
практически
только
и3
ионов'
ну)кно
о)кидать
простую
модель
двойного
слоя'
а именно'
по
типу
плоского
конденсатора'
в
которой
центрь|
всех
избь:точньтх
3арядов .одного
знака
рас-
полагаются
в
одной
плоскости.
Фднако
такое
п!^едп9:п-о-)кение
вряд
ли
правильно.
(ак
от-
мечалось
еще
в 1956
г.
[19],
вероятно,
не
веёь
избьтт',,,!й
,'_
ло}кительньтй
заряд,
а
ли1пь
значительная
часть
его нахо-
дится
в первом
(бли>кайшем
к металлу)
атомном
-''-тп''*'.
паличие
свободного
объема
в
последнем
и
деформиРуемость
эле.ктроннь1х
оболочек
ионов
приводит
к тому,
что
!а!бьтточ-
ньтй
полох<ительньтй
заряд
постепенно
от
слоя
к
слою
гасится
отрицательнь]м
до
полного
его
исчезновения.
Б
этом
смь{сле
ионная
обкладка
двойного слоя
в
расплавах
является
диф-
фузной,
т.
е.
распространяется
}{е
на
один'
а
на
несколько
атомнь1х
слоев
в
глубь
электролита.
йнтереснь:*
,'д'Б.р*-
дением сказанному
являются
работьт Б"
А.
'}кп:е,
[.'А.
Аей-
кис
и
соавторов
[23],
которь:е
йоказали,
что
емкость
двойного
слоя
на
границе
)кидкого
свинца
(и
р"д,
других
легкоплавких
металлов)
с
расплавленньтми слоямй
меняется
с потенциалом'
проходя
че-рез
минимум
(6"*,)^
в
точке
нулевого
заряда
(е:0).
Фни
объясняют
рй'с
"
р-;ф;р;ы;;';р;[{ур,,
расплавленной соли,
например'
ее
уплотйейием
вблизй"*"','_
ла
3а
снет
свободного
объема
и
деформации
ионов.
Аействи_
тельно'
и3менение
емкости
с потенциалом
ока3алось
завися-
щим
от
природь1
соли
|1
бёльтпим
в
расплавах \а€1-1;ё!,
чем
в
(€1*
€з€1.
Авторьт
поясняют
это
так)ке
и
с помощью
модели
катион_
нь1х
дь1рок'
число
которь1х
около
металла
меняется
с потен-
циалом.
|[о-видимому,
й тплаках
избьтточньте
3арядь1
распола-
_г-аются
на
глубину
нескольких
атомнь1х
слоев;
то
)ке
самое
1!1о)кно
сказать
и о
катионнь1х
дь|рках' которь1е
так)ке
распре-
деле|{ь1
лиффузно
в
расплаве.
|1о!обные
х(е
в3глядь|
вь|сказьт_
вались
и в отно1пени^и_
и3менения
€
с
,р
в
твердь1х
солях
1э[].
3начительно
менее
точнь1е
измерен'"
емкости
[16]
в
рас-
плавленнь1х
шлаках
пока3али
(рис._143),
*''
"*'',йЁ/
с
'._
тается
почти
постоянной
в определенном
интервале
9.
1(огда
>ке
токи' идущие
на
разряд
ионов'
сильно
увеличиваются'
измерение
6 сильно
ослох(няется
и
на6людается
ка'(ущееся
повь11пение
емкости при
больп:их
анодньтх
и
катоднь|х потен-
т\14алах.
1аким
образом,
здесь
не
удается
вь1явить
минимум 6,
которь:й
отвечает
обь:чно
точке нулевого
3аряда'
т.
е. макси_
муму ме>кфазного
натях{ения
[23].
3
тплаках
}ке
1в
этом
|интервале
потен-
циалов
лех(ит
ли1пь
катодная ветвь
электр,окапиллярн,ой
кри|вой
(см.
рис.
143):
|А0;б
падает. ||ри
этом
и3_
вестное постоянство
величинь1
6 мох<-
но
пояснить
по
аналогии
с воднь1ми
растворами.
Б последних
емкость
двойного
слоя
на некотором
участке
катодной
ветви
тем мень1пе
меняется
с
потенциалом'
чем вь11ше
концентра_
ция
электролита.
|1оскольку
в 1плаках'
как и в
расплавленнь1х
солях'
концен-
трация
ионов
весьма
вели1(а'
значение
6
мо>кет
слабо
меняться
в
некотором
интервале
катодньтх
поляризаций.
3
более
точнь1х
и3мерениях
емв
0,6
0,2
-02
?,0
Рис. 14з.
3ависимость
емкости €
(1''
2',3'и4'\
б
оолее
точнь1х
и3мерениях
емкости
(6)
двойного
слоя
на границе
}кидкого
ц9Рсп[д^
сш1!10ь
|' и
границе
}кидкого
и ме>*<фазного
натя}ке'
г^^
^! ^
ния
о
(1
и
2)
от потен_
1||уна-
с
расплавами
€аФ
-
А12о3
-
;;;;;
';;6"й!
Ё;;;
5!Ф'.
бьтло показано. что вр.пич''н! 8 гпяни!тьт .ппяр^Р.
5!Ф2,
бьтло
пока3ано'
что
величина 6 границы
сплавов:
падает
с
понижением
-
температурь1'
'^1:ё")!'
т
Р}'
,9
9"&"|''ё
становясь
весьма
небольтш,ой (2-
(€а@'
в!Ф,,
41зФ.);
,,
_
Ре,
6
мкф|см2)
в6лизи
ли|![1и
ликвидуса.
.'!|€;"?3:'.А1Р}|{,".]:-
3то,
по-видимому'
объясняется
много-
слойностью
<<двойного>>
слоя'
увеличивающей
его эффективную
толщину
[19].
|(оличество
избь:точнь:х
зарядов
в первом
от
чугуна
ион_
ном
слое
1плака
определяется
3арядом
металла
и
специфине-
ской
адсорбцией.
Ёо
ме>кионнь19
силь{
вьт3ьтвают
появление
второго
ионного
слоя противоположного
заряда.
Аналогично
могут
появляться
третий
и
следующие
3а ним
слои.
9тому
препятствует
тепловое
дви)кение
ионов
и плотность
избьтточ-
ньтх
3арядов_
_мо)кет
бьтть
описана
3атухаюшей
периодической
функцией
[209].
'1аким
образом,
во3никает
многослойность
знакоперемен-
ной
ион,ной
обкладки,
которая
увеличивается
'с
поних(ением
температурь1'
что
и вь13ь|вает
падение
емкости.
.[обавка
к
€аФ
_
А1эФз
двуокиси
кремния
заметно
сних(ает величину
12,
1!

6,
по-видимому'
в
ре3ультате
появления
ковалентньтх
связей
$|
с €, т.
е.
структурированнь:х
кремнекислороднь1х
<<айсбер_
гов>>'
увеличивающих
эффективную
толщину
<<двойного>>
слоя.
14злох<енное
дает
еще
одно
экспериментальное
подтверх{_
дениеэлектрохимической
теории
в3аимодействия
х(идкого
черного
металла
со
1плаками;
8лэнтронап]|плярнь!о двш|неншя
Ёаличие
за'ряда
на
поверхности
)|(идкого
металла,
погру_
х(енного
в
1плак'
ука3ь1вает
на во3мо)кность
так
на3ь1ваемь|х
электрокапиллярнь[х
двих<ений,
скорость
которь!х-в
расплав-
леннь|х
электролитах
долх(на
бь:ть
во много
ра3
больтше,
нем
при
электрофорезе.
_
АейстБитёльно,
скорость
последнего
(о')
пропорциональ_
на только
части скачка
электрического
потенциала
(а
именно
(-потенциалу),
которая
отсчитьтвается
от
второго ионного
слоя
в глубь
раствора
[25]:
о7Ё
-.
-
"ъ"
""-
о'щ.
3десь 8_плотность
заряда
на металлической
фазе,
Ё-
прило>кенньтй
и3вне
градиент
потенциала,
3
!
-
вя3кость
эйектролита.
Фпьтт
показь1вает'
что
значение
(
заметно
отли_
чается от
нуля
только
при весьма
йалой
(миллимоли
в литре)
концентрации
ионов..
|[оскольку
последняя
в
1плаках
и
рас-
плавленнь|х
солях
Ёелика
(десятки
молей
в литре),
мо>кно
принять'
нто
(-потенциал
мал.
|1оэтому,
[{есмотря
на наличие
3аряда
на металле
и
двойного
слоя
на мех<фазной
границе,
скорость
электрофореза
3десь
ничтох(на.
Ёа,ро'ив,
скорость
электрокапиллярнь1х
дви>кений
(о)
равна
в
простейтпем
слунае
[26]
вЁг
,'
-
_
2'\
'
(у'
21)
где
г
-
радиус
металлической
капли.
Фна
не зависит
от
(-по_
тенциала
и при
достаточном
3аряде
(е)
и
гралие!1те
напрях(е_
нття
(Ё)
мо)кет
бьтть
весьма
больш-той
в
шлаках и
расплавлен-
нь|х солях.
3лектрокапиллярнь]е двих(ения
отличаются
от
электро-
фореза
нё
только тём,
что могут
протекать
с больтлими
ско-
ростями
в концентрированнь]х
растворах
электролитов'
но
так)ке
и
тем'
что
они во3мо)кны
только
для
х(идких'
а
не
твердых
частиц.
|!одобньте
дви}кения
капель
ртути
в во-днь|х
растворах
на-
блюдались
рядом
исследователей
|27-29].
€ущность
их
сво_
д|4тся [26]
к слелующему.
Ёа
границе
капли
металла
со
1шла-
ком
ийее'ся
двойной
электринеский
слой.
|1ус1ь заряды
его
располо)кень1
так,
как
пока3ано
на
рис.
144.
Бнеш.тнее
элек-
тринеское
поле
увеличивает
перво]1ачальньтй
поло)китель-
ный
зарял
капли'у
края,
обращенн6го
к
катоду'
||ри
этом
отрицательньте
зарядй'
располох(еннь[е
в шлаке'
смещаются
так,
что
плотность
их
у
этого
края
такх(е
становится
больш.те.
Бзаимное
притях{ение
металла
|4 !!7лака
в
этом
месте
усилит_
ся,
а
ме>кф}зное
натя)кение
пони3ится.
Бдоль
поверхности
капл|4
во3никнет
градиент
натя-
>кения.
Фбусловленнь|е
им силь1
в
тверАой
частице
уравнове1пивают_
ся
упругими
напрях(ениями.
Б
>кидкой
}ке они
вь1зь1вают
вихре-
образньте
потоки'
благодаря
ко'
торь|м
капля совер1шает
реактив_
ное
дви}кение
к катоду.
|!ри'обратном
располо)ке1{ии
заряд0в
в
двойн'ом
слое калля
направляется
к аноду.
|1одобньте
явле!!ия
6ьтли
обнарух<еньт
и в
металлургических
системах
]|30].
1ак
бьтло
установлено,
что капли
меди' никеля
и марганца
перемещаются
по поверхности
)кид-
кого
1плака
(52о|о
(аФ,4\о|0
^|2о3
и 7%
51Фэ)
к
катоду'
а кап-
ли
\!352
-
к аноду.
|1одобньте
двих(ения
не
наблюдаются
у
3а-
сть|'в!пих ка]пель металло,в
и куоочков
тверлой
,оки'си
магн'ия.
(оличественная
теория
электрокапиллярнь1х
дви>кений
бьтла
развита
А.
Ё.
Фрумкиньтм и
Б.
[. .[!евичем
[23;
31].
Аля
случая
идеально'
поляри3уемой капли,
т. е. такой,
у
которой
обмен
ионами со
!плаком 3атормо}кен,
ск0рость
(о,
см|сек)
дви)кения
'
':
="|.=',
(у,22)
2ц*3ц''
где
ц'-вя3кость
капли.
Бсли
унесть'
что вя3кость металла
3начительно мень1ше'
чем
у
1плака' то
формула
(\х/'22)
упростится
до
уравнения
(у,2!).
Фтнеся
о
й
единичному градиенту
(1
в|см'1 п
радиусу
(|
см) и
вь|ра3ив е
в кулонах'
получим
подви)кность
капли
а е.10?
ц
_
--'_
Рг
2т1
.125
|
Рис.
|44.
€хема
возникнове'
ния
электрокапиллярных
двих<ений
положительно
за'
ря>кенной
капли
'//ъ'
\_/,
ъ
(у'
23)

|1риведеннь:е
простейгпие
формуль|
оказались
справедли_
вьтми
и
для
электрокапиллярнь]х
дви}кений
в
расплавленньтх
!|]лаках
[30].
в качестве.иллюстрации
мо}кет
слу>кить
табл. 43.
|-1ервьте
две_
строки
в
ней
показывают,
что
скорость
перемеще-
ния
капли }{|352
п!опорциональна
градиенту
напря>кения'
а
вторая
-и
третья
строки-что
о
пропорциональна
радиусу
капл'!.
Более
того'
подви)кность
ш,
рассчитанная
по
ф'р'у'"
(!.:з1
и известнь1м-и3
литературьт
[16]
.,''.,""й
']!
:ь.
.
10-6 к|см2
и
!!
:
!,5 п3,
сос1авляет
50
}м|сек.6'
т.
е. й.'",'_
ну, близкую
к опь1тной
(46
см|сек.
в).
|
а6луц
ца
43
эпепРокап'лляРныз
дв_1жан!'
п,
аноду
к!пель
(ульфхда
никепя
]]:|1з5:!
з
щл!ко
с 520[
€аФ; 11о/о
^\2оэ'
7'7'
5!о,
йрй'
;лоо"
с
'
"-"
,,
"''*!
0,05
0,025
0,05
/
'
ем
!]' с14/сек.в
2,3
6,6
6,6
4,8
7,5
15
6,6
6,6
0
,075
0,16
30
5,1
15
6
42
46
46
|1равда,
для
больтпих
капель
наблюдаются
отклонения
от
простейш:ей
3ависимости
(\,/,23\.
Ёачиная
(
[
:0,075
см,
с1<орость
дви)кения
перестает
увеличиваться
с
радиусом'
а
при
г:
0,16
см
да>1<е
редко
сни)кается.
Бероятно,
это
обус-
ловлено
тем'
что
уравнение
(у'23)
справедливо
при
условии
Ёг
(е€,
где
с
-
емкость
двойного
слоя.
.[,ействительно'
это неравен_
ство
Р^наРем
случае
вь]полняется
ли1пь
при г{0,
15
см}
есл\4
8
:_6,6
в| см,
€:
15
мкф/см2
|т
е: 15. 10:в
к|см2.'
Б
более
1широком
диапа3оне
проверялось
влияние
вя3ко_
сти 1плака
на
скорость
электрокапиллярнь1х
дви>кений.
1(ак
видно
и3
данньтх
та6л.
44,
подви)кность
капель
\|352
!а!и}сом
0,1-0,12
с7'!.
закономерно
падает
с
вя3костью (ц|
й):ака'при
постоянном
градиенте
Ё
:
2,55
в| см
и
температуре
1400"!.
ьолее
того'
в
согласии
с
уравнением
(!'23)
величина
0
об-
ратно
цропорциональна'вя3,кости
(ц),
а
3начение
плотности
2аРяда
(в)
лостаточно.-
лостоянно
^(1\,2-+3,Б.16_в
ц16дэ)
и
близко
к найденному
(15
.
10_6 к|см2)
другими
методами.
[оАобньте
)ке
результатьт
бьтли полуненьт
[30]
и
для
капель
!!гфра
(г^:
0,075)'
перемещающихся
к
катоду
в
расплавах
ш1чо^-
Б2Ф^3^п!и
1
100"с.
|1ри
уменьшении
солер>к6ния
\аяФ
с
10,2
до
2,30|0
вя3кость
1плака
возрастала
примерно
в
два
раза
(с
9
до
20 пз), а
подви>кность
капли приблизительно
во
столько
х{е
раз
падала
(с
24
до
12,1
см|сек.
в).
1абли|\а
44
завх(хность подв1жнос?,
(и)
капапь
|.{!з$:
от
вязко€ти
.
6еэжелв!,с'ого
щп!ха пР'
{400о с
@|
т'
,"
|о'
см|сек
|
ш' сл|сек'в
!",'#:ъът'"
6
18
30
!о
48
4\
36
30
42
'41
51
56
10
\2
13
\4
\2
\1,2
\\,7
13
,5
2,8
0,95
0,5
0,25
10
3,1
1
,95
0,9
?ак просто
обстоит
дело
тогда' когда
и3менение
состава
ска3ь1вается ли]пь на вя3кости'
а
не на
плотности
3аряда.
Б том
случае' когда
меняется концентрация
определяющих
потенциал ионов'
влияние
состава мох{ет
стать 3начительно
более
с!о>кньтм. Ёапример,
повь11пение
содерх{ания РеФ
в исходном
без>келезистом
11]лаке
6аФ-А1эФз-5|о2
снача-
'1а
сни)кает
подви}кность
капель
\|з5э
(хотя
ц
падает)
'
а 3а-
тем изменяетя направление
дви)кения
их
на обратное
(не
к
аноду'
а
к катоду).
|1о-видимому'
с
ростом
концентрации РеФ
в образовании
дво'йн,ог'о
]слоя
в,се б6льтпую
р'оль
:начинает
!играть
|пер,еход
ионов
х(елеза
из 1плака
в
сульфид:
Р",'*,
-*
Ре1"'''1
_
2е,
1
а не
обратное перемещение
ионов
никеля:
}{|(сул)
-*
ш:,'?*{,
4
и.
Более
того' опь|т пока.3ь1вает' что
дальнейплее
повь11пение
содер)кания
РеФ
(с
8
до
20%) ведет
не
к
увеличению'
а
к
умень|пению
подви}кности
капель \!352,
несмотря
на
рост
их
полох<ительного
3аряда и падение вязкости. Б
связи с
этим
простейгпаЁ
формула
(у,23)'
ока3ь1вается неприемлемой
[30].
3
этом
случае представления
об
идеально
поляри3уемой
капле'
вероятно' неприменимь1
и
следует
поль3оваться более
сло}кнь|м
уравнением
для
подви}кности
[31]:
2т1{
{г12хш)
|2т
ц:
(у,24)

Б
нем
вь|ра)кение в
скобках
назь1вается
коэффициентом
депо-
ляри3ации
(Ё),
х-
удельная
электропроводность
электро-
лита'
а
(у'
25)
где
п
-ч||сло
зарядов
ио,на;
Р
-
постоянная
ФараАея, а
|"
-
предельная
плотность тока.
||оскольку
в
)келе3исть1х
1плаках величинь1
['
и
х
достаточно
велики,
3начение
Ё
мо>кет
3аметно отклоняться
от единицьт. |1оэтому
хотя прй
добавле-
нии
РеФ
вя3кость 1плака
падает'
но
при этом
сильно
увели_
чиваются
электропроводность
{х)
и предельньтй
ток
(|").
€казанное
мох{ет
обусловить
настолько
бьтстрьтй
рост
коэффй-
циента
деполяризации
(ь)'
что
он будет
компенсировать
уменьшение
вязкости
(ц)
и о>килаемое
повь]1пение
плотности
поло)кительного
заряда
(в).
Б
связи
с
этим
подви)кность
кап_
ли
останется
постоя!{ной
или
дах(е
уменьшится.
3
этом
отно|шении
показательны
даннь|е
та6л.45
для
1пла-
ка
с
23оА
РеФ. Ёесмотря
на
четь1рехкратное
увеличение
вяз_
кости'
подвих{ность
капель
}'{!з$я
(г:0,08-0,
1 сло) остается
(тР,_
Ё':
3
в|сн)
практически
неизменной
(19-24.
.\0_3
сн|сек.
в)
в противополо)кность
тому' что наблйдалось
в бе.з>келезисть1х
[шлаках
(см.
табл.
44).
1аблица
45
нез!вхс!}ость
появ|жхост'
вапэпь
!:{1352
от !язхостх
хел.3'сто]о
шл!х.
|13%
г.о! пр'
'|00о
с
Рт
щ__-
пР
|,
1
1,5
,
4
34
ю
42
46
.{3
6|
35
31
6
6,1
5,9
5,8
20
,9
19,7
24
}{зло>кенное
свидетельствует
о том' что
в 1плаках
не
только
во3мо)кнь!
электрокапиллярнь1е
двих(ения
капель металлов'
'|о
в
ряде
случаев
оправдь1ваются
основнь1е
закономерности
этого
вида перемещений.
€ледуец однако'
учесть'
что
для
электрокапиллярнь1х
дви-
жений
необходимо
ли1пь
разлитие
иен<фа3ньтх
натйений
н'а
противополо)кнь1х
краях
капли. }1о
это
ра3личие
мо>кет
быть
так)ке
н
следствием
и3менения
состава
в
приэлектроднь1х
слоях'
т.
е.
слагаемьтм
/1.1р;
уравнения
(!,17).
д28
а29
|[ри неболь1ших содеРх(аниях
,РеФ
в шлаке
коэффициент
деполяризации
не сли[шком велик
и мох{1{о
пользоваться
для
этой
цели
простейтшим
уравнением
(9'23).
Ёа
рис.
145
представленьт
данньте
[32]
по
электрокапилляр-
ным
дви)кениям
капель
стали и
чугуна
(г:0,12
сл) при
тем_
пературе 1450-1560'€
и
градиенте Ё
:6-+10,5
в| см
в тлла-
ках' содер)каших 380/9
(аФ,
42у0
5!о2
и 25оБ
А1эФз. ||о
спе_
циально
измеренным
3начениям
вязкости и
в предполо)кении
применимости
ф"!
у]:-":
^-!у'?3^)
+
5]!',ап/41а
бьтли
расснитань|
плотности
''-
-''';
ряда
на каплях
.
по наиде'ннь]м
подвих(ностям их.
ёй.!у""
.'й.."",' что
пр1.{
'2
больп.тихградиентах напрях{ения'
капля
дви)|(ется
по 1шлаку на_
ц
столько бьтстр'о,
что граничнь|е с
ней
слои шлака
не
успевают
за-
-'
метно
сни3ить
концент0ацию
РеФ и она
остается
бли'зкой к ис-
-с
4
3
2
-о,|
ходной
в
объеме.,
рис.
:дь
пока-
0
1
2
ге0,%
3ь|вает' что
вь1численная
таким
Рис. 145.
3ависимость пдот'
образом
,'''"'.1ь-.!Ёй;
;;;;;:
Ё!''ъ
";';*"#''#ЁЁ6
ла
закономерно
меняется
с со_
в ш|лаке при
содер>кании
дер){(анием
РеФвшлакеиугле_
6вРе:
рода
в
х<елезе.
Фна'
ка\<у1 экспе-
'
_
0'5о6; 2
_
\'ооь' 3
_
р.иментально
найденная
скорость
о:
4
-
4'6%
дви'(ения,
меняет
свой знак
с отрицательного
на
поло)китель-
ный
при
теп{ мень1пей
концентрации РеФ,
чем больтше
0/9
6.
14наче
говоря'
величина
в
становится
отрицательнее
при
умень-
тшег!ии
содер)|(ания РеФ
и
€.
|1о-видимому'
падение
концентрации
РеФ
в
1плаке
и повь|-
шение
7о
€
в металле
способствуют
смещению
равновесия
реакции
Р€1мет1
:Рес2*:*2е
слева направо' т.
е. повь1шению
плотности
отрицательного
3а-
ряда
на капле.
€
другой
сторонь1
необходимо
принять во внимание
влия_
ние на
скорость
(о)
дви>кения
изменения
состава
н^ к-раях
капли.
||оэ1ому
вь1численное
3начение в
включает в
се6я
не
только
плотность
заряда,
но
и
величиньт
(/;,
п,
Р), свя3аннь1е,
например'
с
разлйнной
адсор6цией
кислорода
(г0'2Р).
3лектрокапиллярнь]е
двих(ения
иогут бьтть
исполь3овань|
для
реал[{зации ре)кима
процесса,
бли3кого
к
кинетическому

(так
как
перемещение
капли
способствует
сильному
переме_
тциванию),
а так)ке
для
и3влечения
мелких
корольков
ценнь1х
ферросплавов,
запутав1пихсяв
прои3водственнь1х
1плаках.
Б
этом
отнот|1ении
обнадех<ивающие
ре3ультатьт
бьтли
полуне_
ньт
для
_ко-рольков
феррохрома,
феррованадия [30],
ферроволь_
фрама
,[33], а
так>ке тптейна,
меди
и свинца
[34].
Ёачеотвенная
нарт]|!!а
взапподейотвпя
|1осмотрим
теперь'
в какой
мере
с помощью
электрохими-
ческих представлений
мо>кно
пояснить
1широко
и3вестнь|е
яв-
ления' наблюдаемь|е
при
взаимодействии
металла
со |плаком.
Фстановимся
сначала
на вопросе
о том' почему
окислительная
способность
[плака
(которую
булем
относить
к
равновеснь1м
условиям)
не
определяется
в простой
форме
всейи
существу-
ющими
в нем
ионами
кислорода.
Фкислительная
способность
1шлака
^
!!т_с1,дан
с-ильно
основной.|плак'
содерх{ащий,
например,
€аФ,
!!19Ф,
РеФ
и немного
51Ф2,
т.
е.
состоящий
и3 ионов
(дэ+,
,&[32+, Ре2+,
Ф2-
'и
5!о;_.
.[1,опустим,
что
он
приведен
в
соприкосновение
с
расплавленнь1м
)кидким
>келезом.
(а>к_
дьтй
из
видов
ионов
1плака
булет
стремиться
частично
перейти
в
металлическую
фазу.
3то
стремление
булет
определяться
ра3личием
энергий
связи
частиць1
с
обеими
фазамй
и
темпе-
ратурой.
|1оскольку
энергия
связи
иона
кислорода
с
металлом
дос-
таточно
велика'
и3вестное
число
ионов
Ф2_
мо>кет
перейти
в х{идкое
}келе3о'
о,1,;,
:
Ф1^,"'1*
2е.
(у'
26)
.
Фднако
при
этом
нару1шится
электронейтральность
обеих
фаз.
из-за
недостатка
отрицательнь1х
ионов
1плак
зарядится
поло}кительно'
а
металл
благодаря
присутствию
анионов
кис-
лорода
-
отрицательно.
?ак
как
в проводниках
избьтточньте
зарядь1
вь1талкиваются
на
повер_хность'
то на
границе
ра3де_
ла
металл-1плак
появится
двойной
электринеский
слой
и
во3никнет
связанньтй
с ним
скачок потенциала
||рисутствие
двойного слоя буАет
затруднять
дальнейтший
переход
анионов
кислорода
в
)кидкое
)келезо.
Бсли
поверх_
ность
ра3дела
не
сли1пком
велика
(т.
е.
знанительно
мень!ше'
чем'
например'
в
эмульсиях)'-то'
как
доказь1вается
в электро_
ху|му!и'
достаточно
весьма
небольшого
количества
избь:точньтх
430
0,1
зарядов'
чтобы полностью затормозить
переход анионов
Ф2-.
€ледовательно, ошутимь:й
макроскопический
переход
их
станет возмох(нь1м
только при
условии'
что он 1{е булет
со-
прово)кдаться
дальнейтпим
увеличением
как
плотности
3аря-
да
обкладок
двойного
слоя,
так и
скачка
гтотенциала.
3то
условие
реализуется'
в
частности'
тогда, когда
наряду
с
анионами
кислорода
из
1шлака'в
металл перемещается
экви-
валентное по
заряду количество каких-либо катионов:
м'?[-у:
!|0@е,'
-
2€. (у,27'
1акому перемец1ению
способствует и
располо}кение
3аря-
дов двойного
слоя:
избьтток полох(ительнь1х ионов
в 1шлаке
вь1талкивает и3 него
катионьт' которь|е притягиваются
отри-
цательнь1ми
зарядами, в избьттке находящимися
в металле.
€огласно
ряду
напря>кений,
равновесная
концентрация в
>кидком }келе3е
долх(на
бьтть наибольшей
у
катионов тех ме-
таллов'
которь1е
в
данной
системе
являются
относительно
наиболее
благородными. Б
рассматриваемом
случае
это
бу_
дут
катионьт
}келеза' которь1е и
сопровох{дают переход анио-
нов Ф2_:
Ре12}11
:Ре1""'1
-2е.
(у,28)
Бне
зависимости
от того'
сильно |\л\4
слабо
растворимьт
кальций
и
магний в
расплавленном
)келезе, переход
их в
за-
метнь1х
количествах
и3 1плака
в металл
здесь маловероятен.
|]оло>кение
€а и ]\{9 в
ряду
напрях{ений
таково, н!о
они,
находясь
в
металле'
дол)кнь1
вь1теснять
и3 1шлака
ионь1
>келе-
за и переходить
практически
полность]о
обратно в 1плак:
€81мет1
+
ге|"|,'+ Р€1мет1
+
€'&+о. (у'
29)
(роме
того'
с
помощью
радиоизотопа
€а{5 бь:ло показа-
но
[35],
что
растворимость
кальция
в х{идком
)келе3е; нась|-
щенном
углеродом
и находящимся
под
1плаком
€аФ
-
А12о3-
5|Ф2,
меньше 6. 10_50/0.
1аким
образом,
в
разбираемом
примере
сопрово)кдать
переход
анионов
кислорода в металл могут
в
основном катио-
нь1
}келеза:
Ре|.+'1
*
ФЁ':: Р€1мет)
$
Ф1мет). (у' 30)
Ёе
слелует'
однако'
полагать' что
при
этом
исчезнет
двойной
слой и
скачок
потенциала. 3то
не произойдет'
так
как
тенденции
к
перемещению
в металл
у
ионов о2-
и
Ре2+
(определяемь1е
их
энергиями
свя3и с
фазами)
разлинньт.
Бсли
это
стремление
больц.те
у
о2_, чем
у
р"2*,
?6 образуется
двой-

ной
слой
с отрицательнь1м
зарядом
на
металле
(и
полох<и-
тельнь1м
в тплаке),
которь:й
тормозит переход
Ф2_
и облегчает
переход
Ре2+.
\
Ёа'п,р,оти'в,
если
тенденция
к перех,оду
у'ио'но'в
Ф2-
ме,нь:!е,
чем
у
ге2+,
то
располо)кение
3наков заряда в
двойном
слое
буде'
обратнь:м
(в
металле избьтток
катионов, а в |'плаке
_
анионов),
что так)ке
вь1равнит скорости перехода
обоих
сор-
тов ионов.
йз сказанного
ясно' что
термодинамическая окислительная
способность
1плака не
мо)кет
определяться
только концентра_
цией
всех имеющихся
в
нем
анионов кислорода.
Фна зависит
так)ке и
от концентрации в 1плаке
катионов Ре2+.
Фкислительная
способность 1шлака
3ависит, следователь_
но' не только
от
содерх(ани! в
нем
РеФ,
как
это
вь|текает и3
молекулярной теории,
а определяется
одноБременно концент-
рацией
всех ионов
кислорода и концентрацией
ионов }келеза.
14наче
говоря,
дах(е
в простейтпем
случае
(без
уяета
коэффи-
циентов
активности)
термодинамическую
окислительную
спо_
собность
1шлака
ну}кно
измерять
не мо'1ярной
долей
закиси
х(,еле3а
]'{'п"о, 8 пр'о|и3'ведени,ем
ио,ннь1х_долей кисл,ор,ода
и
)ке_
леза, т.
е.
1{'р"2{
.
|/о2-.
3лутяние
двуокиси
кремния
1{а
окислительную
способность 1плака
Рассмотрим
теперь'
почему окислительное
действие
!плака
при одной и
той )ке концентрации
3акиси }келеза падает
пр!|
добавлении
51Ф2.
Бсли
бьт шлак не
содер)кал 51Фэ и
других
кисль|х и амфо-
тер]{ь1х окислов'
т.
е. если бьт
он
состоял' например'
только
из
,РеФ,
€аФ и
&18Ф, то
концентрация ионов
кислорода в нем
бьтла бь:
практически
постоянной, несмотря
на
сильное
изме_
нение
соде_рх{ания
отдельнь|х
компонентов.
6тепень
перехода
анионов
Ф2_ в
металл
в этом
случае определялась
бь: в пер_
вом прибли)кении
ли1пь
концентрацией ионов
Ре2+ в шлаке.
Более
точно
(и
в
этом
ска3ь|вается отличие
реальнь1х
1шлаков
от совер1пеннь1х
растворов)'
тенденция
к переходу
зависела
бьт
не
только от
ионной
доли
ге2+,
но такх(е
и от
концентра-
ции других
катионов'
поскольку они
с
ра3личной
энергией
удерх(ивают
анионь|
Ф2_
в !|]лаке.
Аобавление
двуокиси
кремния приводит
к значительному
увеличению
свя3и ионов
кислорода
со 1'плаком. Бследствие
этого
дах{е
при постоянном
содерх(ании РеФ введение
51Фэ
умень1шает
стремление
анионов
Ф2- к переходу
в металл. 9то
1,2
!,3
мо>кно'
например'
",,-''""'
пояснить
образованием
достаточ_
но
прочных
кремнекислороднь|х
ани_онов,
вследствие
чего
кон-
центрация
ионов
Ф2- снй>кается.
Б частности,
мох(но
пола-
гать,
что
в основнь|х
шлаках
при
добавлении
5|Фэ
во3никают
анионь1
5]Ф!_:
51о2
+
2о2_
--
5!о1_,
а в общем
случае-иот{ь1
5!"Ф!_:
х51Ф,
+
(у
*
2х)
Ф2-
-*
51рг.
(у'
31)
(у' 32)
1аким
образом,
если
в
молекулярной
теории
влияние
5!Ф2
объясняется
умень1|]ением
степени
диссоциации
ортоси_
л\4ката
)келе3а
на молекульт
свободных
окислов
Ре'5!Ф.]2РеФ
+
51о2,
(у' 33)
то согласно
ионной
теории
о}*о
является
ре3ультатом
падения
активности
анионов
киёлорода
или
(модельно)
уменьшением
их кондентрации
вследствие
образования
кремнекислородных
комплексов.
Аналогично
действуют
и остальнь1е
кисль1е
ионы
(Р2Ф5,'
1|Фэ и
лругие),
а тайх<е
РеэФз,
А1эФз
и
им
подобньте,
если
они пони)кА$г
462_,
например'
тем'
что присутствуют
в
фор_
ме анионов
и
связь1вают
тем
самь1м
ионь|
кислорода.
о
Фбессеривающая
способ1{ость
1шл
ака
Фбратимся
далее
к
вопросу
о том
почему
термодинамиче_
ская
(1.
е. относящаяся
к
условиям
равяовесия)
обессериваю-
щая
ёпособность
1плака
является
функшией
содер)кания
в нем
€аФ.
||усть
сперва
в
}келезе
отс-у_тствует
раствореннь:й
кисло_
роА!
тогда
переход
анио'нов
'$2-
из
шлака
в металл
так
х(е'
как
и
в
случае
иона
Ф2-,
будет
сопр^ов^о}кдаться
перемещением
катионов
Ре2+.
8ведение
в шлац
€аФ
ослабляет
тенденцию
ионов
52_
к такому
переходу,
во'первь|х'
потому'
что
пони_
)кается
концентрац].|1я
к'ак
52_,
так
и Ре2+
и' во-вторь|х'
вслед_
ствие
того'
что
увеличивается
переход
в
металл
анионов
Ф2_-
|1оследнее
так)ке
сопрово)кдается
перемещент1ем
и3вестного
количества
катионов
Ре2*,
и3-3а
чего
умень!шается
число
ионов
ге2+'
приходящихся
на
долю
анионов 52_
при
их
пере-
ходе
в
металл.
Ёапротив,
если
в шлаке
повь|сить
содер}кание
не 6аФ,
а
!!1пФ,
то' как
и в
предь]дущем
случае,
концентрации..
ионов
52-
и
Ре1+
понизятсй.
Фднако
поскольку
металлический
мар-

|з].ц }
Рялу
напря)кений
6ли>ке
*
*Ё'."у'
чем
кальци
й
или
у:ц"й'
постольку
его
катионь1
в
извест1?'а-й"!."йБй
.'-
прово)кдать
переход
анионов
52_
и
Ф2-
в
металл.
3то
ослабит
действие
второй
причинь]
(сводйеася
к
умень1пению
доли
катионов'
сопровб>кда!Фщих
анионьт
серьт)
;
;;;;;;;Б
й",,-
сит
1|]ансь1
перехода
анионов
$2_
в
метал;.
ь
;;ь;";;;;;;"""
'*%б::::3^ф31тчвньтм
буАет
"".дЁ,й.
не
мпс],
а
Ё;а.*-
0 появлением
в
металле
определенной
.',цЁ,"рйи
рас-
творенного
кислорода
компенсация
3^ряда'
необходима
я
для
макроскопического
перехода
анионов
серь1'
мо}к-"'
'-уй*-"-
вляться
не
только
перемещением
катионов
)келе3а
г"|*:
*
$&-"л
?Ре1м"'1
ф
$1мет).
-.--^113{9.'чну:о
роль
мо}кет
играть
так)ке
переход
кислорода
в
обратном
направлении:
€1*.,"т1*
ойл
?
(Ф6,"1
|
2е,
51смет)
_|-
4о;;:5|Ф!1',1
1-
4е,
&"е': *
4о;;:
РФ!*'1-1
5с,
металл
получает
избь:ток
отрицательного
3аряда.
для ощут|{мого.
макроскопичёского
течения
этих
*199*941""
компенсирующие
переходь{
в
основном
ге.т
и3
шлака
в
металл.
(у'
34)
анионов
5й:
*
Ф{""")?$1""'1
{
Ф|'__,1.
(у,
35)
Б
конечном
итоте
установится
-равновесие'
отвечающее
трем
реакциям:
р.аспределению
г?,о
1-йо!,
Ё.Ё'!м,з+1
и
взаимодействию
(_у:3ь).
|!оскольйу
,р,
введении
в
|цлак
ок\4с|т
кальция
активность
анионов
"
*ислорода
повь1!пается'
это
так)ке
способствует
сдвигу
ра_",_',.."й.|?,зь1^""'"!];
"
..
в
сторону
обессеривания
ме'айл1
шзо:.
Фкисление
примесей
|!ерейдем
теперь
к
окислительнь1м
процессам.
_^-1у{:"ие
у.'ерод.1:-1!9'*'"
"
ф";ййъй;
3ависеть
не
::::::
от
концентрации
анионов
кйслорода
в
1]]лаке,
но
и
от
содер)кания
в
нем
катионов
)келеза.
ъ-й;**;ЁЁЁ;
]]
,..*
этих
случаях,
с
одной
сторонь['
*'.','д"',
например'
из
сле-
А}ющих
возмо)кньтх
схем
|':
(у'
36)
(у,37)
(у'
38)
|1оэтому
пРоцессов
катионов
1
€хемы
даньт
без'
|{ь|х
соединений
Ре5!
и
'ьЁЁ:*
в
явной
форме
факта
существоваЁия
проч-
€
лругой
сторонь1'
полнота
сдвига
указаннь1х
равновесий
булет
определяться,
кроме
концентрации
анионов
кислорода'
т!к>ке
эт{ергией свя3и
их
со
1плаком.
Блияние
добавки
5|Фэ
мо)кно
трактовать
двояко
-
ли6о как
умень|шение
концентра-
ции
ионов Ф2_,
ли6о как
усиление
их свя3и с
расплавом.
Б том и
другом
случае
введение
51@э будет
способство-
вать сдвигу
равновесий
влево.
Аля
кремния смеще}1ие
в
эту
сторону
становится
3аметнь{м
ли1]]ь
при значительном
содер-
>хани|4 51о2.
в этом случае
реакцию
правильнее
переписать
в
следующей
форме:
5!1,1:1Ф!"1",1,)'у
*4е?$|,Ф3|*,:
$
5|1мет).
(у,
39)'
.1акое
направление
взаимодействия,
т.е. переход
5|
у!з
|ллака
в металл,
назь1вают обьтчно
кремневосстановительнь|м
пРоцессом.
-
Реакция
удаления фосфора'
как
показь|вает
опь1т' более
чувствительна к
и3менению содер)кания
51Фя.
3амена
одн0го
основного окисла
другим
влияет
на
энер-
гию свя3и
аниона кисдорода со
1плаком
и на прочность
ком-
плекснь1х
анионов. |1оэтому
введение €аФ вместо
'РеФ,
с од-
ной сторонь1'
долх(но
способствовать
сдвигу
равновес|\1,
||2,-
пример
(у'3в)'
вправо.
€
лругой
сторойьт, пони}кение
концентрации
катионов
Ре2*,
осуществляющих компенсаци1о заряда,
будет
тормозить
реак-
ции
окисления"
1аким
о'бразом,
дол)кно
существовать
оптимальное соот-
но1пение
концентраций РеФ и €аФ,
наиболее благоприятное
для
удаления
примеси
(в
настности
фосфора
[37])
из металла.
Фграниниваясь этими примерами,
3аметим,
что
распреде-
ление
элементов
(>келеза,
меди'
никеля,
ко6альта,
кислорода
и
серьт) между >кидкими
:'штейнами
и 1шлаками, а так}ке
в
ряде
других
случаев
мо)кет бьтть
рассмотрено
аналогичнЁтм
образом,
}равненпя
равновесшп
|!олагая,
что
равновесие
устанавливается
в
ре3ультате
в3аимно
обусловленного
процесса
распределения
катионов
и
анионов'
дадим
вь1вод
уравнений,
пользуясь электрохимиче
ской
термодинамикой.
Аначе
говоря'
при
вь1воде
условий
равновесия
булем
по-
лагать'
что ионь| ка>кдого вида'
распределяясь
ме>кду
метал-
лом
и 1плаком'
участвуют
в
о6разовации
двойного
электриче-
ского
слоя
и в во3никновении скачка
потенциала.
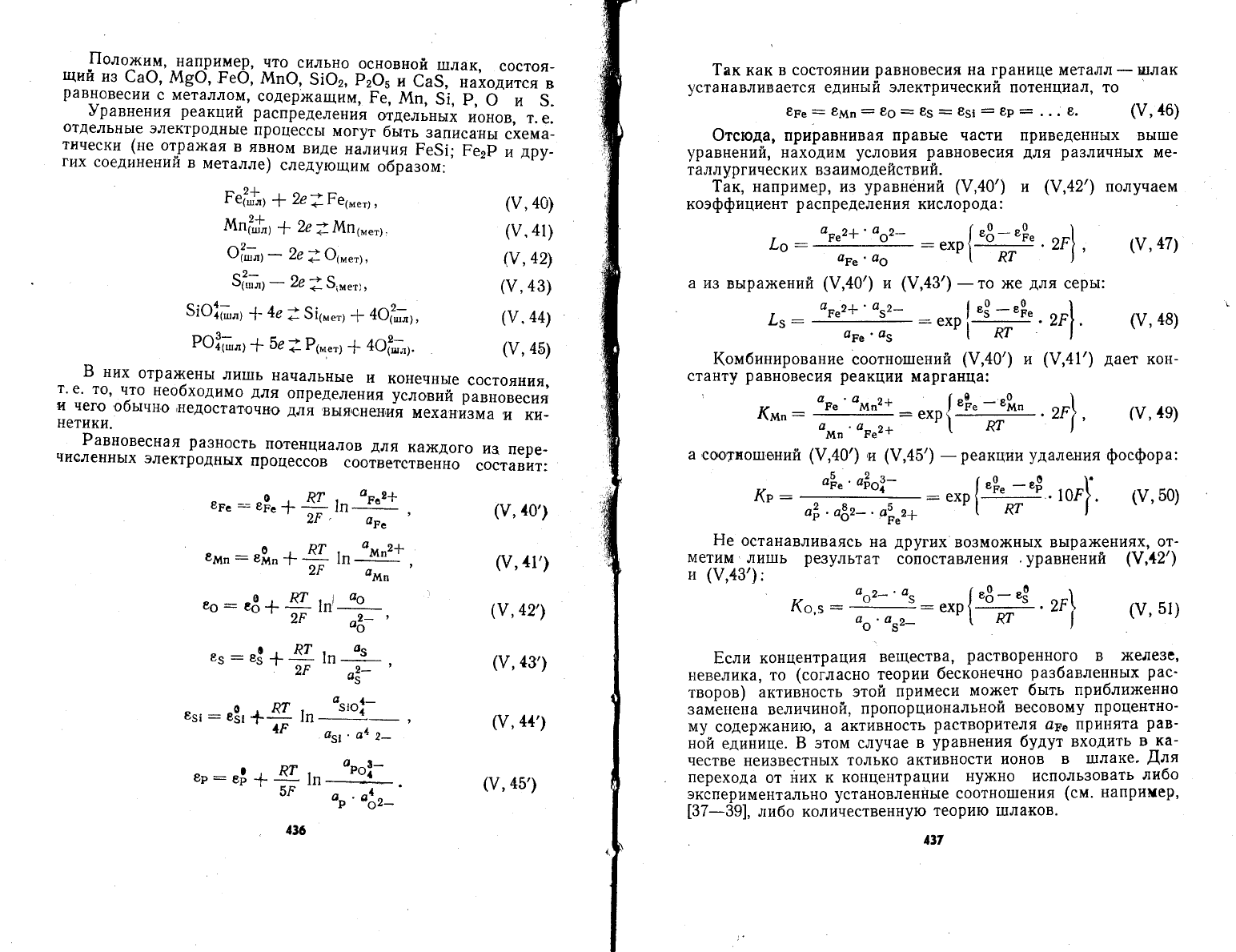
.00''чщ,_напри},{ер'
что
сильно
основной
|'шлак,
состоя-
щий
из
€аФ,
.г!19Ф,
.РеФ,
}1пФ,
5'о2,
Р2о5
,
са5,
й'}'д-й{."
,
равновесии
с металлом,
содер)кащим,
Ре,
йп,
5!,
Р,
Ф
и
$.
9равнения
реакший
распЁеделени}
*дел,ных
ионов.
т.
е.
отдельнь|е
электроднь1е
процессь|
могут
быть
записа'ньл
схема-
тически
(не
отра>кая
в
явном
виде
наличия
Ре5!;
Ёё'Ё
й
дру-
г|'|х
соединений
в
металле)
следующим
образом:
' '
Р.&1:
*
2е?Р€1мет),
/'1','*,
*
2е
?}1[1мет1,
о?,,;;
_
2е
/01'",1,
5&-:_2е]51мет;,
5'о1й,)
1-4е?5!1ме':
*
цФ?йу,
РФ!Б,:
*
5е
?
Р1'",)
*
{оЁй,.
(у'
40)
(у'
41}
м,42'|
(у'
43)
{у.44)
(у'
45)
(у,,ю')
(у,41',)
(у
,42','
(у,43',)
(\{
,44"1
(у,45',)
Б
них
отрах{-ень1
ли[шь
начальные
и
конечнь1е
состояния'
т.
е. то'
что
необхоАимФ
Аля
определения
условий
р.,*'й"с""
и чего
обь:чно
,недостаточн,о
для
,вь1я|онен'ия
механизма
и ки_
нетики.
-__
_|авновесная
ра3ность
потенциалов
для
ках(дого
и3
пере_
численнь|х
электродных
процессов
соответственно
составит:
|п
,""'+
,
@рс
1п
'м''+
,
4м.
ер:
е3
+
дг
'5л
(,
!-
'
5|о;
|п
'-
'
а$'а1
2_
т,
1''!
'
а".
в[э-
€г.:
е3-
+
#
8м,:*!,'+#
ео:е3+$т"1
ез:
в3
+$
:п
ф'
о5
;г'
€з;
:
е8:
+#
1ак
как
в состоянии
равновесия
на
границе металл
_
ш1лак
устанавливается
единьтй электрический потенциал, то
0ге:€мп:€о:05:85|:8Р:...
8.
(у,46)
Фтсюда, приравнивая
правь1е части приведеннь|х вы!пе
уравнений,
находим
условия
равновесия
для
ра3личнь|х
ме-
таллургических
в3аимодействий.
1ак, например' из
уравнений
(у,40')
тт
(\+/,42')
получаем
коэффициент
распределения
кислорода:
|з:
оР"2*' а52_
6Ре
'@9
1(омбинирование
соотно,1пений
(у,40')
и
(9,41')
станту
равновесия
реакции
марганца:
'г-
.
'*'2+
[
'$"
_
"'
\
](м,
:
*#
_
ехр1-ъ.-
.
''|,
а
соотно1шоний (!,40')
и
(!,45')
_
реакции
удаления
|-о:
аРе2+.
ао2_
аР.'
4о
а и3
вь1ра}кений
(9,40')
и
(\ь/,43')
-то
}ке
для
серь1:
-ехр{$#.',}
,
(у,47)
:
ехо !
'3
_'$"
.
2л}.
'1
дг ,
(у' 4в)
дает
кон-
(у'
49)
фосфора:
других
возмо)!(нь|х вь|рах(ениях'
от-
сопоставления
'
уравнений
(у
'42')
:(р
:
.'"
.
й'_.
'}"'+
'?..
'3о1_
-
ехр
{
'ь;'3
.
,',|. (у,50)
Ёе
останавливаясь
на
метим
лишь
ре3ультат
и
(9,43'):
/(о'з
:
1*...!':
ехр{'3;'3
.
,,}
ш,51)
ао'а32-
\
Бсли концентрация
вещества'
растворенного
в )кеде3е'
}1евелика' то
(согласно теории
бесконечно
разбавленяь1х
рас'
творов) активность.
этой
примеси
мох(ет
бьтть
прибли}|(енно
заменена велининой,
пропорциональт:ой
весовому процентно_
му
содер)канию'
а активность
растворителя
сге
принята
рав_
ной
едийице.
Б этом случае
в
уравнения
будут входить
в ка-
честве
неизвестнь1х
только
активности
ионов
в
тплаке.
Аля
перехода
от
йих к концентрации
ну)кно использовать
лнбо
экспериментально
установленнь1е
соотно1шения
(см.
напришер,
[37-39],
;:ибо количественную
теорию шлаков'

Б
тех
случаях' когда металлическую
фазу
нель3я
рассмат.
ривать
как
бесконетно
разбавленньтй
раствор
(нугуньт,
спе-
циальнь1е сталу!,
ферросплавьл,
тптейньт),
замена
активностей
процентнь!м
содер>т{а,нием становится
недопустимой.
Ёарялу
с
эмпирическими
3ависимостями
степени
отклонения
метал-
лической
фазьт
от
идеального
раствора'
мо}кно
восполь3овать"
ся
у!авнениями
количественной
теории
этих
растворов.
€ледует
учесть'
что'
как правило'
на
опь1те
определяются
активности элементов
|1л|1 |4х
соединения'
а не
ионов.
|1оэто-
му
в
вьт!пеописаннь|х
формулах
произведения
ионнь|х
актив_
ностей
мо)кно
3аменить
активно'стью
того
или
иного
окисла'
сульфида
или
другого
соединения.
Ёапример,
ау"{4.ц,2_:
:
4гео1тлл1,
ам||2+|
ауе2+:
&м,о|&уео,
аро1_]ао''-':
аБ'',
й'.
п.
1огда
вь]ра)кения
.(у,47)-(у,51)
примут
о6ьлчньтй
Б[А;
в
частности:
'|
[о
_
4Рео(ш:л1]
(р
:
а?1'ар'о,
4Рео1*ет;
4.'|"о
Ряд
папрягпенпй
|(ак
видно
и3
вь|1'пеприведенньтх
уравнений,
коэффициенть:
распределен|1я
и
константь1
равновесия
могут
бьтть_экспери-.
ментально
найденьт
не
только
обь:чньтми
химическими
мето-
дам#'
но
и
путем
измерения
электродви}кущих
сил.
_--_,1ч'""*ишее
развитие
и
уточнение
метод|1.ки
так\1х
и3мере-
нии
по3волит
построить
электрохимический
ряд
напрях<ений
для
>к11'дких
1плаков'
если
принять
^
3а
стандарт'
например,
нормальнь1й
потенциал
кислорода
е$ или
х<елеза
в$-
^.
Фбратно
ряд
напрях(ений
для
р'с,''.'-,",'"
'',*"'в'
т. е.
наборвеличин'нормальньтх
потенциалов
''.*."'ой
1йп,
б' з;,
о' у'
А1
и
з.
д.)
по отно|пению
к таковому
для
х<елеза (или
кислорода)
мо){(ет
бьтть
вь:числен
по вь11поприведеннь]м
урав-
нениям
и3
значений
коэффишиентов
распределе|\|1я
и констант
равн-овесия,
найденнь:х'
неэлектрохимическими
методами.
Ёапример,
если
воспользоваться
для
реакций
Ре
{
:}1еФ1,,
Ф
:
йе
{
РеФ1шл:
(у,52)
экспериментальнь|ми
даннь1ми
[40]
для
<(констант>>
равновесия'
п1одсчитаннь1х
по
идеальному
3акону
действующих масс
2,
-
$е9)
[А4е|
'\
-
@@|Б1_'
а38
(у'
53)
то
и3
уравнения
е$"
_
е&,
:
0,0001 719 /(,
(у'
54)
ана)тогичного
вь|ра)кению
(9,49)
'
мо'}кно ориентировочно оце-
нить
ра3ность
стандартнь1х
потенциал0в
для
р.асплавленнь1х
оксидов,
т. е.
величину
(е%'"
-е*',),
необходим}ю
для
по-
строения
ряда
напря>кений.
1аблица 46
сопоставлсниа
р!зно€тей
ст!нл!Ртнцх
пот6нцхалов
для
Ра(пл.влон|!ч|
щл8ков
и
зоднн|
РаствоРов
водные
ш!
€ц
}1п
€о
+0,51
-0,25
+0,66
-0,18
-0,
33
-0,56
-0,19
-0,96
3 табл.
46
сопоставлень1 вь1численнь1е
таким
путем
3наче-
ния (в\''"
_
"}",)
с соответствующими
величинами
для
вод-
нь]х
растворов.
1(ак видно из табл' 46, порядок следования
и
знак
ра3ности
потенциал'ов в обоих
рядах
сохраняется одинаковь1м'
3а ис-
ключением парь:
т}.{|,
€о. |!отенциаль| последних
в воднь|х
рас-
творах очень
немного
отличаются
друг
от
друга.
Бследствие
этого
неболь1пое
различие
температурнь1х
коэффициентов
легко мох(ет изме1]ить их поло>кение в
ряду
напря>кений при
повь1щении темпер
атурь|.
Аналогичнь1е
расчеть|
могут бьтть
сделань1
|т
для
других
элементов' если
и3вестньт
соответствующие 3начения
|-;
п
!(;.
с
другой
сторонь|'
стандартнь1е
потенциаль1
металлов
("*')
и
других
веществ
(например,
е!)
могут
бьтть с
извест-
ной
точностью
оценень1 по
изменению изобарнь1х
потенциалов
(А7")
соответствующих
реакший.
1ак,
например''
3начения
62'
известнь]
при
различньтх
температурах
для
реакций
обра-
зования
окисл'ов уз
элементов
(см.
т. |
этой монографии,
стр.
354, 664):
*
',
*
Фв
:
_!_
ме^о
'..
2
||оскольку
в этом случае
^2о
-_
_
+л
(е$
-
е*,),
