Есин О.А., Гельд П.В. Физическая химия пирометаллургических процессов. Часть 2
Подождите немного. Документ загружается.


197. г'
А. 1опорищев' о.
А.
всин,
€'
[.
Братчиков.
[1зв-
вузов.
|-|,ветная металлургця,3' 37, 1961;
1'
50' 1962;
4'
39'
1960.
198.
ш.
Рц|1'
51а}:1 шп6 Б!эеп,
47'
1543'
1927.
199. о. А.
Бсин, Б. .]!1. .[!епинских. йзв.
Ан
сссР'
отн'
2'
60'
1954;
)|(.
прикл.
химии' 32' 313'
1959.
200.
к.
1-.
(
! е з е 1.
}х]еце Ёт!{1е' 6'
157' 1961.
201. о.
А. Рсин, А.
(.
[аврилов,
Б. й. ,г|епинских..[,окл_
Ан сссР' 88'
713' 1953;
){.
физ.
хим., 30' 3' 1959.
202.
ь. € [: а п
9,
6. }' е г
9
е. ,&1е1а1з
'1ес}лпо1о9у,
10, 1946.
203.
к..
5
а
& а
9
а гп !.
.]. |гоп апг
51ее1 1пэ1. )арап, 39,
587, 1953;
Реф. х<.
<<{имия>,
10'
19595' 1955.
204.к. 5апбоп9|,
!.
Фгпог!.
.|.
1гоп ап0
$1ее!
|пз1..|арап,2|'
296' 19571'
-Р}туз'
6!егп. :![е1а1э.
5о|ш1|опз ап6 !п1еггпе[а1!.
€огпрошп0з,
1|'
1959; 5с|.
&9р.п-...
1пэ1. 1о[:о!ц
1-]п!у, А||,244,
1959; Реф. х<.
*1м1еталлур_
гия>'
5,
8869'
1958;
1961,
11А53; Реф. х<.
<<!,имия>>,
5, 606о1, |960.
-
_
205.
ц.
5а[а9агп!,
]. йа1зшэ!!1а.
Рер.
1пз1. !п0. 5с!.
[1п!у-
1о}:о[ш,
7'
180,
1958; Реф.
ж.
<}1еталлургия>,
!0,
2!3в1, 1959'
206.
к.
5
а ту а 1!
ц г
а.
.]. !гоп ап0
51ее1 |пз1. }арап,
45,
238, 1959.
2о7.
о.
А.
Рсин.
ж.
физ.
хим.,
22,617,
|948.
'-
208. о.
А. всигт,
Б. }1. .|[епинских.
!,окл.
Ан
сссР, 95, 13б'
| 954.
209.
м.
€о|1-1а|а9оз,
с.
п.
Р[аззоп. 1гапэ'
Рага6ау
5ос.'
57,
162!,
1961.
210.
А.
| о з !
0
а.
}. }арап 1пз1.
^&1е1а1з,
24,
530, 1960.
21|.с. Б.
Байсбурд,
в.
А. хейфец.
|1зв. вузов,
!{ерная
ме-
таллургия' 5'
11'
1960.
---212^9.
^\-вч'н,
Б. _&1.
.||епинских'
в.
и. мусихин.
[1зв.
Ан
сссР'
отн,
|2,
120, 1954;
жФх'
32,
1372'
195в.
2|3.
в. и. миненко,
€.
}1.
||етров.
Ё. €. Аванова.
йзв.
вузов,
{имия
и химическая
техноло1.ия' |;
3, 1961;
)(.
Бсес.
хим.
об_ва
им.
А..1,1.-йенделеева,
5,
230,
1960;
€текло и керамика'
3, 29, 1959.
2|4.
\^/.
А' Р ! з
с
[:
е г.
Р!уз.
€|легп. 51ее1йа!<!п9,
€агпбг|69е, |{. 1.'
1958,
79; Агс[:.
Р|зеп[:{]{1епшезе|,
24,
3о7,
1953; 26,
?з,
оз, тэь3.
215. А. А.
А п п е
н.
8.
прикл. хим.'
26,
9, 1953.
-^-2|6.о.
А. всин,
Б. .]!1.
-,г!епинских.
.[[окл.
Ан
сссР,
9|, 1187'
1953.
..-21]:
к.
_9_'цбоп9|,
1.
Фгпог1.
5с1.
&ер.
Рез.
!пз1. 1о[:о|<ш
1_]п!у.,
!!А'.339,
1959;
.]. .}арап,^!з1.
}1е1а1з, 22'
316,'1958;
25,
136,
1961; Реф.
}:^:$е19{дургия>'
15,
60691,
1960; 9' 19130,
1959; Реф'
'х<.
.*и*ия,'"
7Б358'
1962.
218. о.
А.
Бсин.
йзв.
Ан
сссР, охн,6,561,
1948.
219.
в.
1шг[6о9ап'
1. Реагз:оп.
!. 1гоп'ап0
51ее1 |пз1., |73,
217.1953.
.^-}29
^1
. !^--вр_:ш^99а'
9'
и'
Фльтшанский.
[еохимия,2,
|44,
1957; 3, 214,
1957;4,
296,
1957.
221. |..
(!.
6е
\{уз. .&1|пега1
йа9.,
32,
47\,
1960;
Реф.
х<. <{имия>,'
|5Б376'
196|'
222.
и.
Ё.
Б
е
л
я
е в.
}сп. хим.,
29,
899, 1960.
-
223.'^.
ц
(вя_тк--ов-сций,
о.
А-Бсин,
м. А.
Абдеев,'
о. А. х а н.
Бестн.
АЁ
(аз(€Р,
2' 19, 1960;
)(.
физ.
хим.,
3!,
:цоз'
:эоо.
9?4.в.
и.-орлов'
9-.
А. всин'
|[' м
щурьт1и',
й. а.'й!р:
сто_б_итов.
_и3в.
вузов,
9ерная
металлургия,
11,'|2,
1960: 5,
2в-
1961.
'
.--221.-ц.
^!,_Барча-т1'-_о.
А. Рсй'н.
€.
к.
чу,".ре'".-
изв.
Ан
сссР' отн,
9,
114,
1957.
226. н.
5с}дгп
а1ат|е
0'
7.
р!уэ.
€}:еп.,
25,
178,
1960.
227'
о.
А'
Рсин,
А.
Ё. 3ахаров.
14зв.
вузов,9ерная
металлур-
гия, |0, 9'
1959.
'228'
^'
Ф. Борисов'
Ё.
(.
Аертев.
йзв.
вузов.
{имия
и
химиче_
ская технология'
3. 420. 19б9.
технология,
3' 420' 19б9
229.в'.
Ф. [росс.
Б.
,
229.
р,. Ф. [росс,
в.
А.
(олесова.
€б.
<|1амяти
(.
А.
Бавило-
ва>'
изд-во
Ан сссР'
23],' |952'
230.
н. Б|ооп.
!|зсцзз. Рага0ау
5ос.,32,7'
1961.
231.
А>к. А.
Бернал.
9сп.
хим.,30'
1312' 1961.
232. ]. 7атпус-|'|'
.}.
р[гув.
е1
га6!цгп,
!9' 13А' 1(
232. ]. 7'а'тпус-\<.|'
}.
р[гув.
е1
га6!цгп,
!9, 13А, 1958;
Реф.
;к'
<{и_
262.,]. 1-ат2ус
мия>,
!0,
34103' 1959.
233.
я.
1(.
(
ьт
р
к
и н. }сп.
хим.,
31'
397' 1962.
234.(овещание'
посвященное
обсу>кдению
электроотрицательности'
[.
структ.
хим.,
3, 495' 1962.
235.
Б. Ф.
Фрмонт.
,]
235.
Б. Ф.
-Ф
р
м о
н
т.
Аокл.
АЁ сссР,
106,
687,
1956;
['.
физ.
хим.
3|, 509, 1957.
'%6.^.
Ф. |(апустинский,
к.
Б.
[цимирский.
)(,
общ-
хим.,
|9, 2191' 1949'
237.
Ё.
А.
6ц99еп1те!гп.
!!зсшэз.
Рага0_ау
5ос.,
4,
91]' 1919
238..!.
|шпэ[й.
.:\4е{а11шг9!са1
5ос.
€оп1егепсез,7,
165, 196|;
!|э_
спээ.
Рага6ау
5ос.,
32, 138, 1961.
239.
$.
1а[епс[:1,;|(.Рцгп[атуа.5с!.
|ер.
&ез.
1пэ1.
1о[то[ш'
[-.]п_|у.,
^12,
|28, 137,
1960; !. .}арап
1пэ1.
.]!1е1а1з'
!9,
165,
1955; }1е1а|1шг9|са[
5ос.
€оп1егепсев,
7' 245'
1961,'
240.
н. в. Б
е л
о
в. 1(ристаллохимия
силикатов с
крупнь!ми
катио_
нами. Р16д-во Ан сссР, 1961'
24|.
А.
Ё.
"т]а3арев.
Фптика
и спектроскопия,4,805'
1958;8'
614'
1960; 9, 195, 1960.
242.
м. [. 8оронков.
,[1окл.
Ан сссР'
_!38'
106' 1961.
243.
^'
Ё. .]]1
а
з_а
р
е
в.. 14зв. Ан сссР,
охн' 7'
13ц' 1962.
244. Р..
€|л.
6е
''0/1,..
}[1пега1
}1а9., 32,
640,
1960; Реф. >к.
<<*,имия>,
15к274' 1961'
245.Р.
о.
п;с}:аг6эоп'
11'те с1тап9|п9'йй'ог16
о1 11-:е
Бх1гас1!оп
?!1е|а11шг9[з1'
|' 1958.
246.-с.
1#.
1о о
р,
с.
5.
5
а гп ! з.
1гапз. !1е1а1!. 5ос'
А!]\{Б'
224'
в78.
1962.
247. ].
о'м.
Бос[г|в.
)!зсцзэ. Рага0ау 5ос.,
32,76' 253' 1961.
248. )!зсцзз.
Рага0ау
5ос.'
32'
1961.
249. п. в.
гельд' о.
А. Ёсин'
.[1.окл.
Ан сссР,
70,473,
|950:'
[.
прикл.
хим.,
23, 1200'
1950.
250.
с'
'т!.
Б
г а 6
у.
.|. €Беш.
Р[туз.,
28, 48, |958.
251.
о.
!{'!|||атпз,
к.
Р1 а66ос[<з, в.
Бга6бшгу.
.}.
5ос.
61азз
1ес[дп.,
43, 308, 1951.
252.\/'/.
Бцез,
Ё. 6е[гг[в
2. апог9. шп6
а119егп. €|егп.,288,307'
1956.
253.
А.
)|е1ае1.
н. Рое9е1.
\а1шгш!эзепзс1':а|1еп' 40'
604'
1953.
254.
.т.
о.
!!1 а с |< е
п а ! е.
).
Р[уэ.
&еу.'
63' 1875' 1959.
255.
в.
А. |!
а з
у
х и н. }сп.
хим.,
21,
3\3,
|9б2.
256.
в.
||.
йашовец. 3лектрометаллургия
алюминия. !{еталлург_
издат'
1938.
267.
^.
и.
Беляев.
Физико-химические
процессь1
при
электроли3е
алюминия.
1!1еталлургиз
дат,
|947.
258.
с.
й.
Ремпель.
Аокл.
АЁ
сссР,
76, 411,
1951'
.-- ?59
€.
к.
чучмар ев,
Ф.
А. Бсин, 3.
А' ||астухов.
.[окл.
Ан
сссР'
!50,
10о4,
196з.

260.
в.
А.
к')кеуров.
)(.
физ.
хим., 26,.694,
1951;
1р.
! конфе-
ренции-
по
физ.-хим.
осн'овам пр_ва
стали'
изд-во АЁ
сссР,
|!9ъ|.
261.д.
м.
'г|аптев,
в.
А.
|(о>кеуров.йзв.'вузов,9ерная
металлургия'
|а
8' 1961.
---29?.-1.
4.-
оренкель.
|(инетическая
теория
>кидкоотей.
йзд-во
Ан
сссР'
1945.
263. п. 3. [ельд,
А.
|.
(ологреева.
)|(.
прикл.
хим.' 21,600,
1948.
294. с.
(.
!{учмарев'^
о.__А'
всин'
/1.
Ё. Бармин.
14зв.
ву_
зов, 9ерная металлургия'
8,
9, 1961.
265..с.^
4^^9учмарев,
Ф. А.
Рсин.
йзв. вузов,9ерная
металлур_
тия,
4, 12,
1963.
-^-^266.
Б.
в.
старк'
ю.
м. 1]]ашаков.
!,окл'
Ан
сссР,
в5,
125,
|9б2.
.^-^267'
п.
м.
11|урь;гин.
1р.
9ральского
политехн.
ин-та'
97,
84'
1959.
268.
А.
)чгог[|п,
Ё.
Бгопэ1е!п,
.&1.
8ге6!3.
}!зспзз.
Рага-
ёау
5ос.' 32,
188,
1961.
269. в.
А.
9к!де,д.
|.
Букун.
}сп.
хим.,
30, 243,
1961.
270.
А:
|(1егпгп.
!|зсшзв.
Рага1ау
5ос.,32,
)оз,':ш1
--_
271.
к.
5. Р!1ъег.
]. Агпег.
€!ей.
5ос.,
в,|, эоуь,
тйу.
272.^.
м.
€амарин,
л.
А.
11[варцм-ан,
м.
и. 1емкин.
}{.
физ.
хим.,
20,
1|,
18э'
1946.
273.о. А.
Рсин,
Б.
А.
кожеуров.
[.
прикл.
хим.,2|,
765,
1948.
274.
т.
Р ё г ! а п с!-
Фп {|е
.ргорег1!ез
о1
эогпе
гп!х1цгев
о[
[шзе6
эа|1в,
$''вч
1е&п|[е
!!1епэ[арз
а|<а0ёп{
5ег!ез
2,
э,.:бьт;__Бйс;;'.-"ъ_.й;,
5ос., 32,
122,
1961.
?!1 | _9
,
1у.
}!зсшэз.
Рага6ау
5ос',
32,
64, 196!.
276' А.
й.
€амарин.
л.
А. ш"аршйан.
изв.
Ан
сссР,
отн,
0,
1457,
1948.
277.
я.
А.
Фльшанский.
!,окл.
Ан
сссР,
76,
93,
1951.
278.и'
^.
Ёовохатский,
о. А.
Бсин.
с.
к
чучмарев.
[,1зв.
вузов,
{{ерная
металлургия'
1!,
22'
1961;
[б,
ь,
:эо).
?19 Р. 4.ц_расов,
А._
Б_очвар.'
8.
общ.';;.;-ц'
1218,
1940.
280' в.
А'
(
о )к
е
у-Р
о-в-.
_
1р.
совЁщания
по
термодинамике
и
строе_
нию
растворов,
изд-во
Ан
сссР;
186'
|959.
28|.
Б.
1цг[0очап,
.т.
Реагзоп.
.1' |гоп
ап6
51ее1
|пз{., |53,
216.1953.
---2!?.^9.А.
Ёсин,.
Б'
}1.
.[1 епинских,
Б.
А.
|4усихин.
]4зв.
Ан
сссР'
отн.
|2,
'20,
1954.
283.
.]
с [
|р гп
а
п.--А,\е{а|1шг9!са1
5ос.
€оп1егепсе,
7,
27,
|96|.
284'
сь
о
ц
'}
а п-н];'
ёь%Б'
Ё;п;:'['1"!';'!-:.''
зЁ;.''ё;й/й
9,
Р87,
1962.
?85 д.
Ё.к"ргинцев.
йзв.
€ибирск.
отд.
АЁ
сссР.9,82,
1960'
286. м.
5 !
|
й о.|
|.
о;зсшзь-
Ёагаа!1!-5'..,
32,
|2в-,
-
п,61.
'
'
287. в. А.
кожеуров.
8.
физ.
хим.,23,484,
1949;
24,233,
1950.
288.-о.^А.^Б^син,
и.
н. 3ахаров'
14зв.
вузов,
н.р,'"
метал_
лургия,
10'
9' |959.
289.
с.
Бо0'плог1!,
|.
9ау!0эоп.
;!1е1а11шг9.
5ос. €оп[егепсеэ,7,
238,1961.
290.
в. А.
(
о )к е
у
р
о
в.
ж.
физ.
хим.,
2в'
729,
|954.
291.
и'
€.
(уликов.
йзв.
АЁ
сссР,
отн,
2,
113,
!955.
,12
292.и.
т.
9рывалин,
@. А. Ёсин.
йзв. вузов,9ерная
метал_
лургия, 6'
10' 1959.
293. в. А.
к
'
)к е
у р
о
в.
14зв. вузов,
9ерная металлургия,
3,
9' 1959.
?9!.]'
в' |г0,
.|. 1ау1ог.
?гапз.
Рага6ау 5ос., 54,_526,
1958.
295.и. 1.
€рь|валин,
Ф. А. Ёсин,
Б. в. {ль:нов'
}(.
не-
органич.
хим., 4,
877, 1959.
296.и.
1.
€рь|валин,
9. А.
Ёсин.
1,1зв. вузов.
{имия
и хими.
ческая
технология,
5,
825' 1961.
297.Б. н. Финк_ельц.ттейн.
|1роблемьт
металловедет{ия
и
физи-
ки
металлов'
1.'
275,
|952.
298. м'
€.
Блантер'
Б' н'
Финкель:птейн,
€.
11|.
[]]иль_
штейн..14зв.
вузов,
1{ерная
металлургия'
3,
10,
1960.
299. А.
д
4.у1о^Рицкий,
Б.'Ё. Финкельштейн,
й.
€.
(у_
ликов.
.('окл.
АЁ
сссР,81,277'
|95\.
300.
ц.
А.
к
'
)к
е
у
р
о в.
ж'
физ.
хим., 2в, 479,
|952.
301._и.
1._9р,'в_алин,
о. А. всин.
|4зв. вузов.
1{ерная
метал-
лургия'
5' 5, 1963;
9' 10'
1962.
---
302.в. Ё._-Б9р_оненков'
о. А. Бсин'
п.
м. 11[урь:гин.
)(.
физ.
хим., 38,
1148,
19&.
303.э.
А' 1-|ас1ухо,в,
о. А.
Рси,н,
с.
(.'!унмарев'
)(.
физ.
хим., 38,
1307,
1964; 3лектрохимия,
!, 78,
1965

!лава
четвертая
3ле!пенть]'
раотвореннь!е
в
петалле
}|
',,'.
о характере связей
ме)кду
атомами
металлов
и
'
раствореннь[х
в
них
элементов,
особенно металлоидов,
не-
мот!эя
на его больтпое 3начение
для
металлургии'
все еще
остается
одним
и3
наименее
разработаттнь:х.
Фбъясняется
это отчасти
его сло)кностью,
а
так)ке и тем' что значительная
часть
попь]ток его
ре1пения
основь1вается
только на
даннь1х'
относящихся
к
равновесию.
1акая характеристика системь1
недостаточна
и по'зволяет
ли|шь
частично осветить отдельнь]е
момецть1
рассматриваемой
проблемьт.'
1олько в
немногих случаях
бьтли
полуненьт
структурнь]е
и
кцнетические
даннь|е для
некоторь]х
элементов'
растворен-
нь1х
в х{идком
х(еле3е.
Ёи>ке
рассматриваются
результать1'
позволяющие сделать
известнь1е заключения о
форме
существования
раствореннь|х
элементов.
|.
Равновеоия
йе'!(ду
га3оп
и .'еталлоп]
Авухатопшь!о
газообразнь!о
эпеп|енть|
Бзаимодействие
двухатомного
таза
([)
с
металлом
{]у[е),
в
частности с )келе3ом'
мо}кет
бь:ть
представлено,
например'
следующей
схемой
1:
цщ+
*[2:4!'\-.
(1!'
а)
1
[|однеркнутьп
обозначения
веществ' образуюших
с
металлом
растворы.
,15

Фтсюда
-
_
||ри
небольтпих
давлениях
и
малой
растворимости
га3а
константа
равновесия
равна1
к:##=к,#.
Р|"_--
|('
||
я*1.
р/::
1('
[!.
'
(1у,3)
€ледовательно.
растворимость
двухатомного
газа
(Ё',
Ф:,
\э и
т.
п.)
в
металлё
,р'.'рцй1нальна
его
давлению
в
степени
#.
'.^--Р:]],".а
,'
определенная
!13
опь]та'
по3воляет
сделать
некоторьте
3аключения_о
форме
-уц*'','","""
растворенно-
го
га3а.
Б
самом
леле' еёли
*
:"1,
1о
уравнение
(1\/,2)
яв-
ляется
законом
[енри
и'
следовательно'
в
металле'
как
у|
в
газе'
имеются
стоу
.;
ъ
;;й].;_
;;ъънт3
ъ?:
"'#;у
}"''^
;ж:#
*#;'ж
лх
;
строения
1т1е,|2)'
9кспериментальное
изучение
изотерм
растворимости
во_
дорода,
а3ота
,
4Ругих га3ов'
,,','',.,''"
н.
,ц;;;Ё"^'*,
А.
А.
}\у^овь1м'
л'ё;;;;.й"ь."й:;""йским,
м.
м.
|(ар
на
_
уховьтм
и
А.
Ё.
.&1орозовым'
а'так)ке'
\Р!гими
авторами
(см.,
например'
|1_3])'
показало/,
нто
х
!
[|',
,.".
(|у'
1)
(|у'
2)
Б
частност",
м_
$.
(арнаухов
и
А.
Ё^.
|1орозов
[4]
устано_
вили,
что
х
:
1|э
(колебаЁия
''
б,1о_
у-
0,50)
.
д'"
.
Б'дБр'д'
в
)кидком
железе
при
температуре
]5ъъ;;Б3с?^|р''Ё"*"".-
2!!-.('-'
-от
5'72
до
31,4
;;-;;";;'"
!""'''.',",,.
результать|
оь]л#-1олучень|
и
другими
исследователями
[5].
г99./'!!
для твердь1х
с-Ре
и
ш;
,рБйБЁциональность
ме)кду
ра-
створимостью
водщод^
у^!Б^
оыла
так).е
подтвер)кде-
на
[6]
лля
темпепафр
400-606.6"^;
интервалов
давлений
1
6'
9._
!!9
и
о,
о :
-
:'6!-с
'_'
й
'.
']."
ё'й'й.'".",'.
А.
Ё.
йоро.""
'|^{,':'-Б;;;;и],
''**.
1(.
1.
т(уро,,.и.,
и
соавторьт
[3]
показали'
что
,"
,й*'"'мерность
сохраняется
@
:
0,47-0,60)
для.'й'"'1;'".;ъ
хромом
при
темпера-
турах
]560_1
700"
с.
п;;;а;;,;';;";;.'
"й"-"-!!!
р'..''й. Ре_\|
и Ре_
у'ьтать]
бьлли
полуненьт
]1рименимость
уравнения
(|\/,3)
бйла
установлена |4
для
-;д'''л:-щ :'#'
':у
:-
}:;'
о бо
зн
а н
еньт
ко
н
цен тр
а
ции соо
тв
етств
у|ощи
х
за6
3|т
растворимости
водорода
в
твердом
&1п
[9],
а
так)ке в
)кид-
ких
Ре
-
./!1п
[10]
и Ре
-
€
[{;
в]. Агталогичньте
ре3ульта_
тьт бь:ли
получены
для
растворимос_тц
$2 в твердом
[11]
и
)кидком
)келе3е
и
расплавах
Ре-51
[4].
€правеАливость
3акона
квадратного
корня
по3воляет
ду_
мать'
что га3ь|
при
растворении
диссоциируют
{'|
дают
'с
ме_
таллом
группировки'
содер)кащие
один
атом
[, т' е'
А4е,['
Ёа
основании
этой
закономерности
ска3ать
что_либо
бёльшее
о
природе
рассматриваемь!х
растворов
нельзя.
Б
настности,
остается
совер1пенно
открь|ть]м
вопрос
о
велинине
у*.
1(роме
того'
невозможно
отдать
предпочтение
одному
и3
трех состояний
|:
ионному'
атомному
или
молекулярному
1.
йначе
говоря,
нель3я
установить
характер
сил
в3аимодег]ст-
вия мех{ду
атомами
Р1е
и
|.
Б технической
литературе
это
обстоятельство
обьтчно
об-
ходят'
условно
полагая'
что
га3ь1,
дающие
с
металлами
устойнт!вьте
соединения
в твердом
состоянии
(йе|)'Р,
.-Ра9-
творяются в
них в
форме
молекул
этих соединений
(РеФ,
мп0, Ре5
и т. п.).
Ёапротив,
\|$
водорода'
образуюшего
с
черными металлами
непрочнь|е
гидридь|,
иногда
допускает-
ся
атомная
форма.
Бпронем,-некоторь:е
исследователи
[12]
настойчиво
отстаи-
вали
'предполо'х(ен'ие
о' сущеетво!вани'и
:в
8иА(Ф$
)келе3е
гид-
рида
РеЁ. !{е>кд}
тем' и3вестно'
что водород
образует
с
)ке-
а-1€3Ф]!1 непрочнь1е соединения,
неустойнивьте
при вьтсоких
температурах
[13].
|1равда, стойкость
гидридов
титана'
ниобия
и тан1ала так)ке
умень1пается
с
ростом
температурь|'
но' со-
гласно м. м.
(арнаухову
и А.
Ё. &1орозову
[4],
введение
их
в
>кидкое
)келезо сильно
увеличивает
растворимость
водоро_
да да)ке
при 1635"€.
||ри этом
поних{ается
тепловой
эффект
растворения
Ё2,
т{1о
обусловлено'
вероятно'
эк3отермичностью
образования
комплексов.
Ёа появление
груг1пировок
типа
гидридов
указь1вает
такх{е
и повь11шение
показателя
степе_
ни
х в
уравнении
(1у,2)
вместе
с
концентрацией
введенного
элемента.
Ёапримёр,
х
:
0,55
[ри
0,45?0
т! и
х
:
0,72
при
3,410/9 1|.
*
€ледует иметь в
виду'
что в
отличие
от
га3ов, где
небольшое
число
атомов
образует
молекулу' в кснденсир'ованнь1х
веществах
имеет
!1есто
взаим,одейс1виё
ках<дой
из частиц со
всеми
остальнь1ми'
||оэтому,
строго
говоря'
атом
растворившегося
металлоида
взаимодействует
со
всеми
&
ионами
металла' т.
е.
ц
:1{''
Фднако
в первом
приблия<ении
мо_х{но
ставить
вопр!ос
о
числе
ионов п1еталла'
приходящихся
!на один
атом
/,
учить]вая
лщ1пь
те
из них, взаимодействие
которых
с
[ сильнее,
чем
остальнь|х.
1
||од
которьлм понимаются электронейтральнь|е
группировки'
в
преде_
лах
которь!х
преоблаАают гомеополярнь1е
связи.

[итир1ваннь!е
авторь1
[4],
исходя
из найденного
ими
неравен-
ства
0,54*(1,
заключают'
что
в
сплаве
содер)катся
двух-
атомнь!е
гидридь|.
частично
диссоциированнь]е
по
реакции
|1еЁу:
]|1е
+
2н.
Фни
рассм'{рйБ'
их
как
группировки'
в
пределах
которьтх
на
определенньтй
период
времени
возни_
кают
направленнь|е
свя3и.
Фднако
для
чистьтх
тантала
|1 нио-
бпя
да>хе
в твердом
состоянии
неи3вестнь1
устойнивь:е
гидри-
дь1'
в
молекуле
которь1х
имеются
два
атома
водорода
[|+].
|1одобньле
}ке
оезулытатьг
бьлли
,'''у,",,,
для
растворимости
\2
в
(п,тавах
Р|
-]
с.
[т,_в:,
.д;';':'ь;,""ко
к
единице.
Б
связи
с этип1
так)ке
вь|ска.ь|вались__предполо)кения
об
образовании
в
расплавах
нитридов
€г\2
[7].
[ледует
далее
3аметить'
что
некоторь1е
исследователи
экспериментально
подтвердили
уравненйе
(1\л,3)
для
столь
вь1соких
давлений'
когда
становятся
несправедливь|ми
ис-
ходнь]е
пось]лки
его
вьтвода.
Б
частности'
пропорциональность
у'":*{.!-:^.]^"_'Рмостью
во49Р9ца
в }келе3е
и
величино
й
1/Б"
оь1ла
код-статирована
при
599"
(
4ля
давлений 25-500
"'"(т'ь!
и
лри
1550'с
цри
200
йта
[|6;
17]'
в'Ё'".,
с этим
остановим_
ся
на
более
общем
термодинамическом
вь]воде
уравнения'
характери3}ющего
равновесие
га3а
с металлом:
[|ри
заданной
темпер.а:уре
оно
сохраняется
при
таких
соотно1пениях
!'авления
(Р")
и
концентрации
(ш"),
Ёри
кото_
рь[х
приращения
изобарньгх
потенциалов
остаются
одинако-
вь1ми:
пё2":
гп47".
.
Беличина
2'
зависит
от
давления
(Р")
газа
фугетивностью
(|")
соотно1пением
а2"
:-
Р!
ё 1л
["'
'|1риращение
ё7"
является
полнь1м
лифференциалом
функ_
ции
от
двух
не3ависимь]х
переменнь|х:
'
'|7":
(#)""
ё8"*
(#)'"''"'
. .Бьтра>кая
первую
частную
прои3водную
чере3
активйостг
(а"),
а
вторую
_
чере3
парциально-молярнь|й
объем
(й)
растворенного
га3а'
получим
а2':#''"+ъ.аР..
348
/!|
спФаз)
:
&[
п(йе\.
(1у'
4)
(1у'
5)
и свя3ана
с его
(1у,6)
(1у'
7)
14з
уравнений
(!у,5), (1у,6)
и
(1\/,7)
находим'
что
пР|ё1п
|"
:
^*"
ам"
+
й,аР..
4р
14нтегрируя последнее в
предполо}кении'
что
раствор
весь-
ма
разбавленнь]й,
т.
е''
что а"
ф
к!:'/",
имеем
п
'*
7о
1п'"
:
:=" +с.
шг
к?',
(1у' 8)
3
частности'
если
растворяется
двухатомнь:й
газ
(гп
:
2),
диссоциирующий
в
металле на атомь|, то
(1у,9)
9тобь: получить
из вь1ра>кения
(1!,9)
закон квадратного
корня'
необходимо
пренебрень слагаемь!м
с
парциальнь1м
объемом и
приравнять
фугетивность
давлению.
Бсе
это воз-
мох(но лишь при слишком больш:их
давлениях.
1о обстоя-
тельство' что
уравнение
(!!,3)
подтвер)кдается опь|том при
3начительнь1х величин0\
Рн",
и.Р.
1(риневский
[16]
поясняет
взаимной
компенсацией
огпибок
от
пренебре)кения слагаемь1м
с7,'
"
от 3амень1
["
на Р".
Аополнительньте
даннь1е
мо}кно получить
путем и3учения
:лзобар
растворимости'
с
помощью
которь1х
определяется
теп-
ловой
эффект
А|/.
Растворимость
двухатомнь]х
га3ов в
ряде
металлов
увеличивается
с
ростом
температурь|'
что
ука3ь|ва-
ет на
эндотермический
характер процесса.
||оскольку
взаимодействие атомов
/у|е
и
/
велико
и
долх(-
но
сопрово)кдаться вь1делением
тепла
(.,[[]
м"_г10),
а связи
ме>кду
молекулами
|2
в га3е весьма
маль1, постольку
следует
о}кидать'
что в процессе
растворения
имеется этап'
при кото-
ром
потребляется
значительное количество
энергии
(2г,
}0).
Б
соответствии
с предь1дущим таким этапом
является
диссоциация
молекул
|
2
на
атомьт, происходящая
|{а поверх-
ности
металла и
облегченная
его силовь|м полем.
Аействи_
тель1{о,
как видно и3
них{еследующего
цикла
^н
г2
+
2!ме
_-->
2/|1еу|
,
|-
)"1--2г
*
2уА4е *--|\|1м"-г
величина
^н
:
\!-|ьт"-т
*
[г,
будет
поло>кительной
только
,
тогда'
когда
!о",|
}
!БЁ
*"-"|
'
}0,)
",
о
1п
,"
:
"г'г
+с.
шг
лт

1аким
образом,
вь|1'шеука3аннь|е
экспериментальнь|е
зако-
номерности
термодинамического характера (влияние
Рг
"
и
[|
приводят
к
вь]воду' что
растворение
некоторь]х
га3ов
в
ряде
металлов
сопрово)кдается
распадом
их
молекул
на
атомь1
и
возникновением
группировок'
содер>кащих
один
атом
[.
Б
какой
форме
находится
атом
га3а
и
какими
связями
он
соединен
с
атомами
металла
._
заключить
на
основании
этих
даннь|х
нель3я.
.&1о>кно
ли|пь
отметить,
что
энергия
в3а-
имодействия
цме
с
/
вел_ика.
1ак,
для
Аэ
опьтт
дае}
теплоту
растворения
]в
)келезе
^Ё/
:
14500-16000
кал|мол6 (,см.
'на*
пример'
1.1
1])
.
}нить:вая'
что |ц.
€Ф€т1вляет
101000
кал,
по-
лучим
АРр.н
_
-|тт"
+^1/
:
-86
ккал|моль'
Б
тех
случаях,
когда
,!А!]'"_'|}1|'),
будет
иметь
место
экзотермически.й
процесс
и
растворимость
[2
падет
с
ростом
темперацрьт.
1ак,
например'
обстоит
дело
в
системах Ё:
-
|(,
\а,
€а, 7т
и
др.
Аополнительнь:й материал
для
понимания
структурь|
рас-
ллава
дают даннь1е
по
растворимости
(5)
га3ов
в бинарньтх
системах.
1ак,
изотер-
ма
растворимости
во-
дорода
в
)кидких
спла-
вах
Ре,
51 имеет
четко
вь1ра)кеннь|й
минимум,
отвечающий
составу
соединения
Ре51
(рис.
1 14).
Более
того'
в ко_
ординатах
18
5'',
1й'в:
и3отерма
складь1вается
и3
двух
прямолинейньтх
отрезков'
пересекаю_
щихся
в
точке
с ]!51
-
:
0'5
[19].
€родство
Ре
к 5| настолько
велико'
что
относительно
сла-
бее
связаннь:й
водород
вь]талкивается
из
рас-
плава.
3тому
способствует
частичная
нась|щенность
(т.
е. за-
метная
доля
ковалентности)
свя3и Ре
-
5|.
Аналогичньте
результать|
бьтли
получень1
для
}кидких
сплавов
€ш-'5п,
где полулогарифминеская
изотерма
так)ке
складь|вается
и3
двух
прямь|х'
пересекающихся
в точке'
соответствующей
со-
ставу
соединения
€ш35п
[19].
.&1енее
четкие
минимумь1
растворимости
водорода
конста_
тировань1
такх{е
для
расплавов
Ре, €г
[8]
и Рё
_
с
[20].
Рис. 1 14.
Блияние
температурь|
и соста-
ва
сплавов
Ре
-
5!
на
растворимость
в
них
водорода
Рядом
авторов
[2\,
221
бьтла сделана попь]тка'
используя
методь|
физинеской
статистики,
дать
формульт
для
раствори-
мости
га3ов в металле. 3 основу вь1вода бьтла полох{ена
мо_
де.ць
растворов
внедрения. €оставляя
функцию распределе-
||ия
для
системь1' состоящей
и3 молекул и атомов
водорода
в
газовой
фазе
и
ионов
водорода в металле'
получают
[21]
вь]ра)кение
для
растворимости.
{ругое
уравнение
находят'
когда
рассматривают
гидридообразующие
металльт'
где при-
ходится
учить1вать
локали3ацию протонов.
Фднако
обе
фор-
муль|
дают
ли!пь весьма прибли>кеннь1е
ре3ультать|:
рассчи-
таннь1е
растворимости
нередко
в
10
ра3
превь11'пают
экспери-
ментальнь1е.
3аметим, что
растворимость
дейтерия
в >келе3е
мень|'пе'
чем водорода; в палладии-
наоборот
[23].
Работь:, посвященнь1е квантовомеханическому
рассмотре_
нию вопроса о
состоянии
атомов
металлоида'
растворенного
в металле'
немногочислень1'
6 помощью модели
свободньтх
электро]{ов бьтла показана
[24]
справедливость
предполох(ения
об 11,они3ац\4|1 водорода
при его
растворении
в
металле. Фднако полуклассический
характер модели, т. е. игнорирование взаимодействия ме)кду
эле,ктронамив
металле,
сни)кает
ценность дока3ательства.
Ёесколько
работ
[26;
2\
посвящено
рассмотре!1ию
дви}ке-
ния
электрона в периодическом поле
ре1шетки'
исках(енном
атомом примеси.
||ри налинии во3мущающего потенциала
появляются локальнь1е энергетические
уровни.
Бсли
они по_
падают
в
зону проводимости металла' то электрон атома при_
меси
(например,
водорода)
коллективи3ируется.
Ёапротив,
если локальньтй
уровень
ока3ь]вается
мех{ду 3онами' то элек_
тронь1
принадле)кат
атомам
примеси. Более того, при
соот-
ветствующих
условиях
электронь!
металла могут
переходить
,на
эти
ур,овни'
1со,3да'вая
,отр'ицательнь1й
]и,о,н
примеси
(,на,п'ри-
мер'
кислорода,
серьт).
Фднако
и в этих
рассу)кдениях'
основаннь1х
на так на3ь|-
ваемом
зонном приблих<ении,
так)ке игнорируется в3аимо-
действие
электронов.
Фстановимся
для
иллюстрации ска3ан-
г|ого
на
работе
[26],
в которой
дано
подробное
рассмотрение
вопроса
о
растворении
атомов металлоидов
в металле в
рам-
ках
зонной
теории.
3нергия
дна
проводящей полось|
металла-растворителя'
складь|вается
и3 трех
величин:
энергии
сублимации
(Ё"),
энергии
первого
потенциала
ионизации
(Ё')
и энергии
Фер-
ми
(Ёд):
Ё.=Ё,
*
Бт*Ёр.
15!

Бсе
они
отрицательнь|'
т.
к.3а начало
отсчета берется
энер-
гия неподви)кного
(свободного) электрона
снару}ки
металла.
Бсли
сравнить
абсолютнь1е 3наченпя
Ё9
и
энергии иони3а-
шии
(е)
атома
примеси' то
при
|д'!>|в|
электрон
примеси
уйдет
в проводящую
полосу
растворителя.
Ёапротив'
при
!в.!{ !"|
электрон останется
у
атома
примеси.
Раснет,
проведенньтй
для
водорода,
растворенного
в меди,
[_1е
дает
однозначного ответа.
|!оэтому
вь!числяется энергия
раст|во:ре,ния
ато'м,о'в пр]имеси. ||ри
этом при,нимаются во
]вни_
мание
две
возмо)кности: 1) атом
ионизован и 2) электрон
остается
в
свя3анном состоянии
у
атома
примеси.
3нергия
растворения
рассматривается
как сумма четь|рех
слагаемьтх
Ё':Ё+Ё'+Ё'*Ёя,
где
Ё-
изменение
энергии
кулоновского взаимодействия
мех{ду
]пр.отоном
и
,свя3а'ннь1м
электр'о'ном
в
ре3уль-
тате
растворения
в
ре1петке
металла;
Ё'-изменение
энергии
кулоновского взаимодействия
для
проводящих
электронов
(ибо
они находятся
теперь
в
дополнительном
поле протона
и связанно-
го электрона);
Ё"
-
обменная
энергия
ме)кду свя3аннь]м электроном
и
электронами
Ферми
с параллельнь1ми
спинами;
62-поп!авка
на
взаимодействие
с
ионами
растворителя
(мели)
[ля
слуная неиони3ованного
атома
расчет
дал
Ё":
:
-0,2
эв,
а
для
ионизованного
Ё'"
:
-2,&5
эв.
Аначе
говоря'
вторая
конфигуратт'ия
ока3ь1вается
энерге_
тически
предпочтительней,
так как
Ё"
<д'.
3кспериментально
найденная
теплота
растворения
водоро-
да
в меди
составляет
|'7\
эв.
}читьтвая
прибли>кенность
расчетов'
ну}{но
считать сов-
падение
удовлетворительнь1м.
||одобньтм
)ке
методом
бьтли вь1численьт
теплотьт
раство-
рения
в меди
некоторь|х
многовалентнь!х металлов
(табл.29).
т€ппоты
ра(творап,я в
{еди некоторнх
1
а6лпца
29
яоталлов'
э8
Ё'',
раснетн.
.
А|
-0,485
-0,335
-1,95
-1,50
-0,53
-0,
50
.8.,
эксперимент.
з52
12
зак. 1798.
Б заключение
отметим'
что
правильнь1й
ответ
на вопрос
возмох{ен
ли11]ь
при
ре|!]ении
многоэлектронной
задачи
с
наи-
более
полнь]м
учетом
всех в3аимодействий.
@логкнь:е
газь|
14звестную
информацию
о
формах
существования
серь1
и
кислорода
(г:
5;
0)
лают
исс}едования
равновесий
метал-
ла с
газами более сло)кного
состава,
отобра)каемь]х
следую-
щей
стехиометрической
схемой:
цР1е
*
хн2г
:
Р1е,|
'
*
х\1е,.
(1у'
б)
9прошая
вь|ра>кение константь|
равновесия
для
неболь-
ших
давлений
и
раз6авленнь1х
растворов,
получим
.:ж*=\%г1
(#)'
(#)'
:
Ёт|о/о|!,
где
[0/о
[]-солер>кание
га3а
в металле,
0/9
(вес.).
€опоставляя
уравнение
(|!'11)
с
экспериментальнь1ми
даннь|ми'
мох<но
найти
х. 1ак,
например'
изучени_е^^равнове-
сия
при окислении
х{идкого
йелеза парами'вольт
[29]
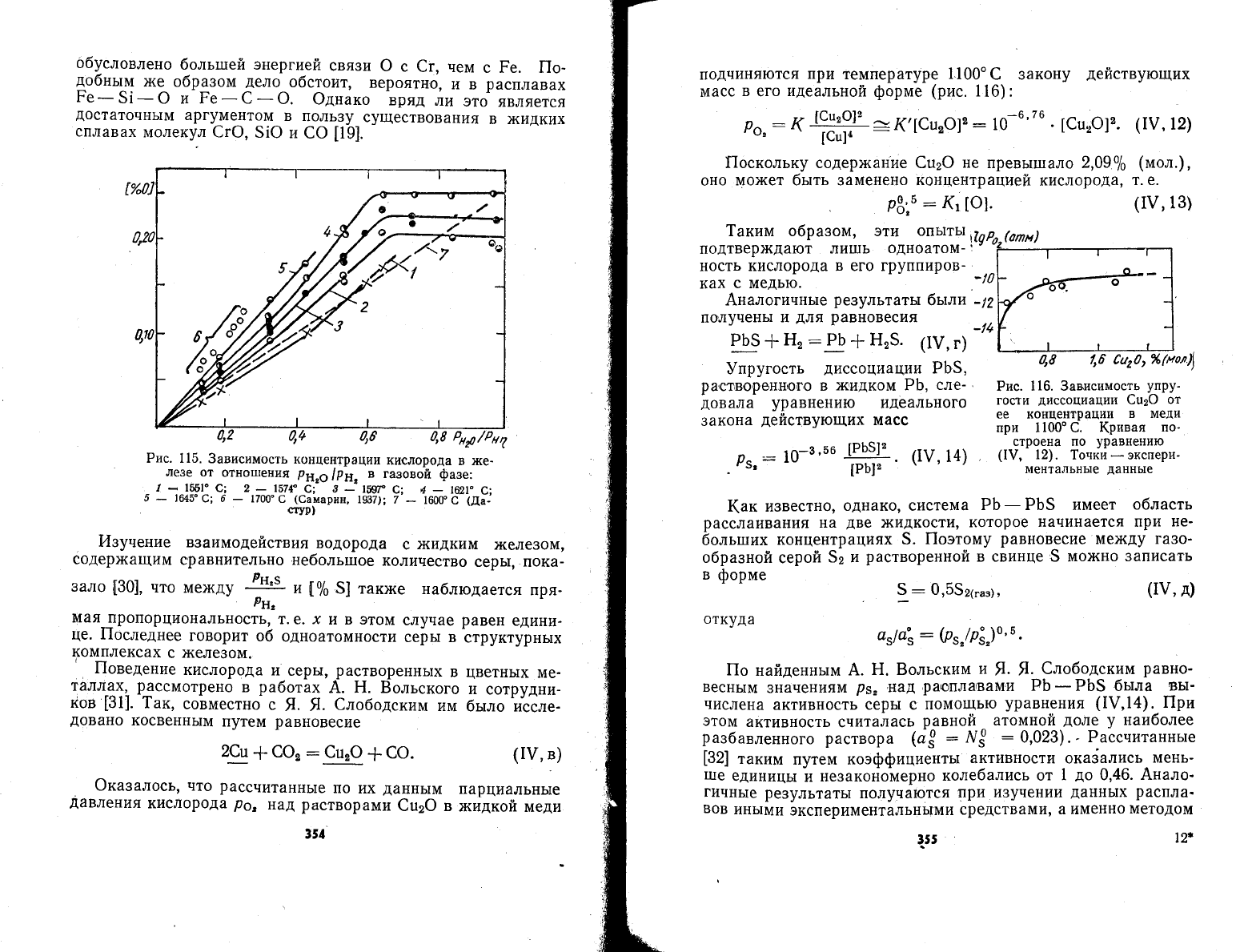
показа_
Рн"о
г п, г
ло' что ме)кду
_'
,
|%
о]
или
|0|1
РеФ] имеется
прямоли_
Рн"
нейная связь.
Ёайденньте
результать|
для
температур
1550-1700" с'
представлень1
на
рис.
115.
Аля
рассматриваемой
системь1
х:
\, что
указь|вает.
на одноатомность
кислорода'
находя-
щегося
в
тех или
инь1х
группировках
с
частицами )келеза.
[!одобньте )ке
ре3ультатьт
бьтли
получень1 |1
для
)кидкого
никеля
и кобальта
[29].
(оненно,
такие исследования
не
дают
сведений
ни
о
координационном
числе кислорода
в металле, ни о величи-
не
у.
Фни, как и
предь|дущие,
не способньт осветить
весьма
ва>йнь:й
вопрос
о прироле связи
!у1е-
|.
Б
сплавах }келе3а с
хромом
растворенньтй
кислород
кон-
центрируется'
по мнению
ряда
авторов
т[19],
преимутт(ественно
около
атомов
€г.
Б
соседстве
с
последними
атомов
Ф
оказьт-
вается
больтше, чем
'г|,о
чисто
стати'стич'ескому'
случайн'о|му
распределению
кислорода
ме)кду
€г
и Ре.
||о_видимому'
это
(1у'
10)
(1у,
11)
обусловлено
больтшей энергией
свя3и
Ф
с
€г, чем
с Ре. |!о_
добньц
>ке^ образом
дело^обстоит,
вероятно,
и
в
расплавах
Ре-51-Ф
и Ре-€-Ф.
Фднако
вряд
ли
это
является
достаточнь1м
аргу{![е-нтом
в
пользу
существования
в >кидких
сплавах
молекул €гФ,
5!Ф
и
€Ф
[19].
Рис. 115.
3ависимость
концентрации
к|слорода
в )ке_
лезе
от
отно1пения
рн2о!Рн,
в газовой
фазе:
.-
/
_*
156|.
с; 2
-_--1574"
-с;
8
_
!56гР
с; 4
_
|{2\.
с;
5
_
!64у€;6
_
1700"6
(€амагин,
1937);7'_
16ш"с
ш;_'
'
йзунение
в3аимодействия
водорода
с
)кидким
)келе3ом'
содер>кащим
сравнительно неболь!|]ое
количество
серь1'.пока-
зало
[30],
что
ме}кду
**
"
[}9
5] такл<е
наблюдается
пря_
Рн"
мая
пропорциональность'
т.
е.
,
и в этом
случае
равен
едини_
це.
1!оследнее
говорит
об
одноатомности
серы в
структурнь1х
комплексах
с
}келе3ом.
|{овеление
кислорода
и-серы'
!аствореннь]х
в
цветнь[х
ме-
талл_141
рассмотрено
в
работа1
А. Ё. Больского
и
сотрудни-
ков
[31].
1ак,
соБместно
с
$' 1'
(ло6одским
им
бьтло
исс'"_
довано
косвеннь]м
путем
равновесие
26ц*со2:6ш'Ф{€Ф.
(|!' в)
Фказалось' что
рассчитаннь1е
по
их
даннь|м
парциальнь1е
давления
кислорода
ро,
над
растворами
€ц:Ф в
>кидкой
меди
154
355
\2:
подчиняются
при
температуре 1100"€
3акону
действуюших
масс
в
его
идеальной
форме
(рис.
116):
Ро":*
-[$Рэ.1('[€ш'Ф]':
10-6'76
.
[сц!о]в.
(1у,
12)
[1оскольку содерх(ание €цэФ
не
превь|1п
ало
2,09о|1
оно
мо}кет бьтть заменено
концентрацией
кислорода'
3;,
:
7(,
[Ф].
1аким образом, эти
опь1ть|
!
подтверх(дают ли1пь
одноатом-
1
ность
кислорода в его группиров-
Аналогичнь|е
результ
атьт 6ьтли
-1 2
полученьт
и
для
равновесия
-14
Р_щ
+
Ё,
:3!
*
Ё'5.
(1!,
г)
}пругость
диссоциации
Рб5,
ра'ств,о,ренн:Ф|Ф
3
){(,!{А(ом РБ,
сле-
,
довала
уравнению
идеального
3акона
действующих
масс
о^
:
10_3'56
[Рь5]'
.
(1у.
14)
.у5'_'
{Рь],
'
\д!'д!]'
(мол.),
т. е.
(1у'
13)
(опм)
ц8
Рис.
116. 3ависимость
упру-
гости
диссоциации
€ц:Ф
от
ее концентрации
в меди
при 1100" с.
1(ривая
по-
строена по
уравнению
(|у'
12).
1онки_экспери-
ментальные
даннь|е
(ак
известно'
однако, система
Рь
-
Рь5 имеет
область
расслаиван|1я
на
две
}1(идкости'
которое
начинается при
не_
больп.тих
концентрациях
$.
||оэтому
равновесие
ме'(ду
газо-
образной
серой
52 и
!астворенной
в свинце 5 мох<но
3аписать
в
форме
.
9:
0,5521",,1,
(19'
д)
откуда
@3/а",
:
(Р.,/4,)'',.
|1о
найденньтм
А.
Ё. Больским
и
$.9.
€лободским
равно'
веснь1м
3начениям
р$"
'\1ад
ра|с|пла1вам'и
РБ
-
РБ5
бь:ла
вь1'
числена
активность
серьт с
помощью
уравнения
(|у,14).
|1ри
этом
активность
считалась
равной
атомной
доле
у
наиболее
разбавленного
раствора
(с3
:
ш3
:0,023).-
Рассчитанньте
[32]
таким
путем коэффишиенть1
активности
ока6ались
мень-
ше
единиць{
и
не3акойойерно
колебались от
1
до
0,46.
Анало.
гичнь1е
ре3ультать1
получаются
при
и3учении
даннь|х
распла-
вов
инь|ми
экспериментальнь|ми
средствами'
а именно
методом

электродви)кущих
сил
[32].
Фднако
коэффициенть1
актив,ности
в
этом
случае
6ьтли больц;е
единиць1
(1,00-1,26).
-3
работах'
проведенньтх
А. Ё.
Больским
и
-Р.
А.
Агране_
вой,
бьтли исследовань1
равновесия:
Ре51Ё':
|е
*
Б'5,
]х1|$
1н2
:
ш1
*
Ё'5.
(|9'
е)
(|9,
х<)
3десь
концентрация
компонентов
расплава
и3менялась
в
более
1пироком
интервале
и
содер}кание
серь|
3начительно
превосходило
имев1шиеся
в
системе
Рб-Рь5.
1(ак и
следовало
ох(идать'
полног0
согласия
с идеальнь1м
3аконом
Аействующих
масс не
оказалось'
причем
в первом
!4}чае
отклонения
бь;ли
несколько
мень11]ими'
чем
во
втором.
!,ля
о6ъяснения
этого
А. Ё.
Больский
и Р.
А.'Агранева
пред_
полагают
частичную.диссоциацию
сульфида
)келе3а
с обра-
3ованием
двухатомной
серьт в
расплаве
2Ре5:.2Ре
{
5я.
||оследнее,
конечно'
маловероятно'
если
учесть'
что
по
их
расчетам.
при
температуре
1200"
с в^.чистом
Ре5
концентра.
ция
такой
серь|
составляет
около
0,60/'.
Ёаконец,
для
согласования
идеального
3акона
действую-
щих
масс
с
даннь1ми
по
расплавам
\|-5
им
приходится
допустить
одновременное
существование
и частичную
диссо-
циацию
двух
сульфилов
(\!5
и
\!з5э).
1аким
образом,
совпадение
или
уклонение
от
идеального
3акона
Аействуюттт.их
масс
они
рассматривают
как одно3нач_
нь;й
критерий
справедливости
той
или
иной
гипоте3ь|
о
форме
существования
растворенного
в металле
элемента.
Фни игно-
рируют
при
этом
другие
причинь1'
которь1е
так}ке
могли
обус_
ловить
переменность
коэффициента
активности
компонента
в
расплаве.
(
ним
относятся
всево3мох(нь!е
степени
уг{орядо_
чения
или
разуг{орядочения
частиц,
не
ведущие,
однако,
к об_
ра3о.ва,нию
молекул.
Б
одной
и3
своих
работ
9.
14. [ерасимов
[33]
рассматривал
как--существование
молекул' 1ак
|1;еидеальность
раствора.
йзуная
равновесие
расплавов
в1
-
5 с
водородом'
он
установил'
"что
предполо}кение
о
существовании
молекул
Б!253
наталйивается
ца 3атруднение. Беличи}]?
(::
равная
(':(#,
(1у.
15)
не стремится
к постоянному
значению
при
переходе
к
разбав_
леннь1м
растворам.
Ёапротив,
если
допустить
присутствие
в
расплаве
молекул Б!5, т. е. наличие
равновесия
8151!{'_ё+н5,
(1\/,з)
то при маль|х содер)каниях серь|
величина |(э,
Р0вная
постоянна'
а активности висмута
и
серь1 совпадают
с
их кон-
центрациями.
Фтсюда
делается
заключение' что
разбавленнь1е
растворь1
содерх{ат серу
в
форме
молекул
Б|5. [|оскольку'
однако'
уравнение
(1у'16)
справедливо
для
больт'ших
содер}каний вис-
мута
([3!]-*
1), постольку его мо)кно преобразовать в виде
р3;,
:
к'[в15]
:
("
[5].
(1у'
17)
14наче
говоря,
опь|тнь|е
даннь]е'
как
|4 пре)кде'
ука3ь1вают
ли11]ь на то, что
наиболее вероятной
формой
.существования
серь1 в
расплаве
являются одноатом1{ь]е
группировки.
(
аналогичнь1м заключениям
приводят
так>ке
ре3ультать1'
относящиеся к в3аимодействию
)кидких металлов со сло)кнь|-
ми га3ами'
растворение
которь]х сопрово}кдается
переходом
в
металл
не
одного'
а
нескольких
его
составляющих.
|!римером этого могут слу)кить системь!
медь
-
сернистьтй
га3 и )келе3о
-
окись
углерода.
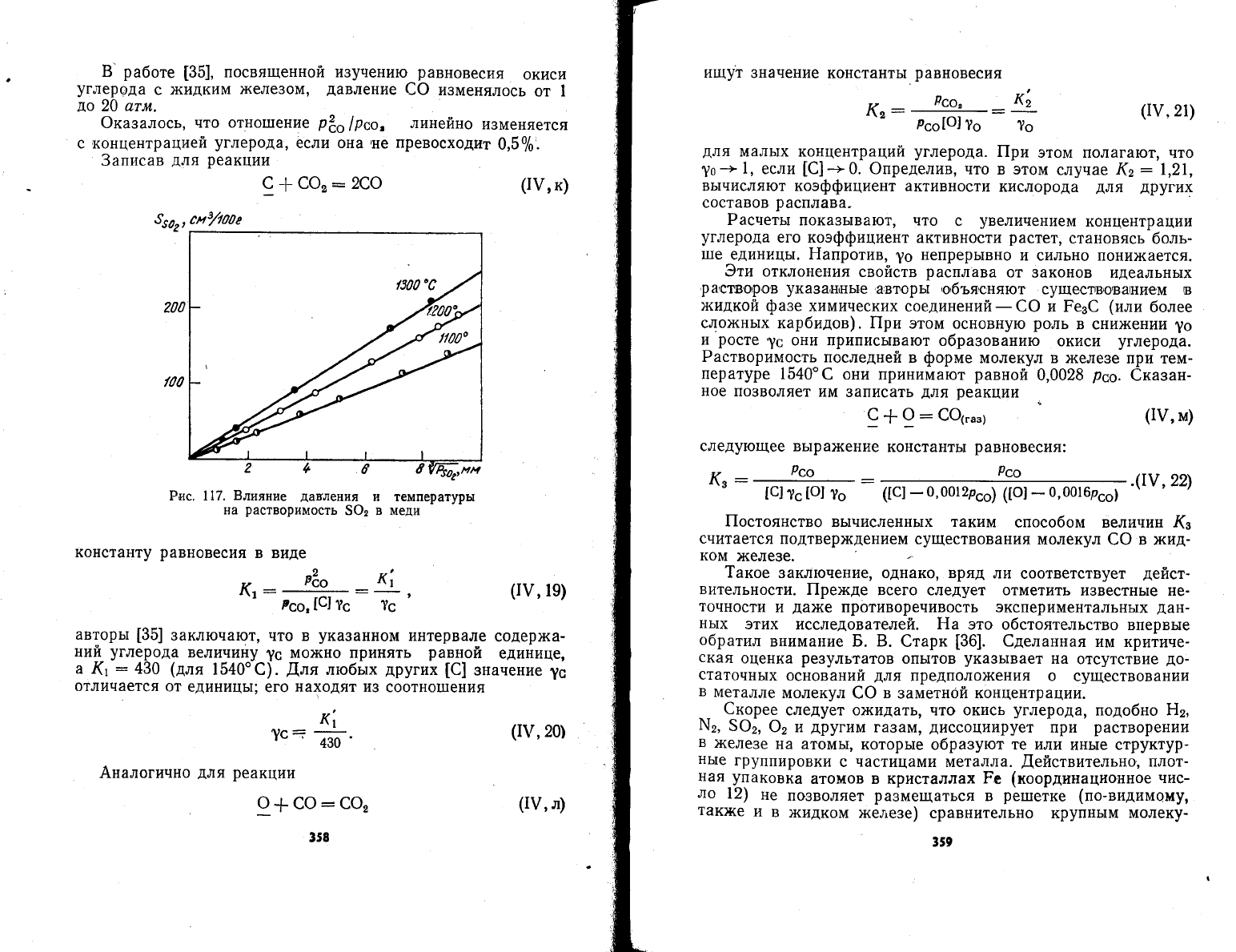
1ак, напирмер'
растворимость
[34]
сернистого
газа в чис-
,,
ог-
той
меди пропорциональна
|
рзо,
при неболь11]их
давлениях
$Ф2
(рис.
117).
|1одобная
закономерность
указь1вает'
что при
растворении
имеет
место
диссоциация
м0лекул
на отдельнь1е атомь| по
уравнению
(!!, и)
(1у'
1в)
(ак
и следовало о)кидать'
растворимость
т5Ф2
в меди'
со-
дер)кащей
значительнь|е
количества
серьт' подчиняется'
по
тем
)ке
даннь]м'
закону квадратного
корня'
так
как
в этом
случае
[$]:
сопз1, а
не прямо
пропорциональна
конце'нтра-
шии
[Ф].
5Фэ("''):
5
+
29,
к=*#!1;
[5Ф,]
:
к'7р-".
(1у' 16)
откуда
Б
работе [35],
посвященной
и3учени|о
равновесия
окиси
углерода
с }кидким
)келезом'
давление
€@
изменялось
от 1
цо
20 атм.
Фказалось,
что отно1пение
р?'|рсо,
линейно
и3меняется
с концентрацией
углерода'
если она
не
превосходит
0,5%.
3аписав
для
реакции
9+сод:2со
и температшы
в меди
(!9'к)
(|у'
19)
(1у'
20)
(1!'
л)
Рис. 117.
Блияние
давления
на
растворимость
5Ф2
константу
равновесия
в виде
!?
-
р2со
"'_
';;;тт;"
к;
?с
авторьт
[35]
заклютают'
что в
ука3анном
интервале
содер}ка-
ний
углерода
величиЁу
тс
мох{но
принять
равной
едийице,
а
(::430
(для
1540"с)..[,ля любь:х
других
[€]
знанение
16
отличается
от
единицьт;
его
находят и3
соотно1шения
к;
тс=
4ю.
Аналогично
для
реакции
о+со-€Ф,
358
'59
ищут
3начение
константьт
|(а: (|у'
21)
для
мальтх
концентраций
углерода.
|[ри
этом полагают'
что
уо->
1,
если
[€]
->0.
Фпределив'
что в этом
случае
|(2: \,2\,
вь!числяют коэффициент
активности
кислорода
для других
составов
расплава-
Расчетьт
показь|вают' что
с
увеличением
концентрации
углерода
его
коэффициент активности
растет'
становясь
боль-
1пе
единицьт.
Ёапротив,
то
непрерь|вно
и сильно поних(ается.
3ти отклонения
свойств
расплава
от
3аконов идеальнь|х
ра'ств'ор'о,в ука3а'н!нь|е
авторь1
т6:$69:3ц9р1
сущест|в'о'ва|ни,ем в
>кидкой
фазе
химинеских
соединений
-
со и Рез€
(или
более
сло)кнь1х карбидов). |{ри
этом основную
роль
в сни)кении
то
и
росте
тс
они припись1вают
образованию
окиси
углерода.
Растворимость
последней
в
форме
молекул в }](елезе
при тем-
пературе
1540"с
они принимают
равной
0,0028
роо.
€казан_
ное
по3воляет
им
3аписать
для
реакции
с
+
о:
€Ф1газ1
следующее
вь|рах(ение
равновесия
Рсо,
:
к;
Р66[@)
}9
?о
константь!
равновесия:
Рсо
(з:
Рсо
(19'
м)
.(|у,22)
[6] тс [Ф] то
(с]
_0'0012рсо)
({о]_
0,0016р"'1
|[остоянство
вь1численнь|х таким
способом величин
&
считается
подтверх(дением
существования
молекул
€Ф в >кид_
ком
желе3е.
]акое
3аключение' однако' вряд
ли
соответствует
дейст_
вительности.
||рех<де
всего следует отметить
известнь|е не_
точности
и
дах{е
противоречивость экспериментальнь1х
дан-
нь1х
этих
исследователей.
Ёа
это обстоятельство
впервь1е
обратил
внимание Б. 3.
€тарк
[36].
€деланная
им критине_
ская
оценка
ре3ультатов
опь1тов
указьтвает
на
отсутствие
до-
статочнь|х
оснований
для
предполох(ения о
существовании
в
металле
молекул
€Ф
в
заметн6й
концентрации.
€корее
следует ох(идать' что окись
углерода'
подобно
Ёя,
!\{2,
5Ф2,
@2 и
.{!}гим
газам'
диссоциирует
при
растворении
в
х{еле3е
на атомь1'
которь1е
образуют
те или
инь1е структур_
нь1е
группировки
с
частицами
металла.
Аействитель1{о'
плот-
ная
упаковка
атомов в кристаллах
Рс
(коорлинашионное чис-
ло
12)
не
позволяет
ра3мещаться
в
ретшетке
(по-видим9му,
такх(е
и
в
х{идком
>келезе)
сравнительно крупнь|м
молеку_
