Дамаскин Б.Б., Петрий О.А., Подловченко Б.И. и др. Практикум по электрохимии
Подождите немного. Документ загружается.


Соответственно для эквивалентной электропроводности соли имеем:
Л = (2.54)
С
Поскольку концентрация даже насыщенного раствора труднораство-
римой соли очень мала, Л можно приравнять Л°, а потому записать:
л° + М • ;
Таким образом, концентрацию раствора труднорастворимой соли мож-
но найти, измерив удельную электропроводность раствора этой соли,
удельную электропроводность воды и воспользовавшись табличными
данными для предельных эквивалентных электропроводностей ионов
соли.
Для проведения этой работы следует использовать сосуд, изобра-
женный на рис. 2.6, в. Предварительно измерить удельную электро-
проводность бидистиллята и убедиться, что его удельная электропро-
водность не более (1—2)-10~
6
Ом-
1
- см-
1
.
Приготовить нащщешьп^ раствор , труднорастворимой соли
(Ва30
4
, СаСОа) или какой-либо другой (по указанию преподавателя).
Для приготовления такого раствора воспользоваться тонко измель-
ченной солью. Измерить электропроводность насыщенного раствора
соли, продув его предварительно инертным газом. Сделать несколько
замеров электропроводности и рассчитать среднее арифметическое
значение.
Рассчитать растворимость соли по уравнению (2.55) и найти про-
изведение растворимости соли по концентрации ее насыщенного раст-
вора.
8. ОПРЕДЕЛЕНИЕ КОНСТАНТЫ УСТОЙЧИВОСТИ
И СТЕХИОМЕТРИЧЕСКОГО СОСТАВА КОМПЛЕКСНЫХ
СОЕДИНЕНИЙ МЕТОДОМ ЭЛЕКТРОПРОВОДНОСТИ
Для определения констант устойчивости и стехиометрических со-
ставов комплексных соединений измеряют электропроводность раство-
ров исходных солей М
п
А и КХ
т
, затем смешивают их и измеряют
электропроводность полученных после смешения растворов. Обы-
чно используют при этом два приема, которые получили названия пря-
мого метода и метода непрерывных изменений.
Рассмотрим вначале прямой метод определения
константы устойчивости. Предположим что ионы К
т+
и
и А
п
~ образуют комплекс по уравнению:
+ оР^- ЯА
п
д
1
~
дп
51$
Очевидно, электропроводность смеси должна уменьшиться по сравне-
нию с той, которая ожидается при отсутствии комплексообразования.
Обозначим электропроводность образовавшегося после смешения раст-
вора через х
с
, ^предполагаемую при отсутствии комплексообразования
электропроводность через к
0
. Тогда, используя уравнение (2.32),
можно записать
(Щ— *с) 10
3
= с
к
(я^
А
+тЯ
к
--Я
КА
|т—(2.56)
где с
к
— концентрация комплекса КА^"^"; Я
А
, и Я
КА
— эквива-
лентные электропроводности А
п
~, и ЧА™~~
дп
соответственно.
В соответствии с уравнением (2.40) ионные электропроводности при
различных концентрациях электролита оценивают по уравнениям
типа:
Я-^-5 1/7, (2.57)
где — предельная электропроводность; ^ — ионная сила раствора.
Коэффициент пропорциональности В можно найти по измерению элект-
ропроводности растворов индивидуальных солей. Если частица
>
не за
р
Яжена
(
т
= д
П
у
9 Т0 ее
эквивалентная электропровод-
ность, очевидно, равна нулю и соответствующий член выпадает из
уравнения (2.56). Если несет положительный (катионный ком-
плекс) или отрицательный (анионный комплекс) заряд, то, приравни-
вая коэффициенты диффузии катионов (или анионов) и учитывая урав-
нение Нернста — Эйнштейна (2.11), полагают
т~* цп
А
т
или
дп—т
л
1 (2.586)
Подстановка этих соотношений вместо Я
НА
в уравнение (2.56) позво-
ляет найтиа затем и константу устойчивости р комплекса по урав-
нению
где 4 и с% — начальные концентрации и А*-.
Метод непрерывных изменений основан на том,
что при смешивании растворов М
П
А и КХ
т
изменение электропро-
водности в первом приближении тем больше, чем выше концентрация
комплекса Обозначим исходную концентрацию КХ
т
через
с о, а концентрацию М
П
А — через рс
0
. Пусть для образования единицы
объема смеси взято (1 — х) объема первого и х объема второго раство-
51 5*
ров. Тогда в образовавшейся после установления равновесия смеси
имеем
(2.60)
(2.61)
с«^с
я
сЪ (2.62)
где Съ, с А и с
к
— равновесные концентрации ионов А
п
~ и
комплекса ЯА™~~
дп
. Величина с
н
зависит от х, а значение л; = х
0>
при котором наблюдается максимум с
н
и, следовательно, минимум
электропроводности, можно определить из условия Ас
к
/йх = 0. Ис-
пользуя это условие и дифференцируя по х уравнения (2.60) — (2.62),
получаем
— с
0
; йсд/йх^рсо (2.63)
И
с
А
= дрс
я
. (2.64)
Из совокупности приведенных уравнений при х = х
0
и р Ф 1 полу-
чаем
С другой стороны, если х = х
0
и р = 1, то из уравнений (2.60), (2.61) и
и (2.64) следует
д
= х
0
/(1 —х
0
). (2.66)
Таким образом, вначале выбирают исходные растворы М
П
А и КХ
т
с одинаковыми молярными концентрациями (р = 1), по положе-
нию экстремума на кривой зависимости Ах от х находят х
0
и по фор-
муле (2.66) рассчитывают ц. Затем аналогичный эксперимент прово-
дят с растворами М
П
А и КХ
т
, имеющими различные молярные кон-
центрации (рф 1). Новое значение лг
0
подставляют в формулу (2.65),
которая при уже известном ц позволяет определить константу устой-
чивости комплекса р.
Отметим, что метод электропроводности дает однозначные резуль-
таты для тех систем, которые образуют только один комплекс.
По заданию преподавателя определить константу устойчивости и
состав комплексных ионов, образующихся в системе: сульфат меди и
оксалат натрия.
Для этого приготовить растворы Си50
4
с концентрацией с
0
=
— 0,01 М (I), а растворы Ыа
2
С
2
0
4
— с концентрациями 0,01 М (II)
и 0,003 М (III). В качестве еще одного компонента при проведении
измерений использовать бидистиллят (IV). Последовательно измерить
электроправедность в смесях: I + IV; 11+IV; III + IV; I + II;
с
п
= с
0
(1
— я)
—
1+Ш с суммарным объемом 50 см
8
. Данные занести в таблицу па
образцу:
Смесь И-IV
Смесь 11+IV
Смесь 1+11
н
2
I, см»
IV, .
см
8
щ
И,
см
8
IV,
см
8
К 2
I,
см
8
II,
см
3
-с
н
2
50
0
50
л
0
50
0
40
10
40
10
30
10
35
15
35 *
15
35
15
30
20
30
20
30
20
25
25
25
25
25
25
20
30
20 30
20
30
15
35
15
. 35 15'
35
10 !
40
10
40
1
10
40
В этой таблице величина х
2
— суммарная электропроводность
смесей I + IV и II + IV (или III + IV).
Построить график зависимости величины Ах = х
2
— х
с
от со-
става смеси в см
3
. По положению максимума на этой зависимости оп-
ределить состав или константу устойчивости комплексного иона.
9. КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Метод установления эквивалентной точки титрования, основан-
ный на измерении электропроводности растворов, называется кондук-
тометрическим титрованием.
Физической основой метода является уравнение (2.32), согласно ко-
торому х возрастает пропорционально концентрации ионов. Рассмот-
рим основы метода на примере титрования сильной кислоты НА силь-
ным основанием ВОН:
Н+ + А-4-В+ + ОН- Н
2
0 + А- + В+
Так как ионы Н+ обладают наиболее высокой подвижностью, то при
добавлении ВОН вначале вследствие замены Н+ на менее подвижные
ионы В+ электропроводность раствора падает. В точке эквивалентно-
сти х достигает минимальной величины, а по мере дальнейшего доба-
вления титранта за счет появления гидроксил-ионов и катионов В+
снова возрастает.
Используя уравнение (2.32), покажем, что между электропровод-
ностью и объемом добавляемого титранта в первом приближении наб-
людается линейная зависимость. Пусть исходный раствор содержит
а эквивалентов кислоты НА, а объем раствора V в процессе титрова-
ния изменяется незначительно, что возможно при использовании от-
носительно концентрированного раствора ВОН. Добавим к раствору
кислоты лгэквивалентов ВОН (л'С а). Тогда удельная электропровод-
ность образовавшегося раствора окажется равной
х =
0,001
(с
н+
к
н+
+с
А
„ +с
в+
(2-67)
122$
где с
н
+ = (а — х)/У; с
А
- = а/К; б'
в
+ == х/К, а потому
х =
+ у + (2:68)
Поскольку сумма 0,001 (Я
н+
+ а/У равна удельной электропро-
водности исходной кислоты ХНА, МОЖНО записать
Х-х
на
-0,001 {Ь
н+
-Ь
в+
)х/У. (2.69)
Отсюда следует, что зависимость между х и объемом добавляемого
раствора основания х, действительно, линейна с коэффициентом угла
наклона
— = -0,001 ^ > (2.70)
6х V
определяемым эквивалентными электропроводностями ионов Н+ и В+.
Уравнение кривой кондуктометрического титрования при х > а
легко получить аналогичным способом, если исходить из раствора ВОН
заданной концентрации, который титруется кислотой. При этом также
получаем вывод о линейной зависимости между электропроводностью
и объемом титранта, но тангенс угла наклона этой зависимости
^-=0,001
(
Л
он
_-Я
А
_)/К (2.7.)
определяется уже величинами Я
он
_ и а потому оказывается
меньше по абсолютной величине.
Схематически зависимость между электропроводностью раствора
и объемом добавленного титранта, называемая кривой кондуктометри-
ческого титрования, для титрования сильной кислоты сильным осно-
ванием изображена на рис. 2.9. Эта зависимость идеализирована, по-
скольку не учитывает, что вблизи точки эквивалентности на величину
электропроводности оказывает влияние диссоциация молекул воды на
ионы Н+ и ОН~. Точку эквивалентности легко найти путем Экстра-
поляции линейных нисходящего и восходящего участков кривой кон-
дуктометрического титрования до пересечения.
При проведении кондуктометрического титрования калибровки
ячейки не требуется, так как задача состоит только в определении точ-
ки эквивалентности. Важно лишь, чтобы объем раствора не сильно воз-
растал в ходе титрования, Иначе электропроводность будет падать
вследствие разбавления. Поэтому по возможности используют титрант
с высокой концентрацией.
1
Кривая кондуктометрического титрования сильного основания
сильной кислотой, очевидно, должна иметь аналогичный вид, но с об-
ратным соотношением наклонов ветвей, так как Х
н
+ >
При титровании двухосновной кислоты с достаточно сильно разли-
чающимися константами диссоциации на кривой кондуктометрического
53
титрования обнаруживаются два излома, отвечающие двум стадиям
нейтрализации.
При титровании умеренно слабой кислоты сильным основанием
электропроводность вначале уменьшается вследствие нейтрализации,
но затем из-за появления хорошо диссоциированной соли линия ней-
трализации искривляется и на кривой титрования появляется плав-
ный минимум, что затрудняет определение точки нейтрализации.
В этом отношении титрование очень слабых кислот сильными основа-
х,мд
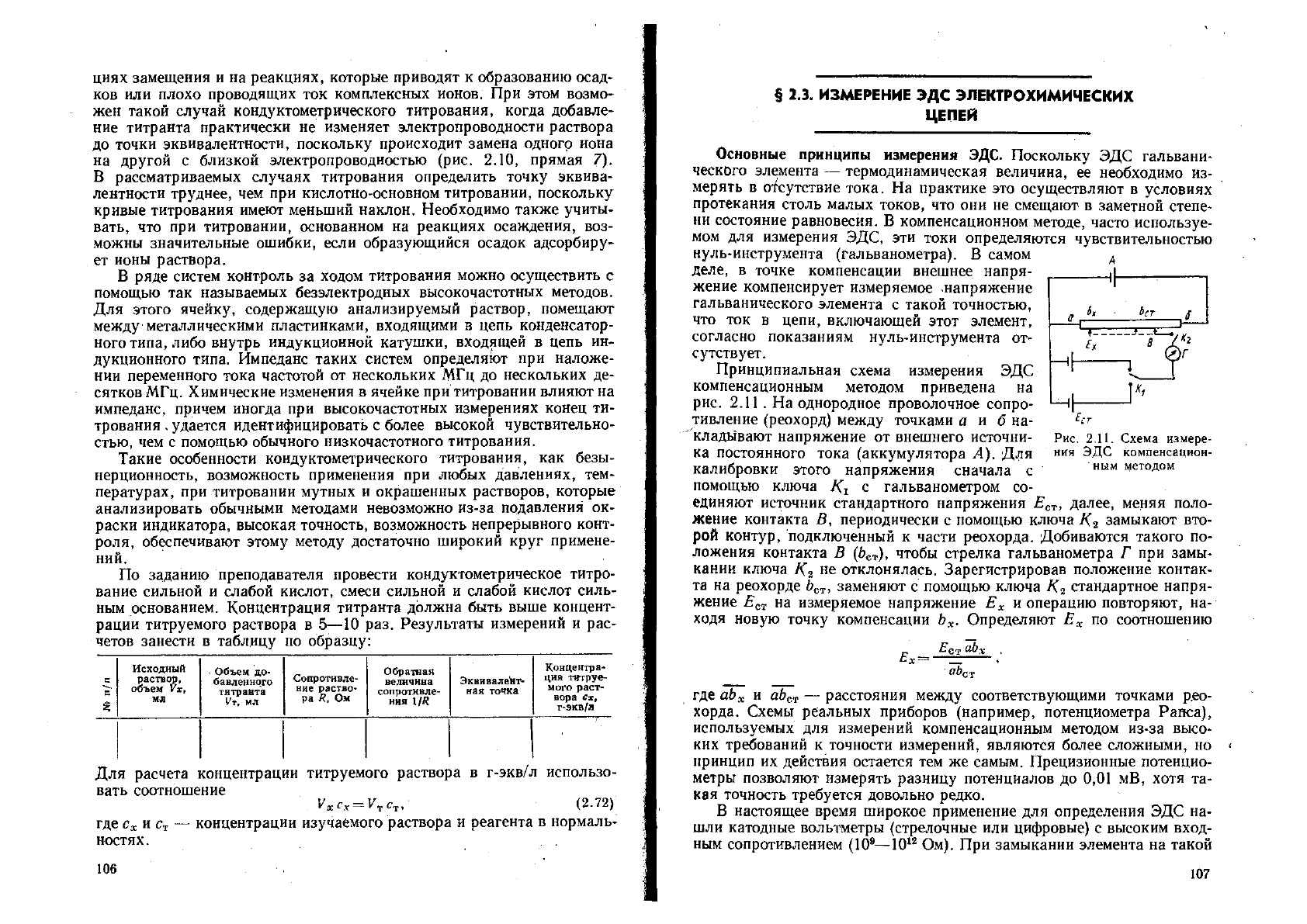
Рис. 2.9. Схематическое изо-
бражение кривой кондуктомет-
рического титрования сильной
кислоты НА сильным основа-
нием ВОН:
толстые линии — общая электро-
проводность; тонкие линии —
вклады отдельных ионов в общую
электропроводность
Рис. 2.10. Типичные примеры кривых
кондуктометрического титрования:
(1+4) — титрование сильной кислоты
сильным основанием; (2+4) — титрование
умеренно слабой кислоты сильным рсно-
ванием; (3+4) — титрование слабой кис-
лоты сильным основанием; (1+5)—титро-
вание хорошо проводящего раствора тит-
рантом с низкой электропроводностью;
(1+6) — титрование хорошо проводящего
раствора титрантом с незначительной
электропроводностью; (7+5) — титрование
при близких электропроводностях удаля-
ющегося из раствора иона и иона титранта
ниями отличается в лучшую сторону, так как электропроводность по
мере добавления титранта сразу начинает линейно возрастать, посколь-
ку в растворе появляется соль слабой кислоты — продукт реакции, хо-
рошо проводящий ток. Досле точки эквивалентности кривая титрова-
ния поднимается более круто из-за возникновения избытка ионов ОН~.
Точка эквивалентности сравнительно точно определяется путем линей-
ной экстраполяции до пересечения двух восходящих линейных участ-
ков, имеющих разный наклон. Поэтому при титровании умеренно сла-
бых кислот иногда прибегают к приему подавления их Диссоциации
(например, путем добавления к водному раствору спирта) и далее по-
лучают такую же кривую, как при титровании очень слабой кислоты.
Рассмотренные выше случаи кондуктометрического титрования иллю-
стрирует рис. 2.10.
Кондуктометрическое титрование с успехом применяется для опре-
деления точки эквивалентности при титровании, основанном на реак-
53
циях замещения и на реакциях, которые приводят к образованию осад-
ков или плохо проводящих ток комплексных ионов. При этом возмо-
жен такой случай кондуктометрического титрования, когда добавле-
ние титранта практически не изменяет электропроводности раствора
до точки эквивалентности, поскольку происходит замена одногр иона
на другой с близкой электропроводностью (рис. 2,10, прямая 7).
В рассматриваемых случаях титрования определить точку эквива-
лентности труднее, чем при кислотно-основном титровании, поскольку
кривые титрования имеют меньший наклон. Необходимо также учиты-
вать, что при титровании, основанном на реакциях осаждения, воз-
можны значительные ошибки, если образующийся осадок адсорбиру-
ет ионы раствора.
В ряде систем контроль за ходом титрования можно осуществить с
помощью так называемых безэлектродных высокочастотных методов.
Для этого ячейку, содержащую анализируемый раствор, помещают
между металлическими пластинками, входящими в цепь конденсатор-
ного типа, либо внутрь индукционной катушки, входящей в цепь ин-
дукционного типа. Импеданс таких систем определяют при наложе-
нии переменного тока частотой от нескольких МГц до нескольких де-
сятков МГц. Химические изменения в ячейке при титровании влияют на
импеданс, причем иногда при высокочастотных измерениях конец ти-
трования
.
удается идентифицировать с более высокой чувствительно-
стью, чем с помощью обычного низкочастотного титрования.
Такие особенности кондуктометрического титрования, как безы-
нерционность, возможность применения при любых давлениях, тем-
пературах, при титровании мутных и окрашенных растворов, которые
анализировать обычными методами невозможно из-за подавления ок-
раски индикатора, высокая точность, возможность непрерывного конт-
роля, обеспечивают этому методу достаточно широкий круг примене-
ний.
По заданию преподавателя провести кондуктометрическое титро-
вание сильной и слабой кислот* смеси сильной и слабой кислот силь-
ным основанием. Концентрация титранта должна быть выше концент-
рации титруемого раствора в 5—10 раз. Результаты измерений и рас-
четов занести в таблицу по образцу:
с
с
2
Исходный
раствор,
объем УХ,
мл
Объем до-
бавленного
титранта
Ут, мл
Сопротивле-
ние раство-
ра Я, Ом
Обратная
величина
сопротивле-
ния 1/Н
Эквивалент-
ная точка
Концентра-
ция титруе-
мого раст-
вора Сх,
г-экв/л
>
Для расчета концентрации титруемого раствора в г-экв/л использо-
вать соотношение
У
х
с
х
= У
т
с
т
, (2.72)
где с
х
и с
т
— концентрации изучаемого раствора и реагента в нормаль-
ностях.
54
§ 2.3. ИЗМЕРЕНИЕ ЭДС ЭЛЕКТРОХИМИЧЕСКИХ
ЦЕПЕЙ
«п
-V'
Ьст л
4
Т "
Ех
Ч 1 1
,1
К<
Основные принципы измерения ЭДС. Поскольку ЭДС гальвани-
ческого элемента — термодинамическая величина, ее необходимо из-
мерять в отсутствие тока. На практике это осуществляют в условиях
протекания столь малых токов, что они не смещают в заметной степе-
ни состояние равновесия. В компенсационном методе, часто используе-
мом для измерения ЭДС, эти токи определяются чувствительностью
нуль-инструмента (гальванометра). В самом
А
деле, в точке компенсации внешнее напря-
жение компенсирует измеряемое напряжение
гальванического элемента с такой точностью,
что ток в цепи, включающей этот элемент,
согласно показаниям нуль-инструмента от-
сутствует.
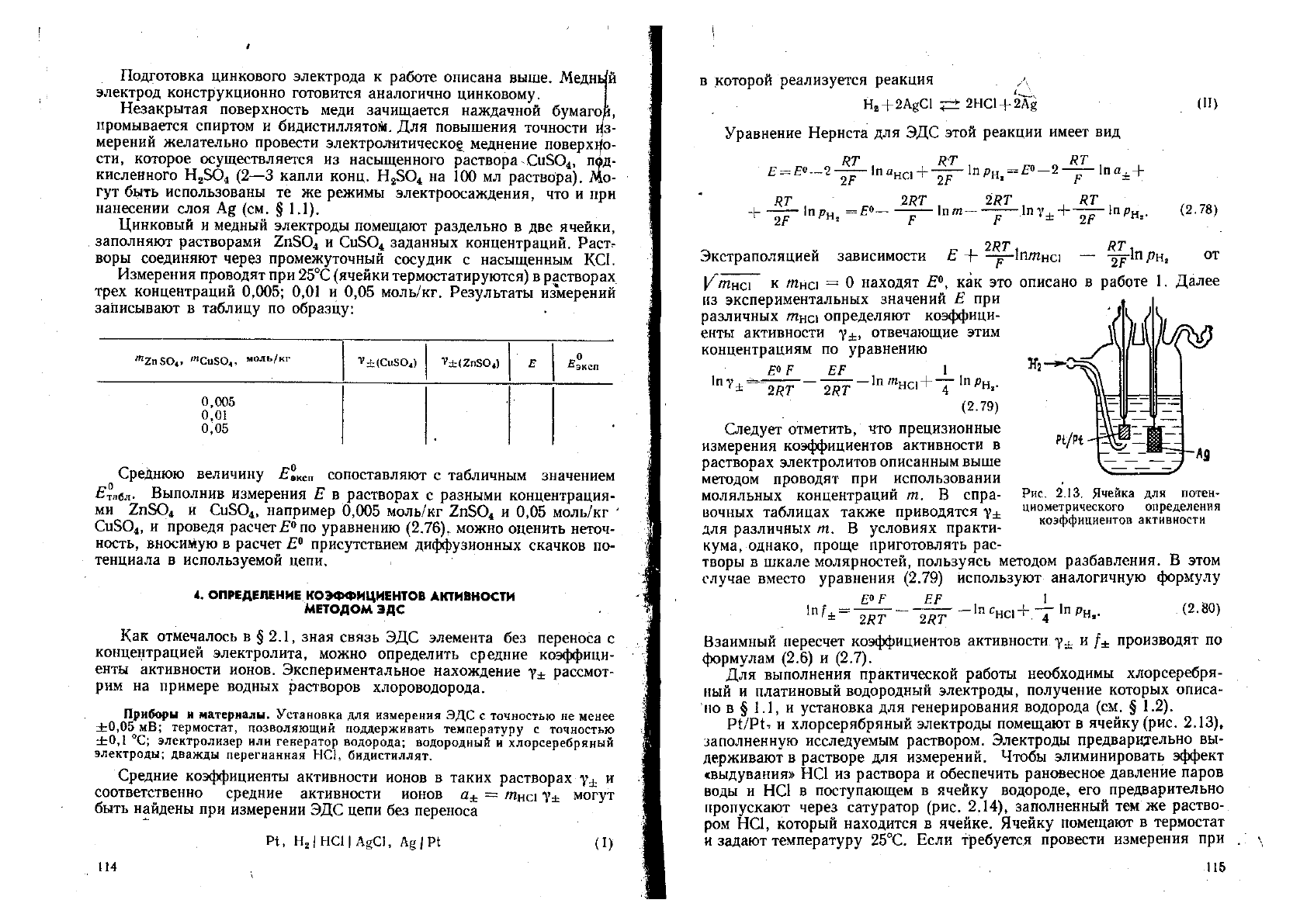
Принципиальная схема измерения ЭДС
компенсационным методом приведена на
рис. 2.11. На однородное проволочное сопро-
тивление (реохорд) между точками а и б на-
кладывают напряжение от внешнего источни-
ка постоянного тока (аккумулятора Л). Для
калибровки этого напряжения сначала с
помощью ключа /С
х
с гальванометром со-
единяют источник стандартного напряжения Е
ст
, далее, меняя поло-
жение контакта В, периодически с помощью ключа /С
2
замыкают вто-
рой контур, подключенный к части реохорда. Добиваются такого по-
ложения контакта В (6
СТ
), чтобы стрелка гальванометра Г при замы-
кании ключа К
2
не
отклонялась. Зарегистрировав положение контак-
та на реохорде й
ст
, заменяют с помощью ключа /С
2
стандартное напря-
жение Е
ст
на измеряемое напряжение Е
х
и операцию повторяют, на-
ходя новую точку компенсации Ь
х
. Определяют Е
х
по соотношению
Е
ст
аЬ
х
,
— >
Рис. 2.11. Схема измере-
ния ЭДС компенсацион-
ным методом
аЬ
ст
где аЬ
х
и
аЬ
С1!
— расстояния между соответствующими точками рео-
хорда. Схемы реальных приборов (например, потенциометра Рапса),
используемых для измерений компенсационным методом из-за высо-
ких требований к точности измерений, являются более сложными, но
принцип их действия остается тем же самым. Прецизионные потенцио-
метры позволяют измерять разницу потенциалов до 0,01 мВ, хотя та-
кая точность требуется довольно редко.
В настоящее время широкое применение для определения ЭДС на-
шли катодные вольтметры (стрелочные или цифровые) с высоким вход-
ным сопротивлением (10
9
—10
12
Ом). При замыкании элемента на такой
54 5*

вольтметр проходят весьма малые токи, которые практически не выво-
дят систему из состояния равновесия. Как было показано в § 1.3, про-
стейший катодный вольтметр можно изготовить самостоятельно на ба-
зе стандартных операционных усилителей.
Источником стандартного (опорного) напряжения, как правило,
является элемент Вестона, который состоит из ртуть (I) сульфатного и
амальгамного кадмиевого электродов и насыщенного водного раствора
сульфата кадмия в качестве электролита:
— С(1 (12,5 мае. %) 13Сс150
4
.8Н20 (насыщ.) | Н^ЗО* (тв) +
Токообразующая реакция:
С4
+ НЙ+
Са
2
+
+ 2Н§
Элемент Вестона может быть изготовлен в
лабораторных условиях, однако в большин-
стве случаев требованиям измерений удовле-
творяют
•
элементы Вестона, выпускаемые
промышленностью. Типичная конструкция
элемента Вестона схематически изображена
на рис/2.12.
При 20°С равновесное напряжение элемен-
та Вестона равно 1,01864 В*. В интервале
температур 0 — 40 °С зависимость ЭДС эле-
мента Вестона от температуры выражается
формулой
Ё = Е
20
—4,06- Ю
-5
((—20) —9,5-10-? (/ — 20)* +
+ 1. Ю-* (7 — 20)®,
где / — температура элемента; , Е
20
— ЭДС
при 20°С.
Методы определения различных физико-химических величин и ко-
личественного анализа растворов на основе измерения ЭДС получили
общее название потенциометрии. В потенциометрии широко исполь-
зуется измерение потенциала исследуемого электрода относительно
какого-либо электрода сравнения (см. с. 20). Потенциалы выражаются
в шкалах либо выбранного электрода сравнения (последний обяза-
тельно должен указываться), либо пересчитываются в водородную шка-
лу, которая отвечает стандартному (нормальному) водородному элект-
роду сравнения [Р1, Н
2
(р = 1 атм = 101,325 кПа), Н+ (а = 1)1.
Для стандартного (нормального) водородного электрода будет исполь-
зоваться принятое в нашей стране сокращенное обозначение н. в. э.
В водородной шкале потенциалов в водных растворах выражаются
стандартные (нормальные) потенциалы электродных реакций, относя-
* Следует отметить, что это значение приводится в абсолютных вольтах,
которые соответствуют рекомендованной ШРАС системе единиц (СИ). В лите-
ратуре и справочниках чаще приводится значение 1,01830 В, которое отвеча-
ет ЭДС элемента Вестона в международных вольтах, т. е. в единицах электри-
ческого напряжения, которые в настоящее время не используются.
Рис, 2.12. Конструкция
элемента Вестона:
/ — амальгама Сд
(12,5 мае. %); 2
—
кристал-
лы СаЗО^/зНаО; 3
—
воз-
дух; 4
—
насыщенный раст-
вор Сд50
4
'
8
/зН
2
0; 5 —паста
Нё50
4
+С<1504-
8
/зН
2
0;
55 12$
щйеся к фундаментальным величинам в электрохимии и представлен-
ные в виде справочных таблиц. Стандартный (нормальный) потенциал
определяется как ЭДС элемента, составленного из исследуемого элек-
трода и н! в. э. при условии, что активности компонентов потенциало-
пределяющей реакции, протекающей на исследуемом электроде, равны
единице. Потенциал н.в.э. при всех температурах принимается равным
нулю. Согласно Стокгольмской конвенции (1953) ШРАС, в схеме галь-
ванической ячейки водородный электрод всегда записывается слева, а'
исследуемый — справа. Потенциал исследуемого электрода считается
положительным, если в режиме источника тока слева направо во внеш-
ней цепи движутся электроны, а в растворе — катионы. Например, за
стандартный потенциал Е° хлорсёребряного электрода принимается
ЭДС гальванической ячейки
—Р1, Н
2
(101,
325
кПа)
(
НС1 (а
±
= 1) | А§С1, А^|Р1 +
Для любой электрохимической реакции
УаА+Г
в
В+...+/»- (А)
электродный потенциал, определенный по отношению к н.в.э., запи-
сывают в виде
/
А В
По виду это уравнение полностью совпадает с уравнением (2.23),
однако в (2.23) Е — ЭДС любой химической реакции, осуществляемой
в электрохимической системе, а Е° — стандартная ЭДС этой реакции;
в то Же время в уравнении (2.23а) эти величины отвечают химической
реакции, получающейся при суммировании исследуемой электродной
реакции и реакции Н
2
2Н
+
+ 2е~. Одинаковое обозначение элект-'
родных потенциалов и ЭДС достаточно широко распространено в лите-
ратуре, что необходимо принимать во внимание.
Во многих электрохимических системах удобно пользоваться зна-
чениями потенциалов, измеренными относительно обратимого водо-
родного электрода (рц
2
== 101,3 кПа), в том же растворе при темпера-
туре опыта. Обозначив такие значения через Е
г
и учитывая, что потен-
циал водородного электрода при рц
2
= сот* должен быть чувстви-
телен только к активности ионов гидроксония, найдем
п'р * 2 з/?Т
Ег^Е — \па
н
^Е+ рН. (2,73)
Надежность измерений ЭДС, так же как и других электрохимиче-^
ских экспериментальных результатов, в большой мере определяется
точностью приготовления растворов, их'чистотой, тщательностью под-
готовки к опыту электродов и электродных сосудов, строгим соответ-
ствием используемых приборов требованиям эксперимента, аккурат-
ное

ностью проведения измерений/Дело в том, что правильные значенйя
ЭДС будут получаться лишь в том случае, если электрод не будет по-
ляризоваться в заметной степени какими-либо посторонними процес-
сами за счет восстановления или окисления примесей раствора, или
же в результате протекания внешних токов через цепь.
При малых плотностях тока поляризация электрода определяется
уравнением
/?Т /1 '
= —, (2.74)
г 6 ц
где 1
0
—ток обмена потенциалопределяющей реакции; I — ток поля-
ризации; 5 — поверхность электрода. Ток обмена /
0
водородного пла-
тинового электрода составляет в 1 М растворе НС1 ~ 1 мА/см
2
ис-
тинной поверхности, а в 0,001 М ~ 0,01 мА/см
2
истинной поверхности. *
Если платинированный платиновый (Р1/Р1) электрод с видимой по-
верхностью 1 см
2
имеет фактор шероховатости 100, то его поляризуе-
мость в растворе 0,001 М НС1 будет определяться соотношением:
АЕ
ПОЛ
= 25^~-, МВ. (2.75)
Значит, требование измерения потенциала с точностью 0,01 мВ будет
соблюдаться лишь при / < 4-10~
4
мА = 4-10~
7
А. Предельный диф-
фузионный ток по кислороду из неперемешиваемого раствора, насы-
щенного воздухом, составляет [см. уравнение (4.10)]:
(а )
пОР
о 4-10~
5
см
2
/с* 10
5
Кл/моль
г
<
л
, .
ч л 1С л / 2
/<°2>==-- сЯ = 3,5-10—
7
моль/см
3
= 0,15 мА/см
2
,
й
6 Ю-
2
см
где 6 — толщина диффузионного слоя; со
2
— концентрация кислоро-
да в растворе, насыщенном воздухом; остальные обозначения — обще-
принятые. Следовательно, для достаточно точных измерений концент-
рация кислорода в растворе должна быть понижена на ~3 порядка,
что может быть достигнуто продувкой раствора инертным газом, со-
держащим не более 0,02 % 0
2
(см. § 1.1). Аналогичными оценочными
расчетами можно показать, что даже для системы А§/А§
+
, где ток об-
мена реакции А§+ + е~ при [Ав+1—0,001 М составляет
~ 100 мА/см
2
, прецизионное измерение равновесного потенциала с
точностью -—'0,01 мВ также требует очистки раствора от кислорода
воздуха. Очевидно, что помимо кислорода недопустимо присутствие
в растворе в заметных количествах каких-либо других окисляющихся
или восстанавливающихся примесей. Такие примеси или продукты их
превращений, а также непосредственно не вступающие в электрохи-
мические реакции «инертные» примеси, адсорбируясь на электроде,
могут сильно снижать ток обмена потенциалопределяющей реакции.
Отсюда понятны высокие требования к чистоте растворов й подготов-
ке электродов в потенциометрии (см. § 1.2).
Очевидно, что чем меньше ток обмена потенциалопределяющей
реакции, в частности чем ниже концентрация участвующих в ней ве-
56
ществ, тем более жесткие требования предъявляются к чистоте раство-
ров, а также к предобработке поверхности электродов.
Отметим также, что если ЭДС системы; включающей водородный
электрод* составляет, например, ~0,4 В, то входное сопротивление
вольтметра для обеспечения точности измерения ЭДС 0,01 мВ должно
составлять не менее 0,4 В/4
-
10~
7
А = 10
е
Ом, иначе ЛЕ
пол
будет вы-
ше 0,01 мВ за счет протекания тока через внешнюю измерительную
цепь.
Определение стандартной ЭДС. Знание стандартной ЭДС (Е°) по-
зволяет определить ЭДС соответствующего гальванического элемента
при различных активностях реагирующих веществ [уравнение (2.23)1,
найти стандартную свободную энергию Гиббса (Е° = — А6°/пР),
/ пРЕ°\
рассчитать константу равновесия реакции /
1п
К = ]• Зависимость
Е° от температуры может быть использована для расчета стандартных
энтропии и энтальпии реакции: Д5° и ДЯ°.
Экспериментальное нахождение ^ рассмотрим на примере реак-
ции 2А§С1 + 2п =г=*2пС1
2
+ 2А§, которая осуществляется в гальва-
ническом элементе без переноса. Принцип определения Е
ь
для
этой реакции описан в § 2.1 и заключается в построении графика
3&Т о у
1
зависимости величины Е — 1пт -—1п 2 от У т, где т —
моляльность раствора [уравнение (2.25а)1. В качестве примера нахож-
дения Е° в цепях с переносом возьмем элемент Даниэля — Якоби,в
котором осуществляется реакция 2п + Си
2+
ае* 2п
2
+ + Си.
ПРАКТИЧЕСКАЯ ЧАСТЬ
1. ОПРЕДЕЛЕНИЕ Е° В ЦЕПИ БЕЗ ПЕРЕНОСА,
ВКЛЮЧАЮЩЕЙ! ЦИНКОВЫЙ И ХЛОРСЕРЕБРЯНЫЙ ЭЛЕКТРОДЫ
Приборы и материалы. Установка для измерения ЭДС с точностью
±0,1 мВ; термостат; серебряный и цинковый электроды; раствор 2пС1
2
; биди-
стиллят.
Для приготовления хлорсеребряного электрода к серебряной про-
волоке приваривают пластину (или сетку) из А§ размером 24-3 ммх
ХЗО мм. Проволоку впаивают в стеклянную трубку. Серебрение плас-
тины и нанесение слоя А§С1 проводят по методике, описанной в § 1.1.
Для приготовления цинкового электрода стержень из цинка плот-
но вставляют в тефлоновую обойму, имеющую в верхней части вы-
ступ в форме керна шлифа; при этом цинковый стержень должен выхо-
дить в нижней части из тефлона на 2—3 см, так, чтобы общая открытая
поверхность цинка составляла I—2 см
2
. Поверхность цинка зачищают
наждачной бумагой, промывают спиртом и бидистиллятом, после чего
на 5—10 с погружают в раствор Н§
2
(М0
3
)
2
. Выделившиеся капельки
ртути растирают шероховатой стеклянной пластинкой до получения од-
56 5*

нородной амальгамированной поверхности. Давление паров ртути над
насыщенной амальгамой цинка очень низкое, поэтому работа с амаль-
гамированным цинковым электродом не требует каких-либо специаль-
ных мер безопасности. Так как имеет место образование насыщенного
раствора 2п в Н§, активность цинка в амальгаме не отличается от ак-
тивности металлического цинка.
Приготовленные таким образом электроды помещают в двухэлект-
родную ячейку (см. § 1.1), в которую наливают раствор 2пС1
3
заданной
концентрации до полного погружения металлических поверхностей.
Ячейку термостатируют при 25°С. Перед началом измерений через раст-
вор 15—20 мин продувают инертный газ. Измерения выполняют, по-
следовательно меняя растворы, причем от меньших концентраций к
большим. Замеры разности потенциалов проводят до установления
постоянного значения с точностью ±0,1 мВ. Результаты измерений
оформляют в виде таблицы;
V
т
3 ЯТ ЯТ
№ опцта
га, моль/кг
V
т
Е, В 1п Т1п 2, В
1
0,002
2
0,005
3
0,01
4
0,05
5
0,1 .
«
Строят график зависимости Е — 1п т—-у- 1п 2 от У/п. Экстра-
полируя эту зависимость до с 0, методом наименьших квадратов
(см. § 1.4) находят стандартную ЭДС (Е°) исследуемой реакции. Полу-
ченное значение Е° сравнивают с табличными данными Е° = Е^
а/А с1
_
— ^2П
2+
/2П»
где в
правую часть входят стандартные потенциалы
электродных реакций (см. приложение I).
2. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРНОЙ ЗАВИСИМОСТИ ЭДС
ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА И РАСЧЕТ НА ЕЕ ОСНОВЕ
ТЕРМОДИНАМИЧЕСКИХ ВЕЛИЧИН ХИМИЧЕСКОЙ РЕАКЦИИ
Приборы и материалы см. в работе 1.
Для выполнения данной работы используем тот же элемент, что и в
работе I. Для какой-либо одной выбранной концентрации 2пС1
2
из-
меряют ЭДС при различных, отличающихся друг от друга На 5—7°,
температурах в интервале 20—50° С. При определении температур-
ного коэффициента ЭДС гальванического элемента термостатирование
проводят, погружая ячейку в термостат (что должно быть предусмот-
рено конструкцией ячейки), и выдерживают при заданной температуре
в течение 25—30 мин.
По полученным результатам строят кривую зависимости ЭДСот тем-
пературы и ее графическим дифференцированием (см. раздел 1.4) оп-
57 119
р деляют температурный коэффициент. Рассчитывают термодинами-
ческие величины для реакции 2п + 2А§С1 ^ 2 + 2пС1
2
:
:г
~А6 = 2РЕ; —
АН
= 2Р[Е — Т
- Д5 = 2Р
йТ
Результаты записывают в таблицу:
№ опыта
г, к Е, В
1
—ДО, кДж
ДЕ/ДГ, В/К
ДЯ, кДж
Д5, Д*к/К
Если преподаватель дает 4—5 студентам определить Е° при 4—5
температурах в интервале 20—50° С (каждому при какрй-либо одной
температуре), то, используя результаты, полученные группой, сту-
дент может рассчитать по вышезаписанным соотношениям (с заменой
Е на Е°, АО на АО
0
, АН на А Я
0
и А5 на А5°) стандартные термодина-
мические величины АО
0
, А Я
0
и АЗ
0
,
3. ОПРЕДЕЛЕНИЕ Е° НА ПРИМЕРЕ ЭЛЕМЕНТА
ДАНИЭЛЯ — ЯКОБИ
Приборы и материалы. Установка для измерения ЭДС; термостат; цинко-
вый и медный электроды; 2п50
4
и Си$0
4
; бидистиллят.
Измерим ЭДС гальванического элемента
Си / 2п | 2п50
4
1 Си50
4
1 Си
на границе раздела двух растворов. ^Сотя диффузионный скачок по-
тенциала на такой границе при одинаковых концентрациях 2п30
4
и Си50
4
незначителен (ввиду близости чисел переноса катионов 2п
2+
и
Си
2+
), для более полного его элимирования измерения лучше прово-
дить в цепи /
Си I 2п
I
2п50
4
\\ КС1 (насыщ.) || Си$0
4
1 Си
Тогда, пренебрегая диффузионными потенциалами, для ЭДС данной
системы можем записать
Е
=
Е0
ЯТ
2 Р
1п-
= Е<>-
ЯТ
т
»
2п
2
+
2 Р +
Поскольку длй симметричного электролита согласно уравнениям
(2.29) и (2.30) коэффициенты активности отдельных ионов приближен-
но можно принять равными средним коэффициентам активности, ис-
пользуя табличные значения последних (см. приложение II), на основе
измерений Е 21ри различных тс
и
*+ = тгп*+ можем рассчитать Е°:
1п
Си
2
+
ЯТ
2 Р
1п
Т
Си
2
+
(2.76)
У±(Си50
4
)
2 Р
1п
У±(2пЗО
А
)
(2.77)
5*
Подготовка цинкового электрода к работе описана выше. МеднУй
электрод конструкционно готовится аналогично цинковому. (
Незакрытая поверхность меди зачищается наждачной бумагоц,
промывается спиртом и бидистиллятом. Для повышения точности Из-
мерений желательно провести электролитическое меднение поверхно-
сти, которое осуществляется из насыщенного раствора Си30
4
, под-
кисленного Н
2
30
4
(2—3 капли конц. Н
2
50
4
на 100 мл раствора). Мо-
гут быть использованы те же режимы электроосаждения, что и при
нанесении слоя (см. § 1.1).
Цинковый и медный электроды помещают раздельно в две ячейки,
заполняют растворами 2п50
4
и Си$0
4
заданных концентраций. Раст^
воры соединяют чер^з промежуточный сосудик с насыщенным КС1.
Измерения проводят при 25°С (ячейки термостатируются) в растворах
трех концентраций 0,005; 0,01 и 0,05 моль/кг. Результаты измерений
записывают в таблицу по образцу:
т
2п50
4
,
т
Си$0
4
, моль/кг
?±(Си50
4
)
?±<2п50
4
)
Е
^эксп
0,005
0,01
0,05
СреДнюю величину Е%
ксп
сопоставляют с табличным значением
Е
г
абл. Выполнив измерения Е в растворах с разными концентрация-
ми 2П50
4
И СиЮ
4
, например 0,005 моль/кг 2п50
4
и 0,05 моль/кг '
Си30
4
, и проведя расчет Я
0
по уравнению (2.76)
г
можно оценить неточ-
ность, вносимую в расчет Е° присутствием диффузионных скачков по-
тенциала в используемой цепи. .
(
4. ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТОВ АКТИВНОСТИ
Методом эдс
Как отмечалось в § 2Л, зная связь ЭДС элемента без переноса с
концентрацией электролита, можно определить средние коэффици-
енты активности ионов. Экспериментальное нахождение рассмот-
рим на примере водных растворов хлороводорода.
Приборы и материалы. Установка для измерения ЭДС с точностью не менее
±0,05
о
мВ; термостат, позволяющий поддерживать температуру с точностью
-ЬОД °С; электролизер или генератор водорода; водородный и хлорсеребряный
электроды; дважды перегнанная НС1, бидистиллят.
Средние коэффициенты активности ионов в таких растворах у
±
и
соответственно средние активности ионов а
±
= т
Н
с\ У± могут
быть найдены при измерении ЭДС цепи без переноса
130 66 119
И, Н
8
|НС1|.А§С1,- / Р1
(I)
в которой реализуется реакция А
Н
2
+2А^С1 2НС1 + 2А'§ (II)
Уравнение Нернста для ЭДС этой реакции имеет вид
ВТ В
К
Т ВТ
+ «НРЙ. (2.78)
2 ВТ ВТ
Экстраполяцией зависимости Е Н—|г-1птнс1 — -^р^Рнг от
|/"т
Н
с1 к тнсг = 0 находят Е°
у
как это описано в работе 1. Далее
из экспериментальных значений Е при
различных тцс\ определяют коэффици-
енты активности у
±
, отвечающие этим
концентрациям по уравнению
Е°Р ЕР 1
1п
у , ^ „ _ — — —
т
нп + ~Т~
1п
р
н
.
г
± 2 ВТ 2 ВТ
мсл
4
(2.79)
Следует отметить, что прецизионные
измерения коэффициентов активности в
растворах электролитов описанным выше
методом проводят при использовании
моляльных концентраций т. В спра-
вочных таблицах также приводятся у±
для различных т. В условиях практи-
кума, однако, проще приготовлять рас-
творы в шкале молярностей, пользуясь методом разбавления. В этом
случае вместо уравнения (2.79) используют аналогичную формулу
Е° Р ЕР 1
Взаимный пересчет коэффициентов активности у
±
и /
±
производят по
формулам (2.6) и (2.7).
Для выполнения практической работы необходимы хлорсеребря-
ный и платиновый водородный электроды, получение которых описа-
но в § 1.1, и установка для генерирования водорода (см. § 1.2).
Р1/РЬ и хлорсерябряный электроды помещают в ячейку (рис. 2.13),
заполненную исследуемым раствором. Электроды предварительно вы-
держивают в растворе для измерений. Чтобы элиминировать эффект
«выдувания» НС1 из раствора и обеспечить рановесное давление паров
воды и НС1 в поступающем в ячейку водороде, его предварительно
пропускают через сатуратор (рис. 2.14), заполненный тем же раство-
ром НС1, который находится в ячейке. Ячейку помещают в термостат
и задают температуру 25°С. Если требуется провести измерения при
Рис, 2.13. Ячейка для потен-
диометрического определения
коэффициентов активности
5*
температурах, сильно отличающихся от 25° С, то необходимо тер
1
-
моста тировать и сатуратор.
Через ячейку в течение всего опыта продувают водород. После
насыщения раствора в ячейке водородом (1—2 ч) измеряют ЭДС с
интервалом 20—30 мин до тех пор, пока расхождения между измерен-
ными величинами не будут превышать 0,05 мВ. Аналогичные измере-
ния выполняют в растворах других концентраций. Растворы НС1 го-
товить нужно очень тщательно, лучше из фиксанала. Сначала готовят
Газ
*
^-<0.0 О О О О О ° О О
Рис. 2.14. Сатураторы:
1 — раствор; 2 — пузырьки газа
наиболее концентрированный раствор из выбранной для измерений се-
рии растворов, а затем разбавлением получают другие растворы. На-
чинать же измерения лучше с самого разбавленного раствора.
При расчетах в значения давления водорода необходимо внести
поправку на давление паров раствора хлороводорода, которое до кон-
центрации НС1 1 М можно-считать равным давлению паров воды (при
25° С К = 24 мм рт. ст. = 3,2-10
3
Па). В уравнения подставляют зна-
чения
• Р-Н
Ри
*~ 760.133,3Па '
(2
'
8,)
где Р — барометрическое давление, Па.
После определения Е° или заимствования его из справочных таблиц
результаты измерения ЭДС и последующих расчетов по уравнению
(2.80) представляют в виде таблицы:
№ опыта
С
НС1>
М
Е, в
1
0,005
п
0;2
116
Если два элемента типа (I) соединить навстречу друг другу
Р*, Н
2
1 НС11 А§С1, | Р1—Р1| А&, А^С11 НС11 Н
2
, Р* (III)
с" с*
то при с" Ф с' получится концентрационный элемент без переноса
с ЭДС
Положим, что для одного из растворов
НС1
/± определен каким-либо
другим независимым способом, например по снижению температуры
замерзания илй по упругости пара. Тогда, измерив ЭДС цепи (III),
в которую включен один из растворрв, например с" с известным значе-
нием можно определить коэффициент активности НС1 в другом
растворе:
(2.83)
Очевидно, что составление элемента (III) не обязательно, а доста-
точно провести серию измерений ЭДС элемента (I) с различными кон-
центрациями НС1, для одной из которых значение /
±
известно^ а зна-
чение Е получать как разницу Е" — Е\
5. ОПРЕДЕЛЕНИЕ КОНСТАНТ УСТОЙЧИВОСТИ
КОМПЛЕКСОВ
Потенциометрические методы широко используются для исследо-
вания комплексообразования.
Если ион металла М
2+
с частицами лиганда Ь образует последова-
тельный ряд комплексов М
2+
Ь
г
- (/ = 0, 1, ..., п)
г
то в условияХ(рЪвно-
весия общая концентрация ионов металла-комплексообразова^еля бу-
дет связана с концентрациями ступенчатообразующихся отдельных
комплексов [М
2+
Ь*}, концентрацией несвязанных в.комплекс ионов
металла [М
2+
] и лиганда Г1Л соотношениями:
в
2 [
мг+
Ч-Г
мг+
1 2 мч'. (
2
-
84
)
т
* =
0
1
*
1
*
1=0
где
0
[М
г+
Ц)
Г
(2.85)
общая концентрационная константа устойчивости комплекса. Для
упрощения записи заряд лиганда'и общий заряд комплексной части-
цы здесь и далее опускаются.
П7

Пусть при восстановлении комплексов М
2+
образуются комп-
лексы М
2+
Ь/(/ = 0, 1, /г'). Тогда на электроде, на котором об-
ратимо протекает реакция М
2+
+ (г — г') е~
ЗР*
А4
2
+, установится
потенциал, равный
о' ЯТ [м
2+
1
+ — . (2.86)
Подставляя (2.84) в (2.86), получаем
Л' ЯТ
1
М
2
+ ,М*' +
Г
(г—г') Р с
*
Т
(2.87)
2 р; и
7
/—о
1
Необходимо оговорить, что так как в этих уравнениях используют-
ся концентрации, а не активности, то они могут быть примейены лишь
в растворах с постоянной ионной силой. Значение
м
г+ отличает-
ся от стандартного потенциала Е°
м
г+
,м
г
+>
так как в
°бщем случае
включает в себя поправки на коэффициент активности и диффузион-
ный потенциал. Постоянство ионной силы обычно достигается за счет
введения в раствор избытка индифферентного электролита. Высокая
концентрация последнего позволяет практически элиминировать диф-
фузионный потенциал.
Анализ экспериментальных зависимостей Е от концентраций ионов
и лиганда при различных их соотношениях на основе уравнения (2.87)
позволяет определить параметры процесса комплексообраЗования.
Рассмотрим случай, когда разряд иона происходит до металла
М
2+
+ ге- М.
Тогда уравнение (2.87) упрощается:
При постоянстве [Ы, в частности, когда сь >' и [1Л ~ сь ~
^ сопз!, должна наблюдаться линейная зависимость Е от 1п с
коэффициентом наклона КТ/(гР). С другой стороны, при сь >
как правило, начиная с определенных, достаточно высоких сь, в раство-
ре присутствует практически один комплекс М
2+
Ь
п
. В этом случае
,
1п
-7Г
1п с
м* + --^ТГ
|ПС
Ь (2-89)
и при сопз* должна иметь место линейная зависимость Е от
130
п С1, из коэффициента наклона которой тр- можно определить д,
а экстраполируя прямую Е — 1п съ к значению 1п сь = 0, найти
— Щ 1п р
п
. Определив ^мг+.м в аналогичной системе, но
не содержащей комплексообразующих частиц, или рассчитав значение
на основе табличных значений 2?м*+,м
и
коэффициента ак-
тивности М
2+
в растворе данной ионной силы, найдем р
п
. Для расчета
нз значений м необходимо также либо определить
диффузионнкй потенциал, либо последний практически полностью
элиминировать.
Определение константы устойчивости комплексных соединений ме-
тодом ЭДС рассмотрим на примере оксалатных комплексов ионов меди
Си (С
2
0
4
)1~.
Приборы и материалы. Установка для измерения ЭДС; каломельный и
медный электроды; соли Си50
4
• 5Н
2
0, К
2
С
2
0
4
, К
2
$0
4
, бидистиллят.
Для нахождения концентрационной константы устойчивости окса-
латного комплекса ионов меди В
2
= Е
Сц
(
С2
°*)—1— измеряют ЭДС эле-
мента
Си / Н^
2
С1
2
| КС1 (насыщ.) 112.10-
3
МСи50
4
, *МК
2
С
2
0
4
, (3—х) МК
2
50
4
| Си
(IV)
Концентрацию оксалат-ионов изменяют, добавляя к раствору 2-10~
3
М
Си50
4
+ ЗМ К
2
50
4
(раствор I) небольшой объем раствора 2-10~
3
М
Си50
4
+ 1М К
2
С
2
0
4
+ 2М К
2
50
4
(раствор II).
Измерения проводят в ячейке типа представленной на рис. 2.15.
Приготовление медного электрода описано в работе 3. Все соли долж-
ны быть тщательно очищены, исследуемый раствор продут инертным
газом, свободным от следов* кислорода. Точную концентрацию в раство-
ре Си$0
4
следует установить титрованием, так как медный купорос при
хранении теряет воду.
В тщательно промытую и ополоснутую раствором I ячейку вводят
точно измеренный объем раствора I (например, 25 мл). Этим же раст-
вором смачивают нижний шлиф левого сосуда, после чего в него нали-
вают раствор насыщенного НС1 и помещают каломельный электрод.
При непрерывном пропускании через раствор инертного газа замеряют
через каждые 5 мин ЭДС до установления постоянного значения. Про-
веряют независимость этого значения от наличия или отсутствия пере-
мешивания (инертным газом или магнитной мешалкой). Если при пре-
кращении перемешивания ЭДС не меняется в пределах ±0,5 мВ, то
из градуированной пипетки последовательно добавляют раствор II
объемом АУ
п
. После введения новой порции раствора и перемешивания
с помощью магнитной мешалки дожидаются установления постоян-
ного значения ЭДС. Величину Д1У
п
подбирают так, чтобы с
Сг
о\~ из-
менилась от ~0,01 до ~0,2, при п = 10. Рассчитывают концентра-цию с
с
,о|~ после введения каждой порции раствора II. По ЭДС в
66 119 5*
