Дамаскин Б.Б., Петрий О.А., Подловченко Б.И. и др. Практикум по электрохимии
Подождите немного. Документ загружается.


растворе I определяют си — Е — ^г 1ш
Си
2*. Результаты записы-
вают в таблицу по образцу:
п
А У
п
, мл
с
С
г
02-
»
'М
Е, В
Строят кривую зависимости Е — 1ш?
Ся
о|- и по линейному участку
кривой определяют п, а его экстраполяцией к 1п Сс
2
о|- — 0—кон-
Рис. 2.15. Ячейка для потенциометрического титро-
вания:
1
—
медный индикаторный электрод; 2
—
исследуемый раст-
вор; 3
—
магнитная мешалка; 4
—
раствор КС1 (нас.); '5
—
пробка из стекловаты; 6
—
каломельный электрод сравне-.
ния; 7 — бюретка для введения порции раствора
центрационную константу устойчивости оксалатного комплекса ионов
двухвалентной меди Си (С
2
0
4
)2~ — Р
2
1см. уравнение (2.89)].
6. ОПРЕДЕЛЕНИЕ ЧИСЕЛ ПЕРЕНОСА МЕТОДОМ ЭДС
Как показано в § 2.1, для определения чисел переноса исполь-
зуют концентрационные элементы с переносом. Если может быть
реализован обратимый электрод М/М
2+
и имеются табличные данные
коэффициентов активности соли Му+ А
г
_, из которых находят а
±
, то
61
значения и 1—I- ио^ов рассчитывают непосредственно из
измерений ЭДС одной гальванической ячейки типа I:
(V)
по уравнению (2.39а):
Расчет ^^ можно выполнить, не используя табличные значения а
±
,
если дополнительно цзмерить ЭДС ячейки типа II, аналогичной ячей-
ке типа I, но с элиминированным диффузионным потенциалом:
Для Е
и
запишем:
?
ЦТ ЯТ Уф
= —— 1п ~г== — 1п— — . (2.91)
11
пР а<_*> пР Т^яц-д
7
Используя приближения Дебая — Гюккеля [см. уравнение (2.29)1
и соотношение (2.5), после простых преобразований получаем
ЯТ <4
2)
/ V- \ т
2
Я - 1
П
__
+
м„
1п
пР \ ] т
х
(2.92)
откуда в общем случае из значений ЕЦ при заданных т
2
и т
1
опреде-
лим 1п (а^/а^) и, подставив в (2.39а), вычислим
Выражение (2.92) существенно упрощается для симметричного
электролита
ЯТ ,
а
±
]
Для такой соли из (2.39а) и (2.93) получаем
Е
1
= 1-чЕ
и
. (2.94)
Если подобрать и электрод, обратимый по аниону в растворе той же
соли (типа М
Х
А, где М
Х
А — труднорастворимая соль),
то можно составить цепь из двух элементов без переноса
М|М^А
л?
_(а^>)|М
1
А, Мх —М
х
А |М^ А^ (а<»>) | М (VII)
ЭДС такой цепи без переноса может быть выражена через средние ко-
эффициенты активности ионов соли (см. приложение III).
ЯТ вйЬ уЯТ , <4
2)
пг
"соли
пг и
±
Сопоставляя (2.95) и (2.90), получаем:
(2.96)
121

Задание 1. Определить числа переноса катионов и
анионов ЫОз.
Приборы и материалы. Установка для измерения ЭДС; два серебряных элек-
трода, промежуточный сосуд; А^Оз, КН
4
Ы0
3
, бидистиллят.
Измеряют ЭДС элементов
-А
б
|А
ё
:ЫОз(т
1
)|А^Оз(т
2
)/А
§
+ (VIII)
2 ВТ а<
2
>
Е
У1 п^-Т"
111
^
(2
'
97)
Н1А
ё
Ы0
3
(т
л
)
Ц
NН
4
N0
3
Ц А§Ы0
3
(т
2
) / (IX)
ВТ а<
2
>
—1п —7— (2.98)
1Х
пР
Е
ч\\\
2Е
1Х
(2.99)
Серебряный электрод готовят аналогично хлорсеребряному, за-
канчивая на стадии нанесения электролитического осадка серебра
(см. § 1.1). На стандартном шлифе электрод помещают в ячейку, анало-
гичную используемой для водородного электрода. И первый, и второй
элементы собирают из двух таких ячеек; одна из них заполняется
0,1 моляльным раствором А§1М0
3
, а другая — х моляльным. При сбо-
ре элемента VIII соединительный сосуд заполняют раствором А§Ж)
3
с
т = х, а элемента IX —МН
4
Ж)
3
(насыщ.). Электроды тщательно
промывают бидистиллятом и перед измерением погружают на несколь-
ко минут в отдельные порции соответствующих растворов А§Ж)
3
.
Элементы термостатируют при 25 °С (в случае элемента VIII должен
термостатироваться и переходный сосуд). Для повышения точности
измерений растворы продувают инертным газом в течение 15—20 мин.
После измерения ЭДС элементов VIII и IX рассчитывают /. и
=•
1
— I- сначала по уравнению (2.97), а затем по уравнению
(2.99). Значения л; берут в интервале 0,01—0,1. Средние коэффициен-
ты активности ионов в растворах А§Ж)
3
составляют: при т = 0,01
у± = 0,895, при т = 0,1 у
±
= 0,731.
Задание 2 Определить числа переноса ионов в растворах
соляной кислоты.
. Приборы и материалы. Установка для измерения ЭДС; два водородных элек-
трода; хлорсеребряный электрод; промежуточный сосуд; растворы НС1, биди-
стиллят.
Из двух водородных электродов, находящихся в растворах НС1
концентраций т
1
и т
2
, составляют цепь с переносом
-Р1, Н
2
1 НС1 (т
г
)
{
НС1 (т
2
) | Н
2
, Р*+ (X)
Промежуточный сосуд заполняют раствором НС1 концентрации т
2
.
Определяют ЭДС (Е
х
) этой цепи. Методика измерений с водородным
электродом описана в работе 4.
Затем определяют ЭДС цепи из двух элементов без переноса, ис-
пользуя в качестве электрода, обратимого по С1~-аниону, хлорсереб-
ряный электрод
( —Р1, Н
2
| НС1 (т
х
) / А§С1, А
ё
-А
ё
, А§С1 | НС1 (т
2
) | Н
2>
Р\+ (XI)
Для определения ЭДС такой цепи достаточно найти отдельно
ЭДС первого и второго элементов.
Из уравнения (2.96) определяют
Задача может быть дополнена измерением ЭДС цепи с переносом
(Яуш), но при элиминированном диффузионном скачке потенциала
на границе ^вух растворов НС1 различной концентрации
— Р*, Н
2
1 НС1 (т
г
) II КС1 (насыщ.)
1!
НС1 (т
2
) / Н
2
, Р*+ (XII)
и расчетом по формуле (2.99). Эту цепь составляют аналогично цепи
I, но промежуточный сосуд заполняют насыщенным раствором КС1.
Все системы при измерениях термостатируются.
Сопоставление величин рассчитанных по уравнениям (2.96) и
(2.99), позволяет оценить неточность, вносимую в оценку I- исполь-
зованием средних коэффициентов активности вместо коэффициентов
активностей отдельных ионов в цепи с переносом даже при элимини-
ровании диффузионного потенциала.
7. ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Концентрацию определенного компонента раствора (как заряжен-
ного, так и незаряженного) можно контролировать потенциометричес-
ки, если подобрать электрод, потенциал которого определяется реак-
цией, включающей этот компонент. Проводя титрование анализируе-
мого компонента, потенциометрически определяют конечную точку
титрования по резкому изменению потенциала электрода в точке
эквивалентности» Так, используя электрод, потенциал которого зави-
сит от рН раствора, можно провести потенциометрическое титрование
кислоты или щелочи по методу нейтрализации. Индифферентные эле-
ктроды используются для «титрования обратимых окислительно-вос-
становительных систем (окислител ьно-восстановительное потенцио-
метрическое титрование). Широко применяется также потенциометри-
ческое титрование по методу осаждения или комплексообразования.
В этом случае рабочий электрод должен быть обратим по отношению
к компоненту раствора (чаще иону), который в процессе титрования
образует осадок или комплекс.
Зависимость потенциала индикаторного электрода Е, измеренного
относительно электрода сравнения, от объема прибавленного титранта
представляет собой интегральную кривую титрования. Дифференци-
альную кривую титрования, позволяющую более точно определять точ-
ку эквивалентности, получают, строя зависимость отношения измене-
ния потенциала АЕ к объему добавленного титранта АV, порции
последнего для повышения точности уменьшают вблизи точки эквива-
62$
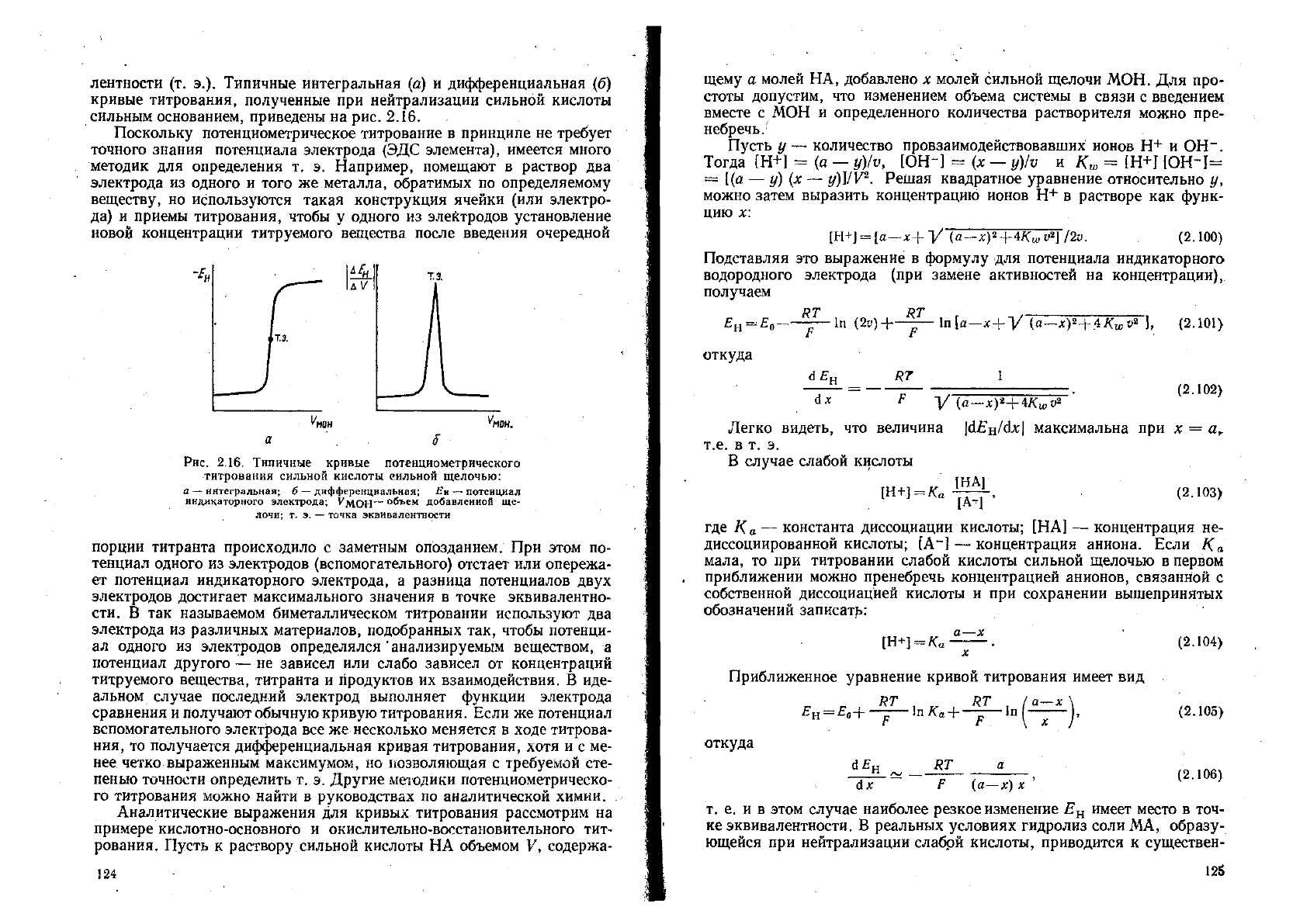
лентности (т. э.). Типичные интегральная (а) и дифференциальная (б)
кривые титрования, полученные при нейтрализации сильной кислоты
сильным основанием, приведены на рис. 2.16.
Поскольку потенциометрическое титрование в принципе не требует
точного знания потенциала электрода (ЭДС элемента), имеется много
методик для определения т. э. Например, помещают в раствор два
электрода из одного и того же металла, обратимых по определяемому
веществу, но используются такая конструкция ячейки (или электро-
да) и приемы титрования, чтобы у одного из элейтродов установление
новой концентрации титруемого вещества после введения очередной
Рис. 2.16. Типичные кривые потенциометрического
титрования сильной кислоты сильной щелочью:
а — интегральная; б
—
дифференциальная; Ян —потенциал
индикаторного электрода; ^МОН"" объем добавленной ще-
лочи; т. э.
—
точка эквивалентности
порции титранта происходило с заметным опозданием. При этом по-
тенциал одного из электродов (вспомогательного) отстает или опережа-
ет потенциал индикаторного электрода, а разница потенциалов двух
электродов достигает максимального значения в точке эквивалентно-
сти. В так называемом биметаллическом титровании используют два
электрода из различных материалов, подобранных так, чтобы потенци-
ал одного из электродов определялся'анализируемым веществом, а
потенциал другого — не зависел или слабо зависел от концентраций
титруемого вещества, титранта и продуктов их взаимодействия. 6 иде-
альном случае последний электрод выполняет функции электрода
сравнения и получают обычную кривую титрования. Если же потенциал
вспомогательного электрода все же несколько меняется в ходе титрова-
ния, то получается дифференциальная кривая титрования, хотя и с ме-
нее чегко выраженным максимумом, но позволяющая с требуемой сте-
пенью точности определить т. э. Другие методики потенциометрическо-
го титрования можно найти в руководствах по аналитической химии.
Аналитические выражения для кривых титрования рассмотрим на
примере кислотно-основного и окислительно-восстановительного тит-
рования. Пусть к раствору сильной кислоты НА объемом V, содержа-
63
щему а молей НА, добавлено х молей сильной щелочи МОН. Для про-
стоты допустим, что изменением объема системы в связи с введением
вместе с МОН и определенного количества растворителя можно пре-
небречь.
Пусть у — количество провзаимодействовавших ионов Н
+
и ОН~\
Тогда [Н+] - (а — у)Ы
у
ЮН-] = (х - у)Ы и К
т
= [Н+1 [ОН-1=
= 1(а — у) (х — у)УУ
2
. Решая квадратное уравнение относительно у,
можно затем выразить концентрацию ионов Н
+
в растворе как функ-
цию х:
[Н+]=г-[а—х+У (а~x)* + Щ
т
VЦ
/2о.
(2.100)
Подставляя это выражение в формулу для потенциала индикаторного
водородного электрода (при замене активностей на концентрации),
получаем
рт &Т
Е
н
~Е
0
—-у-\п
1П
[а-х + У 1, (2.101)
откуда
6Е
И
ЯТ 1
— г— . • (2.102)
р
У (а—х)*+4Ки>&
Легко видеть, что величина \йЕц/йх\ максимальна при х = а
г
т.е. в т. э.
В случае слабой кислоты
{НА]
(2.103)
где К
а
— константа диссоциации кислоты; [НА] — концентрация не-
диссоциированной кислоты; [А~]— концентрация аниона. Если К
а
мала, то при титровании слабой кислоты сильной щелочью в первом
приближении можно пренебречь концентрацией анионов, связанной с
собственной диссоциацией кислоты и при сохранении вышепринятых
обозначений записать
[Н+]=/С
а
(2.104)
X
Приближенное уравнение кривой титрования имеет вид
: Г, , КТ , I
а—х
\
Ян=<*•+ -у— Ь
1п
1—-)>
откуда
йЕ
и
ЯТ
/V/
йх Р {а—х) х
(2.105)
(2.106)
т. е. и в этом случае наиболее резкое изменение Е
и
имеет место в точ-
ке эквивалентности. В реальных условиях гидролиз соли МА, образу-
ющейся при нейтрализации слабой кислоты, приводится к существен-
63$

но более медленному изменению Ец с х вблизи точки эквивалентности
по сравнению с зависимостью (2.105), причем скачок потенциала в точ-
ке эквивалентности тем меньше, чем больше рК
а
- При р/С
а
>8 точка
нейтрализации становится практически не определимой.
Точность определения т. э. существенно зависит от концентрации
титруемого и титрующего растворов* а также от изменения концентра-
ций, обусловленного увеличением объема смеси в ходе титрования.
Окислительно-восстановительному титрованию восстановленной
формы вещества Кес^ окислителем Ох
2
соответствует химическая
реакция
у
1
Яед
1
+ х
2
0х
2
V! Ох
г
+ у
2
Це6
2
(2.107)
сопровождающаяся переносом электронов через индифферентный
электрод согласно двум обратимым полуреакциям:
ОхН-% е- Кес^, (2.108)
Ох
2
+ л
2
е~ Кеа
2
. (2.109)
Очевидно, должно соблюдаться равенство = у
2
п
2
= /г, где п —
число электронов, соответствующее однократному протеканию реак-
ции (2.107)
V! Ох
х
+
пе~ V!
Кес^!, (2.108а)
у
9
0х
2
+пе~ г
2
Кес!
2
. (2.109а)
Так как предполагается, что электрод обратим по обеим этим реакци-
ям, то его потенциал (при использовании концентраций вместо актив-
ностей) равен
Р , *
Г
1 Г Л.
ЯТ
1
10Х
*
]У2
/О
11Т
Е
= —Г-1п -—==^02+ — 1п —. (2.110)
пР
[Ке^]^ пР [Ке<У*
в
Значок «0» поставлен внизу,- чтобы подчеркнуть, что в уравнении в об-
щем случае используется стандартный потенциал данной окислитель-
но-восстановительной электродной реакции относительно некоторого
выбранного электрода сравнения (лишь по водородной шкале Е
0
=
= Е°).
Когда титруется раствор, содержащий первоначально только Кес^,
то для любого момента титрования
^[Охи^МКеЩ
при выражении концентрации в М.
В эквивалентной точке, кроме того, имеем
У
2
[Ш
1
]-{-У
2
[Ох
1
]=г
1
[Ох
2
]4^! Щесу
а следовательно,
^1Ке<и=^10х
в
Ь [Ох1]/[Нес1
1
] = [Дед
2
]/[Ох
2
]. (2.Ш)
Из равенства (2.110) для т. э., используя (2.111), находим
^01* (2.112)
п Р [Ке<Ы
126
V
из Подставляя Щ 1п ^
* =^01+
- У1 + У*
(2.112) в (2.110), получаем
^01)
^2
^01 +Ух ^02
V1 + У
2
(2.113)
Если к раствору объемом о, содержащему а молей добавлено х
молей сильного окислителя Ох
2
(Е
02
> Я
01
), то .практически весь
Ох
2
перейдет в $ес!
2
, а концентрация Кес^ уменьшится на (у/у^Х
Х(х!ю) и станет равной а!У — (лг/а)!, концентрация же
Для кривой потенциометрического титрования получаем
+ ——ш \
..
=
^01
+ —
1п
~~——^
>
(2.114)
пР
а—
(У1/У2)
х
пР
У? 2 (I -*-
У1
X
т. е. в точке эквивалентности при у
г
х у
2
а резко изменяется Е
(рис. 2.17). В то же время резкому подъему Е, х-кривой (очевидно, что
V = сопз1х) предшествует область мед-
ленного изменения Е с х, причем наи-
меньшему значению йЕ/йх, как показы-
вает анализ второй производной й
2
Е/йх
2
,
отвечает значение х = (у 2^1) (а/2); при
этом оттитрована половина Кес^. Дан-
ному значению, как следует из уравне-
ния (2.114), отвечает Е
—
Е
01
. Следова-
тельно, по точке перегиба кривой тит-
рования может быть приближенно оце-
нено значение стандартного потенциала
окислительно-восстановительной систе-
мы. Более тонная оценка требует учета
коэффициентов активности.
Участок кривой Е — х (после точки
эквивалентности) соответствует избытку
окислителя Ох
2
и может рассматри-
ваться как кривая обратного титрования
Ох
а
сильным восстановителем Кес^.
Из рис. 2.17 ясно, что скачок потен-
»
циала в точке эквивалентности тем вы-
ше, чем больше разница стандартных
титрующей систем Е
02
— Е
01
и, как показывает опыт, эта разница
должна составлять не менее 0,20—0,35 В.
При окислительно-восстановительном титровании часто необходи-
мо принимать меры, препятствующие окислению восстановителя кис-
лородом воздуха. В таких случаях титрование проводят в атмосфере
инертного газа, тщательно очищенного от кислорода. Кроме того, сле-
дует учитывать, что процессы окисления и восстановления нередко идут
с участием Н+ или ОН~. Если это имеет место в анализируемой сис-
Рис. 2.17. Типичная кривая
окислительно-восстанови-
тельного титрования силь-
ного восстановления силь-
ным окислителем:
V
— объем добавленного тит-
ра нта; Е
01
И
Я02 —
стандартные
потенциалы титруемой и тит-
рующей систем относительно
выбранного электрода срав-
нения
потенциалов титруемои и
127

теме, то необходимо поддерживать рН постоянным в ходе титрова-
ния, что осуществляется проведением титрования в сильно кислых
(или сильно щелочных) фоновых электролитах или в буферных смесях
с достаточно высокой буферной емкостью.
Задание 1, Определить концентрации сильной и слабой,кис-
лот в смеси их растворов.
Приборы и материалы. Ячейка для потенциометрического титрования с
водородным индикаторным электродом; каломельный электрод; источник водо-
рода; потенциометр или катодный вольтметр (рН-метр); титрованный раствор
щелочи, растворы кислот.
Для выполнения кислотно-основного потенциометрического тит-
рования составляют цепь из водородного (индикаторного) электрода
и электрода сравнения, например цасыщенного каломельного. Рабо-
чее пространство водородного электрода для титрования должно быть
больше, чем в случае, когда водо-
родный электрод используется в ка-^
честве электрода сравнения, В кон-
струкции водородного электрода
должно быть предусмотрено отверстие
для введения бюретки в верхнюю
часть рабочего пространства. Прин-
ципиально подходит ячейка, пред-
ставленная на рис. 2.15 (с )заменой
' тд, т.з.
2
у
мон
электрода и газа). В рабочее про-
Рис. 2.18. Типичная кривая потен- странство ячейки помещают порцию
циометрического титрования сме- титруемого раствора. Пропускают
си сильной и слабой кислот водород до установления постоян-
ного равновесного потенциала, по-
сле чего порциями А V вводят раствор щелочи. Поток водорода в ходе
титровайия должен быть достаточно непрерывным. Сначала раствор
щелочи приливают большими порциями (0,5—1,0 мл). После добав-
ления каждой порции раствор перемешивают (2—4 мин), при этом уст-
раняются небольшие количества кислорода, попавшие в рабочую часть
ячейки со щелочью. Когда изменения потенциала ЛЕ становятся суще-
ственными, порции щелочи уменьшают, а вблизи точки эквивалентно-
сти титрование проводят по каплям. После прохождения участка, отве-
чающего большим АЕ/АУ, пррции добавляемого раствора щелочи
опять увеличивают (до ~ 0,5 мл). Примерное положение точек эквива-
лентности определяют при предварительном титровании. Результаты
титрования записывают в таблицу по образцу:
№ порции
ДУ
П
, мл
Е, В
0
1
128
V
Строят зависимость Е от V (V = 2ДУ
п
), которая имеет вид, подобный
п
представленному на рис. 2.18, и зависимость АЕ/АУ ~ У для более
точного определения точек эквивалентности (т. э.). Зная объем титру-
емого раствора (V) и концентрацию щелочи, находят концентрацию
сильной с
1
^(
Смон
^-
3
-
1
) и слабой ^
с
мон (^.з,-У
т
.
Э
л)|
кислот
В качестве сильных кислот могут быть взяты соляная, серная,
хлорная и др., а слабых — уксусная, муравьиная, фосфорная и др.
Два скачка потенциала отчетливо различаются, если рК
2
— > 4.
Задание 2. Определить концентрацию двухвалентного желе-
за при титровании его перманганатом.
Приборы и материалы. Ячейка для потенциометрического титрования с
платиновым индикаторным электродом; электрод сравнения (например, кало-
мельный); потенциометр или катодный вольтметр (рН-метр); титрованный раст-
вор перманганата, раствор сульфата железа (II) или соли Мора.
Общее уравнение окислительно-восстановительной реакции запи-
сывается в виде
5Ре2++МпО^+8Н+ Мп2++5РеЗ++4Н
2
0
Обратимые полуреакции, отвечающие однократному протеканию
реакции:
5Ре
3
++5в- 5ре2+, Е\ =^0,77,
МпО^+8Н+4-5е~ МП
2+
+4Н
2
0, ,/?!!== 1,51.
При титровании необходимо контролировать [Н+]. Как следует из
уравнения (2.113), потенциал индикаторного электрода в точке эк-
вивалентности при рН 0 равен (0,77+5-1,51
)/6
= 1,39 В (н.в.э.).
Для титрования используется ячейка (см. рис. 2.15), в которой в
качестве индикаторного электрода применяют электрод из гладкой
Р1. В ячейку вводят 0,01—0,1 М раствор сульфата железа (II), добав-
ляют серную кислоту в таком количестве, чтобы ее концентрация
составила М, и титруют раствором перманганата той же концент-
рации (в М), что иРе50
4
, или в ~2 раза большей. Раствор перемеши-
вается магнитной мешалкой. Методика титрования и обработка резуль-
татов^ аналогичны использованным в работе 8. При расчете концент-
раций следует учитывать стехиометрические коэффициенты и
По точкам перегиба участков Е, У-кривой, отвечающих малым
АЕ/АУ, оценивают приближенно значения и учитывая, что для
этого необходимо потенциалы пересчитывать на шкалу н.в.э.
Аналогично проводят титрование раствора соли
Мора (МН
4
)
2
[Ре (80
4
),1-6 Н
2
0.
8. рН-МЕТРИЯ
Потенциометрия лежит в основе наиболее точных и удобных
методов определения рН. Для измерения рН можно исполь*-
5 Зак. 434
129
зовать различные электроды, обратимые относительно ионов Н
+
(Н
3
0+). ЭДС элемента, составленного из такого электрода и элект-
рода сравнения, равна
В-Б. + -&-Ы (2.115)
где Е
0
—ЭДС элемента при а
н
+
—
1, зависящая как от электрода срав-
нения, так и от характера электродных реакций, которые обеспечива-
ют обратимость индикаторного электрода по Н+-иону. Для измерения
рН применяют водородный, хингидронный, сурьмянокислый и стек-
лянный электроды.
Нужно отметить, что «абсолютные» значения рН нельзя опреде-
лить вследствие невозможности нахождения коэффициентов актив-
ности отдельных ионов и наличия диффузионных скачков потенциала.
В настоящее время разработаны методы определения рН с достаточно
высокой точностью, в основе которых лежит использование стандарт-
ных растворов с известными значениями рН.
Пусть индикаторный на ионы Н+ электрод погружен в раствор с
известным рН (рН
0
) и ЭДС элемента составляет Е
г
. ПЪсле замены это-
го раствора на раствор с неизвестным рН (рН
х
) ЭДС элемента равна Я
2
.
Тогда согласно уравнению (2.115)
рН^рН
0
+
2
Р
Ш
ХЕг-Еъ). ' (2.116)
Для точного определения рН* раствора нужно вначале провести
его предварительную оценку, а затем измерить со стандартным раство-
ром с рН
0
, как можно меньше отличающимся от рН исследуемого раст*
вора.
и
Используют также построение калибровочной кривой ЭДС эле-
мента, составленного для измерения рН, по нескольким стандартным
растворам с известным рН
0
. В качестве стандартных растворов часто
применяют раствор Вейбеля 0,01 М НС1 + 0,09 М КС1 с рН
0
2,04±
±0,01 (25°С) и ацетатную смесь 0,1 М СН
3
СООН + 0,1 М
СН
3
СООЫа с рН
0
4,64 (25°С). В приложении IV приведены составы дру-
гих первичных стандартов рН при 25°С и постоянные уравнения тем-
пературной зависимости рН этих растворов (по Бейтсу):
Р
Н ^-у +
В
+ СТ+ОТ*.
Для потенциала обратимого водородного электрода (о. в. э,).
относительно н.в.э., используя (2.48), запишем
1 2,3#Г
Е = —^—\па
н+
= _ рН = Е
э
.ср + ^. ср,
откуда
РН^-^^^.ЕР+ЕВ.СР), (2.117)
66
где Я
э
.
С
р — потенциал о.в.э. относительно выбранного электрода
сравнения; Еэ,
ср
— потенциал электрода сравнения относительно
н. в. э. Необходимость наличия чистого водорода, отсутствия окисли-
телей и сильно адсорбирующихся веществ в исследуемом растворе
сильно ограничивает возможности применения водородного электро-
да для измерения рН.
Рядом преимуществ по сравнению с другими индикаторными элект-
родами обладает стеклянный электрод. Так, в случае его использова-
ния нет необходимости вводить в ис-
следуемый раствор дополнительно
какие-либо вещества (как, например,
водород в случае водородного элект-
рода, хингидрон — в случае хингид-
ронного электрода); не опасны окис-
лители, восстановители и поверх-
ностно-активные вещества; потенциал
устанавливается сравнительно бы-
стро. Этим следует объяснять наибо-
лее широкое распространение стек-
лянного электрода при определении
рН.
По принципу действия стеклян-
ный электрод относится к мембран-
ным Электродам. Разность потенциа-
лов, возникающая по две стороны
мембраны, выполненной из специ-
ального стекла, является функцией
отношения активностей ионов Н
+
в
растворах по одну (а
г
) и по другую
(а
2
) стороны мембраны:
пт
а
= 7Г~
1п
—~> <
211
«)
г а
л
где Е1
С
— потенциал асимметрии. Если концентрация Н+ с одной
из сторон сохраняется постоянной, то
ВТ
ЕСТ.Э — ЯЬ + (2.119)
'где а — активность ионов Н+ со стороны мембраны, контактирующей с
исследуемым раствором; — стандартый для данного стеклянного
электрода потенциал.
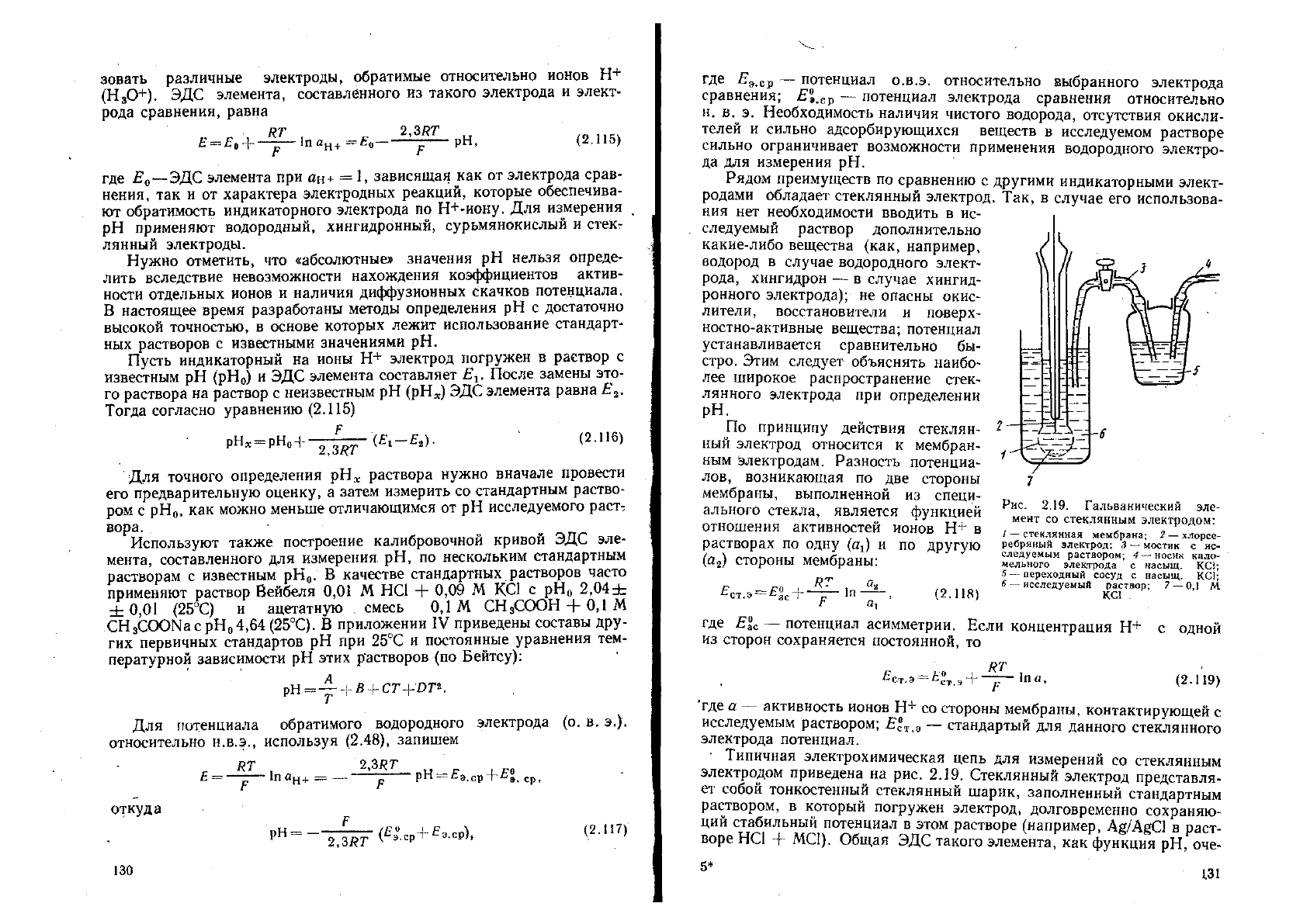
- Типичная электрохимическая цепь для измерений со стеклянным
электродом приведена на рис. 2.19. Стеклянный электрод представля-
ет собой тонкостенный стеклянный шарик, заполненный стандартным
раствором, в который погружен электрод, долговременно сохраняю-
ций стабильный потенциал в этом растворе (например, А§/А&С1 в раст-
воре НС1 + МС1). Общая ЭДС такого элемента, как функция рН, оче-
7
Рис. 2.19. Гальванический эле-
мент со стеклянным электродом:
/ — стеклянная мембрана; 2
—-
хлорсе-
ребряный электрод; 3 — мостик с ис-
следуемым раствором; 4
—
носик кало-
мельного электрода с насыщ. КС1;
5
—
переходный сосуд с насыщ. КС1;
6
—
исследуемый раствор; 7
—
0,1 М
КС1 .
5$
66 119
видно, будет описываться также соотношением (2.115), а, следователь-
но, рассмотренные принципы расчета рН сохраняются. Специфика ра-
боты со стеклянным электродом определяется высоким сопротивлени-
ем стеклянной мембраны. Отсюда возникает необходимость использова-
ния катодных вольтметров с очень высоким входным сопротивлением
или электрометров. Линейная зависимость (2.115) для стеклянного
электрода выполняется обычно до рН не более 12. Следует отметить, что
из-за микротоков утечки заряда коэффициент наклона кривой Е —рН
может быть несколько меньше теоретического значения (2,3 КТ)/Р.
Поэтому при работе со стеклянным электродом, как правило, исполь-
зуют калибровочные графики. В сильно кислых средах (рН < 1) так-
же наблюдается изменение наклона кривой. Линейная зависимость в
интервале рН 0 — 14 обеспечивается использованием при изготовле-
нии стеклянного электрода стекол специального состава.
Задание 1. Определить рН с помощью водородного электро-
да.
Приборы и материалы: водородный электрод; каломельный электрод; про-
межуточный сосуд; источник чистого водорода; потенциометр или катодный
вольтметр; раствор Вейбеля; исследуемый раствор. .
Собирают электрохимическую цепь
РЦЩ\Щ
2
СЛ
2
, КС1 (насыщ.) |{Н+(а
н +
)| Н
а
, Р1
в которой в качестве электрода сравнения берут насыщенный кало-
мельный электрод (насыщ. к. э.).
В сосуд водородного электрода сначала наливают раствор Вейбеля
и измеряют ЭДС элемента Е
г
(см. работу 4). После тщательной отмыв-
ки сосуда водородного электрода и самого электрода последний выдер-
живают несколько минут в отдельной порции исследуемого раствора,
а сосуд сначала ополаскивают и затем наполняют исследуемым раст-
вором. Помещают Р4/Р1 электрод в исследуемый раствор и измеряют
По уравнению (2.116) рассчитывают рН, учитывая, что при определе-
нии Е в вольтах при 2б°С величина /72,3 ЯТ - 1/0,0591 В.
Задание 2. Определить рН с помощью стеклянного элект-
рода.
Приборы и материалы: стеклянный электрод; каломельный электрод; про-
межуточный сосуд; рН-метр или электрометр; вещества, входящие в состав
растворов с определенными рН; исследуемый раствор.
Собирают элемент типа представленного на рис. 2.19.
р*
Электрод
сравнения
Стандартный
раствор
(а^—сопа!)
Стеклян-
ная
мембрана
Н+(а
Н +
)
КС1
(насыщ.)
Н*.С1„ Щ
Р*
67
Поверхность длительно не работавшего стеклянного электрода
предварительно обрабатывают либо разбавленным раствором хромовой
кислоты, либо 5%-ньш раствором аммиака, тщательно промывают во-
дой и бидистиллятом и затем выдерживают несколько суток в разбав-
ленном растворе НС1, а перед помещением в рабочий раствор ополаски-
вают бидистил}!ятом и порцией рабочего раствора.
Проводят калибровку ЭДС цепи, заполняя рабочий сосуд последо-
вательно стандартными растворами с известными рН
0
. Следует обра-
тить особое внимание на необходимость тщательной промывки мембра-
ны водой и рабочим раствором перед каждым измерением. Стандарт-
ные растворы выбирают так, чтобы охватить весь предполагаемый ин-
тервал определения рН. Задают изменение рН
0
при переходе от одно-
го стандартного раствора к другому на 1—1,5 единиц рН. Для приго-
товления калибровочных растворов может быть использована, напри-
мер, универсальная буферная смесь Бриттона (см. Приложение V).
Результаты записывают в таблицу:
№ опыта
Рабочий раствор
№ опыта
состав
рН
Е, В
1
Стандартный раствор
РН
0
1
п
рН
071
п+1
Исследуемый раствор
рн*
Строят график зависимости Е — рН. Линейность зависимости Е ~рН
служит критерием пригодности стеклянного электрода для дальней-
ших измерений. Измеряют ЭДС в исследуемом растворе й по графику
Е — рН находят рН
х
. . , "

Глава 3
ДВОЙНОЙ ЭЛЕКТРИЧЁСКИЙ СЛОЙ
#Теоретические основы
фЭлектрокапиллярные явления
ф Емкость двойного электрического слоя
#Двойной электрический слой и адсорбционные явления на металлах группы
платины
§ 3.1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ
На границе металлического электрода с раствором имеют место два
связанных между собой явления: 1) адсорбция, т. е. изменение кон-
центрации компонентов раствора вблизи поверхности электрода;
2) пространственное разделение зарядов, формирующее двойной
электрический слой и создающее в нем электрическую разность по-
тенциалов. В условиях равновесия связь этих двух явлений можно
описать с помощью термодинамических соотношений.
Предположим, что исследуемый электрод является идеально по-
ляризуемым, т. е. таким электродом,, на котором невозможны фараде-
евские процессы, а весь подводимый к электроду ток является током за-
ряжения, иначе говоря, затрачивается на изменение заряда поверхно-
сти*. Пусть на границе второго электрода (электрода сравнения) с
раствором устанавливается электрохимическое равновесие по иону:
/ : = р,}
р)
. В этих условиях адсорбционные и электрические яв-
ления на исследуемом электроде подчиняются основному уравнению
электрокапиллярности, выведенному А. Н. Фрумкиным:
с1а~ —
д&Е
— (ц!Р) с(3.1)
I
В этом уравнении о представляет собой работу, которую нужно за-
тратить в равновесных условиях, чтобы увеличить на единицу пло-
щадь соприкосновения электрода с раствором при заданных условиях
* В реальных условиях идеально поляризуемым называют электрод, на
котором в определенном интервале потенциалов фарадеевский ток оказывается
значительно меньше тока заряжения, например ртутный электрод в водном
растворе Ыа
2
80
4
в интервале потенциалов от +0,5 до —1,6 В (н. в. э.).
130 66 119
(потенциал Мектрода, температура, состав раствора). Величину а на-
зывают обратимой поверхностной работой; в случае жидкого электро-
да она может быть измерена и совпадает с пограничным натяжением;
ее размерность [о] = Дж/м
2
= Н/м, Величина представляет собой
плотность заряда идеально поляризуемого электрода и имеет размер-
ность = Кл/м
2
; Е — потенциал исследуемого' электрода по от-
ношению к электроду сравнения; и — химические потенциалы
1-го и /-го компонентов раствора; 2/ — зарядовое число иона / с учетом
знака.
Величина Г* называется поверхностным избытком (адсорбцией) ком-
понента I и представляет собой такое количество этого компонента,
которое нужно ввести в раствор
или, наоборот, удалить из раствора
для того, чтобы при увеличении
площади соприкосновения элект-
рода с раствором на единицу объ-
емный состав раствора остался без
изменения. В достаточно разбав-
ленном растворе величину Г^ в
первом приближении можно чис-
ленно Приравнять заштрихован- Рис. 3.1. Схема зависимости концент-
НЬШ площадям 5
Х
ИЛИ $2 на рис. 3.1, рации компонентов раствора от рас-
где схематически представлена за- стояния до границы раздела фаз:
с, —при положительной адсорбции компо-
ВИСИМОСТЬ концентрации компонен- нента 1; с
2
-при отрицательной адсорб-
ТОВ 1 И 2 ОТ расстояния X ДО ПО-
ции
компонента 2. ПлоЩади 5, и 5
2
отра-
г
жают абсолютную величину поверхностнот
верхности электрода. Величина Г^ го избытка *
(моль/м
2
) может быть как положи-
тельной (компонент 1 на рис. 3.1), так и отрицательной (компонент 2
на рис. 3.1) в соответствии с тем, возрастает или уменьшается кон-
центрация данного компонента с вблизи поверхности электрода по
сравнению с его объемной концентрацией с?. Суммирование в урав-
нении (2.1) проводится по всем компонентам раствора (включая ионы
/), за исключением молекул растворителя.
В силу электронейтральности заряд поверхности электрода д ком-
пенсируется алгебраической суммой зарядов, которые несут поверх-
ностные избытки ионов раствора, а потому
Г,. (3.2)
I '
При постоянном составе раствора (|^=сот{) уравнение (3.1) преобра-
зуется в уравнение Липпмана:
(3.3)
Как, следует из уравнения (3.3), максимум электрокапиллярной кри-
вой, отображающей зависимость о от Е при -= сот!, соответствует
потенциалу нулевого заряда Е
джг:0
. Вторичное дифференцирование по
5*

потенциалу уравнения (3.3) приводит к дифференциальной емкости
С двойного электрического слоя:
(3.4)
При
4
постоянной разности потенциалов между исследуемым электро-
дом и электродом, сравнения о зависит от состава раствора. Предпо-
ложим, что раствором является бинарный электролит Аа
электрод сравнения обратим™ аниону А
2
-. В этом случае из уравне-
ний (3.1), (3.2) и условия электронейтральности соли V
+
2
+
+ ==
О
можно получить, формулу
Г+=*(да/д\па
±
)
Е
^ (3.5)
где V = у
+
4- индекс «—» у Е означает, что электрод сравнения об-
ратим по аниону. Если же поддерживается постоянная разность по-
тенциалов между исследуемым электродом и электродом сравнения,
обратимым по катиону М
2
+, то для того же раствора А
у
_, как
нетрудно показать,
(да/д\па
±
)
Е
(3.6)
Рассмотренные уравнения (3.1) — (3.6) имеют строго термодинами-
ческий характер, поскольку относятся к цепям без переноса. Часто,
однако, потенциал идеально поляризуемого электрода измеряют отно-
сительно постоянного электрода сравнения, который отделен от иссле-
дуемого электролитическим ключом, заполненным насыщенным раст-
вором КС1 или ЫН
4
Ш
3
для элиминирования диффузионного потен-
циала (см. § 2.1). В этих условиях вместо уравнения (3.1) получаем
приближенное соотношение
. ёа^—«да—• (З-
7
)
I
из которого вытекают уравнения (3.3) и (3.4). Однако при фиксирован-
ном потенциале Е = сот1 из соотношения (3.7) не удается исклю-
чить активности отдельных ионов. Так, в бинарном растворе соли
при Е = сот! из уравнения (3.7) следует
_
1
(
до
V ^
г
<11п
а+ • А
1п
ИТ [ д\п а
±
+
й\па
±
+
д\па
±
'
(3
'
8)
И лишь в случае симметричного электролита = когда в пер-
вом прн0лижении а
+
& « а
±
[см. формулы (2.29), (2.30)1,
;
в правой
части уравнения (3.8) получаем (Г
+
+ Г_), тогда, используя уравне-
ние (3.2), согласно которому в бинарном растворе 2,2-валентного
электролита Г
+
— = —д/\г\Р, можно рассчитать в отдельности
приближенные величины Г
+
и Сопоставление приближенных и
точных величин поверхностных избытков Г
+
и показывает, что
в водных растворах 1,1-валентных электролитов область применимо-
98 4* 99
сти уравнения (3.7) ограничивается концентрациями, не превышаю-
щими 1 М.
Соотношения (3.1) — (3.7) широко используют при изучении двой-
ного электрического слоя на идеально поляризуемых электродах
(см. § 3.2 и 3.3). Следует подчеркнуть различие физического смысла
поверхностного избытка и поверхностной концентрации; последняя
представляет собой количество молей данного компонента, непосред-,
ственно контактирующих с единицей поверхности электрода. Размер-
ности обеих величин одинаковые (моль/м
2
), но поверхностные концент-
рации всегда положительны, тогда к^к величины Г* могут быть как
больше, так и меньше нуля. Чисто термодинамическим путем опреде-
лить поверхностную концентрацию невозможно; для этого разрабаты-
вают модельные представления о строении границы между электродом
и раствором.
Перейдем теперь к термодинамическому рассмотрению связи элект-
рических и адсорбционных явлений в случае электродов, на поверхно-
сти которых возможно обратимое протекание реакции
Для таких электродов уравнение Нернста (2.47) можно записать в ви-
де
6Е = (у
0х
КТ/пГ)й\па
0х
~(^КТ/пР)А\паы. (3.9)
Характерным примером таких систем является платиноводородный
электрод, на поверхности которого протекает обратимая реакция Н++
Н
адс
, а изменение потенциала определяется по уравнению*
&Е=(КТ/Р) й\иа
н+
~-(ЯТ/Р). й\па
н
= 6\1
н
+/р — й\к
и
/р. (3.9а)
Основное уравнение электрокапиллярности для платиноводород-
ного электрода записывается в виде
(ЗЛО)
и . '
где суммирование проводится по всем компонентам раствора, за ис-
ключением молекул растворителя, ионов Н
+
и атомов Н. Величины
<3' и 0" называют полными зарядами поверхности. Они представляют
собой количество электричества, которое необходимо подвести к
электроду при увеличении его поверхности на единицу в условиях
либо сот! (С}'), либо р
н
^ сот! (<?'').
в
отличие от свобод-
ного заряда полные заряды содержат также количество электриче-
ства, затраченное на реакцию Н+ ~Ь е~ Н
адс
. При этом
<1'=д-РА
н
и (З.И)
• Вместо иона Н
3
0
+
для краткости записи здесь, как и далее, использу-
ется символ Н+.
5*

где Ан поверхностная концентрация атомов Н
адс
; Лн+ — избы-
точное количество ионов Н
4
* в растворе, примыкающем к единице по-
верхности электрода.
Как вытекает из уравнений (3,9а) и (ЗЛО), в рассматриваемой сис-
теме существую? два уравнения Липпмана:
(да/дЕ) и ~~ (да/дЕ)^
Мн
.
(ЗЛ2)
Это связано с тем, что при = соп$( поведение платиноводородного
электрода в обратимых условиях характеризуется не электрокапил-
лярной кривой, как в слу-
чае идеально поляризуе-
мого электрода, а электро-
капиллярной поверхностью
(рис. 3.2). При этом элект-
рокапиллярные кривые,
которым соответствуют
уравнения Липпмана
(3.12), представляют собой
сечения электрокапилляр-
ной поверхности плоско-
стями |лн=сот1 или \х
н
+ =
= сот! (см. рис. 3.2),
Обозначим через Е
г
по-
тенциал платиноводород-
ного электрода, измерен-
ный относительно обрати-
мого водородного электро-
да в том же растворе (см.
§ 2.3). Как следует из урав-
нения (3.9а),
Рис. 3.2. Электрокапиллярные кривые 1- и 2-го
рода водородного электрода, представленные
в виде сечений общей электрокапиллярной по-
верхности плоскостями ~ сот* и |1
н
= соп$1
— (3.13)
Предположим, кроме того, что исследуемый раствор содержит неболь-
шое количество кислоты (например, НС!) и такой избыток соли с тем же
анионом (например, КС1), что все ионы Н
+
в двойном электрическом
слое замещаются катионами К
+
. Это означает, что Лн+ = 0 и =<7.
При постоянной избыточной концентрации КС1 можно полагать, что
[х
к
+ = сопз* и ^ солз{. В этих условиях основное уравнение
электрокапиллярности платиноводородного электрода (ЗЛО) принима-
ет вид
аа= —(9//?) , (3.14)
На основании свойств полного дифференциала функции двух пере-
менных из уравнения (3.14) нетрудно получить следующее важное со-
отношение между дифференциальной емкостью двойного слоя С
д
.
с
=
70
~(д<7и общей поляризационной емкостью платиноводород-
ного электрода:
С
Д
.с=-ЕС
П0
л (дЕ
г
/др^,^(С
11ОЛ
/<),058) (дЕ
г
/д рН)
д
,, (3.15)
где (д/?
г
/дрН)<?' — изоэлектрический сдвиг потенциала; его изме-
рение играет большую роль при изучении двойного электрического
слоя на электродах, обратимо адсорбирующих атомарный водород
(см. § 3.4).
Как следует из уравнения (3.14), для электродов, обратимо адсор-
бирующих водород, следует различать понятия потенциал нулевого
свободного заряда
потенциал нулевого /пол-
ного заряда = Мето-
ды определения этих вели-
чин, а также зависимостей
с/ и от Е
т
, разработан-
ные А. Н. Фрумкиным и
О. А. Петрием, описаны
в § 3.4.
Перейдем к рассмотре-
нию модельных представ-
лений о строении двойно-
го электрического слоя.
Отметим, что эти пред-
ставления развивались в
основном применительно к идеально поляризуемым электродам.
Предположим вначале, что в растворе нет поверхностно-активных
органических веществ (ПАОВ), а адсорбция ионов раствора на электро-
де обусловлена только электростатическим взаимодействием заряда
поверхности с зарядами ионов: кулоновским притяжением в случае
Г/ >0и кулоновским отталкиванием в случае Г
г
< 0. Такие элект-
ролиты называют поверхностно-неактивными. В растворах этих элект-
ролитов между адсорбированными ионами и поверхностью электрода
всегда сохраняется прослойка из молекул растворителя (рис. 3.3).
При потенциале нулевого заряда (п.н.з.) кулоновское взаимодействие
ионов с электродом отсутствует, а потому в растворе поверхностно-
неактивного электролита Г
+
= Г_ = 0*. Следствием этого яв-
ляется независимость п. н. з. от концентрации поверхностно-неактив-
ного электролита. В этом случае п. н. з. определяется только кристал-
лографической гранью данного металла и природой растворителя и его
называют нулевой точкой.
Рис. 3.3. Схема распределения электрических
зарядов на границе электрод/раствор
* Строго говоря, при п. н. з. в растворе поверхностно-неактивного электро-
лита наблюдается небольшая отрицательная адсорбция ионов, обусловленная
падением до нуля концентрации ионов в примыкающем к электроду монослое
растворителя. Однако этот эффект проявляется только в концентрированных
растворах, а при концентрациях с
х
^ 1 М им можно пренебречь, поскольку
Г
+
- Г_ = —Ьс
ь
где 6 — толщина монослоя растворителя.
70 66 119 5*
