Березов Т.Т., Коровкин Б.Ф. Биологическая химия
Подождите немного. Документ загружается.

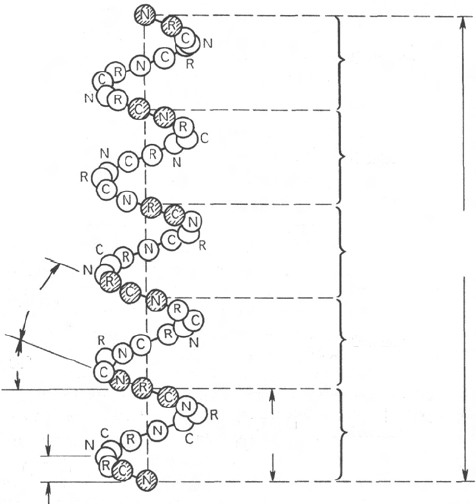
Рис. 1.17. Структура и параметры α-спирали.
последнего находится в прямой зависимости от степени спирализации
белковой молекулы. Не все глобулярные белки спирализованы на всем
протяжении полипептидной цепи. В молекуле белка α-спиральные участки
чередуются с линейными. В частности, если α- и β-цепи гемоглобина
спирализованы, например, на 75%, то лизоцима – на 42%, а пепсина – всего
на
30%.
Таким образом, стабильность вторичной структуры обеспечивается
в основном водородными связями (определенный вклад вносят и главно-
валентные связи – пептидные и дисульфидные).
Водородная связь представляет собой слабое электростатическое
притяжение (взаимодействие, связь) между одним электроотрицательным
атомом (например, кислородом или азотом) и водородным атомом, кова-
лентно связанным со вторым электроотрицательным атомом. Типы водо-
родных связей представлены далее.
По современным представлениям, водородная связь включает не только
электростатические силы притяжения между полярными группами (взаимо-
действие атомов водорода с электроотрицательными элементами: кислоро-
дом, азотом, хлором), но и электронные связи такого же типа, как в ряде
комплексных соединений. Водородные связи, являясь нековалентными,
отличаются малой прочностью. Так, если для разрыва химических меж-
атомных связей необходимо затратить от 84 до 8400 кДж, то для разрыва
одной водородной связи требуется затратить всего лишь 6,3 кДж на 1 моль.
Поскольку в белковой молекуле число водородных связей очень велико (в
образование водородных связей вовлечены все пептидные группы), они
в сумме обеспечивают скручивание полипептидной цепи в спиральную
структуру, сообщая ей компактность и стабильность.
61
0,54
нм
3,6 остатка
5-й шаг
4-й шаг
3-й шаг
18 остатков
2,7 нм
2-й шаг
1-й шаг
0,51
нм
0,15
нм
26°
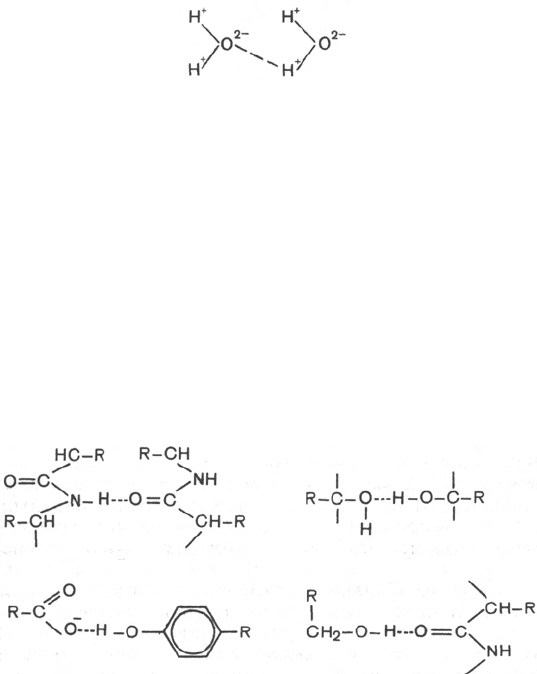
Механизм возникновения водородных связей в элементарной форме
может быть представлен на примере взаимодействия двух молекул воды
(диполи). В диполе воды, как известно, избыток положительных зарядов
приходится на атомы водорода, а избыток отрицательных – на атомы
кислорода.
Благодаря особенностям строения атома водорода при достаточном
сближении двух молекул воды возникает электростатическое взаимодейст-
вие между атомом кислорода одной молекулы и атомом водорода второй
молекулы воды. Следствием этого является ослабление связи между атома-
ми водорода и кислорода в каждой молекуле воды и соответственно
возникновение новой, непрочной связи (отмечена пунктиром) между ато-
мом водорода первой молекулы и атомом кислорода второй молекулы
воды. Эту непрочную связь принято обозначать водородной связью.
В белковой молекуле наиболее важные водородные связи образуются
между ковалентно связанным атомом водорода, несущим частичный поло-
жительный заряд, и отрицательно заряженным ковалентно связанным
атомом кислорода. Ниже представлены примеры водородных связей в бел-
ковой молекуле: а) между пептидными цепями; б) между двумя гидрок-
сильными группами; в) между ионизированной СООН-группой и ОН-груп-
пой тирозина; г) между ОН-группой серина и пептидной связью.
В зависимости от химической природы атома-акцептора водородные
связи отличаются друг от друга степенью прочности. О количестве водо-
родных связей в белковой молекуле судят по данным изотопного метода,
в частности по времени обмена атомов водорода, участвующих в образова-
нии водородной связи, на дейтерий (при обработке белка тяжелой водой
D
2
O, в которой вместо обычного водорода содержится его тяжелый изотоп
дейтерий).
Другой тип конфигурации полипептидных цепей, обнаруженный в бел-
ках волос, шелка, мышц и в других фибриллярных белках, получил
название β-структуры. В этом случае две или более линейные полипеп-
тидные цепи, расположенные параллельно или, чаще, антипараллельно,
прочно связываются межцепочечными водородными связями между NH-
и СО-группами соседних цепей, образуя структуру типа складчатого слоя
(рис. 1.18).
62
а
б
в
г
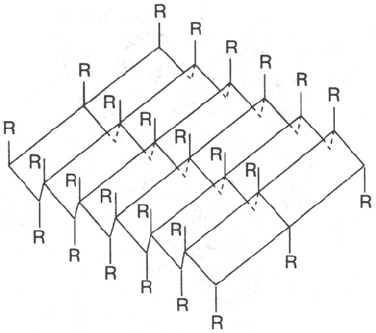
Рис. 1.18. β-Структура полипеп-
тидных цепей.
В природе существуют белки, строение которых, однако, не соответст-
вует ни β-, ни α-структуре. Типичным примером таких белков является
коллаген – фибриллярный белок, составляющий основную массу соедини-
тельной ткани в организме человека и животных (см. главу 21).
Методами рентгеноструктурного анализа в настоящее время доказано
существование еще двух уровней структурной организации белковой моле-
кулы, оказавшихся промежуточными между вторичной и третичной струк-
турами. Это так называемые надвторичные структуры и структур-
ные домены.
Надвторичные структуры представляют собой агрегаты полипеп-
тидных цепей, обладающих собственной вторичной структурой и образую-
щихся в некоторых белках в результате их термодинамической или кинети-
ческой стабильности. Так, в глобулярных белках открыты (βхβ)-элементы
(представлены двумя параллельными β-цепями, связанными сегментом х),
βαβαβ-элементы (представлены двумя сегментами α-спирали, вставленными
между тремя параллельными β-цепями) и др. В больших глобулярных
белках иногда содержатся неодинаковые структурные домены, выполняю-
щие разные функции, как и однотипные домены в пределах одного моно-
мерного белка, образующиеся, вероятнее всего, как результат влияния
генов в первом случае или дупликации генов – во втором. Домены создают-
ся объединением и чередованием α-спиралей и β-слоев, между которыми
открываются более рыхлые структуры (рис. 1.19).
Домен – это компактная глобулярная структурная единица внутри
полипептидной цепи. Домены могут выполнять разные функции и подвер-
гаться складыванию (свертыванию) в независимые компактные глобуляр-
ные структурные единицы, соединенные между собой гибкими участками
внутри белковой молекулы. Открыто много белков (например, иммуногло-
булины), состоящих из разных по структуре и функциям доменов, кодируе-
мых разными генами.
Третичная структура белка
Под третичной структурой белка подразумевают пространственную ориен-
тацию полипептидной спирали или способ укладки полипептидной цепи
в определенном объеме. Поскольку ни первичная структура, ни типы
спиралей или сочетания спиральных и линейных участков полипептидной
63
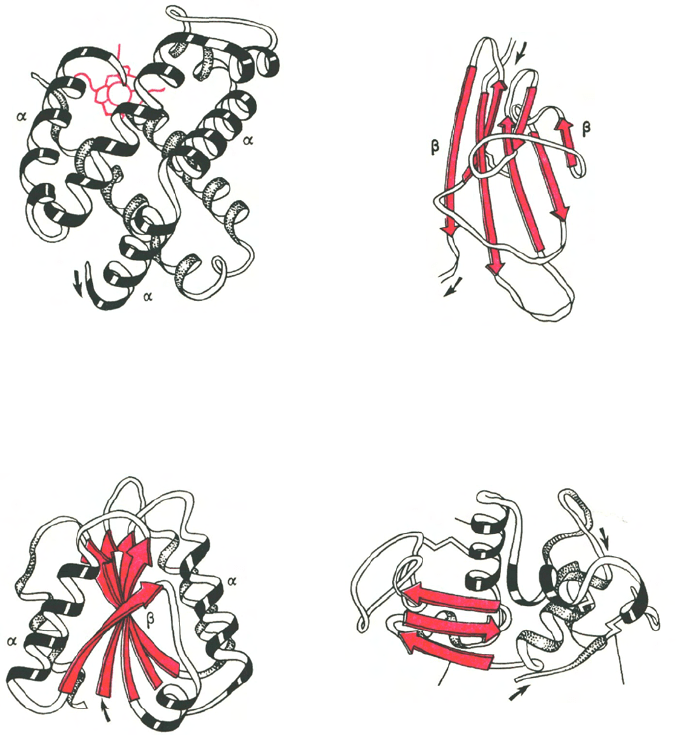
г
Рис. 1.19. Доменное строение глобулярных белков (по А. А. Болдыреву).
а - β-субъединица гемоглобина; б - константный домен иммуноглобулина; в - флаводоксин;
г - лизоцим куриного яйца.
цепи не дают представления об объеме, форме полипептидной цепи, перед
исследователем всегда стоит необходимость определения трехмерной или
пространственной конфигурации белка. Основную роль в решении этих
задач сыграл рентгеноструктурный анализ с высокой разрешающей способ-
ностью. Как было отмечено, метод успешно решает две главные проблемы
химии белков: закономерность последовательностей аминокислотных ос-
татков в полипептиде и закономерность конфигурации молекулы белка.
Межатомные расстояния в молекулах органических веществ составляют
0,1–0,2 нм, а максимальная разрешающая способность современных аппа-
ратов равна 0,2 нм. Это не позволяет установить местоположение каждого
атома, хотя вполне могут быть различимы отдельные сочетания атомов,
особенно при введении в молекулу белков атомов тяжелых металлов
64
а
б
α-Спираль
в
β-Структура
Дисульфидный
мостик
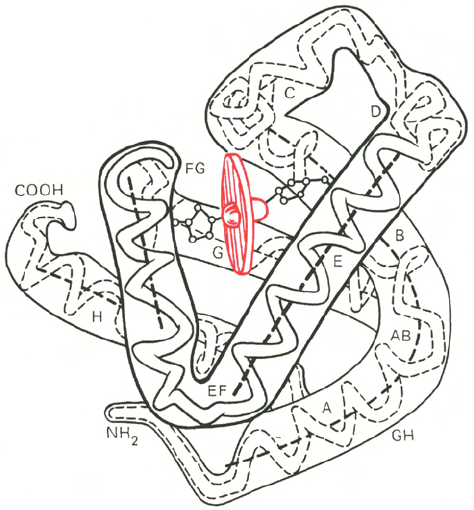
Рис. 1.20. Модель третичной структуры молекулы миоглобина (по Дж. Кендрью).
Латинскими буквами обозначены структурные домены, красным цветом – гем.
(последние благодаря своей высокой электронной плотности используются
в качестве точек отсчета при математической обработке рентгенограмм).
Первым белком, третичная структура которого была выяснена
Дж. Кендрью на основании рентгеноструктурного анализа, оказался мио-
глобин кашалота. Это сравнительно небольшой белок с мол. м. 16700,
содержащий 153 аминокислотных остатка (полностью выяснена первичная
структура), представленный одной полипептидной цепью. Основная функ-
ция миоглобина – перенос кислорода в мышцах. Полипептидная цепь мио-
глобина (рис. 1.20) представлена в виде изогнутой трубки, компактно
уложенной вокруг гема (небелковый компонент, содержащий железо; см.
главу 2).
На протяжении последних десятилетий в связи с повышением разрешаю-
щей способности рентгеноструктурного метода была расшифрована третич-
ная структура более 1000 белков, в том числе гемоглобина, пепсина,
химотрипсина, рибонуклеазы, лизоцима, трипсина и его ингибитора, ряда
фрагментов иммуноглобулинов человека, цитохрома С, карбоангидразы
человека, аспартатаминотрансферазы, инсулина и др. Примеры трехмерной
структуры некоторых из них представлены на рис. 1.21.
Рентгеноструктурный анализ позволяет определить конформацию и ход
полипептидной цепи в пространстве, поэтому для каждого белка может
быть построена объемная модель, отражающая местоположение линейных
и спирализованных участков. При изучении глобулярных белков было
показано, что пространственная структура белков в сильной степени зави-
сит от ряда факторов, в частности от ионной силы и рН раствора,
температуры и т.д. Новейшие методы дифракции рентгеновских лучей
65
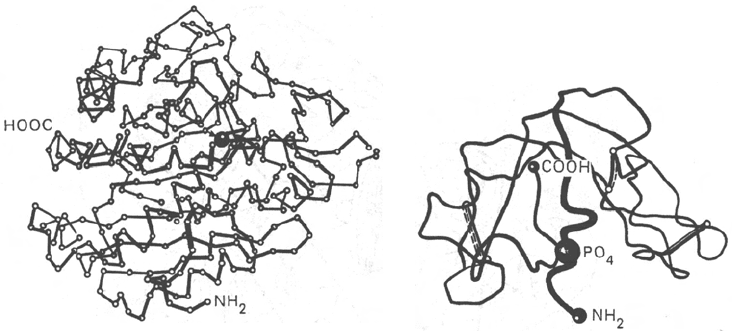
Рис. 1.21. Пространственная конфигурация карбоксипептидазы (а) и рибонукле-
азы
(б).
позволили расшифровать кристаллическую структуру более 100 ферментов.
Для выяснения трехмерной структуры белков в последнее время успешно
применяются также методы низкотемпературной вычислительной техники,
а также математические и компьютерные методы определения объемной
структуры на основании данных последовательностей аминокислот.
В настоящее время получены бесспорные доказательства, что в стабили-
зации пространственной структуры белков, помимо ковалентных связей
(пептидные и дисульфидные связи), основную роль играют так называемые
нековалентные связи (рис. 1.22). К этим связям относятся водородные
связи, электростатические взаимодействия заряженных групп, межмолеку-
лярные ван-дер-ваальсовы силы, взаимодействия неполярных боковых ра-
дикалов аминокислот, так называемые гидрофобные взаимодействия и т.д.
По современным представлениям, третичная структура белка после
завершения его синтеза в рибосомах (см. главу 14) формируется совершенно
автоматически, самопроизвольно и полностью предопределяется первичной
структурой. Основной движущей силой в возникновении трехмерной струк-
туры является взаимодействие радикалов аминокислот с молекулами воды.
При этом неполярные гидрофобные радикалы аминокислот как бы погру-
жаются внутрь белковой молекулы, образуя там сухие зоны, в то время как
полярные радикалы оказываются ориентированными в сторону воды.
В какой-то момент возникает термодинамически наиболее выгодная ста-
бильная конформация * молекулы. В такой форме белковая молекула
характеризуется минимальной свободной энергией. Молекулы белков в
водных растворах обычно принимают ряд стабильных конформаций, инду-
цируемых не только изменениями рН и температуры, но и низкомолеку-
лярными соединениями. Различают две основные формы конформаций:
Т-форму (от англ. tensed – напряженная) и R-форму (от англ. relaxed – рас-
* Конформацией принято называть пространственное расположение атомов в молекуле
белка. Этот термин означает структурное состояние молекулы белка, которое может перехо-
дить без разрыва ковалентных связей в другое структурное состояние, вызванное, например,
вращением вокруг единственной связи.
66
а
б
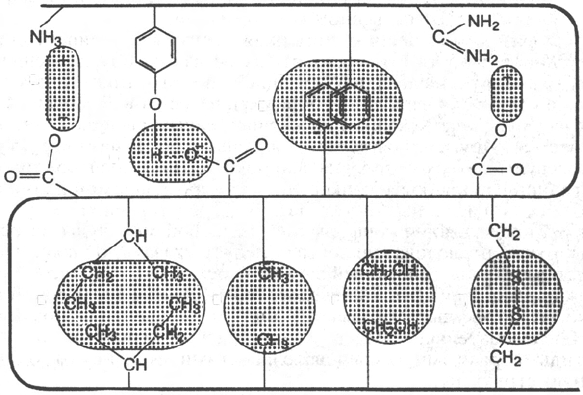
Рис. 1.22. Типы нековалентных связей, стабилизирующих третичную структуру
белка.
а - электростатическое взаимодействие; б - водородная связь; в - гидрофобные взаимодействия
неполярных групп; г - диполь-дипольные взаимодействия; д - дисульфидная (ковалентная)
связь.
слабленная). Между этими формами осуществляются переходы, соответст-
венно отражающиеся в биологических свойствах.
В процессе укладки синтезированной полипептидной цепи, получившем
название фолдинга – формирование нативной пространственной струк-
туры, в клетках происходит отбор из множества стерически возможных
состояний одной-единственной стабильной и биологически активной кон-
формации, определяемой, вероятнее всего, первичной структурой. Описан
ряд наследственных заболеваний человека, развитие которых связывают
с нарушением вследствие мутаций процесса фолдинга (пигментозы, фибро-
зы и др.). Поэтому в настоящее время пристальное внимание исследова-
телей приковано к выяснению зависимости между аминокислотной после-
довательностью синтезированной в клетке полипептидной цепи (первичная
структура) и формированием пространственной трехмерной структуры,
обеспечивающей белковой молекуле ее нативные свойства. Имеется немало
экспериментальных доказательств, что этот процесс не является автомати-
ческим, как предполагалось ранее, и, вероятнее всего, регулируется и конт-
ролируется также внутриклеточными молекулярными механизмами, детали
которых пока полностью не раскрыты. Из клеток выделено несколько
классов белков, названных шаперонами, или белками теплового шока,
которые располагаются между N-концевым сигнальным пептидом и мат-
ричным белком. Предполагается, что основными функциями шаперонов
являются способность предотвращать образование из полипептидной цепи
неспецифических (хаотичных) беспорядочных клубков, или агрегатов бел-
ков, и обеспечение доставки (транспорта) их к субклеточным мишеням,
создавая условия для завершения свертывания белковой молекулы. Эти
результаты наводят на мысль о возможности существования «второй
половины генетического кода», определяя тем самым повышенный интерес
67
Полипептидная цепь
а
б
в
а
в в
г
д
исследователей к проблеме свертывания полипептидной цепи и формирова-
ния ее нативной пространственной конформации.
Таким образом, линейная одномерная структура полипептидной цепи
(т.е. последовательность аминокислотных остатков, обусловленная кодом
белкового синтеза) наделена информацией другого типа – конформацион-
ной, которая представляет собой образование белковой молекулы строго
заданной формы с определенным пространственным расположением отдель-
ных ее частей. Другими словами, третичная – объемная – структура бел-
ковой молекулы детерминирована аминокислотной последовательностью
полипептидной цепи, а более конкретно – размером, формой и полярностью
радикалов аминокислотных остатков. Эти представления могут служить
основой для предсказания конформации белковой молекулы на основании
аминокислотной последовательности. Следует указать, однако, что до сих
пор представляется интригующей загадкой механизм этой тесной и тонкой
связи между аминокислотной последовательностью и трехмерной структу-
рой белковой молекулы. Оказывается, иногда полипептиды почти с одина-
ковыми последовательностями образуют разные структуры и, наоборот,
полипептиды с разными последовательностями формируют одинаковую
трехмерную структуру.
В свою очередь трехмерная структура белковой молекулы также содер-
жит информацию, но уже совершенно нового типа, а именно функциональ-
ную, которую акад. В.А. Энгельгардт назвал интрамолекулярной
информацией. Как будет показано далее, все биологические свойства
белков (каталитические, гормональные, антигенные и др.) связаны с со-
хранностью их третичной структуры, которую принято называть нативной
конформацией. Любые воздействия (термические, физические, химические),
приводящие к нарушению этой конформации молекулы (разрыв водород-
ных и других нековалентных связей), сопровождаются частичной или
полной потерей белком его биологических свойств.
Четвертичная структура белка
Под четвертичной структурой подразумевают способ укладки в простран-
стве отдельных полипептидных цепей, обладающих одинаковой (или раз-
ной) первичной, вторичной или третичной структурой, и формирование
единого в структурном и функциональном отношениях макромолекулярно-
го образования. Многие функциональные белки состоят из нескольких
полипептидных цепей, соединенных не главновалентными связями, а неко-
валентными (аналогичными тем, которые обеспечивают стабильность тре-
тичной структуры). Каждая отдельно взятая полипептидная цепь, получив-
шая название протомера, мономера или субъединицы, чаще всего не
обладает биологической активностью. Эту способность белок приобретает
при определенном способе пространственного объединения входящих в его
состав протомеров, т.е. возникает новое качество, не свойственное моно-
мерному белку. Образовавшуюся молекулу принято называть олигоме-
ром (или мультимером). Олигомерные белки чаще построены из четного
числа протомеров (от 2 до 4, реже от 6 до 8) с одинаковыми или разными
молекулярными массами – от нескольких тысяч до сотен тысяч. В част-
ности, молекула гемоглобина состоит из двух одинаковых α- и двух
β-полипептидных цепей, т.е. представляет собой тетрамер. На рис. 1.23
представлена структура молекулы гемоглобина, а на рис. 1.24 хорошо
видно, что молекула гемоглобина содержит четыре полипептидные цепи,
68

Рис. 1.23. Олигомерная мо-
лекула гемоглобина (крас-
ные диски – группы гема).
каждая из которых окружает группу гема – пигмента, придающего крови ее
характерный красный цвет (см. главу 2).
В определенных условиях (присутствие солей, 8М мочевины или резкие
изменения рН) молекула гемоглобина обратимо диссоциирует на две α-
и две β-цепи. Эта диссоциация обусловлена разрывом водородных связей.
После удаления солей или мочевины происходит автоматическая ассоциа-
ция исходной молекулы гемоглобина (рис. 1.25).
Классическим примером олигомерной молекулы, или надмолекулярной
структуры, является вирус табачной мозаики, представляющий собой ги-
гантскую молекулу с мол. м. около 40•10
6
. Он состоит из одной молекулы
Рис. 1.24. Модель гемогло-
бина (по Перутцу).
α-Цепи светлые; β-цепи темные;
группы гема красные.
69

Рис. 1.25. Обратимая диссоциация
молекулы гемоглобина.
РНК (см. главу 3) и 2130 белковых субъединиц, масса каждой из которых
составляет 17500. Длина вируса примерно 300 нм, ширина – около 17 нм.
РНК вируса имеет спиралеобразную форму. Вокруг РНК нанизаны бел-
ковые частицы, образующие гигантскую надмолекулярную спиральную
структуру, в которой насчитывается около 130 витков (рис. 1.26). Удиви-
тельной особенностью вируса является то, что после разъединения соответ-
ствующими приемами (добавление детергента) РНК и белковых субъеди-
ниц и последующего их смешивания (с предварительным удалением детер-
гента) наблюдаются полная регенерация четвертичной структуры, восста-
новление всех физических параметров и биологических функций (инфектив-
ная способность вируса). Подобная точность процесса спонтанной само-
сборки вируса обеспечивается, вероятнее всего, информацией, содержащей-
ся в первичной структуре молекулы РНК и белковых субъединиц. Таким
образом, последовательность аминокислот содержит в себе информацию,
которая реализуется на всех уровнях структурной организации белков.
Многие ферменты также обладают четвертичной структурой, например
фосфорилаза а, состоящая из двух идентичных субъединиц, в каждой из
которых по две пептидные цепи. Вся молекула фосфорилазы а, таким
образом, представляет собой тетрамер. Отдельные субъединицы чаще всего
не обладают каталитической активностью; вообще регуляторные ферменты
Рис. 1.26. Самосборка вируса та-
бачной мозаики.
70
Добавление
мочевины
Удаление
мочевины
Общая длина
130 витков
