Березов Т.Т., Коровкин Б.Ф. Биологическая химия
Подождите немного. Документ загружается.

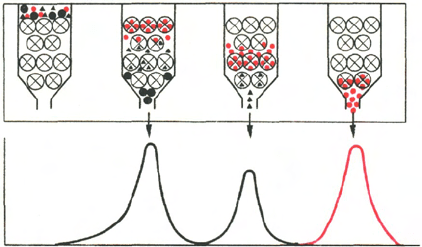
Рис. 1.5. Гель-хроматография
на колонке с сефадексом (схема).
Большие светлые кружки с крести-
ками - зерна сефадекса; малые чер-
ные и красные кружки и треуголь-
ники - белки с различной молеку-
лярной массой; А - колонка в нача-
ле работы; Б, В, Г - колонка в раз-
личные периоды времени. На гра-
фике элюции четко видно разделе-
ние белковых компонентов.
определяется величиной заряда белка при определенных значениях рН
и ионной силы раствора. В последнее время более широкое распространение
получили методы зонального электрофореза белков на различных
носителях, в частности на твердых поддерживающих средах: гелях крахма-
ла и полиакриламида, целлюлозе. Преимущества их по сравнению с мето-
дом свободного электрофореза состоят в том, что исключается размывание
границы белок-растворитель в результате диффузии и конвекции, не
требуется налаживания сложной аппаратуры для определения положения
границы, а для анализа необходимо небольшое количество белка (подробно
эти методы и соответствующая аппаратура рассматриваются в практиче-
ских руководствах по биохимии).
Одним из наиболее распространенных методов фракционирования бел-
ков (как и методов оценки гомогенности) является диск-электрофорез
(от англ. discontinuous – прерывистый, перемежающийся) в полиакриламид-
ном геле, при котором используют пары буферных растворов с различными
значениями рН и разной степени пористости гель. Следует отметить
высокую разрешающую способность гель-электрофореза. Если при элект-
рофорезе белков сыворотки крови человека на бумаге открываются всего
6 фракций, то при электрофорезе в крахмальном геле – 10, а в полиакрил-
амидном геле – до 18 разных белковых фракций.
Для выявления белков при электрофорезе в гелях их обрабатывают
одним из следующих красителей: бромфеноловым синим, амидо черным
10В, кислотным синим 83, кумасси бриллиантовым голубым R-250 и др.
Интенсивность окраски и соответственно относительное содержание каж-
дой белковой фракции обычно определяют денситометрически путем пря-
мого сканирования на денситометре. В последние годы стали применять
методы электрофореза белков с градиентом концентрации геля, что зна-
чительно повышает разрешающую способность, особенно при фракциони-
ровании белков с высокой молекулярной массой, превышающей 50000–
100000.
Весьма перспективными методами разделения белков (как и определе-
ния ряда физико-химических свойств) оказались разные варианты метода
изоэлектрического фокусирования – изотахофореза, основанные на
проведении электрофореза в поддерживающих средах (на колонке или
в тонком слое) с градиентом рН. Точное местоположение на колонке
каждого белка из смеси определяется значением его изоэлектрической
точки, т.е. состоянием, при котором суммарный электрический заряд
белковой частицы при данном значении рН равен нулю. При использовании
31
Концентрация
А
Б
В
Г
мл
метода изоэлектрического фокусирования применяют смеси синтетических
полиаминополикарбоновых кислот (амфолины) для создания градиента рН
в диапазоне от 3,0 до 10,0.
В последние годы широкое распространение для фракционирования
белков получили различные сочетания изоэлектрофокусирования и диск-
электрофореза в полиакриламидном геле – методы двухмерного электрофо-
реза, которые позоляют параллельно анализировать сотни и даже тысячи
белковых фракций.
Очистка белков от низкомолекулярных примесей
Применение в определенной последовательности ряда перечисленных мето-
дов позволяет получить белок в очищенном состоянии, не лишенный,
однако, некоторых примесей солей. Для полного освобождения белков от
низкомолекулярных примесей в настоящее время используют методы
диализа, гельхроматографии, кристаллизации, ультрафильтрации. При диа-
лизе применяют полупроницаемые мембраны (целлофан, коллодийная
пленка), диаметр пор которых варьирует в широких пределах. Белки, как
правило, не диффундируют через такую мембрану, в то время как низкомо-
лекулярные вещества легко проникают через нее в окружающую среду.
Метод кристаллизации белков основан на достижении критической
точки начала осаждения белка из раствора сульфата аммония при мед-
ленном повышении температуры. Уже получены сотни кристаллических
белков *. Однако не всякий кристаллический белок является гомогенным,
поскольку при одной и той же концентрации раствора сульфата аммония
могут кристаллизоваться близкие по размерам и массе разные белки.
Наилучшие результаты при освобождении белков от низкомолекуляр-
ных примесей получают с помощью гельхроматографии и ультрафильтра-
ции. Последняя основана на продавливании растворов белка через спе-
циальные мембраны, задерживающие белковые молекулы, что позволяет не
только освободить белковые растворы от низкомолекулярных примесей, но
и концентрировать их.
Определение гомогенности белков
На заключительном этапе выделения и очистки белков исследователя
всегда интересует вопрос о гомогенности полученного белка. Нельзя
оценивать гомогенность индивидуального белка только по одному какому-
либо физико-химическому показателю. Для этого пользуются разными
критериями. Из огромного числа хроматографических, электрофоретиче-
ских, химических, радио- и иммунохимических, биологических и гравита-
ционных методов наиболее достоверные результаты при определении
гомогенности белка дают ультрацентрифугирование в градиенте плотности
сахарозы или хлорида цезия, диск-электрофорез в полиакриламидном геле,
изоэлектрическое фокусирование, иммунохимические методы и определение
растворимости белка. Действительно, если при гель-электрофорезе белок
движется в виде одной узкой полосы и в этой зоне сосредоточена его
биологическая активность (ферментативная, гормональная, токсическая
* Первый кристаллический фермент уреаза был получен Д. Самнером в 1926 г.
32

и т.д.), то эти данные с большой долей вероятности могут свидетельство-
вать об однородности исследуемого белка.
В основе иммунохимического метода контроля гомогенности исследуе-
мого белка лежит реакция преципитации его с соответствующей антисыво-
роткой, полученной от иммунизированных этим белком животных. Для
строгого доказательства гомогенности белка требуется одновременное
использование нескольких методов.
Не потерял своего значения и метод кристаллизации белков с использо-
ванием сульфата аммония, а также метод определения растворимости
белка. Последний, предложенный еще Д. Нортропом *, основан на правиле
фаз Гиббса, согласно которому растворимость чистого вещества при
данных условиях опыта зависит только от температуры, но не зависит от
количества вещества, находящегося в твердой фазе. Метод может быть
выполнен сравнительно легко и быстро в микромасштабах. Обычно опреде-
ляют растворимость увеличивающегося количества исследуемого белка при
постоянном количестве растворителя.
АМИНОКИСЛОТНЫЙ СОСТАВ БЕЛКОВ
Несмотря на то что первая аминокислота – глицин – была выделена А. Бра-
конно еще в 1820 г. из кислотного гидролизата желатина, полный амино-
кислотный состав белков был расшифрован только к 30-м годам XX в.
Большая заслуга в этом принадлежит работам Н.Н. Любавина, который
в 1871 г. установил, что под действием ферментов пищеварительных соков
белки расщепляются на аминокислоты.
Были сделаны два важных вывода: 1) в состав белков входят аминокис-
лоты; 2) методами гидролиза может быть изучен химический, в частности
амнокислотный, состав белков.
Для изучения аминокислотного состава белков пользуются сочетанием
кислотного (НСl), щелочного [Ва(ОН)
2
] и, реже, ферментативного гидро-
лиза ** или одним из них. Установлено, что при гидролизе чистого белка, не
содержащего примесей, освобождаются 20 различных α-аминокислот. Все
другие открытые в тканях животных, растений и микроорганизмов амино-
кислоты (более 300) существуют в природе в свободном состоянии либо
в виде коротких пептидов или комплексов с другими органическими
веществами.
α-Аминокислоты представляют собой производные карбоновых кислот,
у которых один водородный атом, у α-углерода, замещен на аминогруппу
(—NH
2
), например:
Жирная кислота
α-Аминокислота
* В лаборатории Нортропа в 1930-1931 гг. впервые получены в химически индивидуаль-
ном и кристаллическом состоянии пепсин, химотрипсин и трипсин.
** При кислотном и щелочном гидролизе белков наблюдается почти полный распад
триптофана и цистеина, поэтому для их определения предложены специальные методы.
33
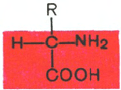
Следует подчеркнуть, что все аминокислоты, входящие в состав природ-
ных белков, являются α-аминокислотами, хотя аминогруппа в свободных
аминокарбоновых кислотах может находиться, как увидим ниже, в β-, γ-, δ-
и ε-положениях.
Классификация аминокислот
Все встречающиеся в природе аминокислоты обладают общим свойством –
амфотерностью (от греч. amphoteros – двусторонний), т.е. каждая амино-
кислота содержит как минимум одну кислотную и одну основную группы.
Общий тип строения α-аминокислот может быть представлен в следующем
виде:
Как видно из общей формулы, аминокислоты будут отличаться друг от
друга химической природой радикала R, представляющего группу атомов
в молекуле аминокислоты, связанную с α-углеродным атомом и не участ-
вующую в образовании пептидной связи при синтезе белка. Почти все
α-амино- и α-карбоксильные группы участвуют в образовании пептидных
связей белковой молекулы, теряя при этом свои специфические для свобод-
ных аминокислот кислотно-основные свойства. Поэтому все разнообразие
особенностей структуры и функции белковых молекул связано с химической
природой и физико-химическими свойствами радикалов аминокислот.
Именно благодаря им белки наделены рядом уникальных функций, не
свойственных другим биополимерам, и обладают химической индивидуаль-
ностью.
Классификация аминокислот разработана на основе химического строе-
ния радикалов, хотя были предложены и другие принципы. Различают
ароматические и алифатические аминокислоты, а также аминокислоты,
содержащие серу или гидроксильные группы. Часто классификация осно-
вана на природе заряда аминокислоты. Если радикал нейтральный (такие
аминокислоты содержат только одну амино- и одну карбоксильную груп-
пы), то они называются нейтральными аминокислотами. Если аминокис-
лота содержит избыток амино- или карбоксильных групп, то она называ-
ется соответственно основной или кислой аминокислотой.
Современная рациональная классификация аминокислот основана на
полярности радикалов (R-групп), т.е. способности их к взаимодействию
с водой при физиологических значениях рН (близких к рН 7,0). Различают
5 классов аминокислот, содержащих следующие радикалы: 1) неполярные
(гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей
частью неполярные); 4) отрицательно заряженные и 5) положительно заря-
женные. В представленной классификации аминокислот (табл. 1.3) приведе-
ны наименования, сокращенные английские и русские обозначения и одно-
буквенные символы аминокислот, принятые в отечественной и иностранной
литературе, а также значения изоэлектрической точки (рI) и молекулярной
массы (М). Отдельно даются структурные формулы всех 20 аминокислот
белковой молекулы.
34
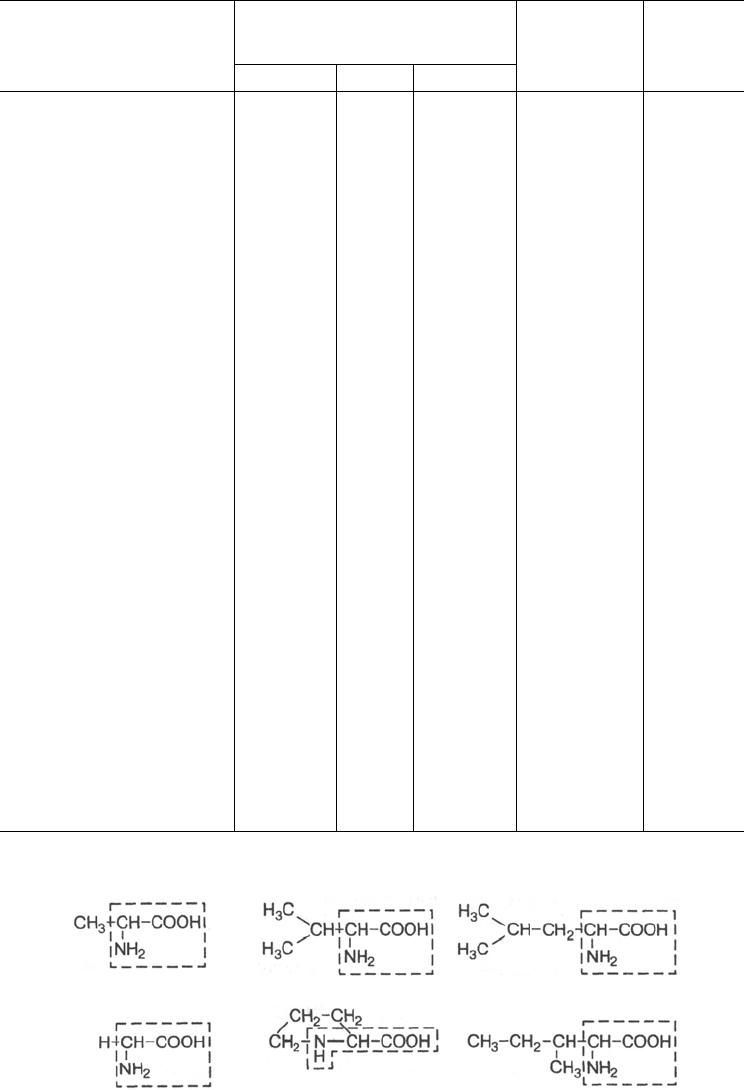
Таблица 1.3. Классификация аминокислот, основанная на полярности радикалов
Аминокислоты
I. Неполярные R-группы
Глицин
Аланин
Валин
Лейцин
Изолейцин
Пролин
II. Полярные, незаряжен-
ные R-группы
Серин
Треонин
Цистеин
Метионин
Аспарагин
Глутамин
III. Ароматические R-
группы
Фенилаланин
Тирозин
Триптофан
IV. Отрицательно заря-
женные R-группы
Аспарагиновая
кислота
Глутаминовая
кислота
V. Положительно заря-
женные R-группы
Лизин
Аргинин
Гистидин
Принятые сокращенные
обозначения и однобук-
венные символы
англ.
Gly
Ala
Val
Leu
Ile
Pro
Ser
Thr
Cys
Met
Asn
Gln
Phe
Tyr
Trp
Asp
Glu
Lys
Arg
His
символ
G
A
V
L
I
P
S
Т
C
M
N
Q
F
Y
W
D
E
К
R
H
русск.
Гли
Ала
Вал
Лей
Иле
Про
Сер
Тре
Цис
Мет
Асн
Глн
Фен
Тир
Трп
Асп
Глу
Лиз
Арг
Гис
М/рI
75/5,97
89/6,02
117/5,97
131/5,97
131/5,97
115/6,10
105/5,68
119/6,53
121/5,02
149/5,75
132/5,41
146/5,65
165/5,98
181/5,65
204/5,88
133/2,97
147/3,22
146/9,74
174/10,76
155/7,59
Среднее
содержание
в белках, %
7,5
9,0
6,9
7,5
4,6
4,6
7,1
6,0
2,8
1,7
4,4
3,9
3,5
3,5
1,1
5,5
6,2
7,0
4,7
2,1
Неполярные R-группы
35
L-аланин
L-валин
L-лейцин
L-глицин
L-пролин
L-изолейцин
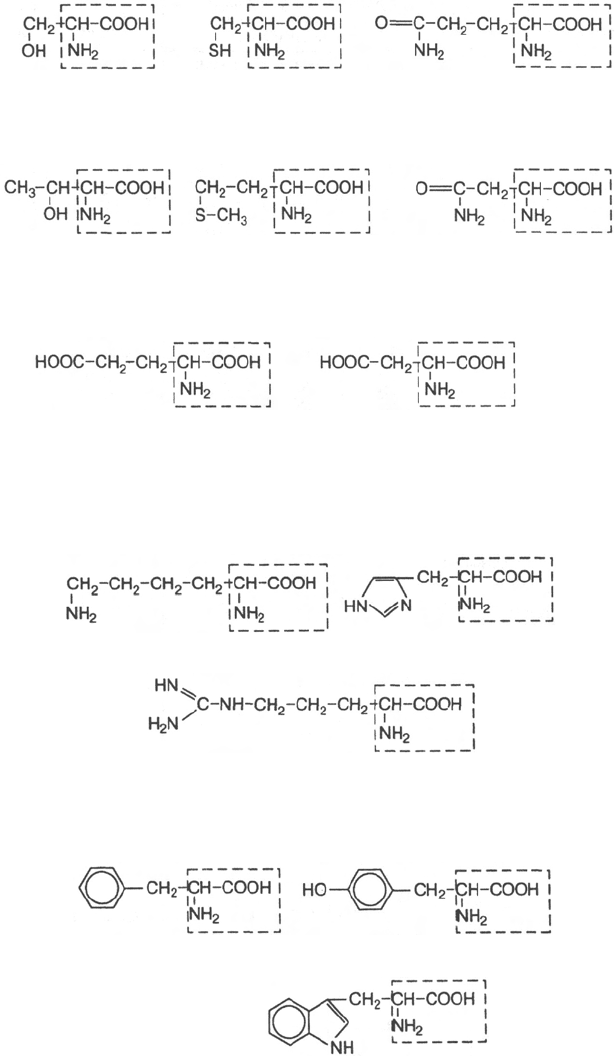
Полярные, незаряженные R-группы
Отрицательно заряженные R-группы
Положительно заряженные R-группы
Ароматические R-группы
36
L-серин
L-цистеин
L-глутамин
L-треонин
L-метионин
L-аспарагин
L-глутаминовая кислота
L-аспарагиновая кислота
L-лизин
L-гистидин
L-аргинин
L-фенилаланин
L-тирозин
L-триптофан

Перечисленные аминокислоты присутствуют в разных количественных
соотношениях и последовательностях в тысячах белков, хотя отдельные
индивидуальные белки не содержат полного набора всех этих аминокислот.
Помимо наличия в большинстве природных белков 20 аминокислот, в неко-
торых белках обнаружены производные аминокислот *: оксипролин, окси-
лизин, дийодтирозин, фосфосерин и фосфотреонин (последние две амино-
кислоты представлены в главе 2):
Первые две аминокислоты содержатся в белке соединительной ткани –
коллагене, а дийодтирозин является основой структуры гормонов щитовид-
ной железы. В мышечном белке миозине обнаружен также ε-N-метиллизин;
в состав протромбина (белок свертывания крови) входит γ-карбоксиглута-
миновая кислота, а в глутатионпероксидазе открыт селеноцистеин, в кото-
ром ОН-группа серина заменена на селен (Se):
Помимо указанных, ряд α-аминокислот выполняет важные функции
в обмене веществ, хотя и не входит в состав белков, в частности орнитин,
цитруллин, гомосерин, гомоцистеин, цистеинсульфиновая кислота, диокси-
фенилаланин и др.
Общие свойства аминокислот
Кислотно-основные свойства. Эти свойства аминокислот определяют многие
физико-химические и биологические свойства белков. На этих свойствах
основаны, кроме того, почти все методы выделения и идентификации
аминокислот. Аминокислоты легко растворимы в воде. Они кристалли-
зуются из нейтральных водных растворов в форме биполярных (амфотер-
ных) ионов (цвиттерионов), а не в виде недиссоциированных молекул
(последнюю структуру приводят для удобства представления, однако все
аминокислоты при физиологических значениях рН имеют структуру цвитте-
риона).
Цвиттерион
* Эти аминокислоты образуются после завершения синтеза белка в рибосоме клеток
в результате постсинтетической химической модификации.
37
Оксилизин
Оксипролин
3,5-Дийодтирозин
ε-N-метиллизин
γ-Карбоксиглутаминовая
кислота
Селеноцистеин
При растворении в воде кристаллическая аминокислота, например
аланин, может реагировать или как кислота (донатор протона):
+
NH
3
CH(CH
3
)COO
–
<=> H
+
+ NH
2
CH(CH
3
)COO
–
,
или как основание (акцептор протона):
+
NH
3
CH(CH
3
)COO
–
+ H
+
<=>
+
NH
3
CH(CH
3
)COOH.
Если радикалы аминокислот нейтральные, то они почти не оказывают
влияния на диссоциацию α-карбоксильной группы или α-аминогруппы,
и величины рК (отрицательный логарифм константы диссоциации) остают-
ся относительно постоянными. Вследствие этого кривые диссоциации почти
всех нейтральных аминокислот накладываются друг на друга и могут быть
рассмотрены на примере аланина. Если к раствору аланина (например,
0,1 М) в воде постепенно прибавлять сильную кислоту (0,1 М раствор НСl)
или сильную щелочь (0,1 М раствор NaOH), то получим кривую титрова-
ния аланина, типичную для всех нейтральных аминокислот (рис. 1.6).
Кажущиеся величины рК' для α-карбоксильной группы и α-аминогрупп
(т.е. значения рН, при которых эти группы в среднем наполовину диссоции-
рованы) довольно сильно различаются, составляя pK
1
= 2,34 и рК
2
= 9,69.
При низком значении рН (ниже pK
1
') почти все молекулы аланина являются
полностью протонированными и несут положительный заряд. Другими
словами, при высокой концентрации водородных ионов в растворе тенден-
ция к диссоциации водорода из структуры аланина оказывается незначи-
тельной. Из кривой титрования видно, что точка перехода между ветвями
кривой располагается при рН 6,02. Это означает, что при данном значении
рН суммарный (или средний) электрический заряд молекулы аланина равен
нулю и она не перемещается в электрическом поле ни к аноду, ни к катоду
(изоэлектрическое состояние). Такое значение рН получило название изо-
электрической точки и обозначается pI. Изоэлектрическая точка аминокис-
лот, не содержащих дополнительных NH
2
- или СООН-групп, представляет
собой среднее арифметическое между двумя значениями рК':
соответственно для аланина
Изоэлектрическая точка ряда других аминокислот, содержащих допол-
нительные кислотные или основные группы (аспарагиновая и глутаминовая
кислоты, лизин, аргинин, тирозин и др.), зависит, кроме того, от кислот-
ности или основности радикалов этих аминокислот. Для лизина, например,
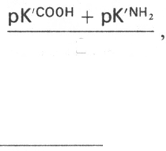
рI должна вычисляться из полусуммы значений рК' для α- и ε-NН
2
-групп.
Таким образом, в интервале рН от 4,0 до 9,0 почти все аминокислоты
существуют преимущественно в форме цвиттерионов с протонированной
аминогруппой и диссоциированной карбоксильной группой. Следует отме-
38
pl =
2
pl
=
2,34
+
9,69
2
= 6,02.
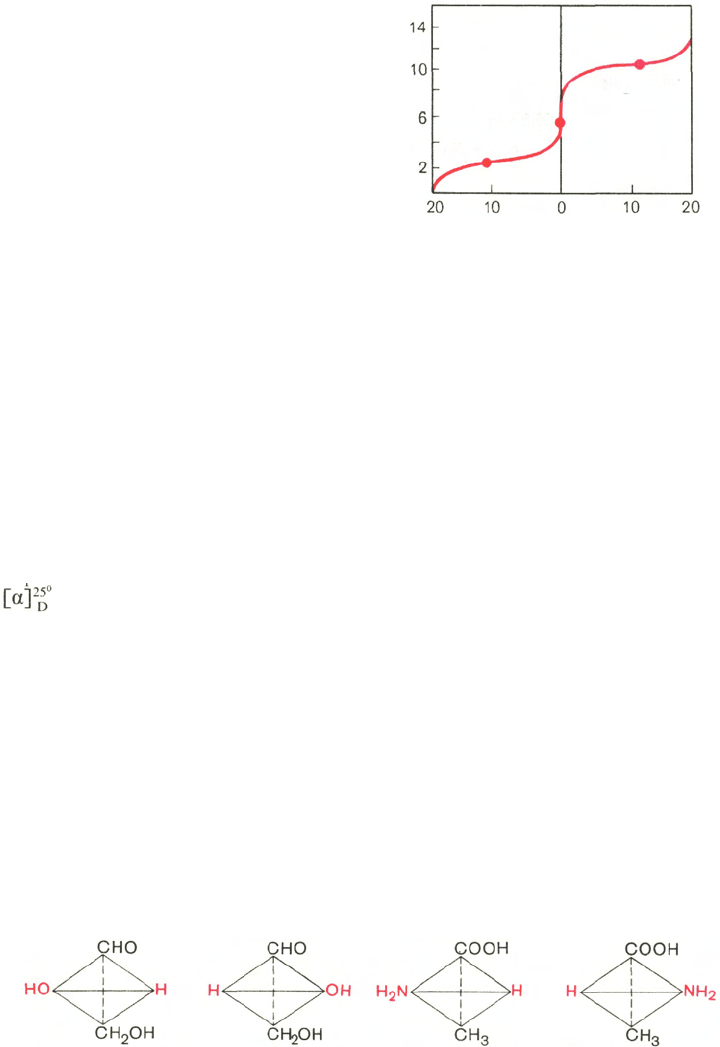
Рис. 1.6. Кривые, полученные при
титровании 0,1 М раствора алани-
на 0,1 М раствором НСl (а) и
0,1 М раствором NaOH (б).
тить, что при физиологических значениях рН тканей и крови (7,1 и 7,4
соответственно) аминокислоты (за ислючением гистидина) не обладают
измеримой буферной емкостью. Эту способность они приобретают только
при значениях рН, близких к величинам их рК (т.е. при рН 1,7–3,2
и 8,6–10,8).
Стереохимия аминокислот. Важнейшим свойством аминокислот, осво-
бождающихся в процессе гидролиза природных белков в условиях, исклю-
чающих рацемизацию, является их оптическая активность. Будучи раство-
ренными в воде (или в НСl), они способны вращать плоскость поляризо-
ванного луча (исключение составляет глицин). Это свойство связано с нали-
чием в молекуле всех природных аминокислот (за ислючением глицина)
в α-положении асимметрического атома углерода (т. е. атома углерода, все
четыре валентные связи которого заняты различными заместителями).
Величины удельного вращения вправо или влево являются количественной
характеристикой оптической активности, и для большинства аминокислот
составляет от 10 до 30°. Примерно половина аминокислот белков
оказалась правовращающей, их обозначают знаком «+» (Ала, Иле, Глу,
Лиз и др.), а чуть меньше половины – левовращающей (Фен, Трп, Лей и др.),
их обозначают знаком «–». Все эти аминокислоты принадлежат к L-ряду,
а величина и знак оптического вращения зависят от природы радикалов
аминокислот и значения рН раствора, в котором измеряют оптическое
вращение.
Стереохимию аминокислот принято оценивать не по оптическому вра-
щению, а исходя из абсолютной конфигурации всех четырех замещающих
групп, расположенных вокруг асимметрического атома углерода в верши-
нах модели тетраэдра. Абсолютную конфигурацию аминокислот принято
соотносить стереохимически с соединением, произвольно взятым для срав-
нения, а именно с глицериновым альдегидом, также содержащим асиммет-
рический атом углерода. Ниже представлены L- и D-стереоизомеры глице-
ринового альдегида. Рядом показаны пространственные конфигурации L-
и D-аланина:
Все аминокислоты, образующиеся при гидролизе природных белков
в условиях, исключающих рацемизацию, принадлежит к L-ряду. Таким
39
рН
а
б
L-глицеральдегид
D-глицеральдегид
L-аланин
D-аланин
pI =
6,02
pK
2
=
9,69
pK
1
=
2,34
образом, природные аминокислоты имеют пространственное расположе-
ние, аналогичное конфигурации L-глицеринового альдегида. Следует еще
раз подчеркнуть, что символы L и D означают принадлежность данной
аминокислоты по своей стереохимической конфигурации к L- или D-ряду,
в то время как знак «+» или «–» указывает на направление изменения
плоскости поляризации светового луча. Среди белковых аминокислот
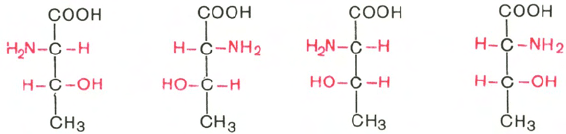
имеются две аминокислоты (треонин и изолейцин), которые содержат по
два асимметрических атома углерода. Следовательно, если не в природе,
то, во всяком случае, в лаборатории возможно получить четыре стереоизо-
мерные формы этих аминокислот *. Для треонина известны все четыре
изомера. Если условно обозначить символом L выделенный из природных
белков треонин, то его зеркальное отображение называют D-треонином.
Два других изомера, получивших наименование диастереоизомеров, или
аллоформ, также могут иметь L- и D-формы. Структурные конфигурации
всех четырех стереоизомеров треонина можно представить следующими
формулами:
Как отмечалось, в белковой молекуле D-аминокислоты не обнаруже-
ны **, однако в живой природе они широко распространены.
Так, D-изомеры глутаминовой кислоты, аланина, валина, фенилаланина,
лейцина и ряда других открыты в клеточной стенке бактерий; в составе
некоторых антибиотиков, в частности актиномицинов, бацитрацина, грами-
цидинов А и S, содержатся аминокислоты D-конфигурации.
Аминокислотный состав (качественный и количественный) многих тысяч
белков, полученных из разных источников, выяснен (табл. 1.4).
При анализе данных табл. 1.4 виден ряд закономерностей. На долю
дикарбоновых аминокислот и их амидов в большинстве белков приходится
до 25–27% всех аминокислот. Эти же аминокислоты вместе с лейцином
и лизином составляют около 50% всех аминокислот. В то же время на
долю таких аминокислот, как цистеин, метионин, триптофан, гистидин,
приходится не более 1,5–3,5%. В протаминах и гистонах отмечено высокое
содержание основных аминокислот аргинина и лизина, соответственно 26,4
и 85,2% (см. «Химия простых белков»).
Химические реакции для открытия и определения аминокислот в гидроли-
затах белков. В курсе органической химии подробно рассмотрено множест-
во химических реакций, характерных для α-амино- и α-карбоксильных групп
аминокислот (ацилирование, алкилирование, нитрование, этерификация
* При чисто химическом (но не ферментативном) синтезе аминокислот в лаборатории
обычно образуется оптически неактивная смесь L- и D-изомеров, обозначаемых как DL-
аминокислоты, или рацематы.
** D-Аминокислоты, очевидно, не играют важной физиологической роли в организме
животных и человека, хотя в органах и тканях содержатся весьма активные ферменты,
катализирующие их распад (см. главу 12 «Промежуточный обмен аминокислот в тканях»). L-
и D-аминокислоты различаются, кроме того, по вкусу: первые – горькие, вторые – сладкие.
40
L-треонин
D-треонин
L-аллотреонин
D-аллотреонин
