Березов Т.Т., Коровкин Б.Ф. Биологическая химия
Подождите немного. Документ загружается.

ков), получивших название лидирующих, или сигнальных, пептидов.
Особенность их состава – преимущественное содержание гидрофобных ра-
дикалов, что позволяет им легко проникать через бислойную липидную
мембрану или встраиваться в мембрану. Эти сигнальные последователь-
ности в рибосомах образуются первыми с N-конца при синтезе белка по
программе сигнальных кодонов, расположенных сразу после инициатор-
ного кодона, и легко узнаются рецепторными участками мембраны эндо-
плазматической сети. При этом образуется комплекс между мРНК, ри-
босомой и мембранными рецепторными белками, формируя своеобразный
канал в мембране, через который сигнальный пептид проникает внутрь
цистерны эндоплазматического ретикулума, увлекая и протаскивая за собой
синтезируемую и растущую молекулу секреторного белка. В процессе
прохождения или после проникновения полипептида в цистерны N-концевая
сигнальная последовательность отщепляется под действием специфической
лидирующей (сигнальной) пептидазы, а зрелый белок через пластинчатый
комплекс (аппарат Гольджи) покидает клетку в форме секреторного пу-
зырька. Следует указать на возможность активного участия в транспорте
белков и других полимерных молекул через мембраны, помимо сигнальных
пептидов, также особых белков – поринов, химическая природа и ме-
ханизм действия которых выяснены пока недостаточно.
СИНТЕЗ МИТОХОНДРИАЛЬНЫХ БЕЛКОВ
В митохондриях клеток высших организмов (см. главу 13) содержится до
2% клеточной ДНК, отличающейся от ДНК ядра по массе и структуре.
Митохондрии имеют весь аппарат, включая рибосомы, тРНК и мРНК,
необходимый для синтеза определенных белков. Синтезируемые в мито-
хондриях белки являются нерастворимыми белками и участвуют в ос-
новном в организации структуры этих же органелл, в то время как местом
синтеза растворимых митохондриальных белков являются рибосомы цито-
плазмы, откуда они затем транспортируются в митохондрии. Рибосомы
в митохондриях имеют меньший размер, чем 80S рибосомы в цитоплазме.
Интересно отметить, что в качестве инициирующей аминокислоты при
синтезе белка в митохондриях эукариот может участвовать N-формил-
метионин, а не свободный метионин, как в цитоплазме. Это обстоятельство
свидетельствует о том, что митохондриальный синтез белка по своему
механизму, очевидно, близок к синтезу белка у прокариот.
ПОСТСИНТЕТИЧЕСКАЯ МОДИФИКАЦИЯ БЕЛКОВ
На V, последней, стадии синтеза белка происходят формирование тре-
тичной структуры и процессинг молекулы полипептида. Синтезированная
на рибосоме в строгом соответствии с генетической программой линейная
одномерная полипептидная молекула уже содержит определенную инфор-
мацию. Такая молекула называется конформационной, т.е. она претер-
певает не хаотичные структурные изменения, а подвергается превращению
(процессингу) в строго определенное трехмерное тело, которое само на-
делено информацией, но уже функциональной. Указанное положение спра-
ведливо для молекул белков, выполняющих в основном структурные
функции, но не для биологически неактивных молекул предшественни-
ков белков, функциональная активность которых проявляется позже в
531
результате разнообразных превращений, объединенных понятием «пост-
синтетическая, или посттрансляционная, модификация». Подоб-
ные модификации структуры полипептида начинаются или сразу после
трансляции, или еще до окончания формирования третичной структуры
белковой молекулы.
Помимо указанного процесса протеолитического удаления сигнального
пептида, во многих белках отщепляется начальный N-концевой метионин.
Оказалось, что в прокариотических клетках имеются особые ферменты,
модифицирующие N-концевые остатки, в частности деформилаза, ката-
лизирующая отщепление формильной группы от N-концевого метионина,
а также аминопептидазы, катализирующие отщепление не только N-кон-
цевого формилметионина (или метионина у эукариот), но, возможно,
и других остатков аминокислот с N-конца пептида. Аналогичному так
называемому ограниченному постсинтетическому протеолизу подвергают-
ся некоторые пробелки, или проферменты (например, трипсиноген, химо-
трипсиноген и др.), и предшественники гормонов (например, препроинсу-
лин, пре-β-липотропин и др.). В ряде случаев наблюдается и С-концевая
модификация синтезированного белка.
Как известно, участок ДНК, несущий информацию о синтезе индиви-
дуального белка, называется геном, а участок, контролирующий синтез
единственной полипептидной цепи и ответственный за него,– цистроном.
Следовательно, если белок состоит из нескольких (более одного) поли-
пептидов, то естественно предположить, что в синтезе такого белка должны
участвовать несколько (более одного) цистронов. Это не всегда соответст-
вует действительности, особенно если полипептидные цепи идентичны
(например, α
2
- и β
2
-цепи гемоглобина). Если, например, пептидные цепи
какой-либо одной белковой молекулы являются неидентичными, то это не
всегда означает, что они синтезируются как результат действия разных
цистронов. Подобный белок может синтезироваться в виде единственной
полипептидной цепи с последующими протеолитическими разрывами в
одном или нескольких местах и отщеплением неактивных участков. Типич-
ным примером подобной модификации является гормон инсулин, синтези-
рующийся в виде единого полипептида препроинсулина, который после
ферментативного гидролиза превращается сначала в неактивный предшест-
венник проинсулин, а затем в активный гормон инсулин, содержащий две
разных размеров и последовательности полипептидные цепи (см. рис. 1.14).
Следует подчеркнуть, однако, что значительно больший удельный вес
имеет посттрансляционная химическая модификация белков, затрагивающая
радикалы отдельных аминокислот. Одной из таких существенных моди-
фикаций является ковалентное присоединение простетической
группы к молекуле белка. Например, только после присоединения пи-
ридоксальфосфата к ε-аминогруппе остатка лизина белковой части – апо-
ферменту – образуется биологически активная трехмерная конфигурация
аминотрансфераз, катализирующих реакции трансаминирования амино-
кислот. Некоторые белки подвергаются гликозилированию, присоединяя
олигосахаридные остатки (образование гликопротеинов), и обеспечивают
тем самым доставку белков к клеткам-мишеням. Широко представлены
химические модификации белков в результате реакции гидроксили-
рования остатков пролина, лизина (при формировании молекул колла-
гена), реакции метилирования (остатки лизина, глутамата), ацети-
лирования ряда N-концевых аминокислот, реакции карбоксилиро-
вания остатков глутамата и аспартата ряда белков (добавление экстра-
карбоксильной группы). В частности, протромбин (белок свертывающей
532
системы крови) содержит ряд γ-карбоксиглутаматных остатков на N-конце,
в образовании которых активное участие принимает витамин К, содер-
жащий фермент. Предполагают, что γ-карбоксиглутаматные остатки при-
нимают участие в связывании ионов Са
2+
, необходимых для инициации
свертывания крови.
Одной из широко распространенных химических постсинтетических
модификаций является фосфорилирование остатков серина и треонина,
например, в молекуле гистоновых и негистоновых белков, а также казеина
молока. Фосфорилирование-дефосфорилирование ОН-группы серина аб-
солютно необходимо для множества ферментов, например для активности
гликоген-фосфорилазы и гликоген-синтазы. Фосфорилирование некоторых
остатков тирозина в молекуле белка в настоящее время рассматривается
как один из возможных и специфических этапов формирования онкобелков
при малигнизации нормальных клеток. Хорошо известны также реакции
окисления двух остатков цистеина и образование внутри- и межцепочечных
дисульфидных связей при формировании третичной структуры (фолдинг).
Этим обеспечивается не только защита от внешних денатурирующих
агентов, но и образование нативной конформации и проявление био-
логической активности.
Менее известны реакции фарнезилирования остатков цистеина
ряда белков: белка G (см. главу 8), группы белков ядерного матрикса,
а также белков-онкогенов ras и протоонкогенов; источником изопрениль-
ных групп является фарнезил-пирофосфат (промежуточный продукт при
синтезе холестерина). Получены доказательства, что блокирование реакции
фарнезилирования, вызванное специфическими препаратами (ингибитора-
ми), приводит к потере канцерогенной активности онкогена ras. Эти
результаты могут служить основой для разработки эффективных средств
борьбы с опухолевыми заболеваниями человека, основанными на инги-
бировании посттрансляционной модификации белков вообще или онко-
белков в частности.
Следует отметить, что, хотя биосинтез белка, представляющий сложный
многоступенчатый процесс, подробно описан во многих обзорах и мо-
нографиях, наши знания о структурно-функциональных взаимоотношениях
многих его этапов все еще недостаточны. Действительно, выделены и
охарактеризованы рибосомы (более полно у Е. coli), состоящие из мно-
жества индивидуальных белков и 3 типов молекул РНК; более того,
выяснена аминокислотная последовательность всех 55 белковых молекул,
первичная и вторичная структура 3 типов РНК, интенсивно изучается
трехмерная структура отдельных белков рибосом прокариот. Тем не менее
многие существенные детали механизма белкового синтеза неясны. На-
пример, недостаточно известно, какие участки или составные части рибосом
ответственны за инициацию, элонгацию и терминацию белкового синтеза;
каков молекулярный механизм процессов транслокации, пептидилтранс-
феразной реакции; каковы тонкие взаимодействия рибосом с белковыми
факторами, мРНК, тРНК и антибиотиками. Потребуется еще немало
усилий для определения полной молекулярной архитектуры рибосом и
отдельных ее субчастиц, а также для выяснения и получения точных данных
об их третичной структуре, форме и размерах, достаточных для раскрытия
на молекулярном уровне функций рибосомы в сложном процессе синтеза
белка.
Внерибосомный механизм синтеза пептидов. Накопленные данные, дей-
ствительно, свидетельствуют о том, что матричный механизм синтеза
лежит в основе биосинтеза почти всех белков живых организмов. Тем не
533

менее синтез ряда низкомолекулярных (коротких) пептидов в биологи-
ческих системах может осуществляться не только без участия нуклеиновых
кислот, в частности без матричной мРНК, но даже в отсутствие рибосом.
Еще на X Международном биохимическом конгрессе в Гамбурге в 1976 г.
Ф. Липман (США) и К. Курахаси (Япония) представили экспериментальные
доказательства синтеза двух природных циклических пептидных анти-
биотиков – грамицидина S и тироцидина как в цельных экстрактах, по-
лученных из Bacillus brevis, так и в изолированных из экстрактов белковых
фракциях. В частности, выделенные из экстрактов В. brevis и очищенные два
белковых препарата обеспечивали точность сборки циклического поли-
пептида – грамицидина S, состоящего из 10 аминокислотных остатков,
расположенных в строгой последовательности. Очищенные белковые фрак-
ции (с мол. массами 100000 и 180000) требовали присутствия только
свободных аминокислот, АТФ и ионов Mg
2+
для синтеза этого цикли-
ческого декапептида (О-фенилаланилпролилвалилорнитиллейцин)
2
:
Показано, что именно легкая белковая фракция (мол. масса 100000)
обеспечивает рацемизирование и включение D-фенилаланина в первую
полипептидную цепь, а тяжелая фракция (мол. масса 180000) – включение
4 остальных L-аминокислот; оба фермента принимают участие также
и в образовании пептидных связей. Аналогично синтезируется такой же
пентапептид на расположенном рядом мультиферментном комплексе, за-
тем оба пентапептида соединяются по типу «голова» к «хвосту» с за-
мыканием цепи и образованием циклического декапептида. В механизме
синтеза предполагается предварительное образование аминоациладенилатов
(при участии этих же ферментов), из которых остатки аминокислот затем
переносятся на SH-группы обоих ферментов. При этом образуются ак-
тивированные промежуточные тиоэфиры, подобные тиоэфирам при синтезе
высших жирных кислот (см. главу 11). В структуре первого (легкого)
фермента открыт ковалентно связанный остаток фосфопантотеина,
поэтому предполагают участие его тиоловой группы в переносе растущей
пептидной цепи с одного участка фермента на другой. Аналогичный
механизм синтеза доказан также для антибиотика тироцидина (декапептид)
и для 13-членного циклического пептида – антибиотика микобациллина.
Таким образом, природа (условно в лице бактериальной клетки), оче-
видно, не утратила полностью существовавшего до матричного, рибо-
сомного, пути атавистического механизма синтеза белковых тел и поль-
зуется для этого весьма примитивными, но достаточно эффективными
приемами.
РЕГУЛЯЦИЯ СИНТЕЗА БЕЛКА
Основным условием существования любых живых организмов является
наличие тонкой, гибкой, согласованно действующей системы регуляции,
в которой все элементы тесно связаны друг с другом. В белковом синтезе не
только количественный и качественный состав белков, но и время синтеза
имеют большое значение. От этого зависит приспособление микроорга-
низмов к условиям окружающей питательной среды как биологической
534
необходимости или приспособление сложного многоклеточного организма
к физиологическим потребностям при изменении внутренних и внешних
условий.
Клетки живых организмов обладают способностью синтезировать ог-
ромное количество разнообразных белков. Однако они никогда не син-
тезируют все белки. Количество и разнообразие белков, в частности
ферментов, определяются степенью их участия в метаболизме. Более того,
интенсивность обмена регулируется скоростью синтеза белка и парал-
лельно контролируется аллостерическим путем (см. главу 4). Таким об-
разом, синтез белка регулируется внешними и внутренними факторами
и условиями, которые диктуют клетке синтез такого количества белка
и такого набора белков, которые необходимы для выполнения физиоло-
гических функций. Все это свидетельствует о весьма сложном, тонком
и целесообразном механизме регуляции синтеза белка в клетке.
Общую теорию регуляции синтеза белка разработали французские
ученые, лауреаты Нобелевской премии Ф. Жакоб и Ж. Моно. Сущность
этой теории сводится к «выключению» или «включению» генов как функ-
ционирующих единиц, к возможности или невозможности проявления их
способности передавать закодированную в структурных генах ДНК ге-
нетическую информацию на синтез специфических белков. Эта теория,
доказанная в опытах на бактериях, получила широкое признание, хотя
в эукариотических клетках механизмы регуляции синтеза белка, вероятнее
всего, являются более сложными (см. далее). У бактерий доказана
индукция ферментов (синтез ферментов de novo) при добавлении
в питательную среду субстратов этих ферментов. Добавление конечных
продуктов реакции, образование которых катализируется этими же фер-
ментами, напротив, вызывает уменьшение количества синтезируемых фер-
ментов. Это последнее явление получило название репрессии синтеза
ферментов. Оба явления – индукция и репрессия – взаимосвязаны.
Согласно теории Ф. Жакоба и Ж. Моно, в биосинтезе белка у бактерий
участвуют по крайней мере 3 типа генов: структурные гены, ген-регулятор
и ген-оператор. Структурные гены определяют первичную структуру син-
тезируемого белка. Именно эти гены в цепи ДНК являются основой для
биосинтеза мРНК, которая затем поступает в рибосому и, как было
указано, служит матрицей для биосинтеза белка. Регуляция синтеза белка
путем индукции представлена на рис. 14.12.
Синтез мРНК на структурных генах молекулы ДНК непосредственно
контролируется определенным участком, называемым геном-операто-
ром. Он служит как бы пусковым механизмом для функционирования
структурных генов. Ген-оператор локализован на крайнем отрезке струк-
турного гена или структурных генов, регулируемых им. «Считывание»
генетического кода, т.е. формирование мРНК, начинается с промотора –
участка ДНК, расположенного рядом с геном-оператором и являющегося
точкой инициации для синтеза мРНК, и распространяется последовательно
вдоль оператора и структурных генов. Синтезированную молекулу мРНК,
кодирующую синтез нескольких разных белков, принято называть по-
лигенным (полицистронным) транскриптом. Координированный одним
оператором одиночный ген или группа структурных генов образует
оперон.
В свою очередь деятельность оперона находится под контролирующим
влиянием другого участка цепи ДНК, получившего название гена-регу-
лятора. Структурные гены и ген-регулятор расположены в разных
участках цепи ДНК, поэтому связь между ними, как предполагают
535
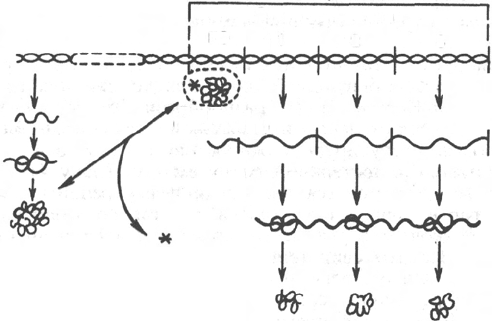
Рис. 14.12. Регуляция синтеза белка путем индукции (схема).
ГР - ген-регулятор; П - промотор; ГО - ген-оператор.
Ф. Жакоб и Ж. Моно, осуществляется при помощи вещества-посредника,
оказавшегося белком и названного репрессором. Образование репрес-
сора происходит в рибосомах ядра на матрице специфической мРНК,
синтезированной на гене-регуляторе (рис. 14.13). Репрессор имеет сродство
к гену-оператору и обратимо соединяется с ним в комплекс. Образование
такого комплекса приводит к блокированию синтеза мРНК и, следо-
вательно, синтеза белка, т.е. функция гена-регулятора состоит в том, чтобы
через белок-репрессор прекращать (запрещать) деятельность структурных
генов, синтезирующих мРНК. Репрессор, кроме того, обладает способ-
ностью строго специфически связываться с определенными низкомоле-
кулярными веществами, называемыми индукторами, или эффекто-
рами. Если такой индуктор соединяется с репрессором, то последний
теряет способность связываться с геном-оператором, который, таким об-
разом, выходит из-под контроля гена-регулятора, и начинается синтез
мРНК. Это типичный пример отрицательной формы контроля, когда
индуктор, соединяясь с белком-репрессором, вызывает изменения его тре-
тичной структуры настолько, что репрессор теряет способность связываться
с геном-оператором. Процесс этот аналогичен взаимоотношениям алло-
стерического центра фермента с эффектором, под влиянием которого
изменяется третичная структура фермента и он теряет способность свя-
зываться со своим субстратом.
Механизм описанной регуляции синтеза белка и взаимоотношения
репрессора со структурными генами были доказаны в опытах с Е. coli на
примере синтеза β-галактозидазы (лактазы) – фермента, расщепляющего
молочный сахар на глюкозу и галактозу. Дикий штамм Е. coli обычно
растет на глюкозе. Если вместо глюкозы в питательную среду добавить
лактозу (новый источник энергии и углерода), то штамм не будет расти,
пока не будут синтезированы соответствующие ферменты (адаптивный
синтез). При поступлении в клетку лактозы (индуктор) молекулы ее свя-
зываются с белком-репрессором и блокируют связь между репрессором
и геном-оператором. Ген-оператор и структурные гены при этом начинают
снова функционировать и синтезировать необходимую мРНК, которая
536
ГР
П
Оперон
Структурные гены
ГО
1
2
3
Репрессор
Индуктор
Репрессор
(неактивный)
ДНК
Транскрипция
мРНК
Полисома
Трансляция
Белки
1
2
3
(активный)
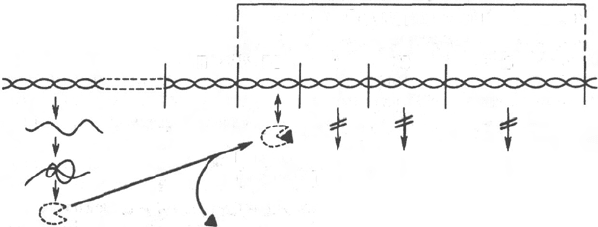
Рис. 14.13. Регуляция синтеза белка путем репрессии (схема).
Обозначения те же, что на рис. 14.12.
«дает команду» рибосомам синтезировать β-галактозидазу. Одновременно
ген-регулятор продолжает вырабатывать репрессор, но последний бло-
кируется новыми молекулами лактозы, поэтому синтез фермента про-
должается. Как только молекулы лактозы будут полностью расщеплены,
репрессор освобождается и, поступив в ДНК, связывает ген-оператор
и блокирует синтез мРНК, а следовательно, синтез β-галактозидазы в
рибосомах.
Таким образом, биосинтез мРНК, контролирующий синтез белка в
рибосомах, зависит от функционального состояния репрессора. Этот реп-
рессор представляет собой тетрамерный белок с общей мол. массой около
150000. Если он находится в активном состоянии, т.е. не связан с ин-
дуктором, то блокирует ген-оператор и синтеза мРНК не происходит. При
поступлении метаболита – индуктора – в клетку его молекулы связывают
репрессор, превращая его в неактивную форму (или, возможно, снижают
его сродство к гену-оператору). Структурные гены выходят из-под за-
прещающего контроля и начинают синтезировать нужную мРНК.
Как было указано, концентрация ряда ферментов в клетках резко
снижается при повышении содержания отдаленных конечных продуктов,
образующихся в цепи последовательных ферментативных реакций. Такой
эффект, получивший название репрессии ферментов, часто наблю-
дается при реакциях биосинтеза. В этих случаях молекулы репрессора,
также образующиеся в рибосомах ядра по «команде» гена-регулятора,
являются неактивными и сами по себе не обладают способностью по-
давлять деятельность гена-оператора и, следовательно, всего оперона, но
приобретают такую способность после образования комплекса с конечным
или одним из конечных продуктов биосинтетического процесса (см.
рис. 14.13).
Конечный продукт выступает, таким образом, в качестве корепрес-
сора. Имеются данные, что в качестве корепрессоров в синтезе ферментов
обмена аминокислот, по-видимому, выступает не только свободная амино-
кислота как конечный продукт биосинтетической реакции, но и комплекс ее
с тРНК – аминоацил-тРНК.
В регуляции экспрессии структурных генов специфическое участие при-
нимает особый белок – катаболитный генактивирующий белок (от англ.
537
ГР
П ГО
Оперон
Структурные гены
1
2
3
Репрессор
(активный)
Репрессор
(неактивный)
Корепрессор
(конечный продукт)
Транскрипция
catabolite gene activation protein, сокращенно CAP). Этот белок, взаимо-
действующий с цАМФ, образует комплекс, способствующий прикреплению
РНК-полимеразы к промоторному участку генома. В присутствии комп-
лекса САР-цАМФ фермент может начать транскрипцию оперона, включая
структурные гены, т.е. в клетках имеется еще один, дополнительный
САР-цАМФ-регулятор, действующий, скорее всего, в качестве положи-
тельного регулятора, поскольку его присутствие необходимо для начала
экспрессии гена.
Таким образом, концепция Ф. Жакоба и Ж. Моно о механизме про-
явления (экспрессии) активности генов признана одним из блестящих
достижений молекулярной биологии. Она явилась логическим развитием
многочисленных исследований, проведенных генетиками и биохимиками
в предшествующие десятилетия.
Регуляция экспрессии активности генов у эукариот осуществляется
значительно более сложным путем, поскольку процессы транскрипции
и трансляции разделены не только пространственно ядерной биомембра-
ной, но и во времени. Эта регуляция базируется как минимум на 6 уровнях
сложных биологических процессов, определяющих скорость синтеза и
распада генетического продукта (рис. 14.14).
Для большинства эукариотических клеток, как и клеток прокариот,
стадия инициации транскрипции является основной, главной регуляторной
точкой экспрессии активности генов. Тем не менее имеются существенные
различия: во-первых, место процессов транскрипции (в ядре) и трансля-
ции (в цитоплазме); во-вторых, активирование транскрипции у эукари-
от связано с множеством сложных изменений структуры хроматина в
транскрибируемой области; в-третьих, в эукариотических клетках пре-
валируют положительные регуляторные механизмы над отрицатель-
ными.
Положительная или отрицательная регуляция определяется типом бел-
ков, вовлеченных в механизм регуляции. Получены доказательства су-
ществования минимум 3 типов белков, участвующих в регуляции процесса
инициации транскрипции, опосредованного через РНК-полимеразу:
специфические факторы, репрессоры и активаторы. Первые вы-
зывают изменение специфичности РНК-полимеразы к данному промотору
или группе промоторов; репрессоры связываются с промотором, блокируя
тем самым доступ РНК-полимеразы к промотору; активаторы, напротив,
связываются вблизи промоторного участка, повышая связывание промо-
тора и РНК-полимеразы.
В многоклеточных организмах среднее число регуляторных сайтов для
одного гена минимум равно пяти; положительные регуляторные белки
связываются со своими специфическими последовательностями в структуре
ДНК (вероятнее всего, посредством водородных связей между амидной
группой Глн или Асн и пуриновыми и пиримидиновыми основаниями
нуклеотидов). Следует указать еще на один момент, почему эукариоти-
ческая клетка использует положительные механизмы регуляции экспрессии
генов. Подсчитано, что в геноме человека содержится около 100000 генов,
соответственно каждая клетка при отрицательном механизме регуляции
могла бы синтезировать 100000 разных репрессоров, причем в достаточных
количествах. При положительном механизме регуляции большинство генов
в принципе неактивно, соответственно молекула РНК-полимеразы не свя-
зывается с промотором и клетка синтезирует ограниченный и избира-
тельный круг активаторных белков, необходимых для инициации транс-
крипции.
538
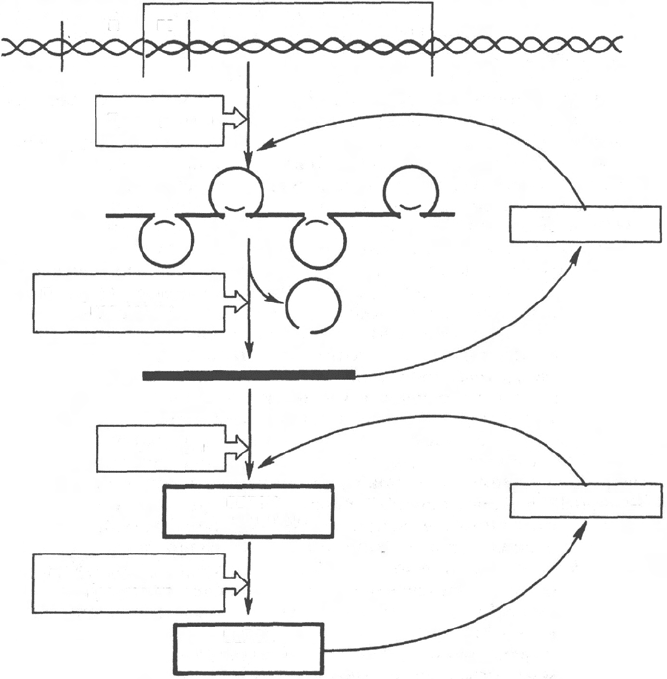
Рис. 14.14. Схематическое изображение регуляции экспрессии активности гена у
эукариот.
У эукариот выделены и охарактеризованы также пять регуляторных
белков, получивших название транскрипционных факторов (TF: IIА,
IIВ, IID, IIЕ и IIF). Они необходимы для узнавания участка (сайта) ДНК,
названного TATA (concensus последовательности, ТАТАААА). Деталь-
ный молекулярный механизм действия факторов транскрипции пока не
раскрыт.
Более подробно в структурном и функциональном отношении у эука-
риот изучена группа белков, получивших название белков – актива-
торов транскрипции. Эти белки имеют специфические структурные
домены для связывания с другими, но определенными регуляторными
нуклеотидными последовательностями в молекуле ДНК. В частности, они
содержат домен, специфически связывающийся с ДНК, и один или не-
сколько доменов, необходимых для активирования или взаимодействия
с другими регуляторными белками. Среди этих белков – активаторов
транскрипции имеются белки, содержащие богатые глутамином домены (до
25%) и богатые пролином домены. Следует отметить, однако, что не-
539
ДНК
П ГО
Структурный ген
Транскрипция
Первичный
транскрипт
Посттранскрипционный
процессинг
Нуклеотиды
Распад мРНК
мРНК
Трансляция
БЕЛОК
(неактивный)
Посттрансляционный
процессинг
БЕЛОК
(активный)
Аминокислоты
Распад белка
которые из них или почти все регуляторные белки активируют транс-
крипцию не прямо, а опосредованно – через промежуточные белки, назван-
ные коактиваторами. Происхождение и механизм действия последних
также не выяснены.
Современные знания о механизмах регуляции экспрессии генов на
посттранскрипционном и посттрансляционном уровнях (см. рис. 14.4) были
подробно рассмотрены ранее (см. главы 13 и 14).
Рассмотрим кратко вопрос о регуляции процессов дифференцировки
клеток высших организмов. ДНК, присутствующая во всех соматических
клетках, вероятнее всего, имеет одинаковую первичную структуру у дан-
ного организма и соответственно располагает информацией для синтеза
любых или всех белков тела. Тем не менее клетки печени, например,
синтезируют сывороточные белки, а клетки молочной железы – белки мо-
лока. Нет сомнения в том, что в дифференцированных клетках имеется
весьма тонкий механизм контроля деятельности ДНК в разных тканях,
обеспечивающий синтез многообразия белков.
Механизмы, лежащие в основе этой регуляции, пока неизвестны. Для их
объяснения существует ряд гипотез. Предполагают, что контроль осу-
ществляется на уровне транскрипции по аналогии с индукцией ферментов
у бактерий и что в этом случае в клетках животных должны функциони-
ровать аналогичные репрессоры. С молекулой ДНК у эукариот связаны
гистоны, поэтому считается, что именно эти белки выполняют роль
репрессоров. Прямых доказательств их роли в качестве репрессоров не
получено, хотя, как было показано, в клетках эукариот открыт класс
регуляторных белков процесса транскрипции. Высказано предположение,
что в ядре синтезируется высокомолекулярная молекула мРНК, содер-
жащая информацию для синтеза широкого разнообразия белков, но в
цитоплазму попадает только небольшая часть зрелой мРНК, а основная
часть ее распадается. Неясны, однако, биологический смысл и назначение
этого механизма избирательного распада и соответственно траты огромной
массы молекулы мРНК.
Существует еще одно предположение, что на ДНК клетки синтези-
руются все мыслимые, возможные мРНК, которые поступают в цито-
плазму, и процесс трансляции регулируется путем специфического и из-
бирательного взаимодействия рибосом с определенными молекулами
мРНК.
Ингибиторы синтеза белка
Один из путей выяснения тонких молекулярных механизмов синтеза
нуклеиновых кислот и белков в клетках – использование таких лекарст-
венных препаратов, которые могли бы избирательно тормозить эти про-
цессы у бактерий, не влияя на клетки организма человека. Некоторые
препараты, действительно, оказывают такое избирательное действие,
взаимодействуя с белками рибосом прокариот и выключая бактериальный
синтез белка. Однако многие из них являются токсичными и для человека.
В настоящее время в медицинской практике применяются многие анти-
биотики, часть из которых будет рассмотрена с целью выяснения мо-
лекулярного механизма их действия на ключевые химические реакции
синтеза белка и нуклеиновых кислот.
Один из мощных ингибиторов белкового синтеза – пуромицин. Он пред-
ставляет собой аналог концевого участка аминоацил-тРНК адениловой
540
