Березов Т.Т., Коровкин Б.Ф. Биологическая химия
Подождите немного. Документ загружается.

новлено, что ДНК локализована в ядре клетки, в то время как синтез белка
протекает главным образом в микросомах цитоплазмы. Первые экспе-
риментальные доказательства необходимости нуклеиновых кислот для
синтеза белка были получены в лаборатории Т. Касперсона. Было показано
также, что присутствующие в цитоплазме рибонуклеиновые кислоты
контролируют синтез цитоплазматических белков. Таким образом, уже
тогда вырисовывалась картина тесной связи между ДНК, локализованной
в ядре *, и синтезом белка, протекающим в цитоплазме и регулирующимся
рибонуклеиновыми кислотами, которые были открыты как в цитоплазме,
так и в ядре. На основании этих чисто морфологических данных было
сделано заключение, полностью подтвержденное в настоящее время, что
биосинтез белка, хотя непосредственно и регулируется рибонуклеиновыми
кислотами, опосредованно связан с контролирующим влиянием ДНК ядра
и что РНК сначала синтезируется в ядре, затем поступает в цитоплазму, где
выполняет роль матрицы в синтезе белка. Полученные значительно позже
экспериментальные данные подтвердили гипотезу о том, что основными
функциями нуклеиновых кислот являются хранение генетической инфор-
мации и реализация этой информации путем программированного синтеза
специфических белков.
В последовательности ДНК —> РНК —> Белок недоставало сведений о
том, каким образом происходят расшифровка наследственной информации
и синтез специфических белков, определяющих широкое разнообразие
признаков живых существ. В настоящее время выяснены основные про-
цессы, посредством которых осуществляется передача наследственной ин-
формации: репликация, т.е. синтез ДНК на матрице ДНК; транскрип-
ция, т.е. синтез РНК на матрице ДНК или перевод языка и типа строения
ДНК на молекулу РНК (см. ранее), и трансляция – процесс, в котором
генетическая информация, содержащаяся в молекуле мРНК, направляет
синтез соответствующей аминокислотной последовательности в белке.
Напомним, однако, что многие тонкие механизмы транскрипции и транс-
ляции окончательно еще неясны.
ТРАНСЛЯЦИЯ И ОБЩИЕ ТРЕБОВАНИЯ К СИНТЕЗУ БЕЛКА
В БЕСКЛЕТОЧНОЙ СИСТЕМЕ
Непосредственное отношение к механизмам передачи наследственной ин-
формации, или экспрессии генов, имеет процесс трансляции, означающий
перевод «четырехбуквенного языка нуклеиновых кислот на двадцатибук-
венную речь белков». Другими словами, трансляция сводится к синтезу
белка в рибосомах. В этом процессе только последовательность рас-
положения нуклеотидов в мРНК определяет первичную структуру белка,
т.е. строго упорядоченную последовательность расположения отдельных
аминокислотных остатков в молекуле синтезируемого белка.
Остановимся на анализе тех условий, которые необходимы для осу-
ществления синтеза белка в бесклеточной системе. В современных пред-
ставлениях о синтезе белка выдающуюся роль сыграли три эксперимен-
тальных подхода, разработанные в начале 50-х годов. Во-первых, в клас-
сических исследованиях П. Замечника и сотр. при использовании меченых
* Получены экспериментальные доказательства наличия ДНК также в митохондриях
(около 1-2% от суммарной ДНК клеток). Она негомологична и некомплементарна ядерной
ДНК. Установлено, что ДНК кодирует синтез некоторых структурных белков самих мито-
хондрий и особых митохондриальных РНК.
511

Таблица 14.1. Состав белоксинтезирующей системы у про- и эукариот в разные
стадии синтеза белка
Стадия
1. Активация
аминокислот
2. Инициация
3. Элонгация
4. Терминация
5. Процессинг и
формирование
третичной
структуры
Прокариоты
20 аминокислот
20 аминоацил-тРНК-синтетаз
Минимум 20 тРНК
АТФ и Mg
2+
мРНК
Инициаторная аминоацил-
тРНК (N-формилметионил-
тРНК)
Инициирующий кодон в мо-
лекуле мРНК (АУГ)
30S и 50S рибосомные
субчастицы
Факторы инициации:
IF-1, IF-2 и IF-3, ГТФ и Mg
2+
Инициирующий комплекс
(функциональная 70S рибо-
сома)
Специфические тРНК, опре-
деляемые кодонами
Факторы элонгации:
EF-Tu, EF-Ts и EF-G,
ГТФ и Mg
2+
Терминирующие кодоны в
молекуле мРНК: УАА, УАГ
и УГА
Факторы терминации
(рилизинг-факторы):
RF-1,
RF-2, RF-3,
АТФ
Специфические ферменты и
кофакторы, вызывающие ос-
вобождение инициирующих
остатков и сигнальных после-
довательностей, ограничен-
ный протеолиз и химическую
модификацию
Эукариоты
20 аминокислот
20 аминоацил-тРНК-синтетаз
Минимум 20 тРНК
АТФ и Mg
2+
мРНК
Инициаторная аминоацил-
тРНК (метионил-тРНК)
Инициирующий кодон в мо-
лекуле мРНК (АУГ)
40S и 60S рибосомные
субчастицы
Факторы инициации:
eIF-1, eIF-2, eIF-2A, eIF-3,
eIF-4A, eIF-4B, eIF-4C, eIF-4D
и кэп-узнающий фактор, ГТФ
и Mg
2+
Инициирующий комплекс
(функциональная 80S рибо-
сома)
Специфические РНК, опре-
деляемые кодонами
Факторы элонгации:
eEF-1α, eEF-1βγ и eEF-2,
ГТФ и Mg
2+
Терминирующие кодоны в
молекуле мРНК: УАА, УАГ
и УГА
Факторы терминации
(рилизинг-факторы):
eRF,
АТФ
Специфические ферменты и
кофакторы, вызывающие ос-
вобождение инициирующих
остатков и сигнальных после-
довательностей, ограничен-
ный протеолиз и химическую
модификацию
512
аминокислот был впервые решен вопрос о месте синтеза белка; им ока-
залась рибосома. При введении крысам
15
N-аминокислот и определении
радиоактивности белков в различных субклеточных фракциях печени, по-
лученных методом дифференциального центрифугирования через различ-
ные промежутки времени, было показано, что радиоактивная метка в
первую очередь появляется во фракции микросом и лишь затем в других
субклеточных образованиях. Во-вторых, добавление АТФ к белоксинте-
зирующей системе цитозоля вызывало «активирование» аминокислоты
и связывание ее с термостабильной и растворимой формой РНК, впо-
следствии названной транспортной (тРНК), что приводило к образованию
комплекса, названного позже аминоацил-тРНК. Ферменты, катализиру-
ющие этот процесс, сейчас называются аминоацил-тРНК-синтетазами.
В-третьих, выяснена роль самих адапторных РНК в процессе трансляции.
Дальнейшие исследования были направлены на поиск других ком-
понентов белоксинтезирующей системы.
Белоксинтезирующая система включает набор всех 20 амино-
кислот, входящих в состав белковых молекул; минимум 20 разных тРНК,
обладающих специфичностью к определенному ферменту и определенной
аминокислоте; набор минимум 20 различных ферментов – аминоацил-
тРНК-синтетаз, также обладающих двойной специфичностью к какой-либо
определенной аминокислоте и к одной тРНК; рибосомы (точнее, полисомы,
состоящие из 4–12 монорибосом с присоединенной к ним мРНК); АТФ
и АТФ-генерирующую систему ферментов; ГТФ, принимающий специ-
фическое участие в стадиях инициации и элонгации синтеза белка в
рибосомах; ионы Mg
2+
в концентрации 0,005–0,008 М; мРНК в качестве
главного компонента системы, несущей информацию о структуре белка,
синтезирующегося в рибосоме; наконец, белковые факторы, участвующие
в синтезе на разных уровнях трансляции. Основные компоненты белок-
синтезирующей системы про- и эукариотов в разные стадии синтеза белка
обобщены в табл. 14.1.
Рассмотрим более подробно структуру и функцию главных компонентов
белоксинтезирующей системы.
Рибосомы
Как известно, живые организмы в зависимости от структуры клеток делятся
на две группы – прокариоты и эукариоты. Первые не содержат ограни-
ченного мембраной ядра и митохондрий или хлоропластов; они пред-
ставлены главным образом микроорганизмами. Клетки эукариот животных
и растений, включая грибы, напротив, содержат ядра с мембранами,
а также митохондрии (в ряде случаев и хлоропласты) и другие субклеточные
органеллы.
Оба типа клеток имеют рибосомы, причем рибосомы эукариот (мол.
масса 4,2•10
6
) значительно большего размера (23 нм в диаметре), чем
рибосомы прокариот (мол. масса 2,5•10
6
, 8 нм в диаметре). Обычно
рибосомы характеризуют по скорости их седиментации в центрифужном
поле, которая количественно выражается константой седиментации s в
единицах Сведберга S (см. главу 1). Величина s зависит не только от
размера частиц, но и от формы и плотности, так что она непропор-
циональна размеру. Число рибосом в микробной клетке равно примерно
10
4
, а эукариот – около 10
5
.
Химически рибосомы представляют собой нуклеопротеины, состоящие
из РНК и белков, причем 80S рибосомы эукариот содержат примерно
513
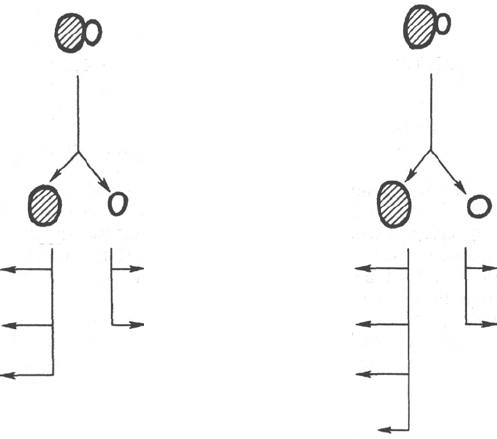
Рис. 14.2. Компоненты рибосом прокариот и эукариот (схема).
равное их количество, а у 70S рибосом прокариот соотношение РНК и белка
составляет 65% и 35% соответственно (рис. 14.2). РНК рибосом принято
называть рибосомными и обозначать рРНК. Как 80S, так и 70S рибосомы
состоят из двух субчастиц, которые можно увидеть под электронным
микроскопом или после обработки рибосом растворами, содержащими
низкие концентрации ионов Mg
2+
. При этих условиях рибосомы дис-
социируют на субчастицы; последние могут быть отделены друг от друга
методом ультрацентрифугирования. Одна из субчастиц по размерам
в 2 раза превышает вторую. Так, у 70S рибосом величины s для субчастиц
равны 50S и 30S, у 80S рибосом – соответственно 60S и 40S (см. рис. 14.2).
Укажем также, что у Е. coli большая и малая субчастицы содержат 34 белка
и 21 белок соответственно и, кроме того, 2 молекулы рРНК с коэф-
фициентами седиментации 23S и 5S в большой и одну молекулу рРНК (16S)
в малой субчастице. Рибосомные белки не только все выделены, но
и секвенированы; отличаются большим разнообразием молекулярной мас-
сы (от 6000 до 75000). Считается, что все 55 бактериальных рибосомных
белков участвуют в синтезе полипептидов в качестве ферментов или
структурных компонентов, но, за исключением небольшого числа, де-
тальная функция большинства из них не выяснена. РНК 23S и 5S содержат
3200 и 120 нуклеотидов соответственно, a 16S РНК – 1540 нуклеотидов.
Субчастицы рибосом клеток эукариот построены более сложно. В их
составе четыре разные рРНК и более 70 разных белков в обеих субчастицах,
при этом большая субчастица (60S) содержит три разного размера рРНК:
28S (4700 нуклеотидов), 5,8S (160 нуклеотидов) и 5S (120 нуклеотидов) – и
около 49 белков. Малая субчастица (40S) содержит всего одну молекулу 18S
рРНК и около 33 белков. Укажем также, что биологические функции
компонентов эукариотических рибосом также связаны, вероятнее всего,
с синтезом полипептидной цепи, но их конкретная роль недостаточно
раскрыта.
514
Прокариоты
70S
5S рРНК
(120 нукл.)
23S рРНК
(3200 нукл.)
34 белка
50S
30S
0,01 мМ
Мg
2+
16S рРНК
(1540 нукл.)
21 белок
Эукариоты
80S
5S рРНК
(120 нукл.)
5,8S рРНК
(160 нукл.)
28S рРНК
(4700 нукл.)
~ 49 белков
60S
40S
18S рРНК
(1900 нукл.)
~ 33 белка
0,01
мМ
Mg
2+
Рибосомы представляют собой сложную молекулярную «машину»
(«фабрику») синтеза белка. Для выяснения тонких механизмов синтеза
белка в рибосомах необходимы более точные сведения о структуре и
функциях всех компонентов рибосом. В последнее время получены данные,
свидетельствующие о вероятной пространственной трехмерной структуре
как целых рибосом, так и их субчастиц. В частности, выяснено, что форму
и размеры 30S и 40S субчастиц рибосом предопределяют не белковые
молекулы этих частиц, а третичная структура входящих в их состав 16S
и 18S рРНК. Более того, по данным акад. А.С. Спирина, для сохранения
пространственной морфологической модели всей 30S субчастицы оказалось
достаточным наличие только двух белков (из 21), содержащихся в оп-
ределенных топографических участках молекулы 16S рРНК.
Известно, что рРНК образуется из общего предшественника всех типов
клеточных РНК, в свою очередь синтезирующегося на матрице ДНК в ядре
(см. главу 13). Рибосомные белки имеют цитоплазматическое происхож-
дение, затем они транспортируются в ядрышки, где и происходит спон-
танное образование рибосомных субчастиц путем объединения белков
с соответствующими рРНК. Объединенные субчастицы вместе или врозь
транспортируются через поры ядерной мембраны обратно в цитоплазму,
где группа рибосом вместе с мРНК образует полисомы или полирибосомы,
принимающие непосредственное участие в синтезе белка.
Аминоацил-тРНК-синтетазы
Экспериментально доказано существование в любых клетках живых ор-
ганизмов специфических ферментов, катализирующих активирование ами-
нокислот и связывание последних с определенными тРНК. Все эти фер-
менты выделены в чистом виде из Е. coli, секвенированы, и для ряда их
установлена трехмерная структура.
Все они оказались чувствительными к реагентам на SH-группы и
требуют присутствия ионов Mg
2+
. Ферменты обладают абсолютной спе-
цифичностью действия, поскольку они узнают только одну какую-либо
L-аминокислоту или одну тРНК. Для тех аминокислот, для которых
открыты две и более тРНК (см. далее), соответствующая аминоацил-
тРНК-синтетаза катализирует аминоацилирование всех этих тРНК. Это
обстоятельство чрезвычайно важно, поскольку в дальнейшем в белковом
синтезе «узнавание» аминоацил-тРНК основано не на природе амино-
кислоты, а на химической природе антикодона тРНК. Считается, что
в молекуле каждой аминоацил-тРНК-синтетазы имеется по крайней мере
3 центра связывания: для аминокислоты, тРНК и АТФ; ферменты весьма
чувствительны также к аналогам аминокислот, которые ингибируют ак-
тивирование соответствующих аминокислот. Некоторые ферменты состоят
из одной полипептидной цепи, другие – из двух или четырех гомологичных
или гетерогенных субъединиц.
Аминоацил-тРНК-синтетазы в последнее время стали делить на 2 класса
в соответствии с различиями в их первичной и третичной структурах,
а также в зависимости от своеобразия механизма катализируемой реакции.
Первый класс включает ферменты, катализирующие синтез аминоацил-
тРНК следующих аминокислот: Арг, Вал, Глн, Глу, Иле, Лей, Мет, Тир,
Трп, Цис; второй класс – аминокислот Ала, Асн, Асп, Гис, Гли, Лиз, Про,
Сер, Тре, Фен. Оказалось, что ферменты 1-го класса обеспечивают перенос
аминоацильной группы сначала ко второй 2'-ОН-группе терминального
остатка адениловой кислоты, затем перемещение ее к 3'-ОН-группе (путем
515
реакции трансэтерификации), в то время как ферменты 2-го класса ката-
лизируют перенос аминоацильной группы непосредственно к 3'-ОН-группе
концевого аденилового нуклеотида.
Аминоацил-тРНК-синтетазы в активном центре содержат гистидин,
имидазольное кольцо которого участвует в связывании АТФ посредством
ионов Mg
2+
. Наибольшим сродством эти ферменты, как было указано,
обладают к молекулам специфических тРНК, хотя конкретный механизм,
посредством которого ферменты узнают подходящую РНК, пока неясен.
В то же время эти ферменты отличаются низкой молярной активностью
(число оборотов не превышает нескольких сот каталитических актов в
минуту).
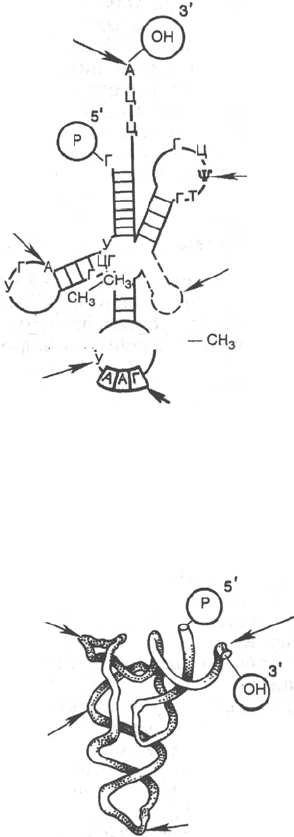
Рис. 14.3. Структура тРНК.
а - общая структура различных тРНК; б - пространственная структура тРНК.
516
Участок
связывания
аминокислот
Петля,
содержащая
дигидроуридин
а
Петля,
содержащая
антикодон
Псевдоуридиловая
петля
Добавочная
петля
Пиримидин
Пурин
Антикодон
Псевдоуридиловая
петля
Участок
связывания
аминокислот
Петля,
содержащая
дигидроуридин
б
Петля,
содержащая
антикодон
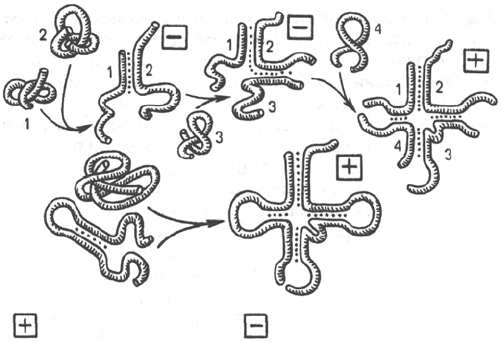
Рис. 14.4. Созревание валиновой тРНК (по А.А. Баеву).
Цифрами обозначены фрагменты молекулы тРНК.
Транспортные РНК
В лаборатории М. Хогланда было выяснено, что при инкубации
14
С-аминокислоты с растворимой фракцией цитоплазмы в присутствии
АТФ и последующим добавлением трихлоруксусной кислоты в образовавшемся
белковом осадке метка не открывается. Эти данные позволили сделать
заключение, что меченая аминокислота не включается в белковую мо-
лекулу. Метка оказалась связанной ковалентно с РНК, содержащейся
в безбелковом фильтрате. Дальнейшие исследования показали, что РНК,
к которой присоединяется меченая аминокислота, имеет небольшую мо-
лекулярную массу и сосредоточена в растворимой фракции, поэтому ее
сначала назвали растворимой, а позже адапторной, или транспортной, РНК
(тРНК). На долю тРНК приходится около 10–15% от общего количества
клеточной РНК. К настоящему времени открыто более 60 различных тРНК.
Для каждой аминокислоты в клетке имеется по крайней мере одна спе-
цифическая тРНК. (Для ряда аминокислот открыто более одной: в част-
ности, для серина, лейцина и аргинина – 6 разных тРНК, для аланина,
треонина и глицина – по 4 разных тРНК, хотя и в этом случае каждая тРНК
связана со специфической аминоацил-тРНК-синтетазой.) Молекулярная
масса большинства тРНК колеблется от 24000 до 29000. Они содержат от
75 до 85 нуклеотидов, в том числе 8 и более из них являются моди-
фицированными основаниями. Аминокислоты присоединяются в конечном
итоге к свободной 3'-ОН-группе (см. ранее о ферментах аминоацил-
тРНК-синтетаз 1-го класса) концевого мононуклеотида, представленного во
всех тРНК АМФ (адениловая кислота), путем образования эфирной связи.
Интересно, что почти все тРНК обладают не только удивительно сходными
функциями, но и очень похожей трехмерной структурой (рис. 14.3).
Установлена первичная структура почти всех 60 открытых тРНК
(рис. 14.4). Знание последовательности нуклеотидов и, следовательно,
состава тРНК дало в руки исследователей много ценных сведений о
биологической роли отдельных компонентов тРНК. Общей для тРНК
оказалась также нативная трехмерная структура, установленная методом
517
Печень
Дрожжи
Активное состояние
Неактивное состояние
рентгенокристаллографического анализа и названная первоначально кон-
формацией клеверного листа; на самом деле эта конформация имеет
перевернутую L-образную форму (см. рис. 14.3). Определение тРНК этим
методом позволило выявить ряд отличительных особенностей структуры.
В молекуле тРНК открыты спирализованные участки, необычные водо-
родные связи и гидрофобные взаимодействия во внеспирализованных
участках. Показано, что тРНК имеет псевдоуридиловую петлю, обра-
зованную из нуклеотидов, содержащих псевдоуридин (ТψС), и дигидро-
уридиловую петлю. Обе петли участвуют в образовании угла буквы L. На
3'-ОН-конце располагается одинаковая для всех тРНК последовательность
триплета ЦЦА-ОН, к которой присоединяется посредством эфирной связи
специфическая аминокислота. Связывание в основном происходит через
3'-ОН-группу концевого аденилового нуклеотида, хотя, как было указано,
получены доказательства возможности предварительного присоединения
аминокислоты и через его 2'-ОН-группу.
Роль отдельных участков тРНК недостаточно раскрыта. В частности,
псевдоуридиловая петля, по-видимому, обеспечивает связывание амино-
ацил-тРНК с рибосомой, а дигидроуридиловая петля, вероятнее всего,
необходима как сайт (место) для узнавания специфическим ферментом –
аминоацил-тРНК-синтетазой. Имеется, кроме того, добавочная петля,
состав которой варьирует у разных типов молекул тРНК; ее назначение
неизвестно. Существенным, с полностью раскрытой функцией участком
является антикодоновая петля, несущая триплет, названный антикодо-
ном, и расположенная на противоположной стороне от того конца, к кото-
рому присоединяется аминокислота. Антикодоновая петля состоит из
7 нуклеотидов: три занимают центральное положение и формируют
собственный высокоспецифичный антикодон, по два нуклеотида распо-
ложены по обе стороны от него, включая модифицированный пурин и
варьирующее основание с одной стороны и два пиримидиновых осно-
вания – с другой стороны. Антикодон является специфичным и компле-
ментарным к соответствующему кодону мРНК, причем оба они анти-
параллельны в своей комплементарности.
Тщательный анализ нуклеотидной последовательности разных тРНК
показал, что все они содержат одинаковый 5'-концевой нуклеотид – ГМФ –
со свободной 5'-фосфатной группой. Адапторная функция молекул тРНК
заключается в связывании каждой молекулы тРНК со своей специфической
аминокислотой. Однако, поскольку между нуклеиновой кислотой и спе-
цифической функциональной группой аминокислот нет соответствия и
сродства, эту функцию узнавания, точнее, посредника между тРНК и
аминокислотой, должна выполнять белковая молекула фермента. Взаимо-
действие между аминоацил-тРНК-синтетазой и тРНК принято обозначать
как «вторичный генетический код», подчеркивая тем самым его ключевую
роль в обеспечении точности синтеза белка, причем правила кодирования
являются, вероятнее всего, более сложными, чем правила «первичного»
генетического кода (см. далее).
Матричная РНК
Ранее было указано на необходимость участия предобразованной молекулы
РНК для правильной расстановки аминокислот в полипептидной цепи. Еще
сравнительно недавно предполагали, что такой молекулой может служить
рРНК. Это предположение как будто бы подкреплялось и опытами по
заражению клеток Е. coli ДНК фага. Оказалось, что немедленно после
518
заражения синтез нормальных клеточных ДНК прекращается и начинается
интенсивный синтез фаговой ДНК. Более того, весь белоксинтезирующий
аппарат клеток перестраивался на синтез только фаговых белков. Состав
синтезированных фаговых белков отличался от состава белков бактерии.
Было высказано предположение, что при заражении фагом, очевидно,
меняется последовательность оснований в РНК, однако и эта гипотеза не
подтвердилась. По мнению ряда известных ученых, предобразованная
РНК, необходимая для изменения типа синтезируемого белка, должна
обладать высокой скоростью обновления своего состава, т.е. молекула
такой РНК должна синтезироваться и распадаться с такой скоростью,
чтобы обеспечить подобную скорость обновления нуклеотидного состава.
Фактически рРНК оказалась метаболически малоактивной и весьма ста-
бильной, поэтому становилось очевидным, что она не может служить
в качестве матрицы.
В ряде лабораторий (в частности, в лаборатории С. Бреннера) были
получены данные о возможности существования в клетках в соединении
с рибосомами короткоживущей РНК *, названной информационной (иРНК).
Сейчас она обозначается как матричная РНК (мРНК), потому что ее роль
заключается в переносе информации от ДНК в ядре (где она синтезируется
под действием ДНК-зависимой РНК-полимеразы) до цитоплазмы, где она
соединяется с рибосомами и служит матрицей, на которой осуществляется
синтез белка. Эта блестящая гипотеза затем экспериментально была до-
казана в лаборатории М. Ниренберга. При изучении влияния различных
фракций клеточной РНК на способность рибосом, выделенных из Е. coli,
к синтезу белка было установлено, что некоторые из них стимулировали
включение
14
С-аминокислот в синтезируемый полипептид. Добавление
синтетического полинуклеотида, в частности полиуридиловой кислоты
(поли-У), в белоксинтезирующую систему приводило к включению в
синтезирующуюся белковую молекулу единственной аминокислоты –
фенилаланина. Поли-У вызывал синтез в бесклеточной системе необычного
полипептида полифенилаланина. Таким образом, искусственно синтези-
рованный полирибонуклеотид, добавленный к препаратам рибосом, вклю-
чавшим известные к тому времени факторы белкового синтеза и источники
энергии, вызывал синтез определенного, запрограммированного полипеп-
тида.
Эти опыты открыли возможность для экспериментальной расшифровки
всего генетического кода, при помощи которого информация от РНК
передается на синтезируемый белок. Последовательность нуклеотидов РНК
реализуется в специфической последовательности аминокислот синтези-
руемой полипептидной цепи. Опыты М. Ниренберга свидетельствуют
также о том, что не рибосома и не рибосомная рРНК являются матрицей,
на которой синтезируются специфические белки, а эту роль выполняют
поступающие извне матричные РНК. Итак, ДНК передает информацию на
РНК, которая синтезируется в ядре и затем поступает в цитоплазму; здесь
РНК выполняет матричную функцию для синтеза специфической белковой
молекулы. Матричная гипотеза белка, как и других полимерных молекул
ДНК и РНК (см. ранее), в настоящее время получила подтверждение. Ее
правомочность была доказана в экспериментах, которые обеспечивали
точное воспроизведение первичной структуры полимерных молекул. Этот
* Впервые на возможность существования в клетках быстро обменивающейся молекулы
РНК было указано в работах А.Н. Белозерского и А.С. Спирина.
519
синтез в отличие от малоуправляемого химического синтеза отличался не
только высокой скоростью и специфичностью, но и направленностью
самого процесса в строгом соответствии с программой, записанной в
линейной последовательности молекулы матрицы.
Природа генетического кода
Проблема синтеза белка тесно связана с понятием генетического кода.
Генетическая информация, закодированная в первичной структуре ДНК,
еще в ядре переводится в нуклеотидную последовательность мРНК. Вопрос
о том, каким образом эта информация передается на белковую молекулу,
долго не был ясен. Первые указания на существование прямой линейной
зависимости между структурой гена и его продуктом – белком можно найти
у Ч. Яновского. В серии изящных опытов с применением методов гене-
тического картирования и секвенирования он показал, что порядок из-
менений в структуре мутантного гена триптофансинтазы у Е. coli точно
соответствует порядку изменений в аминокислотной последовательности
молекулы белка-фермента.
Эукариотические клетки обладают особым механизмом точного и эф-
фективного перевода последовательности мРНК в соответствующую по-
следовательность аминокислот синтезируемого белка. Сами молекулы
мРНК не имеют сродства к аминокислотам, и было высказано пред-
положение о том, что для перевода нуклеотидной последовательности
мРНК на аминокислотную последовательность белков необходим некий
посредник, названный адаптором (см. ранее). Молекула адаптора должна
быть наделена способностью узнавать нуклеотидную последовательность
специфической мРНК и соответствующую аминокислоту. Клетка, имеющая
подобную адапторную молекулу, может встраивать каждую аминокислоту
в подходящее место полипептидной цепи в строгом соответствии с нуклео-
тидной последовательностью мРНК. Остается, таким образом, незыб-
лемым положение, что сами по себе функциональные группы аминокислот
не способны вступать в контакт с матрицей и информационной мРНК.
Было показано, что в нуклеотидной последовательности мРНК имеются
кодовые «слова» для каждой аминокислоты – генетический код. Вероятнее
всего, он заключается в определенной последовательности расположения
нуклеотидов в молекуле ДНК. Вопросы о том, какие нуклеотиды от-
ветственны за включение определенной аминокислоты в белковую мо-
лекулу и какое количество нуклеотидов определяет это включение, ос-
тавались нерешенными до 1961 г. Теоретический разбор показал, что код не
может состоять из одного нуклеотида, поскольку в этом случае только
4 аминокислоты могут кодироваться. Однако код не может быть и
дуплетным, т.е. комбинация двух нуклеотидов из четырехбуквенного «ал-
фавита» не может охватить всех аминокислот, так как подобных ком-
бинаций теоретически возможно только 16 (4
2
= 16), а в состав белка
входит 20 аминокислот. Для кодирования всех аминокислот белковой
молекулы был бы достаточным триплетный код, когда число возможных
комбинаций составит 64 (4
3
= 64).
Из приведенных данных М. Ниренберга становится очевидным, что
поли-У, т.е. РНК, гипотетически содержащая остатки только одного
уридилового мононуклеотида, способствует синтезу белка, построенного из
остатков одной аминокислоты – фенилаланина. На этом основании был
сделан вывод, что кодоном для включения фенилаланина в белковую
молекулу может служить триплет, состоящий из трех уридиловых нуклео-
520
