Артюхов В.Г., Ковалева Т.А., Шмелев В.П. Биофизика
Подождите немного. Документ загружается.

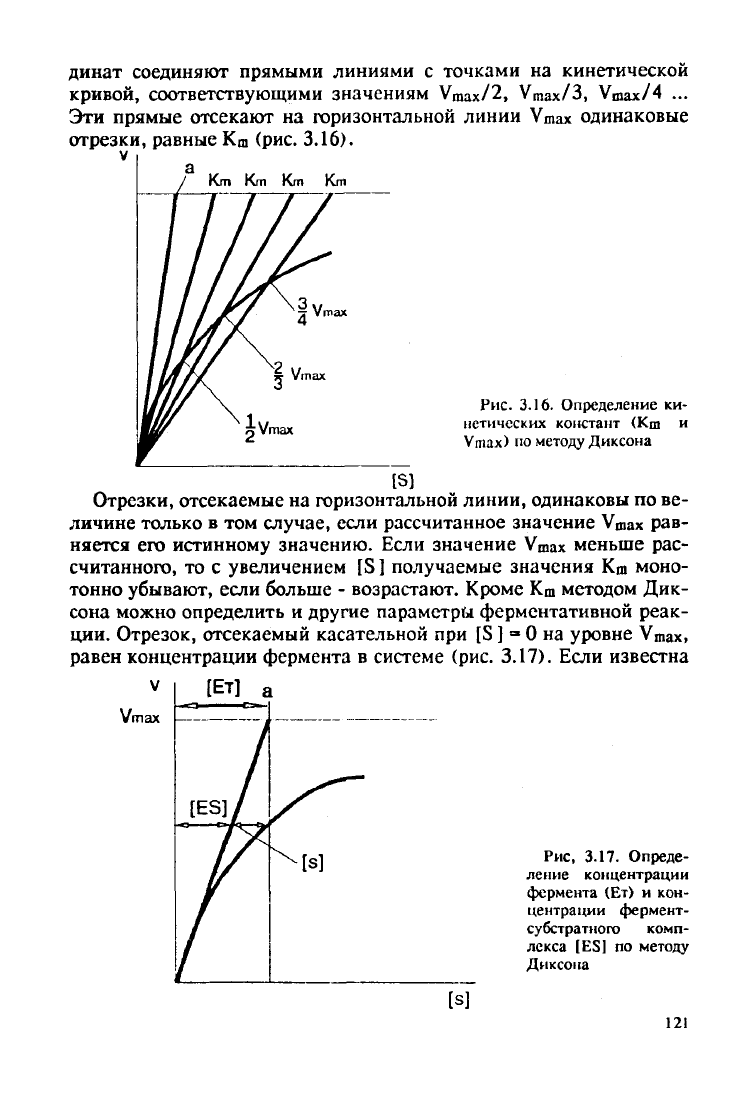
динат соединяют прямыми линиями с точками на кинетической
кривой,
соответствующими значениям
Vmax/2,
Vmax/3,
Vmax/4
...
Эти прямые отсекают на горизонтальной линии
Vmax
одинаковые
отрезки, равные К
ш
(рис.
3.16).
KJTI Km K/n rvn
Рис.
3.16. Определение ки-
нетических констант (Кш и
Vmax)
по методу Диксона
[S]
Отрезки, отсекаемые на горизонтальной линии, одинаковы по ве-
личине только в том случае, если рассчитанное значение
Vmax
рав-
няется его истинному значению. Если значение
Vmax
меньше рас-
считанного, то с увеличением [S ] получаемые значения Km моно-
тонно убывают, если больше - возрастают. Кроме К
ш
методом Дик-
сона можно определить и
другие
параметры ферментативной реак-
ции.
Отрезок, отсекаемый касательной при [S ] = 0 на уровне
Vmax,
равен концентрации фермента в системе (рис.
3.17).
Если известна
Рис,
3.17. Опреде-
ление концентрации
фермента (Ет) и кон-
центрации
фермент-
субстратного комп-
лекса [ES] по методу
Диксона
121

концентрация
фермента в системе, можно проверить правильность
проведения касательной. Расстояние
между
осью ординат и каса-
тельной
дает
значение [ES]. Отрезок
между
кривой и касательной
равен концентрации свободного субстрата [S ].
Каким
бы методом ни определяли или рассчитывали К
ш
и
Vmax,
существует
систематическая ошибка определения, вытекающая из
самого характера этих методов.
Для численного определения величин
Vmax
и К
ш
целесообразно
использовать методы статистической обработки результатов на
ЭВМ,
дающие помимо численных значений достоверные сведения о
величинах статистических ошибок.
Определение констант скоростей ферментативной реакции
Мы
рассмотрели различные графические методы определения К
ш
и
Vmax,
входящих в уравнение Михаэлиса. Но эти параметры опре-
деляются константами скорости элементарных стадий фермента-
тивной
реакции ki и k-i, кг:
ki k
2
E +
S^TES
ilE+P.
k-l k-2
Константу кг можно найти из уравнения кг = Vmax/[Eo]. Кон-
станты скорости ki, k-i, k-2 определить труднее. Однако они
дают
более фундаментальные представления о реальных процессах, про-
исходящих в
ходе
ферментативной реакции. Можно узнать, напри-
мер,
насколько быстро
субстрат
взаимодействует с ферментом, и
сравнить эту величину со скоростью распада фермент-субстратного
комплекса.
Поэтому целесообразно рассмотреть эксперименталь-
ные
методы определения этих параметров.
Метод Слэтера
Строят график зависимости Km от v и получают прямую с накло-
ном
1/ki [Е] (рис.
3.18),
где k-i - константа диссоциации фермент-
субстратного комплекса. Данный метод применяют в особых
случа-
ях, когда можно в условиях эксперимента изменить кг (ингибитор,
связывающийся с субстратом без влияния на ki).
Метод Гутфройнда и Рафтона
Этот метод можно применять, если имеется специальная аппара-
тура
для изучения предстационарной кинетики. Для того чтобы по-
нять
сущность данного метода, надо провести анализ накопления
продукта ферментативной реакции во времени (рис.
3.19).
В мо-
122
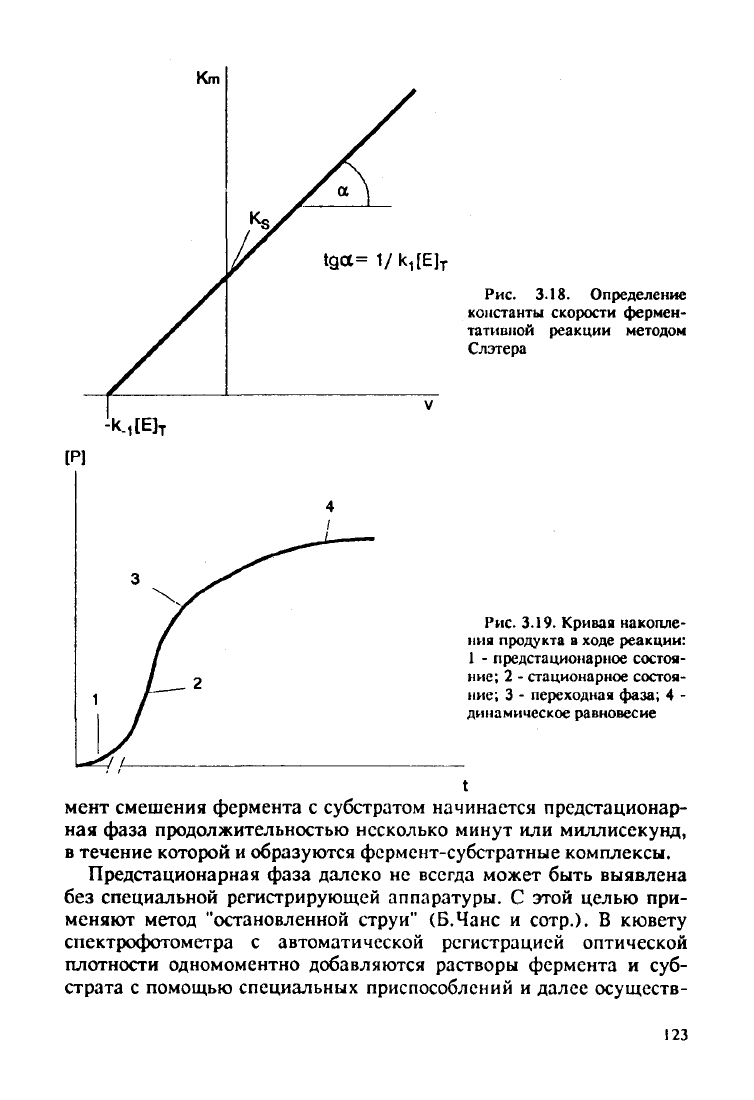
Km
tga=i/k
1
[E]
T
Рис.
3.18.
Определение
константы скорости фермен-
тативной реакции методом
Слэтера
Рис.
3.19. Кривая накопле-
ния
продукта
в
ходе
реакции:
1
-
предстационарное состоя-
ние;
2 -
стационарное состоя-
ние;
3 -
переходная фаза;
4 -
динамическое равновесие
мент смешения фермента
с
субстратом начинается предстационар-
ная
фаза продолжительностью несколько минут или миллисекунд,
в течение которой и образуются фермент-субстратные комплексы.
Предстационарная фаза далеко
не
всегда может быть выявлена
без специальной регистрирующей аппаратуры.
С
этой целью при-
меняют метод "остановленной струи" (Б.Чане
и
сотр.).
В
кювету
спектрофотометра
с
автоматической регистрацией оптической
плотности одномоментно добавляются растворы фермента
и суб-
страта
с
помощью специальных приспособлений
и
далее осуществ-
123
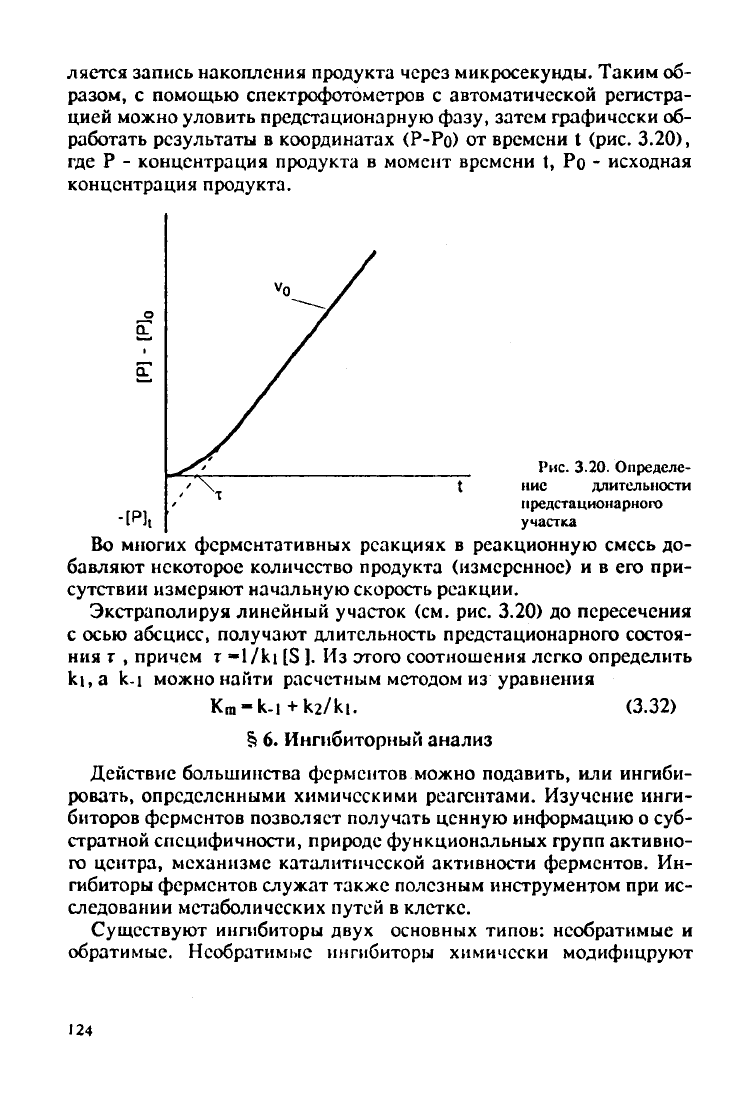
ляется запись накопления продукта через микросекунды. Таким об-
разом,
с помощью спектрофотометров с автоматической регистра-
цией
можно уловить предстационарную фазу, затем графически об-
работать
результаты
в координатах (Р-Ро) от времени t (рис.
3.20),
где Р - концентрация продукта в момент времени t, Pn - исходная
концентрация
продукта.
о
Рис.
3.20. Определе-
\ t нис длительности
нредстационарного
участка
Во многих ферментативных реакциях в реакционную смесь до-
бавляют некоторое количество продукта (измеренное) и в его при-
сутствии измеряют начальную скорость реакции.
Экстраполируя линейный участок (см. рис. 3.20) до пересечения
с осью абсцисс,
получают
длительность предстационарного состоя-
ния
г , причем т «1/ki [S ]. Из этого соотношения легко определить
ki, a k-i можно найти расчетным методом из уравнения
K
m
-k-i+k2/ki.
(3.32)
I» 6. Ингибиторный анализ
Действие большинства ферментов можно подавить, или ингиби-
ровать, определенными химическими реагентами. Изучение инги-
биторов ферментов позволяет получать ценную информацию о суб-
стратной специфичности, природе функциональных групп активно-
го центра, механизме каталитической активности ферментов. Ин-
гибиторы ферментов
служат
также полезным инструментом при ис-
следовании метаболических путей в клетке.
Существуют
ингибиторы
двух
основных типов: необратимые и
обратимые. Необратимые ингибиторы химически модифицруют
124

важные для проявления активности функциональные группы моле-
кулы фермента. Например, иодацетамид - необратмый ингибитор,
взаимодействует с SH-группами цистеина (ингибитор папаина,
глицеральдегидрофосфатдегидрогеназы).
Обратимое ингибирование бывает
двух
типов: конкурентное и
неконкурентное. Конкурентный ингибитор конкурирует с субстра-
том за связывание с активным центром, по своей
структуре
напоми-
нает
субстрат
данного фермента. Но в отличие от субстрата конку-
рентный ингбитор не подвергается ферментативному превращению
ki
E + I^EI.
k-i
Классическим примером конкурентного ингибирования является
ингибирование сукцинатдегидрогеназы малоновой кислотой. В этом
случае
химические структуры ингибитора и субстрата аналогичны.
Ингибитор связывается с той же группой активного центра, что и
субстрат,
и занимает участок связывания субстрата, поэтому актив-
ность фермента уменьшается. Здесь
субстрат
и его аналог (ингиби-
тор) конкурируют за участок связывания на ферменте.
Конкурентное ингибирование может быть вызвано не только
аналогами субстрата, но и другими реагентами, химическая струк-
тура
которых отличается от субстрата, но они
могут
реагировать с
функциональными группами активного центра. В активном центре
фермента различают центр связывания и каталитический центр
(способствующий превращению субстрата). При конкурентном ин-
гибировании ингибитор может связываться с обоими участками, но
влиять на группы центра связывания. Ингибитор может также вза-
имодействовать только со связующим участком, при этом образует-
ся
комплекс EI, который препятствует превращению субстрата.
Конкурентные ингибиторы изменяют (увеличивают) К
ш
:
Km'-Km (1+7^7).
(3.33)
где К
ш
- истинное значение константы Михаэлиса до влияния инги-
битора; Ki - константа ингибирования.
При
конкурентном ингибировании
Vmax
не изменяется, К
ш
уве-
личивается; при линеаризации в координатах Лайнуивера-Берка
можно получить серию веерно расположенных прямых (рис.
3.21):
Ki ^-,
(3.34)
А./Ц
К
т
-\
125
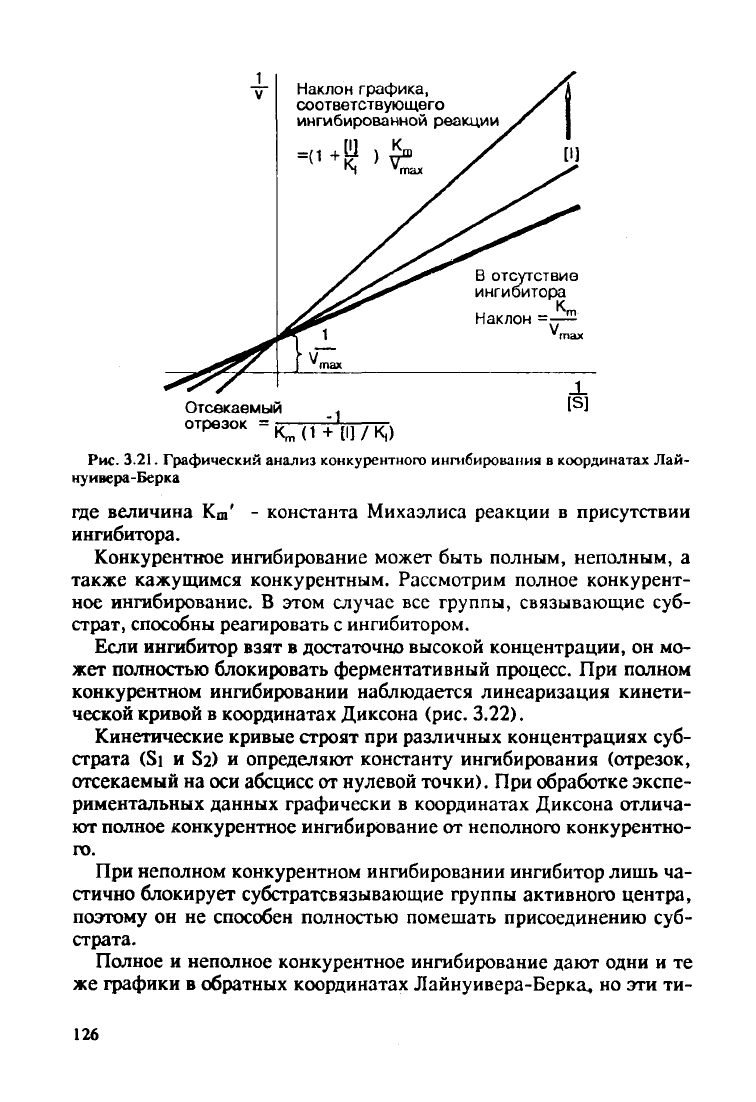
Наклон графика,
соответствующего
ингибированной
реакции
к,
В отсутствие
ингибитора
Наклон =—-
Отсекаемый
отрезок
= ;
-1
[S]
K
m
(1 +
[I]/K,)
Рис.
3.21. Графический анализ конкурентного ингибировання в координатах Лай-
нуивера-Берка
где величина К
ш
' - константа Михаэлиса реакции в присутствии
ингибитора.
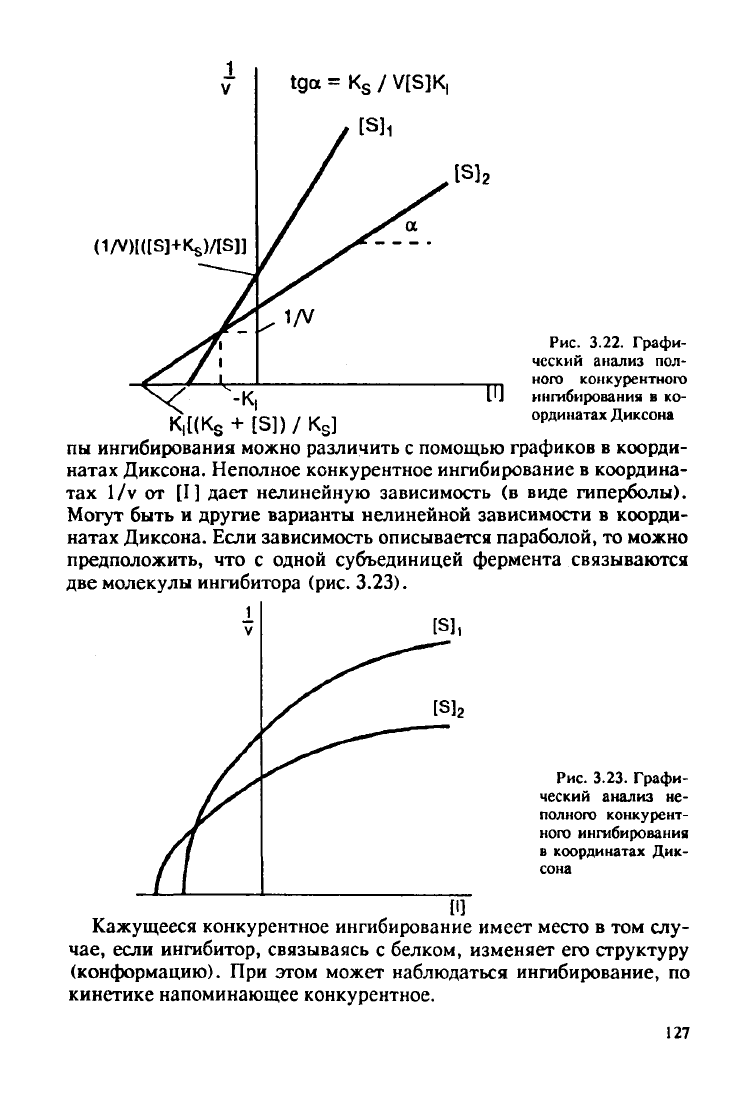
Конкурентное ингибирование может быть полным, неполным, а
также кажущимся конкурентным. Рассмотрим полное конкурент-
ное ингибирование. В этом
случае
все группы, связывающие суб-
страт, способны реагировать с ингибитором.
Если ингибитор взят в достаточно высокой концентрации, он мо-
жет полностью блокировать ферментативный процесс. При полном
конкурентном ингибировании наблюдается линеаризация кинети-
ческой кривой в координатах Диксона (рис.
3.22).
Кинетические кривые строят при различных концентрациях суб-
страта (Si и S2) и определяют константу ингибирования (отрезок,
отсекаемый на оси абсцисс от нулевой точки). При обработке экспе-
риментальных данных графически в координатах Диксона отлича-
ют полное конкурентное ингибирование от неполного конкурентно-
го.
При
неполном конкурентном ингибировании ингибитор лишь ча-
стично блокирует субстратсвязывающие группы активного центра,
поэтому он не способен полностью помешать присоединению суб-
страта.
Полное
и неполное конкурентное ингибирование
дают
одни и те
же графики в обратных координатах Лайнуивера-Берка, но эти ти-
126
tga
= K
s
/ V[S]K,
II]
Рис.
3.22. Графи-
ческий анализ пол-
ного конкурентного
ингибирования в ко-
ординатах
Диксона
K,[(K
S
+ [S]) / K
s
]
пы
ингибирования можно различить
с
помощью графиков
в
коорди-
натах Диксона. Неполное конкурентное ингибирование
в
координа-
тах
1/v от [I]
дает
нелинейную зависимость
(в
виде гиперболы).
Могут
быть
и
другие
варианты нелинейной зависимости
в
коорди-
натах Диксона. Если зависимость описывается параболой,
то
можно
предположить,
что с
одной субъединицей фермента связываются
две молекулы ингибитора (рис.
3.23).
[S],
Рис.
3.23. Графи-
ческий анализ не-
полного конкурент-
ного ингибирования
в координатах Дик-
сона
[I]
Кажущееся конкурентное ингибирование имеет место
в том слу-
чае, если ингибитор, связываясь
с
белком, изменяет
его
структуру
(конформацию).
При
этом может наблюдаться ингибирование,
по
кинетике напоминающее конкурентное.
127
Таким образом, в некоторых случаях причиной ингибирующего
эффекта
является изменение нативной конформации белка, а не
изменение модифицированной группы. При кажущемся конкурент-
ном
ингибировании возможно также, что ингибитор,
будучи
свя-
занным
с белком, препятствует активированному действию суб-
страта на каталитически активную конформацию. Ингибитор как
бы возвращает молекулу фермента в неактивное состояние. Эти
представления были подтверждены экспериментальными данными
о том, что мочевина и гуанидинхлорид, которые влияют на конфор-
мацию белков, конкурентно ингибируют некоторые ферменты.
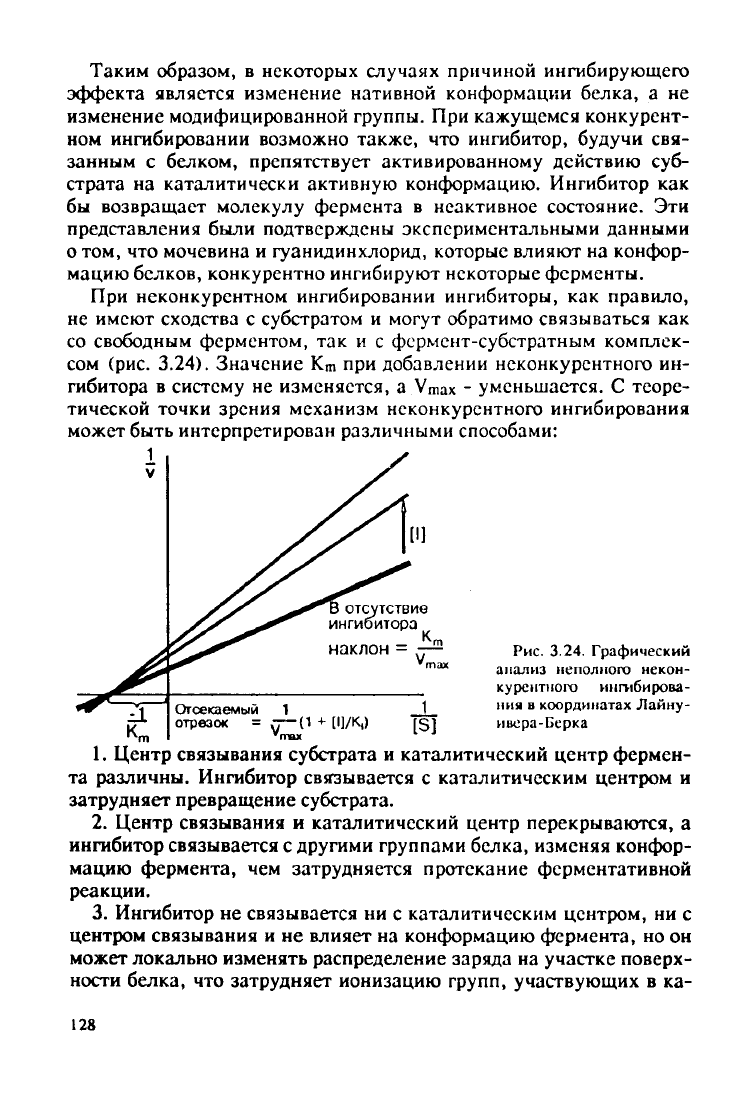
При
неконкурентном ингибировании ингибиторы, как правило,
не имеют
сходства
с субстратом и
могут
обратимо связываться как
со свободным ферментом, так и с фермент-субстратным комплек-
сом (рис.
3.24).
Значение К
т
при добавлении неконкурентного ин-
гибитора в систему не изменяется, a
Vmax
- уменьшается. С теоре-
тической точки зрения механизм неконкурентного ингибирования
может быть интерпретирован различными способами:
К
Осекаемый
1 I
отрезок
= —
(1
+
[IJ/K.)
]§]
Рис.
3.24. Графический
анализ неполного некон-
курентного
ингибирова-
ния
в
координатах
Лайну-
ннсра-Берка
1. Центр связывания субстрата и каталитический центр фермен-
та различны. Ингибитор связывается с каталитическим центром и
затрудняет превращение субстрата.
2. Центр связывания и каталитический центр перекрываются, а
ингибитор связывается с другими группами белка, изменяя конфор-
мацию фермента, чем затрудняется протекание ферментативной
реакции.
3. Ингибитор не связывается ни с каталитическим центром, ни с
центром связывания и не влияет на конформацию фермента, но он
может локально изменять распределение заряда на участке поверх-
ности белка, что затрудняет ионизацию групп,
участвующих
в ка-
128

талитическом акте реакции. Например, одновалентные ионы таким
путем ингибируют фермент фумаразу
v =
(3.35)
или
[Л
'~
I/'
'
max
(3.36)
-1
где
V'max
- максимальная скорость реакции в присутствии ингиби-
тора.
Неконкурентное ингибирование, как и конкурентное, бывает
трех
видов: полное, неполное и кажущееся. Для полного неконку-
рентного ингибирования можно предположить
следующую
схему
реакции:
E + S -*ES-»E + P;
E + I ^ EI;
ES + I Z
При
неконкурентном ингибировании
субстрат
и ингибитор кон-
курируют не за участок связывания, а за конформацию, необходи-
мую для проявления активности фермента.
При
полном неконкурентном ингибировании.ингибитор и суб-
страт не влияют на связывание
друг
друга
с ферментом, но комп-
лексы фермента, содержащие ингибитор, совершенно не активны.
Полное
неконкурентное ингибирование в координатах Диксона ли-
неаризуется (рис.
3.25):
Рис. 3.25.
Графиче-
ский
анализ
полного
не-
конкурентного
ингибиро-
вамия
в
координатах
Диксона
(I)
129
ES +
I^TESI;
V'max
=
J£± (3.37)
При
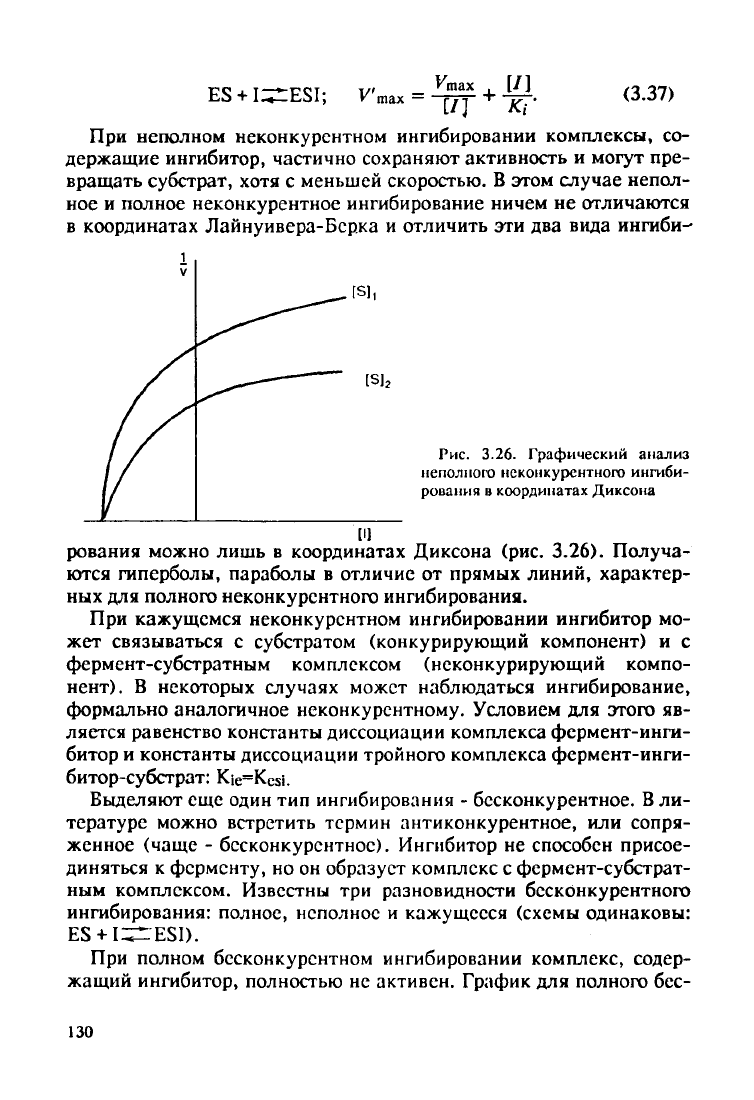
неполном неконкурентном ингибировании комплексы, со-
держащие ингибитор, частично сохраняют активность и
могут
пре-
вращать
субстрат,
хотя
с меньшей скоростью. В этом
случае
непол-
ное и полное неконкурентное ингибирование ничем не отличаются
в координатах Лайнуивера-Бсрка и отличить эти два вида ингиби-
Рис.
3.26. Графический анализ
неполного неконкурентного ингиби-
рооания в
координатах
Диксона
[I]
рования можно лишь в координатах Диксона (рис.
3.26).
Получа-
ются гиперболы, параболы в отличие от прямых линий, характер-
ных для полного неконкурентного ингибирования.
При
кажущемся неконкурентном ингибировании ингибитор мо-
жет связываться с
субстратом
(конкурирующий компонент) и с
фермент-субстратным комплексом (неконкурирующий компо-
нент).
В некоторых
случаях
может наблюдаться ингибирование,
формально аналогичное неконкурентному. Условием для этого яв-
ляется равенство константы диссоциации комплекса фермент-инги-
битор и константы диссоциации тройного комплекса фермент-инги-
битор-субстрат:
Kie=K
CS
i.
Выделяют
еще один тип ингибирования - бесконкурентное. В ли-
тературе
можно встретить термин антиконкурентное, или сопря-
женное (чаще - бесконкурентное). Ингибитор не способен присое-
диняться к ферменту, но он
образует
комплекс с фермент-субстрат-
ным комплексом. Известны три разновидности бесконкурентного
ингибирования: полное, неполное и кажущееся (схемы одинаковы:
При
полном бесконкурентном ингибировании комплекс, содер-
жащий ингибитор, полностью не активен. График для полного бес-
130
