Андреева А.В. Основы физикохимии и технологии композитов
Подождите немного. Документ загружается.

a)
6)
в)
I ff
!O
If
!B
?5
JO
JS
1O
<tf
fff
SS
£0 SS
7ff
7f
fff
'Sf
SO
Axo>*«jv:i»
»<<v»:j>
J \ ff
I
ОТ I
.Of
\
«
\
W
\
ИГ
f
f
-is
if
gfjff
л
*ff
*fjff
fs
so
ef
re
7S sa
sf
so
iV
v"
""j*
Vi
V.JJC
Puc.
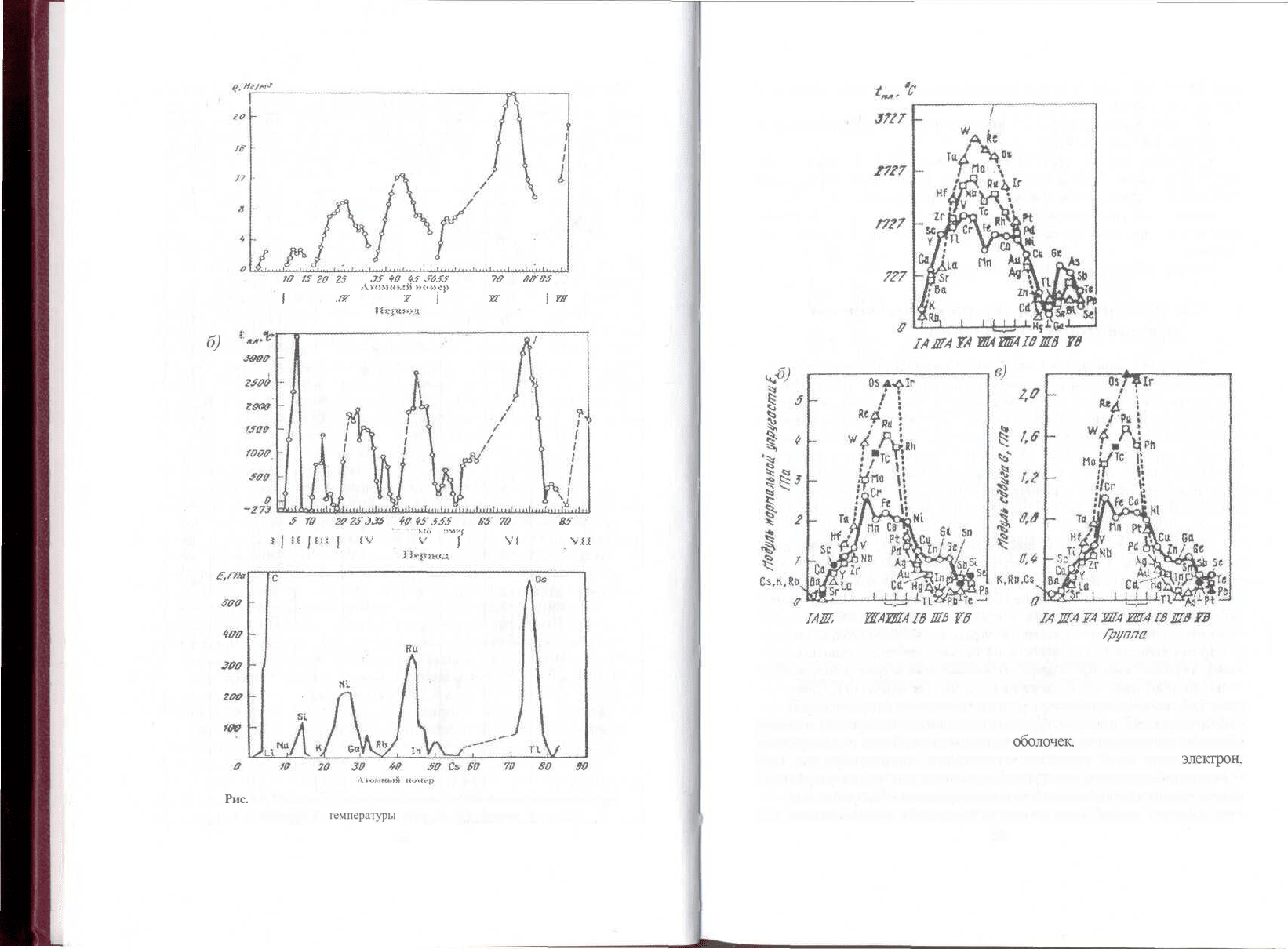
2.2. Изменение свойств элементов в зависимости от атомного номера:
а - плотности; б -
температуры
плавления: е - модуля упругости
24
а)
LAMA
ТА
ШШ1В
MS
78
ТА
Ж
А 7А
WA
МА1В
ШЗ
70
Группа
Группа
Рис. 2.3. Изменение свойств переходных металлов от положения в периодической
таблице: а - температуры плавления; б - модуля упругости; в - модуля сдвига
Периодичность химических, оптических, электрических и магнитных
свойств атомов различных элементов в зависимости от Z связана со сход-
ным строением внешних электронных
оболочек,
определяющих эти свой-
ства. Эта периодичность сохраняется и для ионов. Теряя один
электрон,
атом по ряду свойств становится подобным атомам предыдущей группы.
Таким образом, периодическая таблица может быть представлена
как связное целое и объяснена, исходя из электронного строения ато-
25
мов.
На основании анализа Периодической системы Менделеева можно
сделать следующие заключения.
• В каждой подгруппе (А) по мере увеличения Z наблюдается уси-
ление металлических свойств.
• В каждом периоде с увеличением Z наблюдается ослабление металли-
ческих и усиление неметаллических свойств (ослабление энергии связи
внешних электронов с ядром при переходе от периода к периоду).
• Взаимное расположение элементов
s,p,dj
подгрупп в каждой
группе отвечает повышению электроотрицательности элементов слева
направо.
• Все неметаллы, кроме Н, Не -
р-элементы.
2.2. Электронная структура и типы связей
элементов и соединений
Электроны, принадлежащие к самой внешней оболочке (оболочке
с наибольшим квантовым числом), называются валентными. Именно
они принимают участие во взаимодействии между атомами системы.
Все химические связи возникают потому, что электроны одновременно
могут находиться около двух ядер. Химическое взаимодействие между
атомами происходит путем обмена или обобществления валентных
электронов таким образом, что каждый атом системы приобретает ус-
тойчивую электронную конфигурацию. Возникающие при этом типы
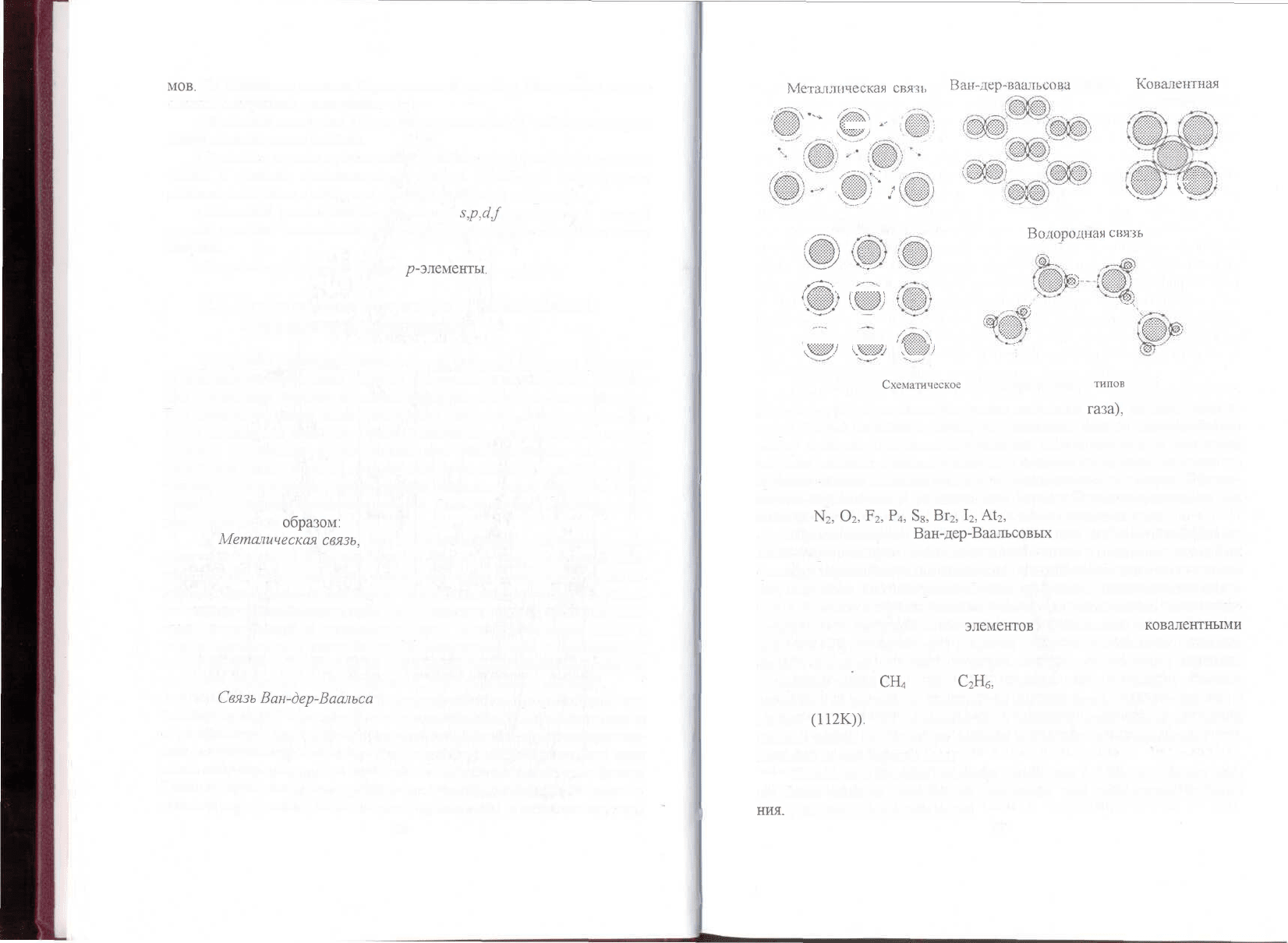
связи схематично показаны на рис. 2.4. Они могут быть классифициро-
ваны следующим
образом:
1.
Металическая
связь,
при которой валентные электроны поки-
дают свои атомы и образуют (внутри твердого тела) свободный элек-
тронный газ. Она возникает в том случае, когда атомы имеют мало ва-
лентных электронов по сравнению со свободными валентными орбита-
ми и когда эти электроны слабо удерживаются ядром. Свободные элек-
троны ответственны за характерные черты металлов: высокую тепло- и
электропроводность и пластичность. Металлическая связь устанавливается
между атомами, имеющими сверх устойчивых конфигураций один или два
электрона (например, элементы групп IA, ПА и переходные металлы).
2.
Связь
Ван-дер-Ваалъса
(молекулярная) не требует обмена или
"обобществления" электронов и может устанавливаться между атомами
с устойчивыми электронными конфигурациями. Центры положитель-
ных и отрицательных зарядов в атоме могут не совпадать, поэтому атом
ведет себя как диполь, что приводит к слабым силам взаимодействия.
Таким образом, связь Ван-дер-Ваалъса - это взаимодействие наведенных
диполей между собой. Если внешние орбиты всех атомов в молекулах
26
Металлическая
связь
Ван-дер-ваальсова
связь
Ковалентная
связь
О
\-~*
-'Й
5
^
.
)
i
I
-
\4SS8>/
'ЦК'"
/
^Щ/
VX
Ионная связь
(§)<а
С'
Водородная
связь
iV
(Ш
щ
ш
Н) (Ш
'Ш;
ЗШ>
«Ж
Шу/
Рис. 2.4.
Схематическое
изображение различных
типов
связи
заполнены (образуется конфигурация инертного
газа),
то электроны не
могут близко подойти к ядрам, что вызывает слабое взаимодействие
между атомами. Это является причиной низких температур плавления
твердых веществ и низких температур кипения жидкостей, которые со-
храняют многие свойства молекул в парообразном состоянии. Для эле-
ментов периодической таблицы силы Ван-дер-Ваальса характерны для
молекул
N
2
,
O
2
,
F
2
,
P
4
,
S
8
,
Br
2
,I
2
,
At
2
,
а также инертных газов.
При определении
Ван-дер-Ваальсовых
сил особенно важными яв-
ляются три фактора: число электронов, размер и форма молекул. Эти
факторы справедливы для элементов и соединений, хотя для соедине-
ний возможно большее разнообразие, например, температуры плавле-
ния и кипения инертных газов возрастают с увеличением числа элек-
тронов (то же справедливо для
элементов
и соединений с
ковалентными
связями). Путем сравнения сходных молекул установлено, что чем
больше молекула, тем более высокую температуру плавления она имеет
(например, метан
СН
4
и этан
С
2
Н
6
,
внешние атомы у которых одинако-
вы (атомы водорода), но температура кипения этана (185К) выше, чем у
метана
(112К)).
На основании двух рассмотренных факторов можно
сделать вывод: температура кипения возрастает пропорционально уве-
личению молекулярного веса.
Вещества с высокой степенью симметрии структуры обычно име-
ют более высокие температуры плавления, чем родственные соедине-
ния,
у которых симметрия ниже.
27

Наиболее важным для технологии примером сил Ван-дер -Ваальса
является сцепление между макромолекулами в термопластических по-
лимерных материалах, когда связь внутри молекулы или цепочки явля-
ется ковалентной.
3. Ковалентная
связь,
при которой валентные электроны обобще-
ствлены определенными атомами так, что каждый из
партнеров
приоб-
ретает устойчивую электронную конфигурацию. Эта направленная
связь приводит к высокому тепло- и электросопротивлению (поскольку
нет свободных электронов) и отсутствию пластичности (поскольку
атомы жестко связаны друг с другом). Ковалентная связь характеризу-
ется тем, что электроны распределены одновременно и приблизительно
равномерно около обоих ядер. Ковалентные связи характерны для эле-
ментов, занимающих промежуточное положение между металлами и
неметаллами, таких как В,С, Si, Ge, As, Sn, Sb, Bi, Se, Те и др. Если
электроны, образующие связь, расположены ближе к одному из двух
атомов, то говорят, что связь имеет ионный характер.
Чистые элементы
могут
затвердевать в виде молекулярных кри-
сталлов, кристаллов с
ковалентными
или металлическими связями. В
этих же формах могут кристаллизоваться и соединения. Кроме того, в
случае соединений разных атомов появляется новая возможность, кото-
рая отсутствует у чистых элементов. Энергия ионизации всех атомов
одного и того же чистого элемента одинакова и электроны распределе-
ны равномерно. В соединениях разных элементов, где в наиболее ус-
тойчивой конфигурации электроны не всегда распределены равномерно
по отношению к связываемым атомам, может возникнуть электрический
диполь. Поскольку два связанных атома могут иметь различные энергии
ионизации, электроны большую часть времени могут находиться вблизи
одного из положительных ядер. Такое разделение зарядов может привести
к возникновению сильных внутримолекулярных сил такого типа, который
не найден у чистых элементов, например ионным типам связи.
4. Ионная связь, при которой валентные электроны так перерас-
пределяются между атомами разного сорта, что атом каждого типа,
приобретая или теряя один или два электрона, получает устойчивую
конфигурацию. Этот тип связи ведет к большим значениям тепло- и
электросопротивления. У ионных монокристаллов возможна небольшая
пластичность. Ионная связь устанавливается в соединениях атомов двух
типов: в одном из них недостает одного или двух электронов для обра-
зования устойчивой конфигурации, а второй имеет один или два элек-
трона сверх устойчивой
конфигурации
(например, NaCl). Эксперимен-
тально найдено, что связь между двумя атомами с сильно различающи-
мися по величине энергиями ионизации обычно гораздо прочнее, чем
28
связь между атомами с близкими энергиями ионизации. Ионный харак-
тер влияет на энергетическую устойчивость химической связи и ее
свойства. Стремление к достижению состояния с минимальной энерги-
ей - один из факторов, которые определяют, какие химические превра-
щения
будут
происходить. Чем прочнее связь, тем большее количество
энергии требуется для разрушения этой связи и образования другого
соединения. Ионные связи более устойчивы, чем
ковалентные
и ионный
характер связи влияет на ее химические свойства.
В ионных кристаллах характерная
для
металлов подвижность
электронов отсутствует. Это означает, что у ионных кристаллов нельзя
ожидать появления металлических свойств. Ионные
вещества,
например
LiF,
NaCl,
образуют кристаллы правильной формы с четкими гранями.
Чистые кристаллы таких твердых веществ обычно прозрачны и бес-
цветны, но они могут быть окрашены очень небольшими добавками
примесей. Такое же действие оказывают дефекты, имеющиеся в кри-
сталлической решетке. Большинство ионных кристаллов имеют высо-
кие температуры плавления.
Для соединений характерен еще один новый вид связи - водород-
ная связь.
5. Водородная связь - тип связи, промежуточный между валентным и
невалентным межатомным взаимодействием. Водородная связь может об-
разоваться в соединениях при наличии атома водорода между двумя элек-
троотрицательными атомами - фтора, азота, кислорода и, реже, хлора. В
результате образуется устойчивый комплекс, в котором атом водорода иг-
рает роль мостика, соединяющего фрагменты молекул, причем с одним из
двух атомов
(F,
N, О) фрагмента атом водорода связан
ковалентной
связью,
а с другим - межмолекулярной водородной связью.
В водородной связи атом водорода соединен с двумя другими ато-
мами. Правила возникновения межатомной связи предполагают, что у
атома водорода, использующего только
15-орбиту
для межатомного
взаимодействия, не могут возникнуть две ковалентные связи. Объясне-
ние образования водородной связи базируется на полярной природе
связей F-H, О-Н, N-H. Например, в молекуле
Н
2
О
электронная пара,
образующая связь в группе
О-Н,
смещена к ядру кислорода и удалена
от ядра водорода. Такой частично ионный характер связи О-Н ведет к
тому, что атом водорода приобретает некоторый положительный заряд,
а это позволяет электронам другого атома О приблизиться к протону, если
даже протон уже связан. Образуется вторая, более слабая водородная связь
(на рис. 2.4 для молекулы воды
ковалентная
связь обозначена сплошными
линиями пересекающихся орбит атомов кислорода (большие кружки) и
водорода (маленькие кружки), а водородная - пунктирной линией).
29

I
Одним из условий, определяющих возможность образования
прочных водородных
связей,
является кислотный характер атома водо-
рода. Водородная связь, образованная фтористым водородом - одна из
наиболее прочных. В жидком состоянии не существует отдельных мо-
лекул
HF
- они образуют группировки молекул
(HF)
X
.
Газообразный
фтористый водород помимо обычных молекул
HF,
содержит молекулы
H
2
F
2
,
H
3
F
3
,...,
H
6
F
6
.
Энергия этой связи по величине находится между
Ван-дер-Ваальсовыми
и
ковалентными
связями.
Водородные связи играют важную роль в определении таких
свойств, как растворимость, температура плавления и температура ки-
пения, и влияют на форму и устойчивость кристаллической решетки.
Водородные связи могут быть как межмолекулярными так и внутримо-
лекулярными, например, они могут приводить к объединению карбок-
сильных групп с образованием циклических структур. Водородные свя-
зи являются одним из факторов, стабилизирующих глобулярную струк-
туру молекул белков, которая определяет функционирование белков в
живых клетках. Они же в значительной степени влияют на свойства
древесины и бумаги, построенных из волокон целлюлозы, отвечают за
уникальную структуру нуклеиновых кислот и др.
Электронное строение и типы связей элементов периодической
системы - ключ к пониманию структуры и свойств простых и сложных
веществ, образованных этими элементами. Два или более атомов распо-
лагаются друг около друга так, как это энергетически выгодно. Это
справедливо независимо от того, сильно или слабо связана группа ато-
мов, содержит эта группа лишь несколько или
10
23
атомов, является
расположение атомов упорядоченным (как в кристалле) или неупорядо-
ченным (как в жидкости). Группа атомов устойчива тогда и только то-
гда, когда энергия атомов, расположенных вместе, ниже, чем у отдель-
ных атомов. Единственной физической причиной конкретной кристал-
лической структуры любого элемента и его модификаций является пе-
рекрытие валентных и
подвалентных
оболочек его атомов, приводящее
к образованию определенных межатомных связей. Число протяжен-
ность и симметрия
орбиталей
атомов данного конкретного элемента
полностью определяют число,
длин}',
ориентировку и энергию меж-
атомных связей, образующихся в результате перекрытия этих орбита-
лей, а следовательно, размещение атомов в пространстве, т.е. кристал-
лическую структуру, основные физико-химические свойства элемента.
На Земле наиболее распространены химические элементы первого,
второго и третьего периодов системы Д. И. Менделеева. Зависимость
распространения элементов от порядкового номера показывает, что
четно-четные элементы (по числу протонов и нейтронов в ядре) распро-
странены шире и составляют 60% всех элементов (или ядер), тогда как
четно-нечетные или нечетно-четные составляют 36%, а нечетно-
нечетные - 4%. Самые распространенные на Земле химические элемен-
ты О, Si, S, Fe, Mg являются четно-четными. Именно нечетно-
нечетными и нечетно-четными элементами оказались последние откры-
тия At, Fr, Pm, Tc.
В современной технологии композиционных материалов широко
используются достижения
элементоорганической
химии, связывающей
органическую и неорганическую химию в единую область знания. Вве-
дение атомов различных элементов в органические молекулы, их моди-
фикация и фазовые превращения являются мощным стимулом создания
материалов с принципиально новыми физико-химическими свойствами.
Электронное строение атомов
диктует
кристаллическое строение
соединения, а изменение электронного состояния атомов при изменении
температуры, давления, концентрации легирующего элемента определя-
ет разнообразные фазовые переходы системы. Полиморфные превраще-
ния, образование твердых растворов,
эвтектик,
химических соединений
и другие фазовые переходы могут происходить в композите как на ста-
дии его технологического проектирования, так и в процессе эксплуата-
ции, определяя функциональные свойства материала. Поэтому при соз-
дании композиционного материала необходимо прогнозировать, анали-
зировать и использовать положительные качества фазовых переходов, про-
исходящих как внутри отдельных компонентов, так и на границах раздела.
зо
31
Глава 3. Фазовые переходы и их влияние
на структуру и свойства материалов
Как отмечалось, межфазное взаимодействие оказывает влияние на
прочность связи компонентов композита, возможность химических ре-
акций и образования новых фаз на границах, формируя такие свойства
как термостойкость, устойчивость к действию агрессивных сред, проч-
ность и другие важные
эксплутационные
характеристики нового мате-
риала. Поэтому при производстве и эксплуатации композитов возникает
актуальная
научная физико-химическая проблема изучения граничных хи-
мических реакций и фазовых переходов в многокомпонентных системах.
3.1. Основные виды фазовых диаграмм
двухкомпонентных
систем
При разработке новых соединений огромное значение имеют фа-
зовые диаграммы состояния, отражающие взаимодействие компонен-
тов, образование твердых растворов, стабилизацию тех или иных фаз,
образование промежуточных соединений и фазовые равновесия.
Фазовая диаграмма изображает зависимость устойчивого фазового
состояния одно- или многокомпонентного вещества от термодинамиче-
ских параметров, определяющих это состояние (температуры, давления,
напряженностей
электрических и магнитных полей и др.) Диаграмма
состояния представляет собой графическое изображение
соотношений
между параметрами состояния системы и ее составом. Для двухкомпо-
нентных систем обычно строят фазовые диаграммы в координатах тем-
пература - состав (при постоянном давлении).
Законы термодинамики определяют условия равновесия фаз и
форму диаграмм состояния. Согласно правилу фаз Гиббса, максималь-
ное число фаз Р, которые могут сосуществовать в химической системе,
плюс число степеней свободы F равно числу компонентов С плюс 2:
P+F=C+2. (3.1)
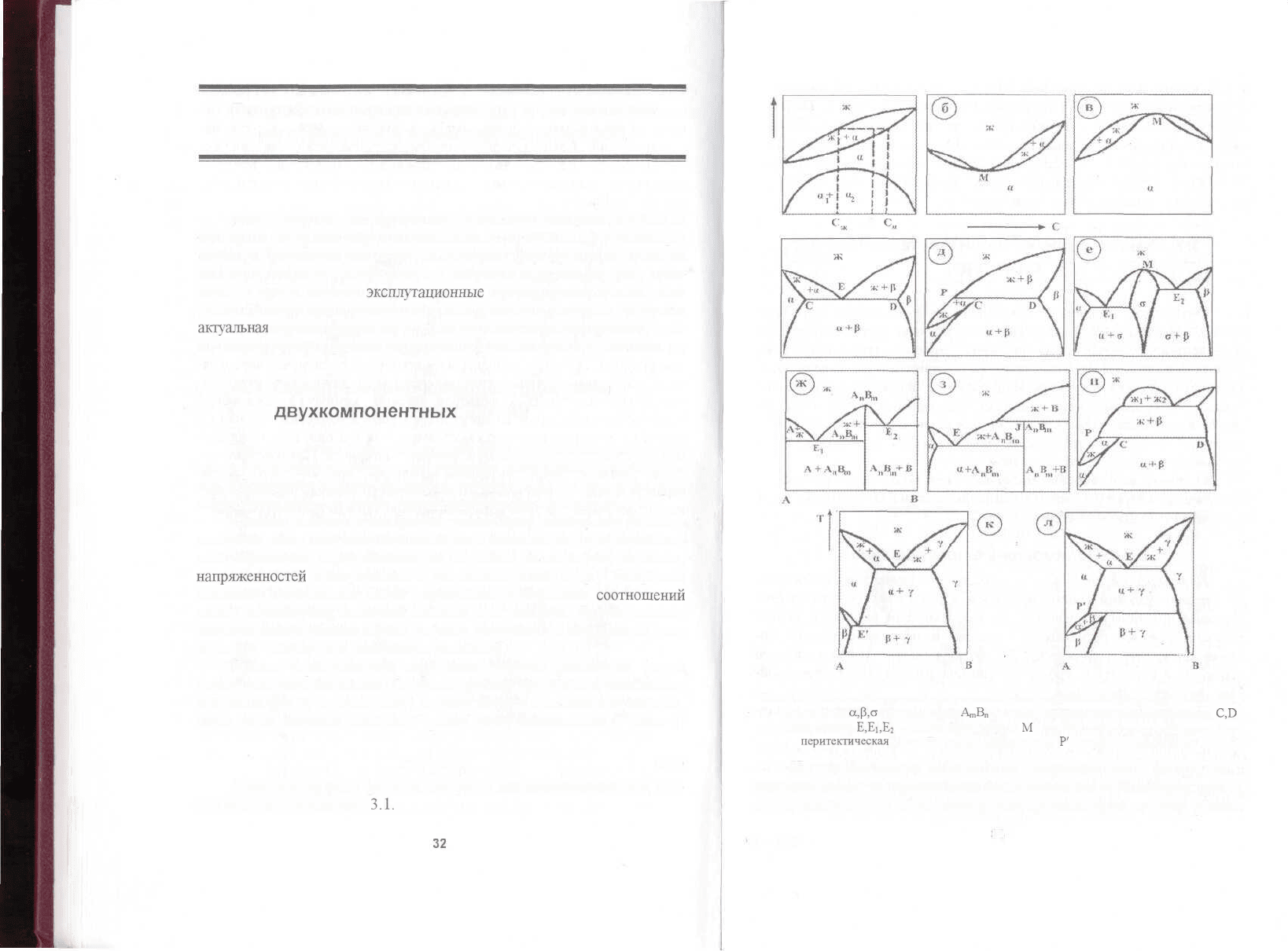
Характерные виды фазовых диаграмм для двухкомпонентных сис-
тем представлены на рис.
3.1.
0
С'.„
С
С„
© .
Рис. 3.1. Диаграммы состояний разных типов в координатах температура (Т) -состав (С):
ж -жидкая фаза;
<х,р,о
-твердые фазы;
АшВ„
- химическое соединение компонентов;
C,D
- тройные точки;
Е,Е
Ь
Е
2
- эвтектические точки;
М
- точки максимума и минимума; Р -
перитектическая
точка; Е' - эвтектоидная точка;
Р'
- перитектоидная точка
Их условно можно разделить на следующие типы: диаграммы с
неограниченной и ограниченной растворимостью компонентов друг в
друге; диаграммы с образованием непрерывного ряда твердых раство-
32
2 -
1352
33

ров с другим компонентом (рис.
3.1,
о-в);
диаграммы с образованием
ограниченных (прерывистых) твердых растворов и механических сме-
сей (рис.
3.1,г-л)
между компонентами (эвтектические и
перитектиче-
ские
превращения (с участием жидкой фазы) и
эвтектоидные
и
перитек-
тоидные
превращения (с участием твердых
растворов));
диаграммы с обра-
зованием химических соединений между компонентами (рис.
3.1,
ж,
з),
диаграммы с полиморфными превращениями и др.
3.2. Фазовые превращения металлических
структур
Физической причиной конкретной кристаллической структуры
любого элемента и его модификаций является перекрытие валентных и
подвалентных
оболочек его атомов, приводящее к образованию опреде-
ленных межатомных связей. Число, протяженность и симметрия орби-
талей атомов данного конкретного элемента полностью определяют
число, длину, ориентировку и энергию межатомных связей, образую-
щихся в результате перекрытия этих орбиталей, а, следовательно, раз-
мещение атомов в пространстве, т.е. кристаллическую структуру, а так-
же физико-химические свойства элемента.
Основные виды фазовых превращений рассмотрим на примере ме-
таллических
структур,
поскольку металлы составляют большую часть
элементов таблицы Менделеева.
3.2.1. Полиморфные превращения
Полиморфные превращения (способность веществ в зависимости
от внешних условий кристаллизоваться в различных формах) имеют
огромное практическое значение, так как, благодаря различной раство-
римости легирующих элементов в высоко- и низкотемпературных мо-
дификациях, путем термической обработки можно получать желаемую
структуру и изменять в огромном диапазоне физико- химические свой-
ства металлических сплавов.
Повышение температуры в связи с увеличением энергии и ампли-
туды тепловых колебаний атомов вызывает полиморфные превращения
многих металлов. Наиболее характерными для металлов являются фазо-
вые переходы плотных гексагональных
(ПГ)
и
гранецентрированных
кубических (ГЦК) упаковок в объемно-центрированную кубическую
(ОЦК) структуру (табл.
3.1).
34
Таблица 3.1. Полиморфные переходы в металлах, происходящие при
нормальном давлении с повышением температуры
Тип
перехода
Плотные гексагональ-
ные
(М§)-ЮЦК
Двойные плотные
гексагональные (La)
-ЮЦК
ГЦК-»ОЦК
ПГ-*ГЦК
Двойные ПГ
н»ГЦК
Сложная
ковалентно-
металлическая
структу-
ра -металл
Ковалентный
кристалл
— металл
Металл
Li,
Na,
Be, Sc, Y, Gd,
Tb,
Dy
(Ho,
Er, Tm,
Lu),
Ti, Zr, Hf,
Tl
Pr,
Nd,
(Pm),
Sm,
(Am,
Cm, Bk,
Cf,
Es,
Md)
Ca, Sr, La, Ce, Yb, Ac, Th, Pu, Mn, Fe
Co
La,Ce, Am, Cm, Bk, Cf, (Es, Fm, Md)
Mn
(p-»y),
U,
Np,
Pu
Sn, Si, Ge (при высоких давлениях)
Число
металлов
16
10
10
1
9
4
3
Примечание:
1.Ряд
переходных металлов (Сг, Mn, Fe, Co) с сильно связан-
ными неспаренными внешними
Зй?-электронами,
а также
лантаниды
и актиниды с
неспаренными электронами глубинных
4/-
и
5/^оболочек
с повышением температуры
испытывают магнитные переходы в последовательности
ферромагнетная
- антифер-
ромагнитная - парамагнитная фаза. 2. В скобках дан прогноз переходов, основанный
на закономерностях электронного строения металлов [4].
Отметим важную закономерность полиморфных превращений в
металлах: если металл имеет ОЦК структуру при ОК или начиная с не-
которой более высокой температуры, то при дальнейшем нагревании
вплоть до
7
га
ОЦК-структура
не испытывает никаких превращений. Ряд
металлов имеют ОЦК структуру при абсолютном ОК (К, Rb, Cs, Fr, Ba,
Ra, Eu, No, V,
Nb,
Та, Pa, Cr, Mo, W).
Единственное "исключение" из этой закономерности превращение
ОЦК
a
-Fe->
ГЦК 5-Fe, происходящее при нагреве выше
911°С,
кото-
рое лежит в основе термической обработки стали и чугуна. Однако при
1394°С
происходит нормальное превращение ГЦК y-Fe
—>
ОЦК 5-Fe,
связанное с термическим расщеплением
Зя*
6
-оболочки.
Уникальный пе-
реход обусловлен наличием у Fe четырех не спаренных 3d- орбиталей,
определяющих магнитный момент на атоме Fe, и двух расщепленных
Зй?-орбиталей.
Перекрытие таких
Зс/'-оболочек
и обусловливает ОЦК
структуру a -Fe при температурах ниже
911°С.
Переход a
-Fe-»
y-Fe
связан с ферромагнитным состоянием железа при температурах ниже
768°С и антиферромагнитным состоянием а
ю
,
(P)-Fe в интервале темпера-
тур
768-911°С.
При
911°С
происходит переход
антиферро-магнитного
ОЦК
а
нм
(P)-Fe в парамагнитное ГЦК y-Fe и, следовательно, это превращение не
представляет исключения из общей последовательности переходов.
2* 35

Движущей силой полиморфных превращений, происходящих при
повышении температуры, является увеличение энергии решетки и ам-
плитуды тепловых колебаний атомов. Например, As, Sb,
Bi.
имеющие
ковалентные
слоистые структуры (вследствие перекрытия валентных р
орбиталей и образования трех
ковалентных
связей в двойных слоях),
при нагреве до плавления из-за разрушения ковалентных связей перехо-
дят в металлическое состояние с ОЦК ближним порядком.
С полиморфным превращением вещества, на основе которого об-
разуется твердый раствор, всегда связано и превращение самого твердо-
го раствора. На рис.
3.1,к,л
приведены диаграммы состояния с наиболее
часто встречающимися вариантами такого превращения. При эвтекто-
идном
превращении (рис.
3.1,к)
температура трехфазного равновесия
(эвтектоидная
точка Е', где твердые растворы а и р, образующиеся на
основе двух модификаций компонента А, взаимодействуют с твердым
раствором у, на основе компонента В) расположена ниже температуры
(Т
п
)
- полиморфного превращения, а область гомогенного твердого рас-
твора на основе низкотемпературной модификации (Р) более узкая, чем
на основе высокотемпературной модификации (а); при
перитектоидном
превращении (рис.
3.1,л)
- наоборот.
3.2.2. Условия образования и виды
твердых растворов
Твердые растворы - однородные (гомогенные) кристаллические
фазы переменного состава в двойных или многокомпонентных систе-
мах. Образование твердых растворов следует рассматривать из первых
принципов, а именно, с позиций возникновения связей между атомами
растворителя и растворяющихся элементов. В зависимости от положе-
ния атомов растворенного элемента различают твердые растворы заме-
щения, внедрения и вычитания.
В твердых растворах замещения растворенное вещество замещает
исходное - атом на атом, ион на ион, молекула на молекулу. При этом
число частиц (атомов, молекул) в элементарной кристаллической ячейке
остается
постоянным.
Один из важнейших факторов, определяющих возможность обра-
зования растворов замещения, - размеры замещающих друг друга ато-
мов. Юм-Розери (1934г.) установил, что если различие в атомных диа-
метрах металлов и веществ с ковалентной связью превышает 15%, то
взаимная растворимость компонентов сильно ограничена и уменьшает-
ся пропорционально увеличению разницы атомных диаметров. В преде-
лах различия атомных диаметров
±15%,
компоненты могут
образовы-
36
вать непрерывные (обычно при
<8%
и одинаковой кристаллической
структуре)
или широкие, но ограниченные области твердых растворов
замещения. В настоящее время чаще используется другой размерный
фактор - межатомное расстояние R. Для химических соединений с ион-
ной связью непрерывные твердые растворы замещения образуются при
всех температурах, если
Aft/R<4-5%.
Если
ДЯ/Л
лежит в пределах от 15
до
20-25%,
то даже при высоких температурах образуются только огра-
ниченные твердые растворы замещения. При
Д/MR
> 20-25% взаимное
растворение по типу замещения отсутствует.
Второй необходимый фактор для образования растворов замеще-
ния - химическое подобие компонентов, в частности, близость типа
химической связи. В качестве параметра, определяющего возможность
образования твердого раствора замещения, используют различие в сте-
пени ионности связи, иногда - разность
электроотрицательностей
ато-
мов замещающих друг друга элементов и др. Непрерывные твердые
растворы замещения образуются между изоморфными металлами, близ-
ко стоящими в таблице Менделеева. В качестве примеров можно привести
системы: Ag-Au,
K-Rb,
Se-Te,
Mo-W,
Au-Cu,
Ge-Si,
Nb-Ta,
Co-Ir,
со-
стоящие из близких компонентов одной группы;
Ir-Pt,
Au-Pt,
Cu-Ni,
Ni-Fe,
Fe-Cr,
состоящих из близких компонентов одного периода; Au-Pd,
Co-Pd,
Fe-Pd,
состоящие из компонентов близких групп и периодов.
Рассмотрим образование растворов замещения на основе модели
перекрывания внешних валентных
^-оболочек,
применительно к важ-
нейшим промышленным металлическим сплавам с плотной кубической
упаковкой: Fe, Co, Ni, Си, а также сплавов на базе металлов с плотной
гексагональной структурой: Mg,
Zn,
Ti, Zr и др.
Перекрытие строго сферических
s-оболочек
ведет к образованию
ГЦК -- структуры типа меди, а перекрытие слегка вытянутых или
сплюснутых сфероидальных
s-оболочек
-- плотных гексагональных
структур. Замещение атома в решетке растворителя, например Ni, с
атомным радиусом
1,24А
и электронной концентрацией
2эл/ат,
боль-
шим атомом легирующего элемента, например Си
(г=1,28А,
1эл/ат),
ве-
дет к оттеснению атомов никеля от узла, занятого атомом меди, и соз-
данию зоны сжатия. Согласно модели перекрывающихся
s-оболочек
происходит совмещение максимумов электронной плотности 4s-
оболочки
атома меди с максимумами
4^
2
-оболочек
атомов никеля. Атом
меди оказывается центром зоны сжатия, быстро убывающей к перифе-
рийным атомам никеля на расстоянии 2-3 постоянных решетки. Ло-
кальный характер изменения длины и энергии межатомных связей во-
круг растворенного атома объясняет реальные отклонения от правила
Вегарда.
постулирующего линейные изменения параметра (или атомно-
го объема) при возрастании доли легирующего элемента.
37

Растворение атомов меньшего размера путем замещения узлов ре-
шетки металла-растворителя с позиций модели жестких сфер, стягивае-
мых электронным газом, объяснить нельзя, поскольку, чем меньше
атом, тем свободнее он должен располагаться в вакантном узле и тем
больше должна быть растворимость. Однако и тут растворимость огра-
ничивается размерным фактором: если атомный радиус "чужого" атома
более чем на 15% меньше атома растворителя, то растворимость исчеза-
ет. Атомы
"
не любят болтаться" в пустоте. С позиций перекрывающих-
ся
^-оболочек
меньший атом стягивает к себе атомы растворителя до
совмещения
максихгумов
электронной плотности их валентных s-
оболочек. Если атом слишком мал. то перекрытия связи из-за возраста-
ния сопротивления решетки стягиванию ее атомов к малому чужому
атому не возникнет и атом, как бы выталкивается из решетки-
растворителя в другую фазу.
Твердые растворы
внедрения
образуются путем размещения ато-
мов растворенного компонента между атомами решетки растворителя.
Эти растворы образуются лишь при наличии ограниченной рас-
творимости между компонентами, так как для заполнения «промежут-
ков» между- атомами решетки растворителя требуется относительно не-
большое количество растворяемого компонента. Если при образовании
твердого раствора замещения параметр решетки растворителя уменьша-
ется или увеличивается в зависимости от размеров атомов растворенно-
го компонента, то в твердых растворах внедрения параметр элементар-
ной ячейки всегда увеличивается.
Растворы внедрения чаще всего образуются при растворении ма-
лых атомов легких элементов (В, С, N, О, Н) в междоузлиях металлов.
При этом структура металла сохраняется неизменной, а температура
плавления обычно понижается с увеличением процента примеси вне-
дрения. Неметаллические элементы внедрения растворяются в метал-
лах, образуя металлические связи. Их внешние электроны, взаимодей-
ствуя с внешними оболочками атомов металла, коллективизируются и
вносят вклад не только в металлическую связь, но и в проводимость
металла. Атомы легких элементов превращаются в катионы, повышая
электронную концентрацию. Они в основном располагаются в окта- (в
ГЦК и
ПГ-структурах
г
оп
=0,41г
М
е,
в
ОЦК-структуре
г
оп
=
0,154-0,633г
Ме
,
где
г
оп
,
г
та
,
г
Ме
- радиусы
окта-.
тетрапор
и атома металла соответствен-
но) и тетрапорах (в ГЦК- и
ПГ-
структурах
г
тп
=0,225г
Мс
,
в ОЦК-
структуре
r
m
=
0,291r
Me
)
металла. Если размеры атома примеси внедре-
ния близки к радиусу
октапор.
то в металле, как правило, наблюдается
значительное растворение примеси внедрения. Внедряющийся атом
создает вокруг себя небольшие напряжения решетки
металла-
38
растворителя. Если радиус атома примеси внедрения больше радиуса
междоузлия, то его внедрение возможно при суперпозиции максимумов
электронной плотности
s-оболочек
металла и
2s-,
р-оболочек
внедряю-
щегося легкого атома. Внедренный атом расталкивает окружающие его
атомы металла, создавая зону сжатия, локализованную вокруг атома
внедрения. Если радиус атома примеси внедрения несколько меньше
радиуса междоузлия, то его внедрение возможно при суперпозиции
максимумов электронной плотности
s-орбиталей
металла и
2s-,
р-оболочек
внедряющегося легкого атома. При этом создается зона растяжения, внутри
которой параметры решетки несколько увеличиваются, а электронная кон-
центрация убывает от атома внедрения к периферии зоны.
Если атом примеси внедрения слишком велик или слишком мал по
сравнению с междоузлием, то перекрытия максимумов электронной
плотности и образования металлических связей не
происходит,
атом
выталкивается решеткой, и значительной растворимости примеси вне-
дрения в металле не наблюдается.
В твердых растворах вычитания число атомов в элементарной
ячейке кристалла уменьшается по сравнению с числом атомов в ячейке
чистого компонента. Такие растворы часто образуются на основе несте-
хиометрических
соединений.
В жидком состоянии большинство металлов образуют друг с дру-
гом и даже с неметаллами, переходящими при плавлении в металличе-
ское состояние (Si, Ge, Bi, Sb и др.),
непрерывные
или очень широкие
области растворов. Непрерывные ряды твердых растворов образуются
редко и только между
изоструктурными
металлами
(K-Rb,
Ti-Zr,
V-Nb,
Mo-W,
Fe-Cr,
Fe-Ni,
Co-Ni
и т.д.). Большей частью растворы
легирующих элементов в металлах ограничены (Cu-Zn,
Cu-Sn,
Al-Cu.
Mg-Al,
Ni-Cr, Fe-C и др.), а иногда растворимость столь мала, что эле-
мент можно считать практически нерастворимым (Fe-B,
Fe-O,
Cu-O,
Al-Na).Однако
растворимость, даже крайне малая, всегда есть. На этом
основано модифицирование и управление электрофизическими свойст-
вами полупроводников Si, Ge и др.
Итак, образование твердых растворов и химических соединений
зависит исключительно от электронного строения компонентов и опре-
деляется следующими факторами:
• близостью внешних орбитальных диаметров, обусловливающих
коллективизацию валентных электронов и образование металлических
связей (образованию растворов внедрения способствует близость орби-
тальных диаметров бора, углерода, азота, кислорода к размеру междо-
узлий в решетке металла-растворителя);
39

•
I
1
• способностью к образованию промежуточных соединений путем
перекрытия валентных и
подвалентных
орбиталей атомов, что ограни-
чивает области твердых растворов (стремление к образованию соедине-
ний усиливается по мере удаления компонентов друг от друга в перио-
дической системе, что отражается количественно разностью их элек-
троотрицательностей);
• числом коллективизированных электронов, выражаемым элек-
тронной концентрацией в электронах на атом (с повышением электрон-
ной концентрации возрастает энергия связи, что способствует сближе-
нию атомов и перекрытию внешних оболочек);
• способностью решетки металла-растворителя переводить в метал-
лическое состояние полуметаллические и неметаллические элементы
путем коллективизации их
внешних
валентных электронов (электрон-
ное строение ионов легирующих элементов, образующихся при раство-
рении, предопределяет стабилизацию ОЦК-,
ГЦК-
или
ПГ-фаз
незави-
симо от собственной структуры растворяющегося элемента).
3.3. Влияние на фазовые переходы внешних
полей и размеров компонентов композита
Наряд}'
с рассмотренными, нужно учитывать и другие виды фазо-
вых переходов, например, в магнитных и электрических полях. Как по-
казывают исследования, при низких температурах (<100К) фазовые пе-
реходы в магнитном поле указывают на относительный характер разде-
ления веществ на металлы, полупроводники и диэлектрики. В магнит-
ном поле одно и то же вещество может быть и диэлектриком, и полу-
проводником, и металлом, что особенно важно при разработке новых
композитов для решения задач современной микроэлектроники.
Следует отметить, что на фазовые переходы влияют и размеры
компонентов композита. Для слоевых композитов с субмикронной тол-
щиной слоев за счет действия сил поверхностного натяжения могут
стать стабильными
эпитаксиальные
фазы, которые отсутствуют на объ-
емных фазовых диаграммах.
Фазовые превращения нужно учитывать при эксплуатации изде-
лий из любых материалов, тем более из композитов - сложных соеди-
нений,
работающих в экстремальных условиях, где обычные материалы
не могут быть применены, например, жаропрочные стали не могут быть
использованы при Т>700°С, предельные рабочие температуры сплавов
на основе никеля не превышают 1000°С. Для требований современной
техники указанные параметры уже недостаточны. Тугоплавкие металлы
(W, Mo,
Nb
и др.) и сплавы на их основе, обладая высокими температу-
рами плавления, имеют низкую окалиностойкость и
требуют
создания
40
защитных покрытий, способных противостоять воздействиям агрессив-
ных сред при повышенных температурах. Тугоплавкие соединения типа
карбидов,
боридов,
нитридов и
т.п.,
а также керамические материалы,
отличаясь хорошей
жаростойкостью,
имеют низкие показатели ударной
вязкости и прочности на растяжение. Устранить указанные недостатки и
разрыв между требованиями современной техники и рабочими парамет-
рами известных материалов и сплавов можно путем создания и приме-
нения новых композиционных систем, например, при выборе исходных
компонентов кермета (современного композита, содержащего металлы
или сплавы и один или несколько видов керамики) руководствуются
принципами их химического, физического и технологического согласо-
вания. Химическое согласование предполагает отсутствие химического
взаимодействия между керамической и металлической составляющими;
физическое - отсутствие взаимного растворения при нагреве и необхо-
димое сочетание свойств компонентов (коэффициент теплового расшире-
ния, модуль упругости и др.); технологическое согласование - близость
температур спекания керамической и металлической составляющих и др.
Все эти параметры определяются на основе анализа фазовых диа-
грамм и возможных фазовых переходов в системе.
41

I
Глава 4. Физико-химические свойства
основных компонентов композитов
Хотя в композитах
использзтот
самые разнообразные материалы
как неорганического, так и органического происхождения, все же сле-
дует выделить среди них основные типы материалов, такие как метал-
лы, полимеры и керамики. Рассмотрим более подробно их физико-
химические свойства. Наряду с ними кратко охарактеризуем свойства
полупроводников,
стекол, жидких кристаллов, достаточно часто входя-
щих в состав современных композитов.
4.1.
Металлы
Это вещества, обладающие в обычных условиях характерными ме-
таллическими свойствами — высокими значениями электро- и теплопро-
водности, отрицательным температурным коэффициентом электриче-
ской проводимости, способностью хорошо отражать световые волны
(блеск), пластичностью. Ранее основными признаками металла считали
блеск, пластичность и ковкость. Но металлическим блеском обладают и
некоторые неметаллы (например, йод). В настоящее время важнейшим
признаком металла признается отрицательный температурный коэффи-
циент электрической проводимости, т.е. понижение электропроводно-
сти с ростом температуры.
Из 109 элементов Периодической системы 86 относятся к метал-
лам. В металлах существует металлическая связь, характеризующаяся
тем, что кристаллическая решетка образована положительными ионами,
тогда как валентные электроны
делокализованы
по всему пространству
решетки, образуя электронный газ, свободно распространяющийся ме-
жду ионами, что обусловливает металлические свойства.
Металлы проводят электрический ток, так как валентные электро-
ны могут свободно двигаться в кристаллической решетке. Причины
подвижности электронов в металлах состоят в том, что они легко уда-
ляются из атома (низкая энергия ионизации) и могут находиться близко
к двум или более положительным ядрам в любой части кристалла (из-за
наличия большого числа свободных валентных орбит). Вещества, в
которых имеются свободные носители зарядов - проводники. В изоля-
торах (диэлектриках) свободные носители зарядов отсутствуют. Ме-
таллы - характерные проводники и энергия
делокализованных
электро-
42
нов (электронов проводимости) - отвечает зоне проводимости. Согласно
зонной
теории,
у
металлов
отсутствует запрещенная зона между валентной
зоной и зоной
проводимости,
а у диэлектриков запрещенная зона большая.
При увеличении заряда атомных ядер и заполнении свободных ор-
бит области между двумя ядрами постепенно становятся относительно
более "привлекательными" для электрона по сравнению с другими час-
тями пространства. Электроны все больше стремятся локализоваться в
этих областях, в результате чего появляются частично
ковалентные
свя-
зи с их направленным характером между соседними атомами.
Итак,
ненаправленную
металлическую связь можно рассматривать,
как разновидность направленной ковалентной связи. Она возникает в
том случае, когда атомы имеют мало валентных электронов по сравне-
нию со свободными валентными орбитами и когда эти валентные элек-
троны слабо удерживаются ядром.
Прочность связи в кристаллической
структуре
металла характеризу-
ется энтальпией
атомизации,
которая меняется от
61,4кДж/моль
у Hg до
850
кДж/моль
у W. Максимальная энтальпия атомизации характерна для
металлов рядов
Nb-Ru
и
Hf-Ir.
Относящиеся к ним металлы отличаются
высокими температурами плавления и большой механической прочностью.
Все металлы делятся на четыре группы: s, p,
d.f.
Металлы групп d
и / называют
переходными,
s и р - простыми. Среди
^-металлов
выде-
ляют щелочные и
щелочно-земельные,
из
J-платиновые
металлы. Груп-
па редкоземельных элементов включает как
d-,
так
и/-металлы.
Большинство металлов кристаллизуется в одном из трех структур-
ных типов, а именно в кубической и гексагональной
плотнейших
(ГЦК,
ГП) упаковках или в
объемоцентрированной
кубической
(ОЦК)
решетке.
Многие металлы при изменении температуры и давления претер-
певают полиморфные превращения. При плавлении металлы сохраняют
свои электрические, тепловые и оптические свойства. Вблизи темпера-
туры плавления в жидких металлах наблюдается примерно такой же
ближний порядок, как и в кристаллических металлах, который с повы-
шением температуры нарушается вплоть до полного
разупорядочения.
Физические и химические свойства металлов меняются в очень
широких пределах. Например, электропроводность металлов зависит от
равномерного и непрерывного движения электронов внутри кристалла.
Это подтверждается тем фактором, что малые количества примеси
сильно уменьшают проводимость.
Металлы являются главными конструкционными материалами.
Поскольку металлические связи не имеют резко выраженного направ-
ленного
характера,
неудивительно, что многие металлы можно легко
деформировать, не нарушая их кристаллической структуры. Под
деист-
43
