Журнал - Проблемы криобиологии 2010 №3
Подождите немного. Документ загружается.

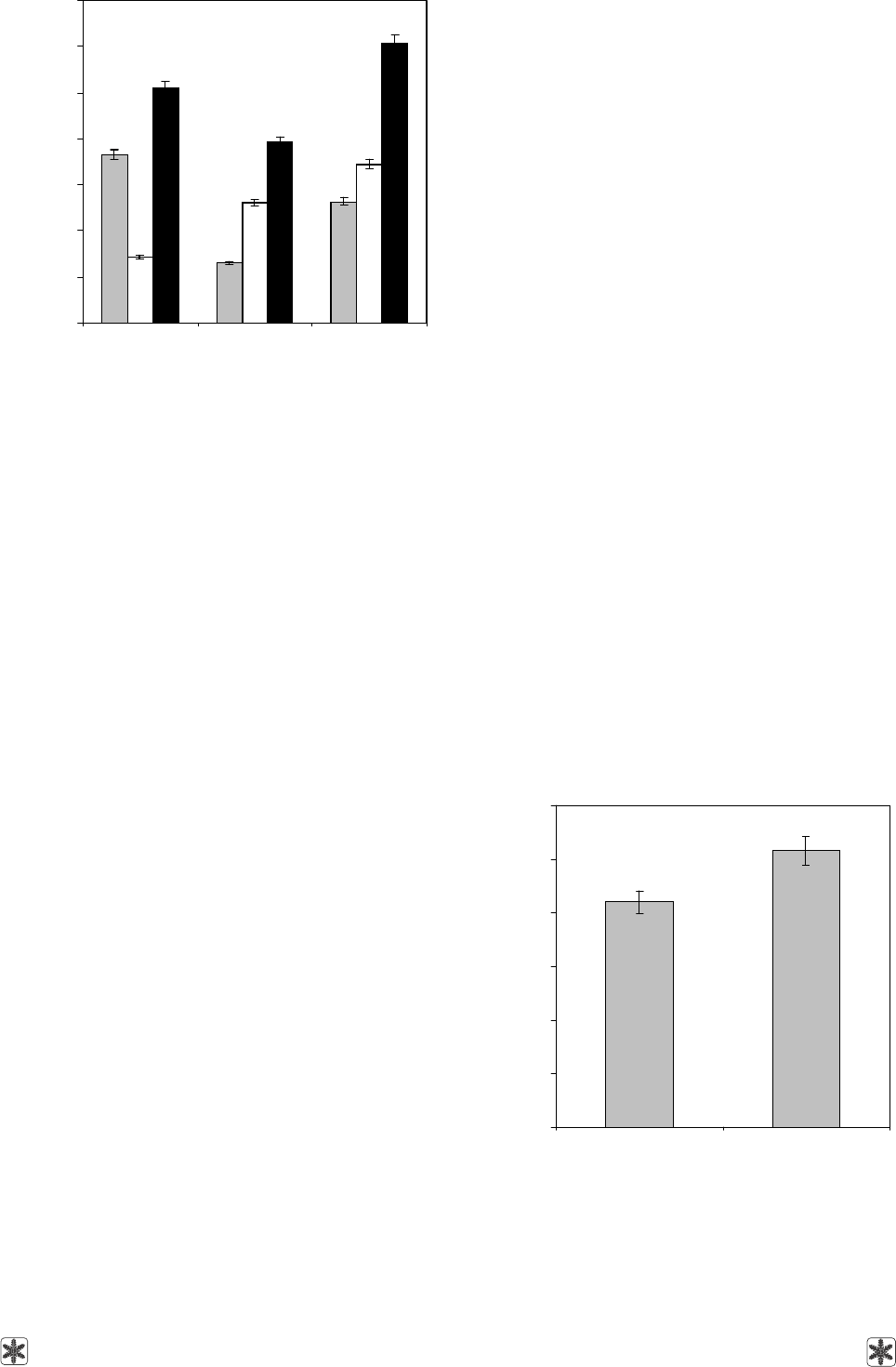
293
problems
of cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
что полученные результаты вызваны конформа-
ционными изменениями белковых молекул, приво-
дящих к увеличению доступности белковых сай-
тов, ответственных за их антиоксидантные свойст-
ва. Это согласуется с данными других авторов,
которые показали, что замораживание изолиро-
ванных белковых молекул приводит к разрыхлению
их структуры [2, 16, 23].
Предположение об участии белков в антиокси-
дантной активности экстрактов подтверждается
результатами исследований антирадикальной
активности отдельных фракций ЭПЧ. В частности
показано, что почти все фракции обладают такой
активностью и содержат быстро и медленно вос-
станавливающие центры. Установлено, что про-
цесс замораживания-оттаивания приводит к увели-
чению антирадикальной активности в некоторых
фракциях с молекулярными массами от 700 кДа
за счет как быстрой, так и медленной фаз. Антира-
дикальная активность уменьшается главным об-
разом за счет снижения в низкомолекулярных
фракциях (менее 5кДа).
При анализе содержания в ЭПЧ фенольных
соединений, являющихся наиболее эффективными
"перехватчиками" свободных радикалов, установ-
лено, что после медленного замораживания (до
–20°С) их содержание в ЭПЧ снижается, а после
быстрого (до –196°С) достоверно не изменяется
(рис. 4).
Исследования способности свежих экстрактов
удалять H
2
O
2
показали, что данная активность для
0
10
20
30
40
50
60
70
Свежевыделенный
Fresh
Ингибирование поглощения, %
Absorbance inhibiting, %
Замороженный
до –20°С
Frozen down to
–20°C
Замороженный
до –196°С
Frozen down to
–196°C
Рис. 3. Влияние различных режимов замораживания на
активность быстро и медленно восстанавливающих
ABTS
+
-радикал центров ЭПЧ.
Fig. 3. Effect of different freezing regimens on activity of
rapidly and slowly reducing the ABTS
+
radical HPE centers
Rapid freezing down to –196°C leads to the antiradical
activity increasing due to the rise in the activity of slowly
reducing centers (Fig. 3). Slow reduction of ABTS
+
radical is known to be is mainly stipulated with protein
molecules’ conformational changes [17], which lead
to increasing of the accessibility of protein sites, re-
sponsible for their antioxidant properties. This is in con-
cordance with the reported observations, that freeze-
thawing of isolated protein molecules leads to loosen-
ing of their structure [2, 16, 23].
The assumption of protein participation in antioxi-
dant activity of extracts is confirmed by the decolori-
zation assay of separated HPE fractions. In particular,
it has been shown that almost all the fractions possess
such an activity and contain rapidly and slowly reduc-
ing centers. Freeze-thawing has been established to
result in the rise if antiradical activity in some fractions
with molecular masses from 700 kDa due to both rapid
and slow phases. Antiradical activity decreases mainly
due to the reduction in low molecular fractions (less
than 5 kDa).
When analyzing the content of phenol compounds,
being the most effective free radical scavengers, in
HPE it has been found that after slow freezing (down
to –20°C) their content in HPE decreases, and after
rapid one (down to –196°C) does not change statisti-
cally and significantly (Fig. 4).
Investigations of the ability of fresh extracts to neu-
tralize H
2
O
2
have demonstrated that this activity for
samples obtained from different placentas varied from
0.9 to 5 mM/mg of protein and was observed predomi-
0
20
40
60
80
100
120
Содержание фенолов, % от контроля
Phenols content, % of control
Замороженный
до –20°С
Frozen down to
–20°C
Замороженный
до –196°С
Frozen down to
–196°C
Рис. 4. Содержание фенолов в ЭПЧ после заморажива-
ния-оттаивания. Контроль – свежевыделенный ЭПЧ.
Fig. 4. Content of phenols in HPE after freeze-thawing. Fresh
HPE is the control.
294
problems
of cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
образцов из разных плацент была от 0,9 до 5 мМ/мг
белка и наблюдалась преимущественно во фрак-
циях с молекулярной массой порядка 200 кДа.
Известно, что основным механизмом антиокси-
дантной защиты во внутриклеточной среде яв-
ляются ферментативные антиоксиданты, характе-
ризующиеся высокой специфичностью действия, в
частности каталаза (молекулярная масса ~250 кДа),
обеспечивающая разложение перекиси водорода
и препятствующая тем самым ее вовлечению в
реакцию Фентона с образованием гидроксильного
радикала [1, 3]. Сопоставление литературных дан-
ных и полученных нами результатов позволяет
предположить, что снижение содержания перекиси
водорода в образцах, содержащих ЭПЧ, обусловле-
но действием каталазы. Исследуемая активность
достоверно не изменялась как после медленного,
так и после быстрого замораживания (рис. 5).
Одним из основных механизмов антиоксидант-
ной защиты биологических макромолекул во
внеклеточной среде являются хелатные соедине-
ния, связывающие ионы металлов переменной
валентности и препятствующие тем самым их
вовлечению в реакции разложения перекисей с
образованием гидроксильного радикала. Экспери-
ментально установлено, что хелатирующая спо-
собность экстрактов плаценты уменьшается после
медленного и увеличивается после быстрого замо-
раживания (рис. 6).
Показано, что частичное разворачивание бел-
ков, происходящее под действием нагрева или дру-
гих стрессорных факторов, увеличивает их анти-
оксидантную активность [10, 14]. Известен тот
0
0,5
1
1,5
2
2,5
Свежевыделенный
Fresh
Замороженный
до –20°С
Frozen down to
–20°C
Замороженный
до –196°С
Frozen down to
–196°C
Рис. 5. Влияние различных режимов замораживания на
способность ЭПЧ разлагать перекись водорода.
Fig. 5. Effect of different freezing regimens on ability of
HPE to break-down the hydrogen peroxide.
0
2
4
6
8
10
12
14
16
Свежевыделенный
Fresh
Связанное железо, %
Bound iron, %
Замороженный
до –20°С
Frozen down to
–20°C
Замороженный
до –196°С
Frozen down to
–196°C
Рис. 6. Хелатирующая активность ЭПЧ.
Fig. 6. Chelating activity of HPE.
nantly in all the fractions with molecular mass of ap-
proximately 200 kDa. The main mechanisms of anti-
oxidant protection in intracellular medium is known to
be highly specific enzyme antioxidants, in particular cata-
lase (molecular mass ~250 kDa), providing the decom-
position of hydrogen peroxide and preventing thereby
its involvement to Fenton's reaction with the formation
of hydroxyl radical [1, 3]. The comparing of the litera-
ture data and our findings allows to assume that the
reduced content of hydrogen peroxide in the samples
comprising HPE is stipulated with the effect of cata-
lase. The studied activity did not statistically and sig-
nificantly differ both after slow and rapid freezing
(Fig. 5).
One of the main mechanisms of biological macro-
molecules’ antioxidant protection in extracellular me-
dium are chelating compounds, binding transition metal
ions and preventing thereby their involvement into the
reactions of peroxide decomposition reaction with the
formation of hydroxyl radical. It was experimentally
found that chelating ability of placental extracts de-
creased after slow and increased after rapid freezing
(Fig. 6).
It has been shown that partial unfolding of proteins
occurring under the effect of heating or other stressor
factors increases antioxidant activity [10, 14]. The fact
that freezing also leads to the conformational changes
of protein molecules is known [6, 7, 10, 13, 18]. There-
fore the obtained results enable to speculate that freez-
ing leads to a rise in antioxidant activity due to confor-
mations changes of antioxidant molecules. Decrease
in the activity after rapid freezing may be related both
to the utilization of antioxidants for scavenging free
radicals or to their destruction during the solution con-
centrating at freezing.
Количество нейтрализованной H
2
O
2
, мМ/мг белка
Amount of neutralized H
2
O
2
, mM/mg of protein

295
problems
of cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
Литература
Меньщикова Е.Б., Зенков Н.К. Антиоксиданты и ингиби-
торы радикальных окислительных процессов // Успехи
современной биологии.– 1993.– Т. 113, N4.– С. 442–453.
Нардид О.А. Влияние замораживания на структурно-
функциональные свойства некоторых гемопротеинов//
Проблемы криобиологии.– 1999.– №3.– С.31-34.
Саприн А.Н., Калинина Е.В. Окислительный стресс и его
роль в механизмах апоптоза и развития патологических
процессов // Успехи биологической химии.– 1999.– Т. 39.–
С. 289–326.
Andrabi S.M.H., Ansari M.S., Ullah N., Afzal M. Effect of
non-enzymatic antioxidants in extender on post-thaw quality
of buffalo (Bubalus bubalis) bull spermatozoa // Pakistan
Vet. J.– 2008.– Vol. 28, N4.– P. 159–162.
Berlett B.S., Stadtman E.R. Protein oxidation in aging, disease,
and oxidative stress // J. Biol. Chem.– 1997.– Vol. 272, N33.–
P. 20313–20316.
Cao E., Chen Y., Cui Z., Forster P.R. Effect of freezing and
thawing rates on denaturation of proteins in aqueous
solutions // Biotechnol. Bioenerg.– 2003.– Vol. 82, N6.– P. 684–
690.
Cofrades S., Careche M., Carballo J., Colmenero F.J.
Freezing and frozen storage of actomyosin from different
факт, что замораживание также приводит к конфор-
мационным изменениям белковых молекул [6, 7,
10, 13, 18]. Поэтому полученные результаты позво-
ляют предположить, что замораживание приводит
к увеличению антиоксидантной активности вслед-
ствие конформационных изменений антиоксидант-
ных молекул. Снижение активности после быстро-
го замораживания может быть связано как с рас-
ходованием антиоксидантов на ингибирование
свободных радикалов, так и с их разрушением в
процессе концентрирования раствора при замора-
живании.
Выводы
При быстром замораживании повышается анти-
оксидантной активности ЭПЧ, которая проявляет-
ся в увеличении способности ингибировать сво-
бодные радикалы и хелатировать ионы железа. В
ЭПЧ после быстрого замораживания практически
не изменяются железовосстанавливающая актив-
ность и способность разлагать перекись водорода.
При медленном замораживании ЭПЧ снижается
их антиоксидантная активность (кроме способнос-
ти разлагать перекись водорода), определяемая
различными методами. Полученные результаты
показали, что для выяснения механизмов влияния
замораживания-оттаивания на антиоксидантную
активность биологических объектов необходимы
дальнейшие исследования. Несомненный интерес
представляет также определение роли антиокси-
дантной активности белков, которая увеличивается
после низкотемпературного воздействия, при лече-
нии различных заболеваний.
Conclusions
After rapid freezing the HPE antioxidant activity
manifested in the ability to scavenge free radicals and
chelate ferrous ions increases. In HPE after rapid
freezing the ferric reducing activity and ability to de-
compose hydrogen peroxide do not change. After slow
freezing of HPE their antioxidant activity (except the
ability to decompose hydrogen peroxide), examined by
different methods, decreases. The findings have shown
that to elucidate the mechanisms of the effect of
freeze-thawing on antioxidant activity of biological ob-
jects the further investigations are needed. Of doubt-
less interest is also the evaluation of the role of protein
antioxidant activity, increasing after low temperature
effect, in the treatment of different diseases.
Литература
Menschikova E.B., Zenkov N.K. Antioxidants and inhibitors
of radical oxidative processes// Uspekhi Sovremennoy Biolo-
gii.– 1999.– Vol. 113, N4.– P. 442–453.
Nardid O.A. Effect of freezing on structural and functional
properties of some hemoproteins// Problems of Cryobiology -
1999.– N3.– P. 31–34.
Saprin A.N., Kalinina E.V. Oxidative stress and its role in
mechanisms of apoptosis and development of pathological
processes // Uspekhi Biologicheskoy Khimii.– 1999.– Vol. 39.–
P. 289–326.
Andrabi S.M.H., Ansari M.S., Ullah N., Afzal M. Effect of
non-enzymatic antioxidants in extender on post-thaw quality
of buffalo (Bubalus bubalis) bull spermatozoa // Pakistan
Vet. J.– 2008.– Vol. 28, N4.– P. 159–162.
Berlett B.S., Stadtman E.R. Protein oxidation in aging, disease,
and oxidative stress // J. Biol. Chem.– 1997.– Vol. 272, N33.–
P. 20313–20316.
Cao E., Chen Y., Cui Z., Forster P.R. Effect of freezing and
thawing rates on denaturation of proteins in aqueous
solutions // Biotechnol. Bioenerg.– 2003.– Vol. 82, N6.– P. 684–
690.
Cofrades S., Careche M., Carballo J., Colmenero F.J.
Freezing and frozen storage of actomyosin from different
species // Z. Lebensm. Unters. Forsch. A.– 1996.– Vol. 203,
N4.– P. 316–319.
Dinis T.C.P, Madeira V.M.C., Almeida L.M. Action of phenolic
derivates (acetoaminophen, salycilate, and 5-aminosalycilate)
as inhibitors of membrane lipid peroxidation and as peroxyl
radical scavengers // Arch. Biochem. Biophys.– 1994.–
Vol. 315, N1.– P. 161–169.
Eckhardt B.M., Oeswein J.Q., Bewley T.A. Effect of freezing
on aggregation of human growth hormone // Pharmaceutical
Research.– 1991.– Vol. 8, N11.– P. 1360–1364.
Elias R.J., Kellerby S.S., Decker E.A. Antioxidant activity of
proteins and peptides // Critical Reviews in Food Science
and Nutrition.– 2008.– Vol. 48, N5.– P. 430–441.
Goth L. A simple method for determination of serum catalase
activity and revision of reference range // Clin. Chim. Acta.–
1991.– Vol. 196, N2/3.– P. 143–151.
Henriquez C., Aliaga C., Lissi E. Kinetics profiles in the
reaction of ABTS derived radicals with simple phenols and
polyphenols // J. Chil. Chem. Soc.–2004.– Vol. 49, N1.– P. 74–76.
Jordan G.M., Yoshioka S., Terao T. The aggregation of bovine
serum albumin in solution and in the solid state // J. Pharm.
Pharmacol.– 1994.– Vol. 46, N3.– P. 182–185.
Medina-Navarro R., Duran-Reyes G., Diaz-Flores M., Vilar-
Rojas C. Protein antioxidant response to the stress and the
1.
2.
3.
4.
5.
6.
7.
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.

296
problems
of cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
species // Z. Lebensm. Unters. Forsch. A.– 1996.– Vol. 203,
N4.– P. 316–319.
Dinis T.C.P, Madeira V.M.C., Almeida L.M. Action of phenolic
derivates (acetoaminophen, salycilate, and 5-aminosalycilate)
as inhibitors of membrane lipid peroxidation and as peroxyl
radical scavengers // Arch. Biochem. Biophys.– 1994.–
Vol. 315, N1.– P. 161–169.
Eckhardt B.M., Oeswein J.Q., Bewley T.A. Effect of freezing
on aggregation of human growth hormone // Pharmaceutical
Research.– 1991.– Vol. 8, N11.– P. 1360–1364.
Elias R.J., Kellerby S.S., Decker E.A. Antioxidant activity of
proteins and peptides // Critical Reviews in Food Science
and Nutrition.– 2008.– Vol. 48, N5.– P. 430–441.
Goth L. A simple method for determination of serum catalase
activity and revision of reference range // Clin. Chim. Acta.–
1991.– Vol. 196, N2/3.– P. 143–151.
Henriquez C., Aliaga C., Lissi E. Kinetics profiles in the
reaction of ABTS derived radicals with simple phenols and
polyphenols // J. Chil. Chem. Soc.–2004.– Vol. 49, N1.– P. 74–76.
Jordan G.M., Yoshioka S., Terao T. The aggregation of bovine
serum albumin in solution and in the solid state // J. Pharm.
Pharmacol.– 1994.– Vol. 46, N3.– P. 182–185.
Medina-Navarro R., Duran-Reyes G., Diaz-Flores M., Vilar-
Rojas C. Protein antioxidant response to the stress and the
relationship between molecular structure and antioxidant
function // PLoS ONE.– 2010.– Vol. 5, N1.– e8971.
Oyaizu M. Studies on product of browning reaction prepared
from glucose amine // Jpn. J. Nutr.– 1986.– Vol. 44.– P. 307–
315.
Pawelek P.D., Cheah J., Coulombe R. et al. The structure of
L-amino acid oxidase reveals the substrate trajectory into an
enantiometrically conserved active site // EMBO J.– 2000.–
Vol. 19, N16.– P. 4204–4215.
Re R., Pellegrini N., Proteggente A. et al. Antioxidant activity
applying an improved ABTS radical cation decolorization
assay // Free Radical Biology and Medicine.– 1999.– Vol. 26,
N9/10.– P. 1231–1237.
Sarciaux J.M., Mansour S., Hageman M.J., Nail S.L. Effect
of buffer composition and processing conditions on
aggregation of bovine IgG during freeze-drying // J. Pharm.
Sci.– 1999.– Vol. 88, N12.– P. 1354–1361.
Shinde V., Dhalwal K., Paradkar A.R., Mahadik K.R. Effects
of human placental extract on age related antioxidant enzyme
status in D-galactose treated mice // Pharmacologyonline.–
2007.– Vol. 1.– P. 252–261.
Shinde V., Dhalwal K., Paradkar A.R. et al. Evaluation of in
vitro antioxidant activity of human placental extract //
Pharmacologyonline.– 2006.– Vol. 3.– P. 172–179.
Singleton V.L., Orthofer R., Lamuela-Raventos R.M. Analysis
of total phenols and oxidation substrates andantioxidants by
means of Folin-Ciocalteau reagent // Methods Enzymol.–
1999.– Vol. 299.– P. 152–177.
Storz G., Christman M.F., Sies H., Ames B.N. Spontaneous
mutagenesis and oxidative damage to DNA in Salmonella
typhimurium // Proc. Natl. Acad. Sci. USA.– 1987.– Vol. 84,
N24.– P. 8917–8921.
Thirion C., Larcher D., Chaillot B. et al. Circular dichroism
studies of freeze-drying-induced conformational changes in
human hemoglobin // Biopolymers.– 1983.– Vol. 22, N11.–
P. 2367–2381.
Togashi S.I., Takanashi N., Iwama M. et al. Antioxidative
Collagen-Derived Peptides In Human-Placenta Extract //
Placenta.– 2002. – Vol. 23, N6.– P. 497–502.
Wolff S.P., Garner A., Dean R.T. Free radicals, lipids and
protein degradation // Trends Biochem. Sci.– 1986.– Vol. 11,
N1.– P. 27–31.
Поступила 13.07.2010
Рецензент О.В. Липина
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
relationship between molecular structure and antioxidant
function // PLoS ONE.– 2010.– Vol. 5, N1.– e8971.
Oyaizu M. Studies on product of browning reaction prepared
from glucose amine // Jpn. J. Nutr.– 1986.– Vol. 44.– P. 307–
315.
Pawelek P.D., Cheah J., Coulombe R. et al. The structure of
L-amino acid oxidase reveals the substrate trajectory into an
enantiometrically conserved active site // EMBO J.– 2000.–
Vol. 19, N16.– P. 4204–4215.
Re R., Pellegrini N., Proteggente A. et al. Antioxidant activity
applying an improved ABTS radical cation decolorization
assay // Free Radical Biology and Medicine.– 1999.– Vol. 26,
N9/10.– P. 1231–1237.
Sarciaux J.M., Mansour S., Hageman M.J., Nail S.L. Effect
of buffer composition and processing conditions on
aggregation of bovine IgG during freeze-drying // J. Pharm.
Sci.– 1999.– Vol. 88, N12.– P. 1354–1361.
Shinde V., Dhalwal K., Paradkar A.R., Mahadik K.R. Effects
of human placental extract on age related antioxidant enzyme
status in D-galactose treated mice // Pharmacologyonline.–
2007.– Vol. 1.– P. 252–261.
Shinde V., Dhalwal K., Paradkar A.R. et al. Evaluation of in
vitro antioxidant activity of human placental extract //
Pharmacologyonline.– 2006.– Vol. 3.– P. 172–179.
Singleton V.L., Orthofer R., Lamuela-Raventos R.M. Analysis
of total phenols and oxidation substrates andantioxidants by
means of Folin-Ciocalteau reagent // Methods Enzymol.–
1999.– Vol. 299.– P. 152–177.
Storz G., Christman M.F., Sies H., Ames B.N. Spontaneous
mutagenesis and oxidative damage to DNA in Salmonella
typhimurium // Proc. Natl. Acad. Sci. USA.– 1987.– Vol. 84,
N24.– P. 8917–8921.
Thirion C., Larcher D., Chaillot B. et al. Circular dichroism
studies of freeze-drying-induced conformational changes in
human hemoglobin // Biopolymers.– 1983.– Vol. 22, N11.–
P. 2367–2381.
Togashi S.I., Takanashi N., Iwama M. et al. Antioxidative
Collagen-Derived Peptides In Human-Placenta Extract //
Placenta.– 2002. – Vol. 23, N6.– P. 497–502.
Wolff S.P., Garner A., Dean R.T. Free radicals, lipids and
protein degradation // Trends Biochem. Sci.– 1986.– Vol. 11,
N1.– P. 27–31.
Accepted in 13.07.2010
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.

297
* Автор, которому необходимо направлять корреспонденцию:
ул. Переяславская, 23, г. Харьков, Украина 61015; тел.: (+38
057) 373-30-07, факс: (+38 057) 373-30-84, электронная почта:
cryo@online.kharkov.ua
* To whom correspondence should be addressed: 23,
Pereyaslavskaya str., Kharkov, Ukraine 61015; tel.:+380 57 373
3007, fax: +380 57 373 3084, e-mail: cryo@online.kharkov.ua
Institute for Problems of Cryobiology and Cryomedicine of the Na-
tional Academy of Sciences of Ukraine, Kharkov, Ukraine
Институт проблем криобиологии и криомедицины
НАН Украины, г. Харьков
УДК 581.817:577.342:547.42
Т.Ф. СТРИБУЛЬ*, Ю.С. ЛЫСАК, А.М. КОМПАНИЕЦ
Изменение интенсивности флуоресценции клеток меристемной
ткани винограда под действием ряда криопротекторов
UDC 581.817:577.342:547.42
T.F. STRIBUL*, YU.S. LYSAK, A.M. KOMPANIETS
Change in Fluorescence Intensity of Grape Meristem Cells
Under Effect of Some Cryoprotective Agents
Исследована зависимость флуоресцентного свечения клеток меристемы винограда от воздействия на меристему нескольких
веществ с криопротекторными свойствами. Обработанные криопротекторами меристемы облучали лазером для возбуждения
фотоэлектронной эмиссии и получали спектры флуоресценции через 1, 3, 5, 20 и 120 мин. Установлено, что влияние
криозащитных веществ проявлялось в изменении интенсивности свечения в диапазоне исследованных длин волн.
Ключевые слова: флуоресценция, свободнорадикальные реакции, антиоксиданты, флавопротеиды, пероксидазное окисление,
хлорофилл, меристема.
Досліджена залежність флуоресцентного світіння клітин меристеми винограду від впливу на меристему деяких речовин з
кріопротекторними властивостями. Меристемы, обробені кріопротекторами, опромінювали лазером для збудження
фотоелектронної емісії і отримували спектри флуоресценції через 1, 3, 5, 20 та 120 хв. Встановлено, що вплив кріозахисних
речовин виявлявся у зміні інтенсивності світіння у діапазоні досліджених довжин хвиль.
Ключові слова: флуоресценція, вільнорадикальні реакції, антиоксиданти, флавопротеїди, пероксидазне окислення, хлорофіл,
меристема.
The effect of some substances with cryoprotective properties on grape meristem fluorescence and viability was studied. Treated
with cryoprotectants meristems were irradiated with laser to excite photoelectron emission and the fluorescence spectra were obtained
in 1, 3, 5, 20 and 120 min. It has been established that the effect of cryoprotective agents (CPAs) manifested in the change of
fluorescence intensity within the range of the studied wave lengths.
Key words: fluorescence, free radical reactions, antioxidants, flavoproteins, peroxidation, chlorophyll, meristem.
Криопротекторы в той или иной степени вызы-
вают нарушения в живой клетке, что может отра-
зиться на энергетических, структурных или био-
химических характеристиках процессов, которые
в ней происходят [8].
Метаболизм растительных тканей сопровож-
дается флуоресценцией [2]. Флуоресценция, связан-
ная с внутриклеточным окислением липидов, пред-
ставлена двумя процессами. Один из них протекает
в нативной клетке и является свободнорадикальной
реакцией неферментативного окисления ненасы-
щенных жирных кислот. Второй процесс в норме
подавлен, но развивается при повреждении объекта
и обусловлен пероксидазным окислением различ-
ных субстратов [10]. Вместе с тем главная состав-
ляющая флуоресценции растительных клеток свя-
зана с хлорофиллом. Поглощение молекулой хлоро-
филла электромагнитных волн сопровождается
переходом ее в возбужденное состояние. Меха-
низм флуоресценции заключается в возвращении
молекулы хлорофилла в исходное состояние,
сопровождающееся испусканием света [8].
Cryoprotective agents (CPAs) cause the various
impairments in living cells, which may affect energetic,
structural or biochemical characteristics of the proc-
esses taking place in it [8].
Metabolism of plant tissues is accompanied with
fluorescence [2]. Fluorescence, related to intracellular
lipid oxidation, is represented by two processes. One
of them occurs in native cell and represents a free
radical reaction of non-enzymatic oxidation of non-satu-
rated fatty acids. The second process normally is sup-
pressed, but develops during injury of the object as the
result of peroxidation of various substrates [10]. At
the same time the main component of plant cell fluo-
rescence is related to chlorophyll. The chlorophyll
molecule’s absorption of electromagnetic waves is ac-
companied by its transition into an excited state. The
mechanism of fluorescence consists in a reversion of
chlorophyll molecule into the initial state, accompanied
by light emission [8].
During the injury the oxidation of lipids and phenols
in the plant tissues is intensified, causing the rise in
fluorescence intensity, that exceeds the normal level
problems
of cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3

298
problems
of cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
При повреждении растения в его тканях усили-
вается окисление липидов и фенолов, что вызывает
увеличение интенсивности флуоресценции, превы-
шающее уровень свечения в норме [4]. Изменение
претерпевает и фотосинтетический аппарат, в кото-
ром увеличивается количество возбужденных ком-
понентов [5]. Изменение флуоресцентного свечения
проходит две фазы: на ранней стадии интенсивность
ее повышается, а затем при умеренном воздейст-
вии фактора постепенно возвращается к норме.
Если действующий фактор достаточно сильно
влияет на структурные и/или биохимические па-
раметры клеток, свечение резко усиливается и за-
тем затухает необратимо [3]. При этом спектраль-
ный состав излучения не изменяется, т. е. природа
процессов в клетке сохраняется, увеличивается
только их интенсивность. Излучение в области
400–650 нм обусловлено окислением липидов и
фенольных соединений, 650–750 нм – электрон-
ным транспортом в хлоропластах. [7].
С целью многократного увеличения интенсив-
ности собственной флуоресценции в клетках ме-
ристем используется метод индукции лазером
фотоэлектронной эмиссии.
Данные об интенсивности флуоресценции позво-
ляют использовать этот показатель для изучения
действия различных веществ (в частности, крио-
протекторов) на растительные клетки.
Цель работы – изучение воздействия криоза-
щитных веществ и их смесей на клетки меристем-
ных тканей винограда при возбуждении в них
фотоэлектронной эмиссии, определение зависимос-
ти изменения состояния клеток меристем в при-
сутствии криопротектора от интенсивности их
флуоресценции.
Материалы и методы
Исследовали меристемы винограда, выделен-
ные из растений, выращенных in vitro. После
выделения меристемы культивировали в течение
24 ч на среде Murashige and Skoog (MS).
Изучали действие на меристемы следующих
растворов: 0,75 М NaCl на дистиллированной воде;
раствор 1 М 1,2-пропандиола (1,2-ПД) на среде
MS; 7%-й раствор поливинилпирролидона с
молекулярной массой 24000 (ПВП) на среде MS;
смесь раствора 1 М 1,2-ПД и раствора 7% ПВП в
соотношении 3:2.
Флуоресценцию клеток меристем винограда
изучали с помощью конфокального микроскопа
LSM-510 META (“Carl Zeiss”, Германия). Исполь-
зовался диодный лазер с длиной волны 405 нм.
Рабочая мощность лазера составляла 180 мВт,
размер лазерной апертуры (pin hole) – 228 мкм.
Спектры флуоресценции получали из лямбда-серий
(lambda stacks) в диапазоне 411–754 нм с шагом
of fluorescence [8]. The changes affect also the pho-
tosynthetic apparatus where the number of excited
components increases [5]. The changes in fluorescence
pass two phases: at early stage the intensity of fluo-
rescence increases and then gradually comes back to
the norm under moderate effect of the factor. If acting
factor intensively affects cell structure and/or biochemi-
cal parameters, the fluorescence amplifies rapidly with
following irreversible decay [3]. Herewith the spectral
profile does not change, i. e. the nature of the proc-
esses in a cell is kept, increases only their intensity [4].
The emission in the 400–650 nm bandwidth results from
the oxidation of lipids and phenol substances, in 650–
750 nm it is associated with electron transport in chloro-
plasts [7].
To multiply the intensity of own fluorescence in plant
cells the laser induction of photoelectron emission is
used [6].
The obtained data on the intensity of fluorescence
enables the use of this index to investigate the effect
of different substances (in particular, cryoprotectants)
to plant cells.
The research aim is to investigate the effect of cryo-
protective agents and their mixtures on the cells of
meristem tissue of grape at the excitation of electron
emission, finding the dependence of the change in the
state of meristem cells in the presence of cryoprotectant
on the intensity of their fluorescence.
Materials and methods
The investigations were performed in grape meri-
stems, isolated from the in vitro grown plants. After
isolation the meristems were cultured for 24 hrs in
Murashige and Skoog (MS) medium.
The effect of following solutions on meristems was
examined: 0.75M NaCl solution in distilled water; 1 M
solution of 1,2-propane diol (1,2-PD) in MS medium;
7% solution of polyvynilpyrrolidone (PVP) with mo-
lecular mass of 24,000 in MS medium; composition of
1 M 1,2-PD solution and 7% PVP solution in the ratio
of 3:2.
Cell fluorescence of grape meristems was studied
by means of confocal microscope LSM-510 META
(Carl Zeiss, Germany). Diode laser with the wave-
length of 405 nm was used [6]. Operating power of
the laser was 180 mW, pin hole made 228 µm. Fluo-
rescence spectra were aquired from the emission lamb-
da stacks within 411–754 nm wave length range with
11 nm bandwidth using Zeiss LSM Image Examiner
software (Carl Zeiss, Germany).
The meristems in the MS medium were placed into
the microscope, fluorescence was exited with the la-
ser and emission was recorded. The aquired spectrum
was considered as control (F
0
) (Fig. 1). The intensity
curve had two maxima around 530 and 680 nm. Then
the meristems were transfered from MS medium into
299
problems
of cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
11 нм с помощью приложения Zeiss LSM Image
Examiner (“Carl Zeiss”, Германия).
Меристемы в каплях среды MS помещали под
микроскоп, возбуждали флуоресценцию и регист-
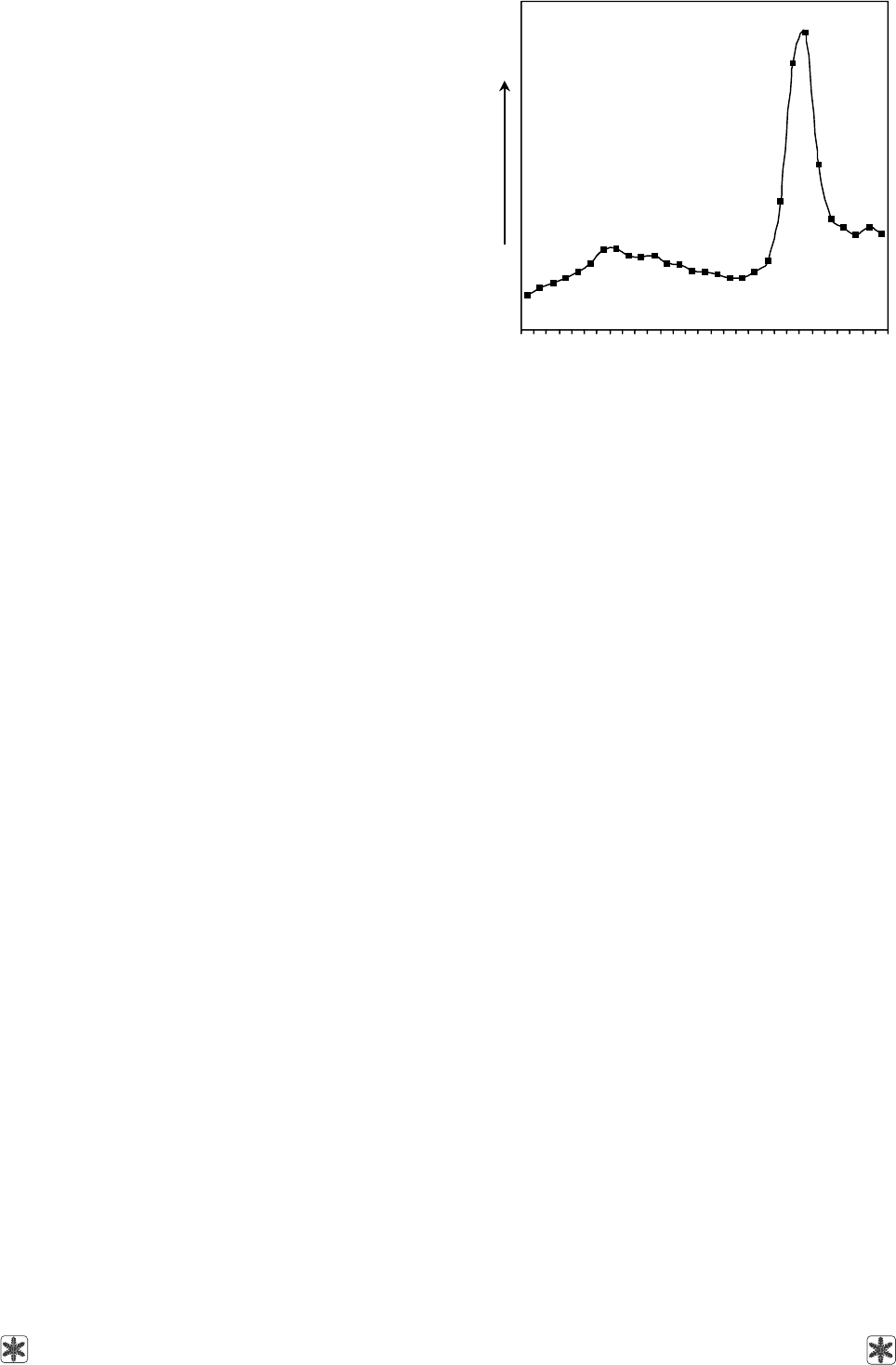
рировали эмиссию. Полученный спектр флуорес-
ценции считали контрольным (F
0
) (рис. 1). Кривая
интенсивности свечения имела два максимума: в
области 530 и 680 нм. Затем меристемы переноси-
ли из среды MS в исследуемый раствор и через
определенное время (1, 3, 5, 20 и 120 мин) регистри-
ровали спектр флуоресценции (F). Полученные
спектры нормировали на соответствующие им
контрольные спектры (F/F
0
). В каждом экспери-
менте использовали по 5–7 меристем.
Параллельно меристемы инкубировали в иссле-
дуемых растворах, затем отмывали от криопро-
текторов путем двукратной смены среды MS в
течение 60 мин. После чего меристемы помещали
в фитотрон для дальнейшего культивирования. На
4-й день подсчитывали количество живых мери-
стем, которые сохраняли зеленый цвет и проявляли
тенденцию к росту в течение всего времени на-
блюдения. Сохранность рассчитывали как отноше-
ние количества живых меристем к их общему коли-
честву .
Результаты статистически обрабатывали с ис-
пользованием программы статистического анали-
за Statistica 6.0. и метода наименьшей существен-
ной разницы. Для оценки достоверности различий
экспериментальных данных применяли критерий
Фишера.
Результаты и обсуждение
Действие растворов криопротекторов на мери-
стемы винограда является стрессовым фактором,
усиливающим окислительные реакции в мембран-
ных системах клеток [6].
Действие раствора 0,75 М NaCl. При исполь-
зовании раствора NaCl в концентрации 0,75 М,
которая в 5 раз превышала изотоническую концент-
рацию, изменился спектр свечения меристем
(рис.2): в области 450–640 нм интенсивность флуо-
ресценции возросла, что свидетельствовало об
усилении окислительных процессов, в области 660–
680 нм интенсивность уменьшилась, что может
свидетельствовать о повреждениях в структурах
хлоропластов.
Сохранность меристем уже на 2-й день культи-
вирования после минутной инкубации в растворе
NaCl была равна нулю, т. е. все меристемы по-
гибли.
По-видимому, гиперконцентрация NaCl вызвала
необратимые повреждения в меристемных клет-
ках, что привело к гибели меристем и ингибировало
флуоресценцию.
investigated solution and in certain time period (1, 3, 5,
20 or 120 min) the fluorescence spectra were recorded
(F). The aquired spectra were normalized by corre-
sponding control spectra (F/F
0
). Each experiment was
performed in 5–7 meristems.
At the same time the meristems were exposed in
investigated solutions, then washed by double change
of MS medium during 60 min. Afterwards the meris-
tems were placed into phytotron for further culturing.
To the 4
th
day the number of living meristems was
counted. We considered the meristem as living one if it
preserved the green color and if it tended to grow dur-
ing the observation period. The viability was determined
as the ratio between number of living meristems and
total amount of meristems.
The results were statistically processed using the
software Statistica 6.0 and method of the least signifi-
cant difference. To assess the statistical significance
of differences of experimental data the Fisher’s crite-
rion was applied.
Results and discussion
The effect of cryoprotectant solutions on grape meri-
stems is a stress factor which strengthens oxidative
reactions in cell membrane structures [6].
Effect of 0.75M NaCl solution. When applying
the NaCl solution under concentration of 0.75 M, which
in 5 times exceeds the isotonic concentration, the fluo-
rescence profile in meristems changed (Fig. 2): within
the 415–650 nm range the fluorescence intensity in-
creased that testified the rise in oxidation intensity; in
417
449
513
545
577
609
641
673
706
738
Длина волны, нм
Wave length, nm
Рис. 1. Спектр флуоресценции меристем винограда в
среде MS при возбуждении лазером с длиной волны
405 нм.
Fig. 1. Fluorescence spectrum of grape meristem in MS
medium under 405 nm wave length laser exitation.
Интенсивность флуоресценции
Fluorescence intensity
0
0,5
1
1,5
2
2,5
3
400 500 600 700
0
0,5
1
1,5
2
2,5
3
400 500 600 700
300
problems
of cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
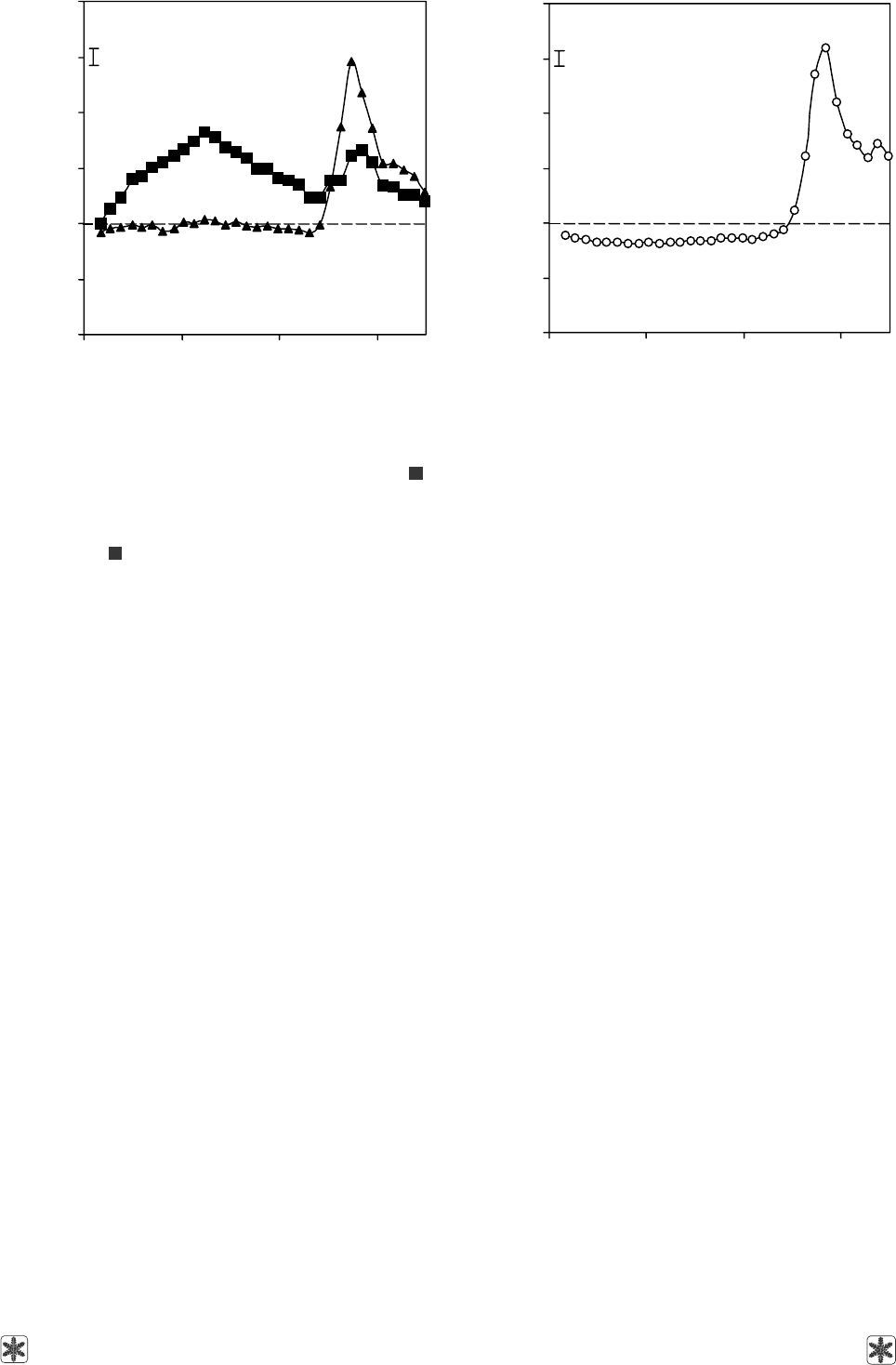
Действие 1 М раствора 1,2-ПД. После 12-
минутного действия 1 М раствора 1,2-ПД отмечено
значительное увеличение интенсивности свечения
в диапазоне всех длин волн (рис. 3), что, по-нашему
мнению, вызвано двумя факторами. С одной сто-
роны, раствор 1 М 1,2-ПД способствовал усилению
окислительных реакций в мембранных системах
клеток, с другой, – усиление интенсивности флуо-
ресценции вызвано возбужденных состояний моле-
кул хлорофилла [5, 10]. Через 120 мин пребывания
в растворе криопротектора спектр флуоресценции
меристем практически совпадал с контрольным.
Сохранность меристем винограда после 3-ми-
нутной инкубации в растворе 1 М 1,2-ПД составила
около 78%.
Действие 7%-го раствора ПВП. Пятиминут-
ная экспозиция меристем в растворе высокомоле-
кулярного криопротектора вызвала рост флуорес-
ценции в области 530 нм, а через 120 минут она не
отличалась от контроля (рис. 4).
В длинноволновой области (680 нм) интенсив-
ность свечения через 1 ч установилась на уров-
не, в полтора раза превышающем контроль, а после
2-часовой экспозиции – в 2,5 раза.
Очевидно, ПВП, будучи непроникающим ве-
ществом, посредством дегидратации вызывал
структурные нарушения мембран, что сопровож-
далось активацией пероксидазных реакций в мем-
бране и самоокислением флавиновых ферментов
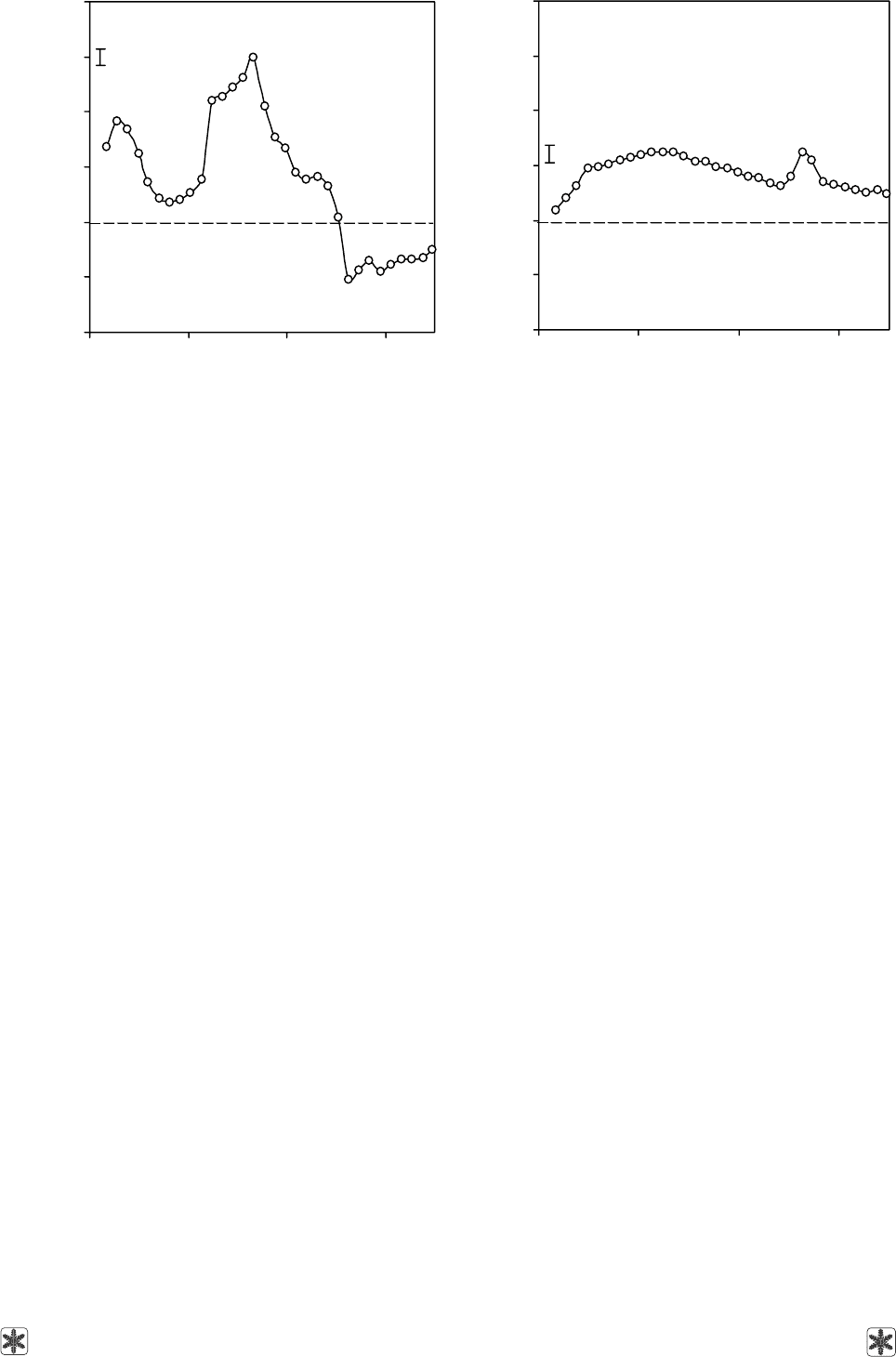
Рис. 2. Нормированный cпектр флуоресценции мери-
стем винограда при возбуждении лазером с длиной
волны 405 нм через 1 мин после действия 0,75 М раствора
NaCl.
Fig. 2. Normalized fluorescence spectrum of grape meristem
under 405 nm wave length laser exitation in 1 minute after
adding of 0.75 M NaCl solution.
the 660–680 nm region the intensity decreased, that
means probably the damaging of the chloroplast struc-
tures.
Viability of meristems after 1 minute incubation in
NaCl solution was equal to zero already to second day
of culture, i. e. all the meristems died.
The effect of 1M solution of 1,2-PD. After 12 mins
of 1 M 1,2-PD solution effect a significant rise in the
intensity of fluorescence in whole wave length range
was noted. We believe that this is caused by two fac-
tors. On the one hand, 1M 1,2-PD solution contribu-
ted to the strengthening of oxidative reactions in cell
membrane stuctures and on another hand the increase
in fluorescence intensity is caused by the rise in the
excited states of chlorophyll molecules [8].
The meristem viability after 3 min incubation in 1 M
1,2-PD solution made about 78%.
The effect of 7% PVP solution. Exposure of
meristems in the solution of high molecular cryoprotec-
tant during 1 hour resulted in rise of the fluorescence
intensity around 530 nm, and in 120 min the intensity
did not differ from ther control one (Fig. 4).
Within long-wave area (680 nm) the fluorescence
intensity after 1 hr of incubation was set at the level,
exceeding the control in 1,5 times, and after 2 hrs of
exposure it was 2,5 times higher than control.
Obviously PVP being non-penetrating substance
caused dehydration resulted in structural impairments
of membranes, that was accompanied with activation
Длина волны, нм
Wave length, nm
Нормированная интенсивность флуоресценции F/F
0
Normalized fluorescence intensity F/F
0
Длина волны, нм
Wave length, nm
Нормированная интенсивность флуоресценции F/F
0
Normalized fluorescence intensity F/F
0
Рис. 3. Нормированный cпектр флуоресценции мери-
стем винограда при воздействии лазером с длиной волны
405 нм через 3 мин после действия 1 М раствора 1,2-ПД.
Fig. 3. Normalized fluorescence spectrum of grape meristem
under 405 nm wave length laser exitation in 3 minutes after
adding of 1M 1,2-PD solution.
0
0,5
1
1,5
2
2,5
3
400 500 600 700
0
0,5
1
1,5
2
2,5
3
400 500 600 700
301
problems
of cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
[10]. Кроме того, влияние ПВП активировало
структурные изменения в хлоропластах клеток и
переход хлорофила в возбужденное состояние.
Такое состояние пигмента сохранялось длительное
время, о чем свидетельствовал высокий показа-
тель интенсивности свечения меристем через 2 ч
[5].
Сохранность меристем после 2-часовой инкуба-
ции в растворе ПВП на 4-й день культивирования
составила около 73%.
Совместное действие растворов криопро-
текторов 1 М 1,2-ПД и 7 % ПВП. При действии
композиции растворов 1 М 1,2-ПД и 7% ПВП
интенсивность свечения в области 530 уменьши-
лась (рис. 5), по сравнению с воздействием каждо-
го вещества отдельно (см. рис. 3 и 4). Спектр
флуоресценции длинноволновой области практи-
чески не отличался от такового для случая экспо-
зиции с 7%-м раствором ПВП.
Сохранность меристем винограда после 120-
минутной инкубации в смеси указанных криопро-
текторов составляла около 87%.
Выводы
Проведенные исследования влияния некоторых
веществ на интенсивность флуоресценции мерис-
тем винограда показали, что инкубация в растворе
0,75 М NaCl приводит к уменьшению флуоресцен-
ции практически до нуля. Это может свидетель-
ствовать о гибели клеток, что подтверждается
Рис. 4. Нормированныe cпектры флуоресценции мери-
стем винограда при возбуждении лазером с длиной
волны 405 нм после действия 7%-го раствора ПВП: –
через 1 ч; – через 2 ч.
Fig. 4. Normalized fluorescence spectra of grape meristem
under 405 nm wave length laser exitation after adding of 7%
PVP solution: – in 1 hour; – in 2 hours after adding.
of peroxidase reactions in membranes and self-oxida-
tion of flavin enzymes [10]. The effect of PVP acti-
vated also the structural changes in cell chloroplasts
and chlorophyll transition into an excited state. This
state of pigment was kept for a long time, that was
confirmed with the high intensity of fluorescence in
meristems in 2 hrs [5].
The viability of meristems after 2 hrs of incubation
in PVP solution made about 73% to the 4
th
day of cul-
ture.
Joint effect of the solution of cryoprotectants of
1M 1,2-PD and 7% PVP. Under the effect of combi-
nation of 1 M solution of 1,2-PD and 7% PVP the
fluorescence intensity around 530 nm increased in less-
er extent (Fig. 5) than under the influence of each
cryoprotectant separately (see Figs. 3 and 4). Fluores-
cence in long-wave bandwidth almost did not differ
from that for 7% PVP.
The meristem viability after 2 hrs of incubation in
the composition of the cryoprotectants made about 87%.
Conclusions
The investigations of the effect of some substances
on the grape meristem fluorescence intensity showed
that incubation in 0,75 M NaCl solution resulted in fluo-
rescence drop almost down to zero. These can attest
the cell death, that is confirmed by the grape meristems
of such an intensity that it led to their death. The effect
of incubation in 1,2-PD and PVP solely was almost
the same. We believe that both cryoprotectants caused
Длина волны, нм
Wave length, nm
Нормированная интенсивность флуоресценции F/F
0
Normalized fluorescence intensity F/F
0
Рис. 5. Нормированный cпектр флуоресценции мери-
стем винограда при возбуждении лазером с длиной
волны 405 нм через 20 мин после действия комбинации
раст-воров 1 М 1,2-ПД и 7% ПВП .
Fig. 5. Normalized fluorescence spectrum of grape meristem
under 405 nm wave length laser exitation in 20 min after
adding of 1M 1,2-PD and 7% PVP solutions combination.
Длина волны, нм
Wave length, nm
Нормированная интенсивность флуоресценции F/F
0
Normalized fluorescence intensity F/F
0

302
problems
of cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
in meristem cells the stress of moderate intensity. The
insignificant level of caused by these cryoprotectants
injuries are confirmed by meristem viability indices in
culture. The composition of the cryoprotectants almost
did not caused the rise in intensity of oxidative proces-
ses in the cells in comparison with effect of each sepa-
rate component of the mixture. The viability of the
meristems after incubation in cryoprotectants’ com-
position was higher than after incubation in solutions
of single cryoprotectants.
Литература
Брайон А.В. Распознавание целых и поврежденных
клеток при флуоресцентно-микроскопическом анализе
растительных тканей // Вісник КДУ. Сер. біол.– 1967.–
№9.– С. 125–127.
Владимиров Ю.А. Свечение, сопровождающее биохими-
ческие реакции // Соросовский образовательный
журнал.–1999.– №6.– С. 25–32.
Владимиров Ю.А., Арчаков А.П. Перекисное окисление
липидов в биологических мембранах.– М.: Наука, 1972.–
252 с.
Карнаухов В.Н. Люминесцентный анализ клеток.– Пу-
щино, 2002.– 131 с.
Петрова Л.Н., Ерошенко Ф.В. Структурная организация
фотосинтетического аппарата и качество зерна озимой
пшеницы // Научный журнал КубГАУ.– 2006.– №24(8).–
С. 5–6.
Тарусов Б.Н., Веселовский В.А. Сверхслабые свечения
растений и их прикладное значение.– М.: Изд-во МГУ,
1978.– 151 с.
Феофанов А.В. Спектральная лазерная сканирующая
конфокальная микроскопия в биологических исследова-
ниях // Успехи биологической химии.– 2007.– Т. 47.–
С. 371–410.
Цей А.А., Веселовский В.А., Тарусов Б.Н. Первичная
неспецифическая хемилюминесцентная реакция
растений в ответ на воздействие токсических факторов
среды // Сверхслабые свечения в медицине и сельском
хозяйстве.– М.: Изд-во МГУ, 1974.– Т. 50.– С. 77–85.
Lavorel J. On a relation between fluorescence and lumines-
cence in photosynthetic systems // In: Progress in photo-
synthetic research / Ed. by H. Metzner.– Tübingen, 1969.–
Р. 883–898.
Qinghua S., Zhiyi B., Zhujun Z. et al. Effects of different
treatments of salicylic acid on heat tolerance, chlorophyll
fluorescence, and antioxidant enzyme activity in seedlings
of Cucumis sativa L // Plant Growth Regulation.– 2006.–
Vol. 48, N2.– P. 127–135.
Поступила 27.04.2010
Рецензент А.И. Осецкий
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
данными о сохранности меристем при последую-
щем культировании. Влияние инкубации в раство-
рах как 1,2-ПД, так и ПВП оказалось практически
одинаковым. Оба криопротектора, как мы пола-
гаем, вызвали в клетках меристем стресс умерен-
ной интенсивности. Незначительность повреждаю-
щего действия данных криопротекторов подтверж-
дают данные о сохранности меристем винограда
при культивировании. Смесь данных криопротек-
торов практически не вызывает усиления окисли-
тельных процессов в клетках, в отличие от каждого
отдельного компонента смеси. Сохранность ме-
ристем после воздействия на них смеси криопро-
текторов выше, чем после воздействия каждого
криопротектора в отдельности.
References
Brayon A.V. Identification of undamaged and damaged cells
in fluorescent microscopy analysis // Visnyk of Kiev State
University. Series Biology.– 1967.– N9.– P. 125–127.
Vladimirov Yu.A. Fluorescence accompanying biochemical
reactions // Soros Educational Journal.– 1999.– N6.– P. 25–
32.
Vladimirov Yu.A., Archakov A.P. Lipid peroxidation in biological
membranes.– Moscow: Nauka, 1972.– 252 p.
Karnaukhov V.N. Luminescence analysis of cells.– Puschino,
2002.– 131 p.
Petrova L.N., Yeroshenko F.V. Structural organization of
photosynthetic apparatus and quality of fall wheat grain //
Scientific Journal of Kuban State Agrarian University.– 2006.–
N24(8).– P. 5–6.
Tarusov B.N. Veselovskiy B.A. Ultra-low plants fluorescence
and their applied value.– Moscow: Moscow State University,
1978.– 151 p.
Feofanov A.V. Spectral laser scanning confocal microscopy
in biological studies // Uspekhi Biologicheskoy Khimii.– 2007.–
Vol. 47.– P. 371–410.
Tsey A.A., Veselovskiy V.A., Tarusov B.N. Primary nonspecific
hemiluminescence response of plants to influence of
environmental toxic factors // "Ultra-low fluorescence in
medicine and agriculture".– Moscow: Moscow State
University, 1974.– Vol. 50.– P. 77–85.
Lavorel J. On a relation between fluorescence and lumines-
cence in photosynthetic systems // In: Progress in photo-
synthetic research / Ed. by H. Metzner.– Tübingen, 1969.–
Р. 883–898.
Qinghua S., Zhiyi B., Zhujun Z. et al. Effects of different
treatments of salicylic acid on heat tolerance, chlorophyll
fluorescence, and antioxidant enzyme activity in seedlings
of Cucumis sativa L // Plant Growth Regulation.– 2006.–
Vol. 48, N2.– P. 127–135.
Accepted in 27.04.2010
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
