Журнал - Проблемы криобиологии 2010 №3
Подождите немного. Документ загружается.


263
problems
of cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
полностью предотвращало наблюдаемое в конт-
роле снижение активности каталазы и Г6ФДГ после
ГХ. Последующая реперфузия нивелировала этот
эффект, полученные данные не отличались от
контрольных значений. Активность ГП тоже была
достоверно выше контроля только после ГХ, хотя
и не достигала интактного уровня. Исключение
составляла ГР, активность которой была выше
показателей контрольной группы как после ГХ, так
и после НР, но ниже значения интактной группы.
Некоторое несоответствие в динамике глутатион-
зависимых ферментов и Г6ФДГ можно объяснить
следующим образом. Снижение активности ГП
после реперфузии, видимо, связано не с недостат-
ком субстрата (восстановленного глутатиона), а с
повреждением самого фермента. Косвенным сви-
детельством этого предположения является сох-
ранение на всех этапах эксперимента высокой
активности ГР, которая катализирует реакцию
восстановления окисленного глутатиона. В этом
случае ее субстратом после реперфузии, видимо,
служит окисленный глутатион, образованный не-
ферментативно, в результате непосредственного
взаимодействия GSH cо свободными радикалами
[10].
Глутатионредуктаза, как известно, является
НАДФН-зависимым ферментом. Образование
НАДФН в пентозофосфатном шунте обеспечивает
работа Г6ФДГ. Однако в связи с тем, что её актив-
ность в присутствии БФ достоверно выше конт-
рольных значений только после ГХ, можно предпо-
ложить, что необходимый для глутатионредуктазы
НАДФН после реперфузии поступает от других
НАДФН-генерирующих систем (малик-фермент,
изоцитратдегидрогеназа), которые могут частично
компенсировать количество восстановленных
эквивалентов [12].
Защитное действие присутствия ДНФ в среде
хранения главным образом проявлялось на этапе
НР. Исключением являлась ГР, активность которой
была выше контрольных значений только после ГХ,
а поступление GSH после реперфузии для нормаль-
ного функционирования ГП объяснялось его био-
синтезом de novo с помощью гамма-глутаминцис-
теинилсинтетазы, а не восстановлением редукта-
зой. В условиях НР удаление ДНФ происходило
постепенно, а значит и мембранный потенциал,
который снизился во время ГХ, восстанавливался
постепенно, тем самым не создавая предпосылок
для быстрого образования АФК и инициации ПОЛ.
Так как защитный эффект ДНФ реализуется на
этапе НР только после его удаления, чего не наблю-
дается в случае с БФ, можно предположить, что
различие в их действии заключается в том, что
ДНФ связывается сывороточным альбумином [3]
и практически полностью удаляется из митохонд-
as for the enzymes of antioxidant defense was revealed
mainly at the stage of HS. Its presence in storage
medium completely prevented the observed in the con-
trol reduction of activity of catalase and G6PDH after
HS. Following reperfusion neutralizes this effect, the
findings did not differ from the control values. Activity
of GP was statistically higher than the control only af-
ter HS, though it did not reach the intact level. The
exception was GR, the activity of which was higher
than the indices of the control group both after HS and
after NR, but lower than those of the intact group.
Some mismatching in the dynamics of glutathione-
dependent enzymes and G6PDH may be explained as
follows. The decrease in GP activity after reperfusion
is likely related not to the lack of substrate (reduced
glutathione) but to the damage of the enzyme itself.
Indirect proof of this supposition is the keeping of high
activity of GR at all the stages of the experiment, which
catalyzes the reaction of reduction of the oxidized glu-
tathione. In this case its possible substrate after
reperfusion perhaps serves oxidized glutathione, formed
not with enzymes as a result of direct interaction of
GSH with free radicals [10].
Glutathione reductase as it is known is NADPH-
dependent enzyme. The formation of NADPH in
pentosophosphate shunt is provided by the activity of
G6PDH. However, due to the fact that its activity in
BF presence is statistically higher than the control val-
ues only after HS one can suppose that essential for
GR NADPH after reperfusion comes from other
NADPH-generating systems (malic-enzyme, isocitrate
dehydrogenase), capable of partial compensation of the
number of reduced equivalents [12].
Protective effect of DNP presence in the storage
medium was mainly manifested at the NR stage. The
exception was GR, the activity of which was higher
than the control values only after HS, and GSH enter-
ing after reperfusion for normal functioning of GP was
explained by its biosynthesis de novo by means of
gamma-glutamine cycteinyl synthetase, but not reduc-
tion with reductase. Under NR conditions DNF was
removed gradually and therefore the membrane po-
tential, which was reduced during HS recovered gradu-
ally, thereby not creating the preconditions for a rapid
ROS formation and LPO initiation.
Since the protective effect of DNP is implemented
at the stage of NR just after its removal, that is not
observed in the case with BF, one may suppose that
the difference in their effect consists in the fact that
DNP binds the serum albumin [3] and is quite com-
pletely removed from mitochondria during washing-out
prior to NR, enabling them to recover of the integrity
of metabolic processes. As for the BF, according to
the data on its pharmokinetics [7] it in a greater extent
circulates in blood in a free state (only 30% of prepara-
tion is bound with plasma proteins), i. e. its potential

264
problems
of cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
рий в ходе отмывки перед НР, позволяя им восста-
новить целостность метаболических процессов.
Что же касается БФ, то согласно данным о его
фармакокинетике [7], он в большей степени цирку-
лирует в крови в свободном виде (только 30%
препарата связывается с плазменными белками),
т. е. его потенциальная способность связаться с
альбумином и быть удаленным из печени перед
реоксигенацией достаточно мала. Таким образом,
несмотря на то, что это свойство относится к преи-
муществам БФ с точки зрения фармакологической
эффективности, оно же существенно минимизирует
возможность удаления препарата из печени при НР
и снижает потенциал его применения как компо-
нента консервирующего раствора. В связи с этим
поиск веществ, которые обладают свойствами
"мягкого разобщителя", но при необходимости
могут быть удалены на этапе НР, остаётся ак-
туальным для разработки новых подходов в ГХ
органов.
Выводы
1. На изолированных митохондриях печени
крыс показано, что разобщающее действие БФ
обусловлено увеличением протонной проводимости
внутренней мембраны.
2. Введение БФ в среду ГХ печени крыс вызы-
вало разобщение ОФ, что сопровождалось сниже-
нием базального уровня ТБК-активных продуктов
и предотвращением снижения активности анти-
оксидантных ферментов.
3. На этапе НР положительный эффект БФ на
перекисные процессы и систему антиоксидантной
защиты значительно ослаблялся, что ограничивает
перспективу его применения как компонента сред
ГХ органов.
ability of binding with albumin and be removed from
liver prior to re-oxygenation was quite low. Thus, in
spite of fact that this property is related to the advan-
tages of BF as for pharmacological efficiency, it sig-
nificantly minimizes the possibility of the preparation
removal from liver during NR and reduces the poten-
tial of its application as the component of preservation
solution. In this connection the search for the sub-
stances with the properties of "mild uncouper", which
may be removed if necessary at the stage of NR, has
remained an actual one for the designing the new ap-
proaches in organ HS.
Conclusions
1. In rat liver isolated mitochondria there has been
shown that uncoupling effect of BF is stipulated with
an increase in proton conductivity of inner membrane.
2. Introduction of BF into HS medium of rat's liver
caused the uncoupling of OP, which accompanied with
the decrease in basal level of TBA-active products
and prevention of the reduction in the activity of anti-
oxidant enzymes.
3. At the stage of NR a positive effect of BF on
peroxidation processes and antioxidant defence sys-
tem was significantly wakened, that restricts the per-
spective of its application as the component of HS
media of organs.
References
Belous A.M., LemeshkoV.V., Yasajtis A.A. Halidor, 1-benzyl-
1(3'-dimethylaminopropoxy) cycloheptane fumarate as
uncoupler and inhibitor of respiratory chain // Biokhimiya.–
1976.– Vol. 41, N5.– P. 881–885.
Bojko A.N., Kabanov A.A., Kamchatnov P.R. et al. Application
of halidor in treatment of chronic brain ischemia // Stroke:
Annex to the Journal of Neurology and Psychiatry named by
S.S. Korsakov.– 2005.– Vol. 15.– P. 45–50.
Lujk A.I., Lukyanchuk V.D. Parameters of interaction of
nitrophenols of different chemical structure with albumin and
their toxicity// Vopr. Med. Khimii.– 1982.– N5.– P. 48–50.
Cherkashina D.V., Tkachova O.M., Somov O.Yu. et al. Effect
of 2,4-dinitrophenol on respiratory activity and ATP content
in rat liver after hypothermic storage and normothermic
reperfusion // Ukr. Biokhim. Zhurn.– 2008.– Vol. 80, N2.– P. 55–
59.
Cherkashina D.V., Tkachova O.M., Somov O.Yu. et al. Pro-
oxidant-antioxidant balance in rat liver after cold ischemia in
presence of 2,4-dinitrophenol and following reperfusion //
Dopovidi NAN Ukrainy.– 2007.– N10.– P. 168–173.
Barut I., Tarhan O. R., Kapucuoglu N. et al. Effect bencyclane
fumarate on intestinal ischemia reperfusion injury // ANZ J.
Surgery.– 2008.– Vol. 78, N6.– P. 476–481.
Bock P.R. A contribution to the pharmacokinetics of ben-
cyclane (Fludilat) in man // Int. J. Clin. Pharmacol. Biopharm.–
1976.– Vol. 13, N4.– P. 246–252.
De Felice F.G., Ferreira S.T. Novel neuroprotective, neurito-
genic and anti-amyloidogenic properties of 2,4-dinitrophenol:
the gentle face of Janus // IUBMB Life.– 2006.– Vol. 58, N4.–
P. 185–191.
1.
2.
3.
4.
5.
6.
7.
8.
Литература
Белоус А.М., Лемешко В.В., Ясайтис А.А. Галидор, 1-
бензил-1-(3'-диметиламинопропокси) циклогептан-
фумарат, как разобщитель и ингибитор дыхательной
цепи // Биохимия.– 1976.– Т. 41, №5.– С. 881–885.
Бойко А.Н., Кабанов А.А., Камчатнов П.Р. и др. Примене-
ние галидора в лечении хронической ишемии мозга //
Инсульт: приложение к журн. неврол. и психиат. им.
С.С. Корсакова.– 2005.– №15.– С. 45–50.
Луйк А.И., Лукьянчук В.Д. Параметры взаимодействия
нитрофенолов различного химического строения с
альбумином и их токсичность // Вопр. мед. химии.– 1982.–
№5.– С. 48–50.
Черкашина Д.В., Ткачова О.М., Сомов О.Ю. та ін. Вплив
2,4-динітрофенолу на дихальну активність та вміст АТФ
у печінці щурів після гіпотермічного зберігання та
нормотермічної реперфузії // Укр. біохім. журн.– 2008.–
Т. 80, №2.– C. 55–59.
Черкашина Д.В., Ткачова О.М., Сомов О.Ю. та ін.
Прооксидантно-антиоксидантний баланс у печінці щурів
1.
2.
3.
4.
5.

265
problems
of cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
після холодової ішемії в присутності 2,4-динітрофенолу
та наступної реперфузії // Доповіді НАН України .– 2007.–
№10.– C. 168–173.
Barut I., Tarhan O. R., Kapucuoglu N. et al. Effect bencyclane
fumarate on intestinal ischemia reperfusion injury // ANZ J.
Surgery.– 2008.– Vol. 78, N6.– P. 476–481.
Bock P.R. A contribution to the pharmacokinetics of ben-
cyclane (Fludilat) in man // Int. J. Clin. Pharmacol. Biopharm.–
1976.– Vol. 13, N4.– P. 246–252.
De Felice F.G., Ferreira S.T. Novel neuroprotective, neurito-
genic and anti-amyloidogenic properties of 2,4-dinitrophenol:
the gentle face of Janus // IUBMB Life.– 2006.– Vol. 58, N4.–
P. 185–191.
Estabrook R.W. Methods in Enzymology.– New York:
Academic Press, 1967.– 41 p.
Griffith O.W. Biologic and pharmacologic regulation of mam-
malian glutathione synthesis // Free Rad. Biol. Med.– 1999.–
Vol. 27, N9-10.– P. 922–935.
Krasinskaya I.P., Marshansky V.N., Dragunova S.F. et al.
Relationships of respiratory chain and ATP-synthetase in
energized mitochondria // FEBS Lett.– 1984.– Vol. 13, N167.–
P. 176–180.
Pandolfi P.P., Sonati F., Rivi R. et al. Targeted disruption of
the housekeeping gene encoding glucose 6-phosphate
dehydrogenase (G6PD): G6PD is dispensable for pentose
synthesis but essential for defense against oxidative stress //
EMBO J.– 1995.– Vol. 14, N21.– P. 5209–5215.
Sammut I.A., Thorniley M.S., Simpkin S. et al. Impairment of
hepatic mitochondrial respiratory function following storage
and orthotopic transplantation of rat livers // Cryobiology.–
1998.– Vol. 36, N1.– Р. 49–60.
Sewerynek E., Reiter R.J., Melchiorri D. et al. Oxidative
damage in the liver induced by ischemia-reperfusion:
protection by melatonin // Hepatogastroenterology.– 1996.–
Vol. 43, N10.– P. 898–905.
Singh I., Gulati S., Orak J.K. et al. Expression of antioxidant
enzymes in rat kidney during ischemia-reperfusion injury //
Mol. Cell Biochem.– 1993.– Vol. 125, N2.– P. 97–104.
Skulachev V.P. Lowering of intracellular O
2
concentration as
a special function of respiratory systems of cells // Bioche-
mistry.– 1994.– Vol. 59, N12.– P. 1433-1434.
Somov A.Yu., Semenchenko O.A., Green C. et al. Mitochon-
drial function after liver preservation in high or low ionic-
strenght solutions: a comparison between UW-based and
sucrose-based (SBS) solution // Cryoletters.– 2009.– Vol. 30,
N1.– P. 1–12.
Поступила 13.04.2010
Рецензент А.Ю. Семенченко
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
Estabrook R.W. Methods in Enzymology.– New York:
Academic Press, 1967.– 41 p.
Griffith O.W. Biologic and pharmacologic regulation of mam-
malian glutathione synthesis // Free Rad. Biol. Med.– 1999.–
Vol. 27, N9-10.– P. 922–935.
Krasinskaya I.P., Marshansky V.N., Dragunova S.F. et al.
Relationships of respiratory chain and ATP-synthetase in
energized mitochondria // FEBS Lett.– 1984.– Vol. 13, N167.–
P. 176–180.
Pandolfi P.P., Sonati F., Rivi R. et al. Targeted disruption of
the housekeeping gene encoding glucose 6-phosphate
dehydrogenase (G6PD): G6PD is dispensable for pentose
synthesis but essential for defense against oxidative stress //
EMBO J.– 1995.– Vol. 14, N21.– P. 5209–5215.
Sammut I.A., Thorniley M.S., Simpkin S. et al. Impairment of
hepatic mitochondrial respiratory function following storage
and orthotopic transplantation of rat livers // Cryobiology.–
1998.– Vol. 36, N1.– Р. 49–60.
Sewerynek E., Reiter R.J., Melchiorri D. et al. Oxidative
damage in the liver induced by ischemia-reperfusion:
protection by melatonin // Hepatogastroenterology.– 1996.–
Vol. 43, N10.– P. 898–905.
Singh I., Gulati S., Orak J.K. et al. Expression of antioxidant
enzymes in rat kidney during ischemia-reperfusion injury //
Mol. Cell Biochem.– 1993.– Vol. 125, N2.– P. 97–104.
Skulachev V.P. Lowering of intracellular O
2
concentration as
a special function of respiratory systems of cells // Bioche-
mistry.– 1994.– Vol. 59, N12.– P. 1433-1434.
Somov A.Yu., Semenchenko O.A., Green C. et al. Mitochon-
drial function after liver preservation in high or low ionic-
strenght solutions: a comparison between UW-based and
sucrose-based (SBS) solution // Cryoletters.– 2009.– Vol. 30,
N1.– P. 1–12.
Accepted in 13.04.2010
9.
10.
11.
12.
13.
14.
15.
16.
17.

266
* Автор, которому необходимо направлять корреспонденцию:
ул. Переяславская, 23, г. Харьков, Украина 61015; тел.:(+38
057) 373-38-71, факс: (+38 057) 373-30-84, электронная почта:
todrin@mail.ru
* To whom correspondence should be addressed: 23,
Pereyaslavskaya str., Kharkov, Ukraine 61015; tel.:+380 57 373
3871, fax: +380 57 373 3084, e-mail: todrin@mail.ru
Institute for Problems of Cryobiology and Cryomedicine of the Na-
tional Academy of Sciences of Ukraine, Kharkov, Ukraine
Институт проблем криобиологии и криомедицины
НАН Украины, г. Харьков
УДК 532.133
А.Ф. ТОДРИН*, Л.И. ПОПИВНЕНКО, С.Е. КОВАЛЕНКО
Теплофизические свойства криопротекторов.
II. Динамическая вязкость ряда криопротекторов, их растворов и смесей
UDC 532.133
A.F. TODRIN*, L.I. POPIVNENKO, S.YE. KOVALENKO
Thermophysical Properties of Cryoprotectants.
II. Dynamic Viscosity of Some Cryoprotectants, Their Solutions and Mixtures
Систематизированы данные разных литературных источников и выведены полиномиальные уравнения для расчета
динамической вязкости воды, 21 чистого криопротектора и водных растворов трех криопротекторов различной концентрации
в зависимости от температуры. Получены эмпирические зависимости для расчета динамической вязкости водных растворов
NaCl и KCl, водных растворов 38 криопротекторов и 18 смесей некоторых криопротекторов от концентрации при разных
температурах.
Ключевые слова: криопротектор, динамическая вязкость, эмпирические уравнения.
Систематизовано дані різних літературних джерел і виведено поліноміальні рівняння для розрахунку динамічної в’язкості
води, 21 чистого кріопротектора і водних розчинів трьох кріопротекторів різної концентрації в залежності від температури.
Отримано емпіричні залежності для розрахунку динамічної в’язкості водних розчинів NaCl і KCl, водних розчинів 38
кріопротекторів і 18 сумішей деяких кріопротекторів від концентрації при різних температурах.
Ключові слова: кріопротектор, динамічна в’язкість, емпіричні рівняння.
The article represent summarized literature data and derivation of polynomial equations to calculate the dynamics viscosity of
water, 21 pure cryoprotective agents and aqueous solutions of three cryoprotective agents in different concentrations depending on
temperature. Empirical equations for various concentration and temperatures were obtained to calculate dynamic viscosity of aqueous
solutions of NaCl and KCl, aqueous solutions of 38 cryoprotective agents and 18 mixtures of some cryoprotectants.
Key words: cryoprotective agent, dynamic viscosity, empirical equation.
problems
of
cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
Динамическая вязкость криопротекторов от-
носится к тем физико-химическим свойствам, ко-
торые играют значительную роль в защите био-
объектов при криоконсервировании. Например, чем
выше вязкость среды, тем требуется меньшая ско-
рость охлаждения для перевода ее в витрифици-
рованное состояние, что снижает вероятность пов-
реждения биообъектов при замораживании.
Однако в доступной литературе данные по
динамической вязкости часто разрознены и имеют
существенный разброс по величине. Кроме того,
табличные значения динамической вязкости в
зависимости от температуры или концентрации
криопротектора имеют большие различия по этим
величинам. Если учесть, что зависимости вязкости
криопротекторов как от температуры, так и от кон-
центрации имеют ярко выраженный нелинейный
характер, то интерполяция внутри этих интервалов
приведет к значительному отклонению величины
вязкости для промежуточных значений температур
или концентраций от истинного значения. В то же
время применение эмпирических зависимостей
динамической вязкости от температуры или кон-
Dynamic viscosity of cryoprotective agents (CPAs)
is referred to those physical and chemical properties,
playing an important role in the protection of biological
objects during cryopreservation. For instance, the
higher is the medium viscosity, the lower cooling rate
is required for its transition into a vitrified state, thereby
reducing the probability of damaging the biological
objects during freezing.
However, in available literature the data on dynamic
viscosity are frequently scattered and have significant
dispersion. In addition, the table values of dynamic vis-
cosity depending on temperature or concentration of
CPA differ greatly on these values. If to take into ac-
count that the viscosity dependencies both on tempe-
rature and concentration are of vividly manifested non-
linear character, then interpolation within these intervals
leads to significant deviation of the viscosity value for
intermediate temperature values or concentrations from
the true value. At the same time the application of
empiric dependencies of dynamic viscosity either on
temperature or concentration of CPA in the experimen-
tal data will allow to determine quite accurately the
value of viscosity for any concentrations or temperatures.

267
problems
of cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
Температура, °С Temperature, °C
Динамическая вязкость, сП
Dynamic viscosity, cP
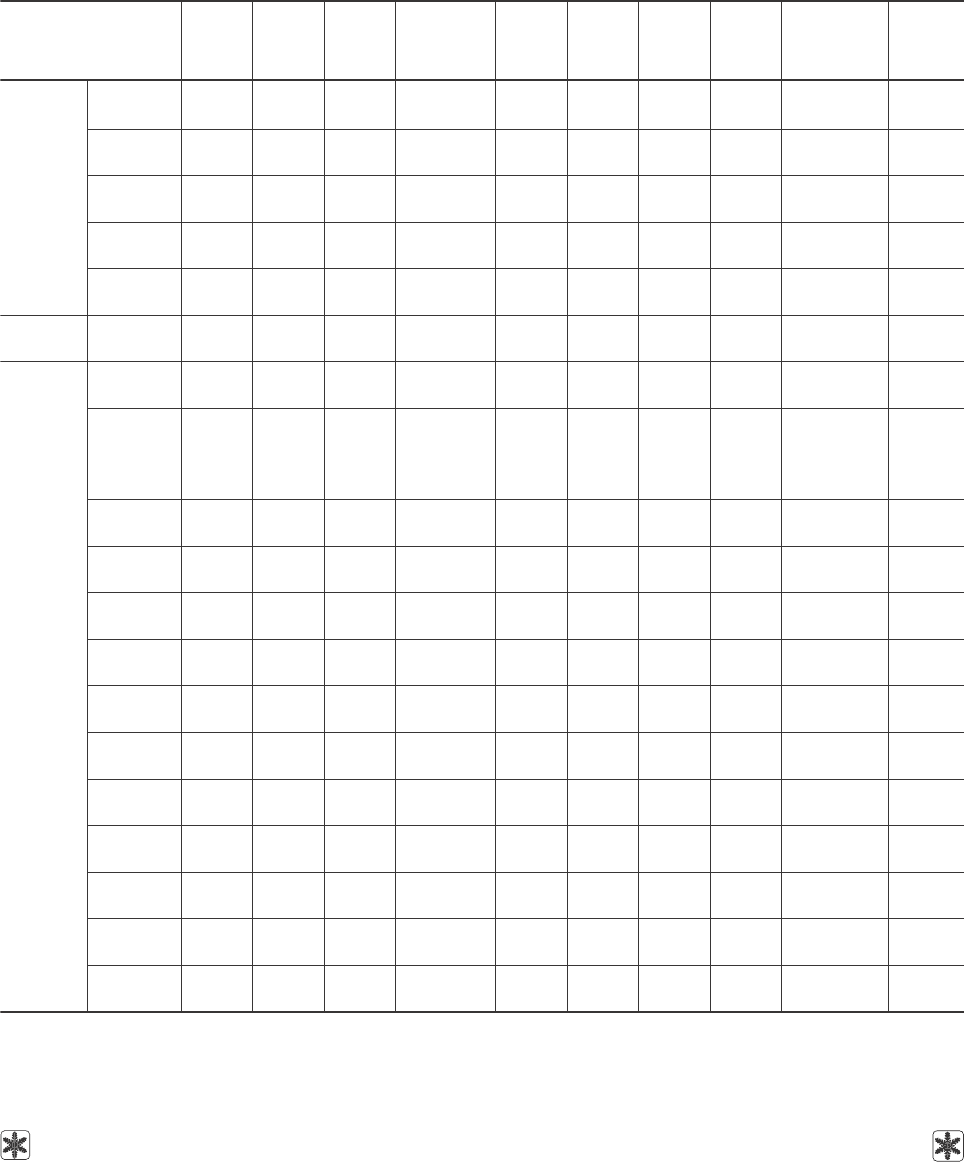
Зависимость динамической вязкости воды от температуры.
Dependence of water dynamic viscosity on temperature.
центрации криопротектора по экспе-
риментальным данным позволит с
достаточно высокой точностью опре-
делить значение вязкости для любых
значений концентраций или темпе-
ратур.
Цель работы – обобщение и сис-
тематизация литературных данных на
основе построения эмпирических
формул для расчета значений дина-
мической вязкости чистых криопро-
текторов, их водных растворов и
смесей в зависимости от массовой
концентрации и температуры.
Наряду с вязкостью криопротекто-
ров были обработаны литературные
данные по динамической вязкости
воды и водных растворов NaCl и KCl,
которые крайне важны как в жизне-
деятельности человека, так и в крио-
биологии.
The research aim was to summarize the literature
data on the base of deriving empiric formulae to
calculate the values of dynamic viscosity of pure CPAs,
their aqueous solutions and mixtures depending on mass
concentration and temperature.
Along with viscosity of CPAs there were processed
literature data on dynamic viscosity of water and
aqueous solutions of NaCl and KCl, which are
extremely important both for human vital activity and
cryobiology.
The values of dynamic viscosity of water depending
on temperature are taken from different sources [5, 7,
8, 14, 15 , 18, 27, 38, 56, 62, 69]. This dependence is
presented in Fig. 1.
The curve in Fig. 1 can be divided into two parts
(zone of positive temperatures and supercooling tem-
peratures), each of them is well described with poly-
nomials of the fifth degree in relation to the tempera-
ture. For water at positive temperatures the empiric
equation to calculate dynamic viscosity is as follows:
µ = –4,319×10
–10
t
5
+ 1,397×10
–7
t
4
– 1,837×10
–5
t
3
+
+ 1,313×10
–3
t
2
– 5,928×10
–2
t + 1,789,
where t is the temperature, °C
This equation enables to calculate the viscosity of
water within the range of temperatures from 0 to 100°C
at approximation dispersion
σ
2
= 0.9999. As the result
of calculations we obtain the value of dynamic viscosity
in centipoise (1 cP = 10
–3
Pa·s)
For supercooled water within the interval of tempe-
ratures –35...0°C the viscosity may be calculated with
the formula (at
σ
2
= 0.9998):
µ = –1,673×10
–6
t
5
– 1,093×10
–4
t
4
– 2,813×10
–3
t
3
–
– 2,699×10
–2
t
2
– 0,1548t + 1,780.
0
2
4
6
8
10
12
14
16
18
20
-40 -20 0 20 40 60 80 100
Значения динамической вязкости воды в
зависимости от температуры взяты из различных
источников [5, 7, 8, 14, 15, 18, 27, 38, 56, 62, 69]. Эта
зависимость представлена на рисунке.
Кривая на рис. 1 может быть разбита на две
части (зона положительных температур и зона пе-
реохлаждения), каждая из которых хорошо описы-
вается полиномами пятой степени относительно
температуры. Для воды при положительных тем-
пературах эмпирическое уравнение для расчета
динамической вязкости имеет вид:
µ = –4,319×10
–10
t
5
+ 1,397×10
–7
t
4
– 1,837×10
–5
t
3
+
+ 1,313×10
–3
t
2
– 5,928×10
–2
t + 1,789,
где t – температура, °С.
Это уравнение позволяет рассчитать вязкость
воды в диапазоне температур от 0
до 100°С при
дисперсии аппроксимации
σ
2
= 0,9999. В результате
расчета получаем значение динамической вязкос-
ти в сантипуазах (1 сП = 10
–3
Па·с).
Для переохлажденной воды в интервале темпе-
ратур –35...0°С вязкость может быть рассчитана
по формуле (при
σ
2
= 0.9998):
µ = –1,673×10
–6
t
5
– 1,093×10
–4
t
4
– 2,813×10
–3
t
3
–
– 2,699×10
–2
t
2
– 0,1548 t + 1,789.
Для чистых криопротекторов зависимость дина-
мической вязкости от температуры описывается
полиномом шестой степени:
µ = a
6
t
6
+ a
5
t
5
+ a
4
t
4
+ a
3
t
3
+ a
2
t
2
+ a
1
t
+ a
0
. (1)
Значения коэффициентов полинома a
6
÷a
0
(1) для
ряда криопротекторов представлены в табл. 1. Для

268
problems
of cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
соблюдения размерностей принимается: a
6
–
сП·°С
–6
, a
5
– сП·°С
–5
, a
4
–
сП·°С
–4
, a
3
– сП·°С
–3
,
a
2
– сП·°С
–2
, a
1
– сП·°С
–1
, a
0
– сП.
Такую же зависимость имеет динамическая
вязкость растворов криопротекторов от темпера-
туры.
Для определения динамической вязкости вод-
ных растворов криопротекторов в зависимости от
их массовой концентрации используется полино-
миальное уравнение:
µ = b
6
С
6
+ b
5
С
5
+b
4
C
4
+b
3
C
3
+b
2
C
2
+b
1
C
+b
0
, (2)
где С – массовая концентрация криопротектора, %.
Такой же вид имеет зависимость для расчета
динамической вязкости водных растворов NaCl и
KCl, а также для смесей криопротекторов. Значе-
ния коэффициентов b
6
÷b
0
полинома (2) для водных
растворов NaCl и KCl, водных растворов ряда крио-
протекторов и их смесей представлены в табл. 2–5.
Для смесей криопротекторов в качестве массовой
концентрации принимается концентрация второго
криопротектора. Коэффициенты уравнений (1) и (2),
не вошедшие в таблицы, равны нулю. Коэффи-
циенты b
6
÷b
0
имеют размерности сП.
Поскольку подготовка криопротекторов к рабо-
те в основном осуществляется при комнатной
температуре, мы вынесли в отдельную таблицу
значения коэффициентов полиномов для расчета
динамической вязкости ряда криопротекторов при
температуре 20°С (табл. 3).
В табл. 6 приведены коэффициенты уравнения
(1) для расчета динамической вязкости водных
растворов некоторых криопротекторов в зависи-
мости от температуры при разных концентрациях.
Литературные данные обрабатывали с по-
мощью программы Excel.
В таблицах даны следующие условные обоз-
начения: ДМСО – диметилсульфоксид; ДМФА –
диметилформамид; ДМАц – диметилацетамид;
ТЭГ – триэтиленгликоль; ДЭГ – диэтиленгликоль;
ФА – формамид; МФА – метилформамид; МАц –
метилацетамид; ЭГ – этиленгликоль; БД – бутан-
диол; ПД – пропандиол; ПЭО – полиэтиленоксид;
ОЭГ – оксиэтилированный глицерин; ПВП – поливи-
нилпирролидон; ОЭП – оксиэтилированный пенти-
эритрит.
Выводы
Получены эмпирические уравнения для расчета
динамической вязкости для воды, 21 чистого крио-
протектора и водных растворов трех криопротек-
торов различной концентрации в зависимости от
температуры.
For pure CPAs the dependence of dynamic viscosity
on temperature is described with the polynomial of the
six degree:
µ = a
6
t
6
+ a
5
t
5
+ a
4
t
4
+ a
3
t
3
+ a
2
t
2
+ a
1
t
+ a
0
. (1)
The values of polynomial coefficients a
6
÷a
0
(1)
for some CPAs are given in the Table 1. To keep di-
mensions it is assumed that: a
6
is сP·°С
–6
, a
5
– сP·°С
–5
,
a
4
–
сP·°С
–4
, a
3
– сP·°С
–3
, a
2
– сP·°С
–2
, a
1
– сP·°С
–1
,
a
0
– сP.
Dynamic viscosity of CPAs solutions have the same
dependence on temperature.
To examine dynamic viscosity of aqueous solutions
of CPAs depending on their mass concentration the
polynomial equation was used:
µ = b
6
С
6
+ b
5
С
5
+b
4
C
4
+b
3
C
3
+b
2
C
2
+b
1
C
+b
0
, (2)
where C is mass concentration of the CPA, %.
The same appearance has the equation for calcu-
lation of dynamic viscosity of aqueous solutions of NaCl
and KCl, as well as the mixture of CPAs. The values
of coefficients b
6
÷b
0
of polynomial (2) for aqueous
solutions of NaCl and KCl, aqueous solutions of some
CPAs and their mixtures are given in the Tables 2–5.
For the mixtures of CPAs as mass concentration the
concentration of the second CPA is assumed. The
coefficients of equations (1) and (2) not presented in
tables are equal to zero. Coefficients b
6
÷b
0
have the
dimensions of cP.
Since the preparing of CPAs for application is
mainly performed at room temperature we have
summarized in a separate table the values of polynomial
coefficients to calculate dynamic viscosity of some
CPAs at 20°C (Table 3).
Table 6 demonstrates the coefficients of the equa-
tion (1) to calculate dynamic viscosity of aqueous solu-
tions of some CPAs depending on temperature under
various concentrations.
The literature data were processed using Excel
software.
The following abbreviations are used in the Tables:
DMSO – dimethyl sulfoxide; DMFA – dimethyl form-
amide; DMAc – dimethyl acetamide; TEG – triethyle-
ne glycol; DEG – diethylene glycol; MFA – methyl
formamide; MAc – methyl acetamide; EG – ethylene
glycol; BD – butane diol; PD – propane diol; PEO –
polyethylene oxide; OEG – oxyethyl glycerol; PVP –
polyvinylpyrrolidone; OEP – exyethyl pentaerythrit.
Conclusions
There have been obtained empirical equations to
calculate dynamic viscosity of water, 21 pure CPAs
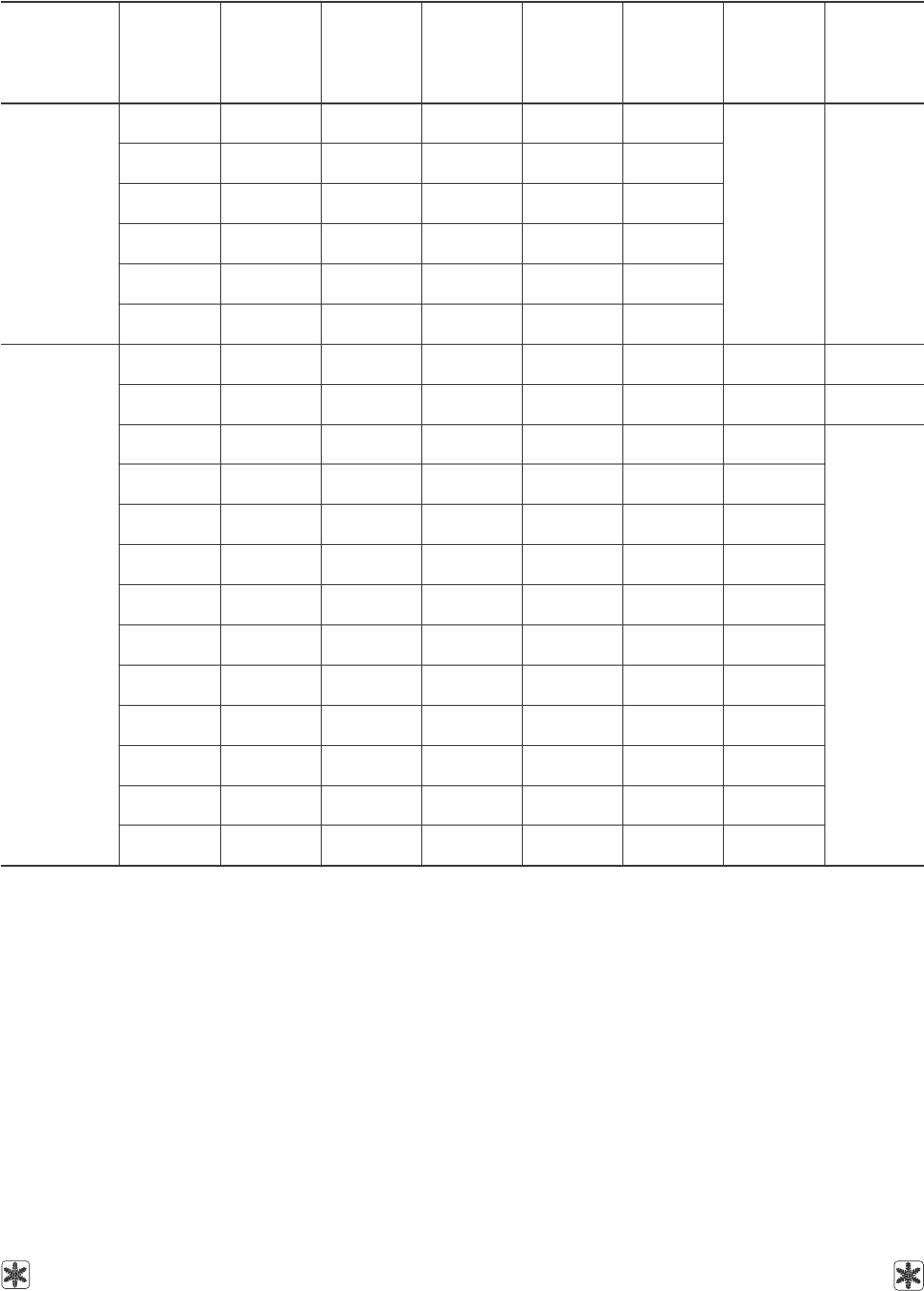
ЌовтсещеВ
ЌЌЌЌЌЌЌecnatsbuS
a
6
, × 01
01-
a
5
, × 01
8-
a
4
, × 01
6-
a
3
, × 01
4-
a
2
, × 01
3-
a
1
, × 01
2-
a
0
σ
2
нозапаиД
С°,рутарепмет
erutarepmeT
C°,egnar
кинчотсИ
ecnerefeR
ыдимА
sedimA
цАМД
cAMD
000 69500,0-4081,0331,2-633,16699,0521...0]96,42,4[
АФМД
AFMD
000 900,0-1091,0618,1-551,19699,008...01-
,45,84,8,4[
]96,86
цАМ
cAM
000 0 230,186,51-556,71579,006...03]96,4[
АФМ
AFM
000 0 41970,0301,3-524,25689,054...51]96,94,4[
АФ
AF
000 8708,0-624,870,33-852,79659,005...5]96,94,8,4[
дискО
edixO
ОСМД
OSMD
000 3561,0-472,245,21-359,35319,055...51
,03,32,61,4[
]96,35,54
ытрипС
slohoclA
нирецилГ
lorecylG
00 8,5361831-0131105224-63369469,007...02
,71,51,8,6[
]96,56,02
нирецилГ
-жалхоереп
йыннед
deloocrevO
lorecylg
000 0 72242007601-140219899,051...0]55[
ГЭД
GED
00 613,696,61-0618,876-8,8112999,0001...0
,74,42,4[
]06
лонатеМ
lonahteM
000 60000,0-49850,0751,1-3018,04096,0001...0
,34,92,72,8[
]96,26
ГЭТ
GET
00 762,2311,7-32,585,874-2,4111 001...02]96,06,4[
ГЭ
GE
000 59,11-8,7015,063-782,755699,004...01-
,92,02,8,4[
]34
лонатЭ
lonahtE
00 42350,05511,0-1449,0117,4-428,14999,0001...05-
,34,92,8,7[
]96,36,26
2,1 - ДБ
2,1 - DB
00 84,0354,65-1,8930,1531-2,9025779,056...01]96[
3,1 - ДБ
3,1 - DB
000 16,11-9,4129831-41,6233899,056...52]96[
4,1 - ДБ
4,1 - DB
000 674,4-43,797,037-4,0027399,009...02]96,42[
3,2 - ДБ
3,2 - DB
000 0 174,330,851-161,984546,056...52]96[
2,1 - ДП
2,1 - DP
127,771,04-76,3875,98-8,6252761-5,2424899,0051...0
,06,75,82,4[
]96,26,16
3,1 - ДП
3,1 - DP
000 19,1-82,3431,343-83,1012899,058...02]96[
269
problems
of cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
На основании имеющихся литературных дан-
ных получены полиномиальные уравнения для
расчета динамической вязкости водных растворов
NaCl и KCl, водных растворов 38 криопротекторов
и 18 смесей различных криопротекторов в зависи-
мости от концентрации при различных темпера-
турах.
and aqueous solutions of three CPAs of different
concentration depending on temperature.
Polynomial equations to calculate dynamic viscosity
of aqueous solutions of NaCl and KCl, 38 CPAs and
18 mixtures of different CPAs depending on concent-
ration under various temperatures were derived basing
on available literature data.
Таблица 1. Коэффициенты уравнения (1) для расчета динамической вязкости ряда чистых криопротекторов в
зависимости от температуры, дисперсии аппроксимаций и диапазоны температур применения уравнения
Table 1. Coefficients of the equation (1) to calculate dynamic viscosity of some pure CPAs depending on temperature,
dispersion of approximations and temperature ranges of equation application
ровтсаР
noituloS
,арутарепмеТ
С°
C°,erutarepmeT
b
3
, × 01
4-
b
2
, × 01
3-
b
1
, × 01
2-
b
0
σ
2
нозапаиД
йицартнецнок
%.ссам,С
noitartnecnoC
%,Cegnar
)m/m(
кинчотсИ
ecnerefeR
lCK
5276050,01161,0-8142,0398,09999,0
0÷ 83]93[
0328140,03731,0-3392,0797,09999,0
5335130,06790,0-9092,0917,09999,0
0451620,065180,0-9013,0256,09999,0
5434810,067740,0-7982,0695,09999,0
0528210,040420,0-5672,0745,06999,0
lCaN
03925,0867,076348,0297,10,10÷ 52]51[
510 34,1413,041,14899,00÷ 52]34[
020 33,0726,1200,12809,00÷ 53
]06,15,04,91,51[
520 63,0271,198,06699,00÷ 53
030 3,021,1108,02899,00÷ 53
530 72,0420,1917,08999,00÷ 53
040 22,0420,1456,05799,00÷ 53
540 12,0619,0695,07999,00÷ 53
050 91,0848,0945,08999,00÷ 53
550 61,0138,0405,07999,00÷ 53
060 5141,06208,0964,04899,00÷ 53
560 41,0537,05534,077999,00÷ 53
070 21,0307,01604,067999,00÷ 53
270
problems
of cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
Таблица 2. Коэффициенты уравнения (2) для расчета динамической вязкости водных растворов
NaCl и KCl в зависимости от концентрации и температуры, дисперсии аппроксимаций
и диапазоны концентраций применения уравнения
Table 2. Coefficients of the equation (2) to calculate dynamic viscosity of aqueous solutions NaCl and KCl
depending on concentration and temperature, dispersion of approximations and range
of concentrations of the equation application

ЌовтсещеВ
ЌЌЌЌЌЌЌecnatsbuS
b
6
, × 01
9-
b
5
, × 01
7-
b
4
, × 01
5-
b
3
, × 01
4-
b
2
, × 01
3-
b
1
, × 01
2-
b
0
σ
2
нозапаиД
,Сйицартнецнок
%.ссам
noitartnecnoC
)m/m(%,Cegnar
кинчотсИ
ecnerefeR
ыдимА
sedimA
диматецА
edimatecA
0000 3984,01062,0998,03099,00÷ 05]96[
цАМД
cAMD
00 12240,0-9125,0343,1-833,2200,16199,00÷ 59]96,95[
тсародоВ -
еымиров
ыремилоп
retaW
elbulos
sremylop
1=nГЭО
1=nGEO
000 815,19,5-92,11200,18999,00÷ 06]12,2,1[
2=nГЭО
2=nGEO
000 305,1448,5-51200,14999,00÷ 06]12,2,1[
4=nГЭО
4=nGEO
000 765,1463,5-92,51200,17999,00÷ 06]12,2,1[
5=nГЭО
5=nGEO
000 904,1330,4-28,11200,13999,00÷ 06]12,2,1[
6=nГЭО
6=nGEO
000 619,1865,6-95,71200,19999,00÷ 06]12,2,1[
7=nГЭО
7=nGEO
000 7892,07831,0215,3200,18999,00÷ 06]12,2,1[
8=nГЭО
8=nGEO
000 432,1830,2-747,4200,19999,00÷ 06]12,2,1[
9=nГЭО
9=nGEO
000 3196,03618,08914,0200,110÷ 06]12,2,1[
01=nГЭО
01=nGEO
000 9757,01081,0738,1200,19999,00÷ 06]12,2,1[
02=nГЭО
02=nGEO
0000 52,4897,1200,19799,00÷ 03]12,2,1[
03=nГЭО
03=nGEO
0000 627,165,11200,11859,00÷ 03]12,2,1[
ОЭП - 004
OEP - 004
0000 482,1930,3200,18499,00÷ 03
,61,01,1[
]02
ОЭП - 0001
OEP - 0001
000 371,110,2-527,6200,13859,00÷ 05
,61,01,1[
]02
ОЭП - 0051
OEP - 0051
0000 938,430,71200,14469,00÷ 03]9[
ОЭП - 0002
OEP - 0002
0000 568,3568,3200,1899,00÷ 03
,61,01,1[
]02
ОЭП - 0004
OEP - 0004
0000 710,9223,8200,12899,00÷ 03
,61,01,1[
]02
ытрипС
slohoclA
нирецилГ
lorecylG
369,324,7-723,514,71-90,6271,01-200,11899,00÷ 57
,31,21,8,1[
,83,53,02,61
,76,46,44
]96
нирецилГ
lorecylG
0250900383-0008460000845-000061320002193-3899,057 ÷ 001
ГЭ
GE
000 7921,097260,0-96,2200,16899,00÷ 06]25,31,3[
лонатЭ
lonahtE
00 9210,07442,0-7596,0108,4200,169,00÷ 001
,85,44,04,8[
]96
4,1 - ДБ
4,1 - DB
00 7852,0246,2-328,9337,1-200,13999,00÷ 001]96[
ыдовелгУ
obraC -
setardyh
азорахаС
esorcuS
0537,2904,2-839,7762,9-959,6200,16899,00÷ 05]66,46,83[
азолагерТ
esolaherT
000 6937,0999,1-80,6200,15589,00÷ 52]46[
271
problems
of cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
Таблица 3. Коэффициенты уравнения (2) для расчета динамической вязкости ряда водных
растворов криопротекторов в зависимости от концентрации при 20°С, дисперсии
аппроксимаций и диапазоны концентраций применения уравнения
Table 3. Coefficients of equation (2) to calculate dynamic viscosity of aqueous solutions of CPAs
depending on concentration at 20°C, dispersion of approximations and range
of concentrations of the equation application

овтсещеВ
ecnatsbuS
,арутарепмеТ
С°
,erutarepmeT
С°
b
6
, × 01
9-
b
5
, × 01
7-
b
4
, × 01
5-
b
3
, × 01
4-
b
2
, × 01
3-
b
1
, × 01
2-
b
0
σ
2
нозапаиД
йицартнецнок
%.ссам,С
noitartnecnoC
%,Cegnar
)m/m(
кинчотсИ
ecnerefeR
ыдимА
sedimA
АФМД
AFMD
520 84740,04801,0-5857,0858,1-535,3598,02379,00÷ 001]96[
цАМ
cAM
5300 306600,0-72020,05965,084,1127,0999,00÷ 001]96[
цАМ
cAM
04 000 61940,0-7996,0710,1656,01999,00÷ 57]96[
анивечоМ
aerU
5200 60240,0-2774,0855,1-599,2398,09499,00÷ 54]63[
АФМ
AFM
5200 418200,079380,0-8915,0351,1598,05399,00÷ 001]96[
АФ
AF
5200 94800,05611,0-5875,02553,0-398,01999,00÷ 001
]96[0300 58600,032890,0-8235,09873,0-108,03999,00÷ 001
53 0000 31790,08451,0917,02799,00÷ 57
тсародоВ -
еымиров
ыремилоп
retaW
elbulos
sremylop
ПЭО
PEO
73 0000 2101,0874,77496,06899,00÷ 03]02,2,1[
.в.м(ПВП
)00001
.m.m(PVP
)000,01
5200 289,590,43-89,9795,24-398,03399,00÷ 05
[]82
5300 875,384,51-12,2279,2917,07599,00÷ 05
540 33,5266,42-79,683,911-88,75695,08399,00÷ 05
550 24,0172,8-83,3261,42-89,31405,05599,00÷ 05
272
problems
of
cryobiology
Vol. 20, 2010, №3
проблемы
криобиологии
Т. 20, 2010, №3
Таблица 4. Коэффициенты уравнения (2) для расчета динамической вязкости ряда водных растворов криопротекторов в зависимости от концентрации при
различных температурах; дисперсии аппроксимаций и диапазоны концентраций применения уравнения
Table 4. Coefficients of equation (2) to calculate dynamic viscosity of aqueous solutions of CPAs depending on concentration at different temperatures;
dispersion of approximations and range of concentrations of the equation application
Продолжение на следующей странице.
Next page to be continued.
