Журнал. Биотехнология. Теория и практика
Подождите немного. Документ загружается.


табанда (ИЭ=3,3; ИИ=5-8), балпанда
–(ИЭ=5,3; ИИ=5-6);
22. Argulus coregoni – табанда (ИЭ=2,6;
ИИ=5-9), қаракөзде (ИЭ=2,9; ИИ=8-10);
23. Caspiobdella caspica -шоқырда
(ИЭ=10,0 ; ИИ=3);
24. Myxobolus musculi – балпанда
(ИЭ=5,3; ИИ=3-8);
25. Myxosporidia – орыс бекіресінде
(ИЭ=10,0;ИИ=8-9), майшабақта (ИЭ=1,6;
ИИ=2-7), қылышта (ИЭ=33;ИИ=5);
2 сурет - Анизакид балаңқұртының орналасуы
51
Биотехнология. Теория и практика. № 20092
12. Caryophyllaes laticeps - табанда
(ИЭ=3,3; ИИ=3), қаракөзде (ИЭ=4,1;
ИИ=1-4);
13. Leptorhynchoides plagicephalus – орыс
бекіресінде (ИЭ=27,3; ИИ=1-8), парсы
бекіресінде (ИЭ=50,0; ИИ=4-5), шоқырда
(ИЭ=18,2 ; ИИ=5-26);
14. Pomphorhynchus laevis – орыс
бекіресінде (ИЭ=9,1; ИИ=7);
15. Dactylogyrus corni – табанда (ИЭ=6,1;
ИИ=4-10), балпанда (ИЭ=5,3; ИИ=5-6);
16. Dactylogyrus wunderi – табанда
(ИЭ=5,6; ИИ=1), қаракөзде (ИЭ=4,3;
ИИ=3-4);
17. Dactylogyrus sphyrna– қаракөзде
(ИЭ=6,7; ИИ=3-6);
18. Nitchia sturionis – орыс бекіресінде
(ИЭ=9,1; ИИ=2), парсы бекіресінде
(ИЭ=25,0; ИИ=5);
19. Amphilina foliacea – орыс бекіресінде
(ИЭ=9,1; ИИ=3);
20. Henneguya psorospermica –
көксеркеде (ИЭ=8,3; ИИ=6);
21. Caligus lacustris- ақмарқада (ИИ=11),
Ескерту: ИЭ= (инвазияның экстен
сивтілігі - %); ИИ= (инвазияның интенсив-
тілігі - дана)
Каспийдің кез келген координаттарынан
зерттелген балықтардың ішінде орыс
бекіресінде, парсы бекіресінде, шоқырда,
беріште, көксеркеде, майшабақта, табанда,
балпанда, ақмарқада, қаракөзде және
қылышта Anisakidae тұқымдасына жататын
балаң
құрттары жиі кездесетіні анықталды.
Бұлардың ақтық иелері итбалықтар және
балық жейтін құстар, ал аралық иесі төменгі
шаянтәрізділер бұлар судың планктонының
құрамында болады. Балықтар шаян
тәрізділермен қоректенгенде залалданып,
қосымша иесіне айналады. Итбалықтардың
миграция жасауы гельминттердің жұмырт
қаларының таралуына, ал залалданған
шаянтәрізділердің қозғалуы теңіз суындағы
балықтардың залалдануына себеп болады.
-
-
-
Anisakis, Сontraсаecum, Porrocecum
Балықтың ағзасында анизакид балаң
құрттары оның денесін жауып тұратын сірі
қабықтарында орналасады, ішкі ағза
ларының бетінде немесе ұлпасында, бұлшық
етінде жартылай мөлдір қабықта оралған
спираль тәріздес немесе созылған күйінде
кездеседі. Балаңқұртының түсі ақ-сарыдан
бастап, қызыл-қоңырға дейін болады. Балаң
құрттардың ұзындығы 4-см-ден 6 см-ге, ені
0,2-0,5 мм-ге дейін кездеседі.Анизакид
балаңқұрттарымен зақымданған балықтар
адамдар мен етқоректілердің денсаулығына
өте қауіпті. Балаңқұрттар балық тағамдары-
мен бірге асқорыту жүйесіне түскеннен
-
-
-

3 сурет – «Қазақстан Республикасының ұлттық биотехнология орталығы» РМК Иммунобио-
технология және иммунохимия зертханасының аға ғылыми кызметкері биология ғылымдарының
кандидаты Қ.Қ. Балтин теңіз экспедициясыкезінде зерттеу жүргізуде
өнімдерінің дәмін татуға болмайды, уақы-
тында қалдықтарды залалсыздандыру керек.
Балықтың қалдығын көлдерге және қоқыс-
тар төгетін жерлерге тастауға, шикі балық-
пен және оның қалдықтарымен үй жануар-
ларын қоректендіруге тыйым салынады.
Балық өнімдеріне ихтиопатологиялық
зерртеулер жүргізген кезде одан анизакидтің
тірі балаңқұрттары табылғанда, суыққа
қатырып- залалсыздандыруға жіберіледі.
Балықты залалсыздандырғаннан кейін тірі
және тіршілікке қабілетті анизакид балаң
құрттарының бар жоғын білу үшін зерттеу
жұмыстары қайталанады. Мұздату жолымен
залалсыздандыру талаптарының шарттары
орындалмағанда, балық-ет ұнын алу үшін
өндірістік өңдеуден өткізіледі.
-
Биотехнология. Теория и практика. № 20092
52
кейін, ішектің қабырға сына өтіп, сонда
түлейді, бірақ жыныстық жетілу кезеңіне
дейін дамымайды. Балаңқұрттардың тоғы-
шарлық етуінен кілегей қабықтары қабы-
нып, асқазан түйіліп ауырады және ас
қорыту жүйесі жұмысының бұзылуына,
организмнің улануына, әр түрлі аллергиялық
нәтижелердің ауыр түріне әкеліп соқтырады.
Сондықтан теңіз тағамдарының анизакид
балаңқұрттарымен залалдануын әрқашанда
қадағалау керек. Балықтарды өңдеумен
айналысатын адамдар, алдын-алу шарала-
рын сақтауға тиісті, оның ішінде, шикі
балықтың тартылған етінің және балық шикі
-
Таспа құрттардан Eubothrium crassum
орыс бекіресінің ішегінде (ИЭ=13,6%)
тоғышарлық етеді.Ұзындығы 15-25 см
болатын ақ түсті гельминт. Caryophyllaes
қоздырғышының сазан, табан және қаракөз
балықтарында 2 түрі табылды. Желбезекте,
балық денесінің үстінде шаянтәрізділер –
Caligus (ақмарқада, табанда, балпанда) және
балық биті - Argulus (табанда, қаракөзде:)
балықтың кейбір түрлерінде бар екені
анықталды. Diplostomum балаң құрттары
беріштің, көксеркенің, табанның, қара-
көздің, балпанның, ақмарқаның, сазанның
және орыс бекіресінің көздерінде бары
зерттеу барысында байқалды. Диплостомоз-
дың өте кең таралуы ақтық иелері шағала-
лармен және тағы басқа да балық жегіш
құстармен байланысты. Құстар көздері
көрмей қалған балықтарды судың бетінен
алып жеп, ішегінде 0,4-0,5 см сорғыш
құрттар пайда болады да, саңғырығымен су
Бекіре балықтардың ішек қуысында
тікен бастыларға жататын гельминт
Leptorhynchoides көп таралғаны анықталды.
Инвазияның экстенсивтілігі 18,2% -50,0%
аралығында болып, 26 данаға дейін
тоғышарлар кездесті.
Табанның, балпанның және қаракөздің
желбезектерінде Dactylogyrus қоздырғыш
тарының үш түрі бары зерттеу нәтижесінде
дәлелденді.
-

бетіне жұмыртқаларын шашып ауруды
таратады. Бұл ахуал көптеген көлдер мен
өзендердекездеседі.
құрттары метацеркарийлер
тұқы тектес балықтардың: (аққайран, шабақ,
қаракөз, қызыл қанат, қаяз, гольян) бұлшық
етінде орналасады, сондықтан балықтар
қосымша иесі болып есептеледі. Ал аралық
иелері Codiella туыстығына жататын ұлулар.
Әдеби деректерге жүгінсек, Codiella ұлу-
лары Каспийде, Жайықта және Қыйғашта
табылмаған, тек қана Еділ өзенінің бойында
ғана кездескен. Сондықтан залалданған
Жайық пен Қыйғаш өзендерінің теңізге
қосылатын аймақтарында зерттелген қара-
көз балықтарының бұлшық еттерін компрес-
сорий арқылы микроскоппен қарағанда
Opistorchis felineus-тің балаң құрттарымен
залалданған болып шықты. Описторхоз
адамдарда және етқоректі жануарларда
кездесетін, гельминттер арқылы жұғатын
ауру. Жыныстық жетілген қоздырғыш ақтық
иелерінің өт жолдарында, өт қабында, ұйқы
безінде тоғышарлық тіршілік етеді. Қоздыр-
ғыштың балаң
Әдебиеттер
1. Агапова А.И. Паразиты рыб водоемов Казахстана // «Наука» Казахской ССР. - Алма-
Ата, 1966.
2. Быховский Б.Е. Определитель паразитов пресноводных рыб СССР // Академия Наук
СССР. - Москва– Ленинград, 1962.
3. Головин Н.А., Бауэр О.Н. Ихтиопатология. – Москва: Мир, 2007.
4. Грищенко Л.И., Акбаев М.Ш., Васильков Г.В. Болезни рыб и основы рыбоводства. –
Москва:Колос, 1999.
5. СоторовП.П. Справочникветеринарноговрача-ихтиопатолога. – Москва,1999.
Қорыта айтқанда, Каспий теңізінде
ауланған балықтардың 15 түрін ихтио-
патологиялық зерттеу нәтижелері бойынша
Anisakidae тұқымдасына жататын Anisakis,
Сontraсаecum, Porrocecum тоғышарларының
жаппай таралуы бізді алаңдатады. Себебі
Каспий теңізінің балықтары Астана тағы
басқа да қалалардың базарларында сатылу-
да. Ал енді анизакидоз Каспийде ғана
табылып тұрған жоқ, шет елдерден келетін
балықтарда да (әсіресе майшабақтарда ) жиі
кездесіп жатады.
Описторхоздан жыл сайын елімізде 1,6-
2,0 мың адам емделуден өтеді. Осы
себептерге байланысты, зертханаларда
(базарлардың, өңірлік, облыстық) балық-
тарды тексерістен өткізген кезде, әсіресе
адамға жұғатын ауруларды анықтағанда,
ихтиопатологиялық зерттеу жұмыстарын
жоғарғы деңгейде жүргізуіміз керек.
53
Биотехнология. Теория и практика. № 20092
Резюме
Summary
В результате ихтипатологических исследований 15 видов рыб Каспийского моря выявлено широкое
распространение паразитов из семейства Anisakis, Сontraсаecum, Porrocecum.
As a result of ichthypatological researches of 15 species of fish of Kaspian Sea wide expansion of parasites from
Anisakis, Сontraсаecum, Porrocecum families were detected.
қаракөз балықтар Каспийге Еділ өзені
арқылы таралғаны дәлелденген.
Қорытынды
В связи с ухудшением экологии, увели-
чением роста социальнозначимых болезней
человека и животных в настоящее время
остро стоит вопрос поиска эффективных и
биологически безопасных средств, пред-
назначенных для профилактики и диагнос-
тики заболеваний человека и животных. В
настоящее время перспективной альтерна-
тивой традиционным диагностическим и
профилактическим препаратам являются
средства на биологической основе. В послед-
ние годы многими учеными ближнего и
дальнего зарубежья активно ведутся иссле-
дования по изучению свойств антиидио-
типических антител. Огромный научный и
практический интерес представляют анти-
идиотипические антитела вида Ат2β ,
УДК 619.616.981.42
ИНДУКЦИЯ СПЕЦИФИЧЕСКОГО ИММУННОГО ОТВЕТА
К АНТИГЕНУ БРУЦЕЛЛ С ПОМОЩЬЮ МОНОКЛОНАЛЬНЫХ
АНТИИДИОТИПИЧЕСКИХ АНТИТЕЛ
С.Г. Оспанова, Ш. Серикова, А.К. Булашев, С.З. Ескендирова, К.Т. Шенжанов,
Ж.А. Сураншиев
Казахский агротехнический университет им. С. Сейфуллина РК МСХ, г. Астана
В статье приведены результаты изучения возможности индукции специфического иммунного ответа к
антигену бруцелл с помощью моноклональных антиидиотипических антител. Показано, что в популяции
антиидиотипических антител (АИАТ), продуцируемых штаммами 2Д9 и 2G9 присутствуют АИАТ вида Ат2
несущие «внутренний образ» антигенабруцелли способные индуцировать соответствующий иммунный ответ.
,
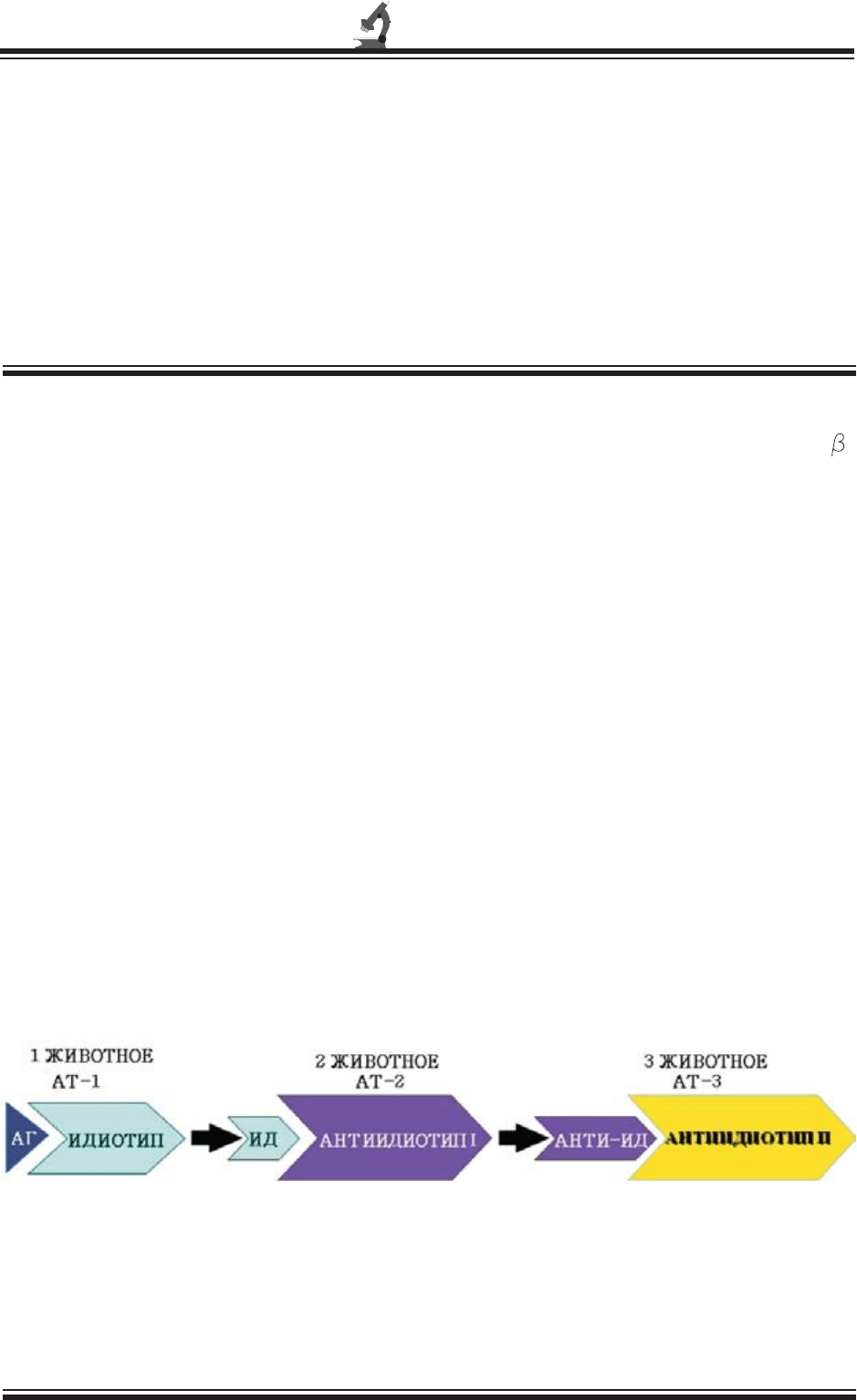
АГ АТ АД
АД
Схема получения антиидиотипических антител
- антиген; - идиотипические антитела; - антиидиотипические антитела (анти-ИД);
- антитела против анти-ИД (анти-анти-ИД)
Рис. 1.
12
3
Биотехнология. Теория и практика. № 20092
54
Введение
которые в соответствии с теорией сетевой
организации иммунной системы являются
«внутренним образом» исходного антигена.
Согласно данной теории, до антигенной
стимуляции все лимфоциты иммунной сис-
темы находятся в состоянии динамического
равновесия, обусловленного сложным ком-
плексом идиотип - антиидиотипических
взаимодействий. После введения антигена
равновесие нарушается. Сначала повышает-
ся концентрация специфических к антигену
антител и иммунных Т-лимфоцитов, что
сопровождается повышением концентрации
в организме идиотипов, которые в свою
очередь стимулируют формирование анти-
идиотипов. Процесс на этом не останавли-
вается. Могут формироваться антиидиотипы
ІІІ, IV генераций и т.д. (рисунок 1).

В последнее время появляется все
больше данных о возможности индукции
противоинфекционного иммунитета с
помощью антиидиотипических антител
(АИАТ). В научной литературе имеется
достаточно много сообщений об их
успешном использовании для защиты
животных от различных возбудителей
паразитарной, бактериальной и вирусной
природы [2,3, 4].
В настоящей работе исследовалась
возможность индукции антигенспецифи
ческого иммунного ответа к антигену
бруцелл у мышей линии BALB/c с
помощью моноклональных антиидио-
типических антител.
В работе использованы моно-
клональные антитела (МКА) к антигенам
бруцелл (антитела первого порядка –
АТ1), секретируемые гибридными клонами
7F10 [5], моноклональные анти-
идиотипические антитела, продуцируемые
штаммами гибридом 2G9 и 2D9, полученные
и охарактеризованные нами ранее [6],
поли-В антиген и единый бруцеллезный
антиген, моноспецифические бруцеллезные
антисыворотки, антивидовые иммуно-
глобулины, меченые пероксидазой хрена.
В качестве подопытных животных исполь-
зовали мышей линии BALB/c.
С целью изучения присутствия в
популяции моноклональных антител
иммуноглобулинов вида АТ2 , несущих
«внутренний образ» антигена бруцелл,
АИАТ были исследованы методом
иммуноферментного анализа (ИФА). Для
этого полистироловые планшеты сенси-
билизировали ксеногенными моноспеци
фическими сыворотками, положи-
тельными по бруцеллезу в концентрации
5 мкг/мл в бикарбонатном буфере рН 9,5.
Затем блокировали 1% раствором БСА в
течение 1 часа. После отмывки наносили
серийные разведения антиидиотипических
антител в фосфатно-солевом буфере с
добавлением 0,05% раствора твина, далее
обрабатывали конъюгатом кроличьих
-
-
Материалы и методы исследований
β
антител против иммуноглобулинов
мышей. Реакцию проявляли ортофенилен-
диамином. В качестве отрицательного
контроля использовали нормальную
сыворотку животных.
Для индукции антигенспецифического
иммунного ответа к антигену бруцелл
отдельные группы мышей линии BALB/c
иммунизировали антиидиотипическими
антителами в количестве 100 мкг на одно
животное, 4-кратно, с двухнедельным
интервалом. На 4-й день после последней
инъекции иммунную сыворотку тестиро
вали в ИФА на взаимодействие с
бруцеллезным антигеном. В качестве
положительного контроля использовали
сыворотку, полученную при иммунизации
поли-В антигеном. В качестве отрица
тельного контроля - сыворотку не иммуни
зированной мыши.
Согласно современной классификации,
известны 4 основных вида антиидио
типических антител, различающихся по
функциональной и иммунохимической
активности в зависимости от локализации
идиотопа, к которому они специфичны [7].
1. АТ2 антитела против детерминант
каркасных участков вариабельной области;
2. АТ2 гомотела, направленные
против паратопа антитела, следовательно,
имитирующие антигенные детерминанты,
т.е. несущие «внутренний образ» эпитопа
антигена внутри своего паратопа;
3. АТ2 антитела непосредственно
против идиотопов, ассоциированных с
антигенсвязывающими участками;
4. АТ2 эпитела, узнающие эпитопы
антигенов и гомологичные этим эпитопам
идиотопы антител (рисунок 2).
Из всех вышеназванных видов АИАТ,
особый интерес для науки представляют
антиидиотипические антитела вида АТ2
несущие «внутренний образ» антигена.
Поэтому нашей задачей являлось опре
деление среди популяций АИАТ именно
этих антител.
-
-
-
-
-
Результаты и обсуждение
α
β
γ
ε
β
–
–
–
–
,
55
Биотехнология. Теория и практика. № 20092

АГ - антиген; - идиотип антител АТ ; Ат2 , Ат2 , Ат2 , Ат2 - антиидиотипические антитела,
направленные к идиотипам АД
Рис. 2.
1
1
αβγε
Возможные локализации идиотипа относительно антигенсвязывающей области
Таблица 1
Взаимодействие антиидиотипических антител с ксеногенными сыворотками
в непрямом варианте ИФА
Одним из критериев характеристики
антиидиотипических антител как АТ2 по
сообщениям ряда авторов , является
способность АИАТ взаимодействовать с
ксеногенными антисыворотками, специфич-
ными к исходному антигену, так как только
АТ2 , несущие «внутренний образ» анти-
β
β
[7, 8]
гена, смогут связывать АТ1. Поэтому иссле
довали взаимодействие полученных нами
моноклональных антиидиотипических анти
тел с кроличьей поликлональной моно
специфической антисывороткой в реакции
иммуноферментного анализа. Результаты
исследования приведены в таблице 1.
-
-
-
Биотехнология. Теория и практика. № 20092
56
Как свидетельствуют данные таблицы 1,
исследуемые антиидиотипические антитела
взаимодействовали и с сывороткой КРС, и с
кроличьими антителами. Так, активность
АИАТ, продуцируемых штаммом гибридом
2G9, в реакции с сывороткой кролика
составил 1:3200, при взаимодействии с
сывороткой крупного рогатого скота -
1:1600. Антиидиотипические антитела
штамма 2D9 взаимодействовали с
сывороткой КРС в титрах - 1:1600, с
сывороткой кролика - 1:3200. Результаты
ИФА позволяют сделать заключение о
присутствии антиидиотипических антител
вида АТ2 являющихся «внутренним
образом» антигенов бруцелл. В качестве
отрицательного контроля учитывали
взаимодействие исследуемых антител с
β ,
окончании срока иммунизации, иммунные
сыворотки мышей исследовали на наличие
антител третьего порядка, способных
взаимодействовать с антигеном бруцелл.
Анализ проводили методом непрямого
твердофазного иммуноферментного
анализа. Для этого полистироловые
планшеты сенсибилизировали поли-В
антигеном и единым бруцеллезным
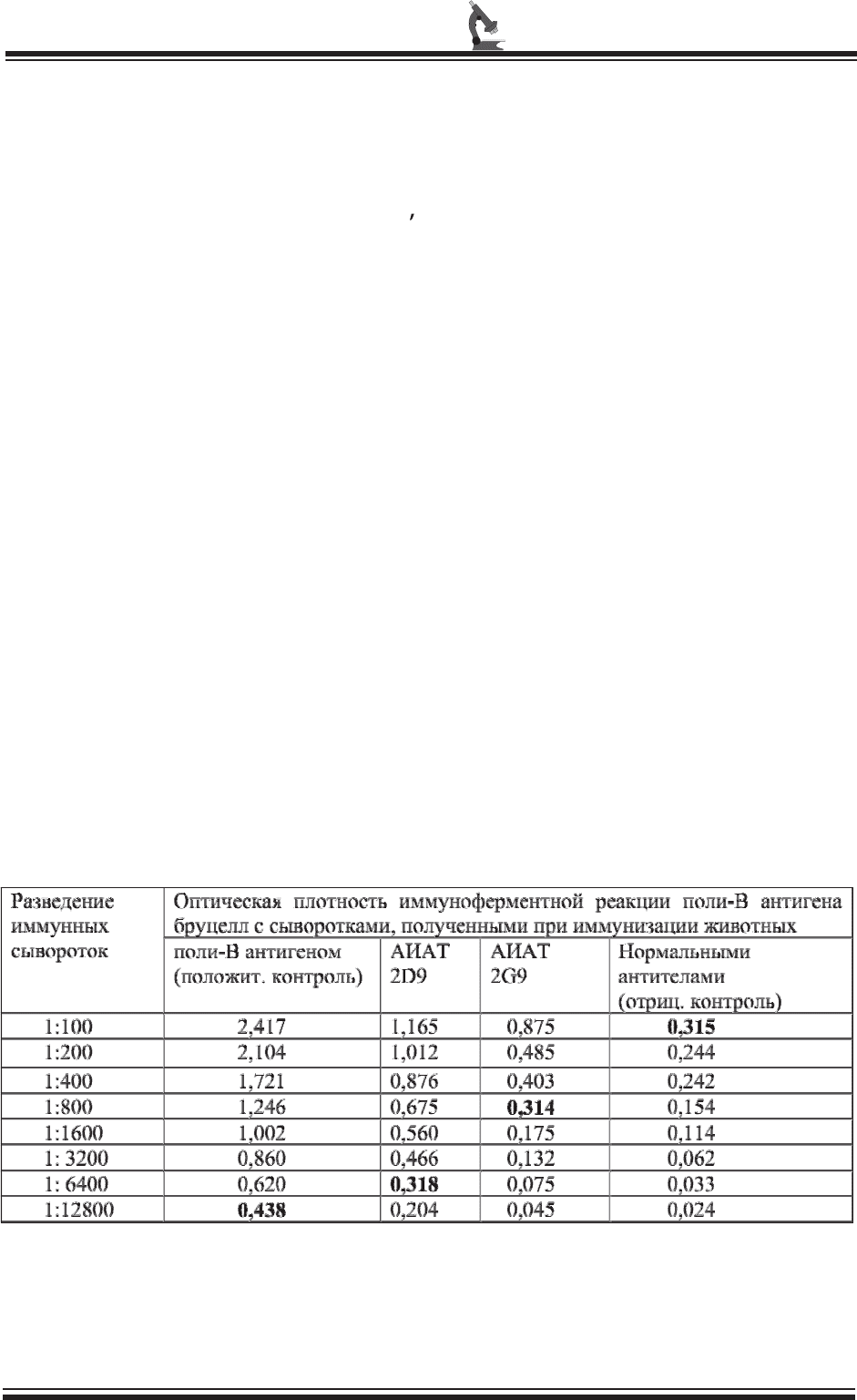
Таблица 2
Индукция специфического иммунного ответа к антигену бруцелл
с помощью моноклональных антиидиотипических антител
57
Биотехнология. Теория и практика. № 20092
нормальной сывороткой крупного рогатого
скота. Было отмечено неспецифическое
взаимодействие антиидиотипических
антител в разведении1:100.
Одним из значимых свойств АТ2
представляющих научный и практический
интерес,являетсяихспособность
индуцировать синтез гомологичных антител
третьего порядка (АТ3 или анти-АИАТ),
направленных против исходного антигена. С
целью определения протективных свойств
полученных антиидиотипических антител
были проведены серии иммунизаций
линейных мышей препаратами АИАТ. По
β
антигеном. Результаты ИФА показали, что в
анализируемых сыворотках (АТ3)
присутствуют антитела, специфически
связывающиеся с антигенами бруцелл
(таблица2).
Данные таблицы 2 показывают, что
полученные антиидиотипические антитела
при введении в организм подопытных
животных способны стимулировать синтез
антител третьего порядка (АТ3),
направленных против исходных антигенов
бруцелл, хотя и в сравнительно низких
титрах относительно положительного
контроля 1:12800. Так, титр опытных
сывороток, полученных при иммунизации
животных моноклональными АИАТ,
продуцируемыми штаммом гибридомы 2D9
в реакции иммуноферментного анализа с
поли-В антигеном и единым бруцеллезным
антигеном, соответственно, составил 1:6400.
Активность АИАТ, синтезируемых
штаммом гибридомы 2G9 в реакции с поли-
В антигеномбыла 1:800.

Таким образом, экспериментальные
исследования свойств моноклональных
антиидиотипических антител показали
возможность использования последних для
индукции в организме животных противо
бруцеллезного иммунногоответа.
-
мышей линии BALB/c, полученных при
иммунизации препаратами моноклональных
антиидиотипических антител, можно
сделать заключение о том, что в популяции
антиидиотипических антител, продуцируе
мых штаммами 2Д9 и 2G9, присутствуют
АИАТ вида Ат2 несущие «внутренний
образ» антигена бруцелл и способные
индуцировать соответствующий иммунный
ответ.
-
β ,
Литература
1. Jerne N.K., Towards a network theory of the immune system //Ann. Immunolog. – 1974. -
Vol. 125. - P. 373-378.
2. Шабдарбаева Г.С. Иммунологические аспекты конструирования диагностикумов на
основе антиидиотипии для выявления кровепаразитов животных: Автореф. … канд. биол.
наук. - Алматы, 2007.
3. Нестеренко В.Г. Антиидиотипические вакцины // Иммунология. - 1991. - №5.
4. Кущ А.А., Посевая Т.А., Симонов В.И. и др. Антиидиотипические антитела к вирусу
протогогерпеса типа 1 нейтрализуют инфекционную активность вируса // Вопросы
вирусологии. - 1991. - №4. - С. 312-314.
5. Булашев А.К. Моноклональные антитела в диагностике бруцеллеза. – Алматы,1995.
6. Оспанова С.Г., Серикова Ш. Получение моноклональных антиидиотипических
антител к антигенам бруцелл // Материалы международной научно-практической
конференции «Биотехнология в Казахстане: проблемы и перспективы инновационного
развития». – Алматы, 2008.
7. Федорова В.А., Девдариани З.Л. Перспективы создания экспериментальных
антиидиотипических вакцин против чумы // Инфекционная иммунология. – 2006. - №3. -
С. 144-148.
8. Протопопова Е.В., Хусаинова А.Д. и др. Получение и изучение свойств
антиидиотипических антител, несущих на своей поверхности гемагглютинирующие
паратопывируса клещевого энцефалита // Вопросы вирусологии.– 1996. - №2. - С. 50-53.
Биотехнология. Теория и практика. № 20092
58
Выводы
На основании результатов исследования
в иммуноферментном анализе сывороток
Түйін
Summary
Мақалада моноклоналды антиидиотиптік антиденелердің көмегімен, бруцелла антигеніне телімді
иммундық жауаптың түзілу мүмкіндігін зерттеу нәтижелері келтірілген. Бруцелла антигенінің «ішкі сипаты»
болатын Ат2 түріндегі АИАТ, 2Д9 және 2G9 гибридома штамдары өндіретін антиидиотиптік антиденелердің
популяциясында бар екендігі және оларды жануарларға енгізген кезде бастапқы антигенге телімді иммундық
жауаптың түзілетіндігі көрсетілген.
The results of studying of possibility an induction antigen-specific immune answer to brucella antigens with the
help monoclonal anti-idiotypic antibodies. In is shown, that anti-idiotypic antibodies kind Ат2 «the internal
image» brucella antigen, is presentat population anti-idiotypic antibodies produced by strains 2Д9 and 2G9 and their
introduction in an organism of animals stimulates the immune answer to an initial antigene.
β
β beingin

УДК 619:578:658.512(616-07)
РЕАКЦИЯ ИММУНОХРОМАТОГРАФИИ НА ОСНОВЕ
МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ДЛЯ ДИАГНОСТИКИ ЯЩУРА
СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
К.Н. Мукантаев
РГП «Национальный центр биотехнологии РК» КН МОН РК, г.Астана
В данной статье описаны исследования по разработке реакции иммунохроматографии на основе
моноклональных антител для диагностики ящура сельскохозяйственных животных. Определено, что
оптимальное соотношение латексных частиц и моноклональных антител составляет 3 мг к 1 мг, соответственно.
Оптимальной концентрацией моноклональных антител в растворе, необходимой для иммобилизации на
нитроцеллюлозную мембрану, является 1 мг в мл. Сравнительный анализ результатов традиционных методов
диагностики и реакции иммунохроматографии показал аналогичность полученных данных.
lii@biocenter.kz
Введение
В систему ветеринарно-профилактичес
ких и карантинных мероприятий, применя
емых при ликвидации ящура сельско
хозяйственных животных, входят вакцина
ция восприимчивого поголовья в угрожае
мых зонах, организация карантинных
мероприятий и уничтожение больных
животных, эффективность которых зависит
от своевременной и ранней диагностики [1].
Поэтому наиболее важным звеном в системе
мер борьбы с ящуром является проведение
диагностических исследований в полевых
условиях, что позволяет мгновенно
реагировать на возникновение очага болезни
и проводить своевременные карантинные
мероприятия.
Анализируя традиционные методы диаг-
ностики вирусных инфекций, становится
ясно, что эти методы не позволяют прово-
дить своевременные и адекватные меро-
приятия по ликвидации очага болезни, так
как они являются сложными лабораторными
методами [2, 3, 4]. Поэтому в 70-8-е годы
были разработаны реакции «нового поко-
ления», такие как иммуноферментный,
радиоиммунный, иммунофлуоресцентный
анализы, что позволило сделать заметный
шаг вперед в лабораторной диагностике.
Основной причиной эффективности этих
диагностических тестсистем является при-
менение особых меток, присутствие которых
или вызываемые ими физические и химичес-
-
-
-
-
-
кие феномены делают более доступной для
регистрации реакцию между антителом и
антигеном [5, 6]. К числу таких реакций,
нашедших в последнее время широкое при-
менение в медицине и ветеринарии, относит-
ся и реакция иммуно хроматографии.
Время постановки реакции, ее простота,
высокая чувствительность и специфичность,
на уровне иммуноферментного анализа, - все
это привело к широкому использованию его
в диагностике инфекционных и неинфек
ционных болезней, обнаружении биомоле-
кул, гормонов, гаптенов и т.п. [7, 8, 9, 10].
Более того, выгодные диагностические
характеристики реакции иммунохромато
графии позволяют использовать их в
полевых условиях. Это решает целый ряд
проблем, связанных с ликвидацией очага
инфекционных болезней. Во-первых,
приступить к проведению ликвидационных
мероприятий, не дожидаясь результатов
лабораторных исследований. Во-вторых,
исключает необходимость транспортировки
патологического материала, которая создает
определенную угрозу распространения
инфекции.
В связи с этим, целью исследования
является разработка реакции иммуно
хроматографии на основе моноклональных
антител для диагностики ящура сельско
хозяйственных животных.
Для достижения цели поставлены
-
-
-
-
-
59
Биотехнология. Теория и практика. № 20092

следующиезадачи:
- получение конъюгата моноклональных
антител против вируса ящура с латексными
частицами;
- разработка реакции иммунохрома
тографии для диагностики вируса ящура в
полевыхусловиях.
Для приготовления латексного конъюгата
моноклональных антител использовали кар-
боксимодифицированные латексные микро-
частицы диаметром 0,3 мкм. Латексные
частицы (2 мл 2,5%-ной взвеси) промывали
один раз при комнатной температуре
буфером, содержащим 2-(N-морфолино)
этаносульфоновой кислоты рН 5,5. До
инактивации латекс обрабатывали раство-
ром, содержащим карбодимид 1-этил-3-(-3-
диметиламинопропил)-карбодимида. Моно-
клональные антитела добавляли к активизи-
рованным микрочастицам к финальному
объему 3 мл и встряхивали в течение двух
часов на вортексе при комнатной темпера-
туре. Раствор бычьего сывороточного
альбумина в буфере, содержащем 0,5 М трис
рН 8,0, добавляли к микрочастицам, для
блокирования остающихся участков сцеп-
ления. Микрочастицы промывали три раза
трисбуфером (pH 8,0), содержащим БСА, и
хранили при 4°C до использования.
На полоску нитроцеллюлозной
мембраны размером 1 см на 5 см вносили
полоску моноклональных антител в
концентрации 1 мг/мл, объем МКА 50 мкл.
Вирус ящура типа А или бешенства
иммобилизовали в концентрации 1 мг/мл,
объем 50 мкл (проверочная полоса).
Полученную мембрану блокировали добав
лением реагента 3% БСА и инкубировали
при 37 С в течение 1 часа. Моноклональные
и вирусные антигены, а также БСА
растворяют в 0,5 М трис-буфере рН 8,0.
Высушивание мембраны проводили при
температуре 37°С в течение двух часов.
Мембраны с иммобилизованными
реагентами хранили при температуре 4°С
при влажности не более 15%.
-
-
Материалы и методы
Приготовление латексного конъюгата.
Иммобилизация моноклональных анти-
тел на нитроцеллюлозную мембрану.
22
о
Сборка компонентов тест-системы.
Реакция иммунохроматографии с
исследуемыми образцами. 100 мкл
исследуемого образца (положительный или
отрицательный контроль) разводили в 5 мл
буфера для образцов. 4 капли буфера для
образцов переносили на ватман для
образцов, расположенных на стрипе. Через
20 минут учитывали результат. Если на
стрипе проявились две полосы после
высыхания, то исследуемая проба считалась
положительной, если только одна нижняя
полоса - проба считалась отрицательной.
Полученные результаты свидетельствуют,
что тест-система работает правильно. В
случае отсутствия нижней полосы при
различных вариантах реакция считалась
недействительной.
Полученный латексный конъюгат диализо
вали в 2 мМ боратном буфере pH 7,2,
содержащем 5% сахарозы и пропитывали
полоску стекловолокна размером 1 см .
Пропитанные латексным конъюгатом кусоч
ки стекловолокна высушивали при 37°С в
течение 2 часов.
После высушивания кусочки стекло
волокна накладывали на подготовленные
нитроцеллюлозные мембраны, при этом
соединение ватмана с мембраной было
таким, чтобы обеспечить непрерывный
поток буфера для образца.
На оба конца полученной конструкции
накладывали пористый ватман размером
1 см . Ватман, расположенный над стекло
волокном, пропитанный конъюгатом, пред
назначен для образца. Ватман с противо
положной стороны - для обеспечения потока
жидкости.
Для фиксирования и надежного прикреп
ления компонентов тест-системы приме
нялся липкий пластырь. При соединении
необходимо сделать небольшое сдавливание
пакета для обеспечения более тесного
контакта компонентов тест-системы.
-
-
-
-
-
-
-
-
2
2
Биотехнология. Теория и практика. № 20092
60
С целью определения оптимальной
концентрации моноклональных антител,
конъюгируемых с латексами, нами проведен
ряд экспериментов, где применялись
различные концентрации моноклональных
антител. Качественные и количественные
Результаты и их обсуждение
