Войнов Н.А., Волова Т.Г., Зобова Н.В. Современные проблемы и методы биотехнологии
Подождите немного. Документ загружается.


ГЛАВА 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ЦЕЛЕВЫХ ПРОДУКТОВ
6.1. Методы выделения и очистки клеточных макромолекул для получения целевого биотехнологического продукта
Современные проблемы и методы биотехнологии. Учеб. пособие 291
иониты используют для предварительного разделения сложных смесей на
менее сложные. На ионном обмене основано получение ионнитного молока
для детского питания. Ионный обмен используют для очистки натуральных
соков от ионов тяжелых металлов. Ионообменные смолы применяют для по-
лучения ионообменных мембран.
Гель-фильтрация обычно используется и для разделения молекул, и
для определения их размеров. Колонки, предназначенные для гель-фильтрации,
заполнены крошечными пористыми инертными шариками; при использова-
нии таких колонок происходит разделение белков или других соединений по
размерам. Молекулы небольшого размера по мере прохождения через колон-
ку проникают внутрь шариков, а более крупные молекулы остаются в про-
межутках между шариками. В результате они быстрее проходят через колон-
ку и выходят из нее первыми (рис. 6.3
). В качестве матрикса можно исполь-
зовать зерна поперечно-сшитого полисахарида (декстран или агароза). Таким
образом, при помощи гель-фильтрации можно разделить смеси веществ в за-
висимости от размеров их молекул. Выход веществ из колонки происходит в
порядке уменьшения их молекулярной массы. Гельпроникающая хромато-
графия на колонке используется для очистки пестицидов, а также жирорас-
творимых витаминов перед их определением методом ВЖХ.
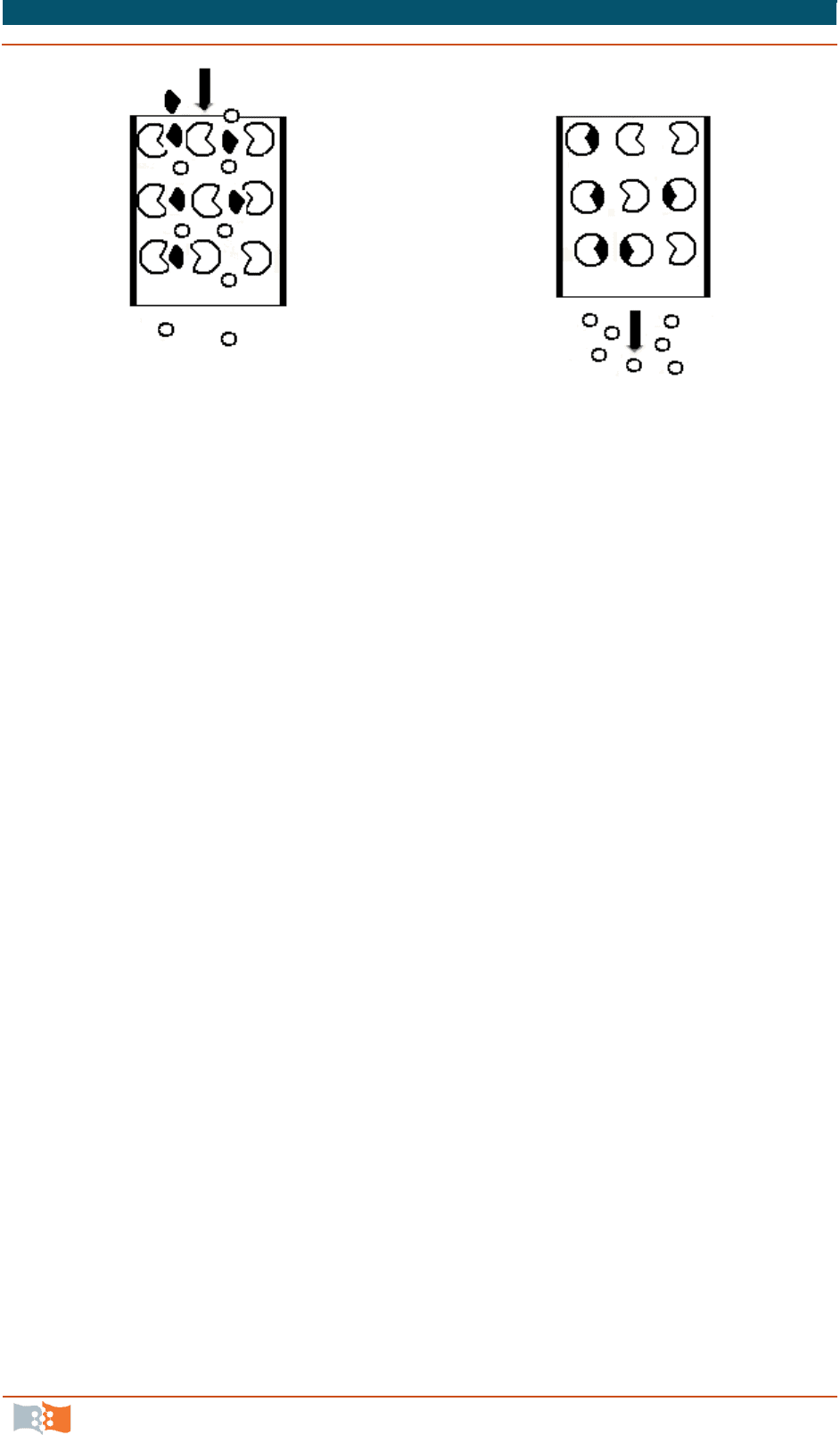
Гораздо более эффективен метод аффинной хроматографии (хрома-
тография по сродству). В основе этого метода лежат биологически важные
взаимодействия, происходящие на поверхности белковых молекул. При аф-
финной хроматографии используется нерастворимый матрикс, ковалентно
связанный со специфичными лигандами (антителами или субстратом фер-
ментов), которые присоединяют определенный белок. Связываемые иммоби-
лизованным субстратом молекулы фермента можно элюировать концентри-
рованными растворами субстрата в свободной форме, а молекулы, связанные с
иммобилизованными антителами, можно элюировать за счет диссоциации ком-
плекса антитело–антиген концентрированными растворами соли или раствора-
ми низкого или высокого рН. Однократная хроматография на такой колонке по-
зволяет зачастую достигнуть очень высокой степени очистки препарата.
а
б
Рис. 6.3. Хроматография на основе «молекулярных сит» (компонен-
ты, размеры которых соответствуют размерам пор или входов в по-
ры адсорбента, задерживаются на колонке): а, б – две стадии процесса
ГЛАВА 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ЦЕЛЕВЫХ ПРОДУКТОВ
6.1. Методы выделения и очистки клеточных макромолекул для получения целевого биотехнологического продукта
Современные проблемы и методы биотехнологии. Учеб. пособие 292
а
б
Рис. 6.4. Аффинная хроматография (в виде частиц различной формы
изображены молекулы с различными химическими структурами, из
которых только одна вступает в специфическое взаимодействие с
частицами геля. Показано, что в выемки на частицах геля входят
лишь молекулы комплементарной формы): а, б – две стадии процесса
Аффинная хроматография может обеспечить полную очистку продукта
из сложной многокомпонентной смеси – культуральной жидкости, экстракта
клеток – в одну стадию, в то время как более традиционные методы осажде-
ния и ионообменной хроматографии требуют многоэтапной очистки, сопря-
женной с большими затратами труда и времени. Определенные неудобства
вызывает относительная дороговизна материалов для аффинной хроматогра-
фии, в частности, веществ, используемых в качестве лигандов. Проблемой
является также быстрый выход колонки из строя при пропускании через нее
смесей, компоненты которых забивают промежутки между гелевыми части-
цами. Поэтому в производственных условиях колонки используются в пе-
риодическом, а не в непрерывном режиме.
После пропускания через колонку порции культуральной жидкости, из
которой выделяют продукт, частицы геля подвергают очистке. Методы очи-
стки основаны: а) на использовании гелевых частиц, превышающих по плот-
ности конгломераты веществ, закупоривающих колонку (различие в плотно-
сти позволяет очистить гель путем его избирательного осаждения или про-
точной промывки, уносящей только загрязняющие частицы); б) на придании
частицам геля магнитных свойств, что позволяет провести их очистку в гра-
диентном магнитном поле; в) на упаковке частиц геля в виде ленты, покры-
той тонкоячеистой оболочкой (лента вращается и проходит попеременно че-
рез жидкость с неочищенным продуктом и через буферный раствор, в кото-
рый переходят загрязняющие примеси).
Масштабирование процесса аффинной хроматографии ограничивается
разрушением структуры геля и уносом его частиц током жидкости. Это в ча-
стности обусловлено тем, что в широких колонках для крупномасштабной
очистки продуктов стенки колонки уже не служат опорой для частиц геля,
увлекаемых жидкостью. Увеличение высоты колонки приводит к пропорцио-

ГЛАВА 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ЦЕЛЕВЫХ ПРОДУКТОВ
6.1. Методы выделения и очистки клеточных макромолекул для получения целевого биотехнологического продукта
Современные проблемы и методы биотехнологии. Учеб. пособие 293
нальному возрастанию сил, разрушающих нижние слои геля. Помимо этого,
для повышения эффективности и степени разделения близких по свойствам со-
единений целесообразно применять мелкие частицы геля (менее 1 мкм в попе-
речнике), но именно такие частицы легче всего увлекаются током жидкости.
В последние годы изыскивают средства укрепления гелей для крупномас-
штабной аффинной хроматографии. Частицы агарозы – наиболее перспек-
тивного материала для гелей – предполагают укреплять путем сшивок.
Наряду с аффинной хроматографией, называемой также аффинной ад-
сорбцией в геле, для крупномасштабного отделения и очистки продуктов
биотехнологических процессов предполагают применять аффинную преци-
питацию и аффинное разделение. При аффинной преципитации лиганд при-
крепляют к растворимому носителю. При добавлении смеси, содержащей со-
ответствующий белок, образуется его комплекс с лигандом, который выпада-
ет в осадок сразу после его формирования или после дополнения раствора
электролитом. Аффинное разделение основано на применении системы, со-
держащей два водорастворимых полимера. Один из полимеров, например
полиэтиленгликоль, несет специфические лиганды. Другой полимер, напри-
мер высокомолекулярный декстран, обладает сродством к остальным, при-
месным компонентам. Так, содержащиеся в разделяемой смеси белки, нук-
леиновые кислоты, фрагменты клеточных структур предпочитают более по-
лярный декстран, тогда как целевой продукт, скажем, фермент, накапливает-
ся «в сетях» полиэтиленгликоля, несущего молекулы лиганда (субстрата, ко-
фактора, ингибитора). Аффинное разделение – наиболее высокоэффективный
из аффинных методов очистки
Гидрофобная хроматография. В ходе создания носителей для аффин-
ной хроматографии были проведены контрольные опыты, в которых изуча-
лось поведение матриц, содержащих удлиняющие мостики, но без лиганда.
Оказалось, что в некоторых случаях ферменты прочно связывались с гекса-
метиленовыми мостиками. Этот факт послужил основой для развития мето-
дов гидрофобной хроматографии, основанных на связывании белка в резуль-
тате взаимодействия между алифатической цепью адсорбента и соответст-
вующим гидрофобным участком на поверхности белковой глобулы. Гидро-
фобные взаимодействия усиливаются с повышением концентрации соли.
Максимальное усиление вызывают соли, проявляющие наибольшую актив-
ность при высаливании, такие как сульфат аммония. Это объясняется тем,
что в основе обоих процессов лежат одинаковые механизмы. При высалива-
нии основной причиной агрегации является усиление гидрофобных взаимо-
действий между белками. Следовательно, при высоких концентрациях соли
большинство белков будут адсорбироваться на гидрофобных группах, свя-
занных с матрицей. Элюцию проводят понижающимся градиентом концен-
трации соли. Белки, которые прочно адсорбируются, обычно удаляют с ко-
лонки, добавляя в элюирующий раствор этиленгликоль.
Наряду с хроматографией перспективными для биотехнологии метода-
ми разделения веществ служат электрофорез и его модификации.

ГЛАВА 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ЦЕЛЕВЫХ ПРОДУКТОВ
6.1. Методы выделения и очистки клеточных макромолекул для получения целевого биотехнологического продукта
Современные проблемы и методы биотехнологии. Учеб. пособие 294
Электрофорез – метод разделения белков и нуклеиновых кислот в
свободном водном растворе и пористом матриксе, в качестве которого можно
использовать полисахариды, например, крахмал или агарозу.
Биомолекулы
обычно несут суммарный положительный или отрицательный заряд, обу-
словленный наличием на их поверхности положительно или отрицательно
заряженных групп аминокислот. Если белковые молекулы поместить в элек-
трическое поле, они начинают перемещаться со скоростью, которая опреде-
ляется их суммарным зарядом, а также формой и размерами.
В середине 60-х гг. был разработан модифицированный метод элек-
трофореза – электрофорез в полиакриламидном геле в присутствии додецил-
сульфата натрия (ДСН-ПААГ). При использовании данного метода белки
мигрируют в инертном матриксе-полиакриламидном геле с высоким содер-
жанием поперечных сшивок. Обычно гель готовят полимеризацией мономе-
ров непосредственно перед использованием. Размеры пор геля могут быть
подобраны произвольно с тем, чтобы гель мог замедлить миграцию опреде-
ленных молекул. При этом белки находятся в растворе, содержащем мощ-
ный, отрицательно заряженный детергент – додецилсульфат натрия или ДСН
(SDS). Связываясь с гидрофобными участками белковой молекулы, этот де-
тергент вызывает развертывание белковых молекул в длинные вытянутые
цепи. Каждая молекула белка связывает значительное количество молекул
детергента, приобретая суммарный отрицательный заряд. По этой причине
белок после того, как будет приложено напряжение, начнет двигаться в на-
правлении положительного электрода. Белки одного размера ведут себя
сходным образом, поскольку, во-первых, их природная структура полностью
нарушена ДСН так, что их форма идентична, во-вторых, они связывают оди-
наковое количество ДСН и приобретают одинаковый негативный заряд.
Крупные белки, обладающие большим зарядом, подвергаются действию зна-
чительных электрических сил, а также более существенному торможению.
В обычных растворах эти эффекты, как правило, взаимно погашаются, но в
порах полиакриламидного геля, действующего как молекулярное сито,
большие молекулы тормозятся значительно сильнее, чем малые, поэтому
оказываются ближе к стартовой линии. Смесь молекул делится на ряд полос,
расположенных в соответствии с их молекулярной массой. Выявить эти по-
лосы можно путем окрашивания соответствующим красителем. Например,
белки идентифицируются красителем кумасси синим. Известно, что близко
расположенные полосы в геле могут перекрываться. Этот эффект препятст-
вует выявлению большого количества белков (не больше 50) с помощью од-
номерных методов их разделения.

ГЛАВА 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ЦЕЛЕВЫХ ПРОДУКТОВ
6.1. Методы выделения и очистки клеточных макромолекул для получения целевого биотехнологического продукта
Современные проблемы и методы биотехнологии. Учеб. пособие 295
Рис. 6.5. Мини-камеры для горизонтального и вертикального электрофоре-
за Mini-PROTEAN® Tetra System и камера Protean: резервуар для буфера,
держатель кассет гелей с системой охлаждения и кассеты гелей со стеклами,
закрепленный на заливочном приспособлении (фирма Bio-Rаd)
Аппаратура для гель-электрофореза может различаться конструктивно
при неизменности принципов разделения. Существует огромное количество
фирм, поставляющих оборудование для электрофореза. Наиболее известна
фирма Bio-Rаd, небольшая часть продукции которой представлена на рис. 6.5
.
Метод двумерного гель-электрофореза, в котором объединены две раз-
личные процедуры разделения, позволяет идентифицировать более 1 000 белков.
Результаты при этом получают в виде «двумерной» белковой карты. При ра-
боте данным методом на первом этапе белки разделяют по их заряду. Для
этого образец помещают в небольшой объем раствора, содержащего неион-
ный (незаряженный) детергент – меркаптоэтанол, и в качестве денатури-
рующего агента – мочевину. В этом растворе происходит солюбилизация,
денатурация и диссоциация всех без исключения полипептидных цепей; при
этом изменения заряда цепей не происходит.
Диссоциированные полипептидные цепи разделяют затем методом
изоэлектрического фокусирования, основанном на изменении заряда белко-
вой молекулы при изменении рН окружающей среды. Каждый из белков мо-
жет быть охарактеризован изоэлектрической точкой – значением рН, при ко-
тором суммарный заряд белковой молекулы равен нулю, и, следовательно,
белок не способен перемещаться под действием электрического поля. При
изоэлектрическом фокусировании белки подвергаются электрофорезу в геле,
в котором с помощью специальных буферов создается градиент рН. Под дей-
ствием электрического поля каждый белок перемещается в ту зону градиен-
та, которая соответствует его изоэлектрической точке и остается в ней. Так
происходит разделение белков в одном направлении двумерного гель-
электрофореза. На втором этапе гель, содержащий разделенные белки, снова

ГЛАВА 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ЦЕЛЕВЫХ ПРОДУКТОВ
6.1. Методы выделения и очистки клеточных макромолекул для получения целевого биотехнологического продукта
Современные проблемы и методы биотехнологии. Учеб. пособие 296
подвергается электрофорезу, на этот раз в направлении, перпендикулярном
тому, что был на первом этапе. В этом случае электрофорез ведут в присут-
ствии ДСН, и белки разделяют по их молекулярной массе, как в одномерном
ДСН-ПААГ. Исходный гель пропитывают додецилсульфатом натрия и, по-
местив его на блок ДСН-ПААГ-геля, проводят электрофорез, в ходе которого
каждая из полипептидных цепей мигрирует сквозь блок геля и образует в нем
отдельную полосу. Неразделенными в результате остаются только те белки,
которые неразличимы как по изоэлектрической точке, так и по молекулярной
массе; такое сочетание встречается очень редко.
Экстракты разрушенных клеток можно фракционировать, подвергая их
высокоскоростному центрифугированию. Такая обработка делит клеточ-
ные компоненты по их размеру: более крупные частицы при центрифугиро-
вании движутся быстрее. Крупные компоненты экстракта, в том числе ядра
или неразрушенные клетки, быстро оседают (седиментируют) при относи-
тельно низких скоростях и образуют осадок на дне центрифужной пробирки.
Центрифугирование является, как правило, первым этапом фракционирова-
ния, с его помощью разделяются только значительно отличающиеся по раз-
меру компоненты. Чтобы достигнуть более высокой степени разделения
фракций, необходимо гомогенат наслоить тонким слоем поверх солевого
раствора.
При ультрацентрифугировании различные фракции седиментируют с
различной скоростью и образуют отдельные полосы, которые можно выде-
лить. Во избежание перемешивания осажденных компонентов солевой рас-
твор должен содержать инертный и хорошо растворимый материал (напри-
мер, сахарозу), плотность которого постепенно увеличивается сверху вниз,
формируя градиент плотности. При седиментации сквозь такие градиенты
сахарозы различные компоненты клетки собираются в отдельные полосы, ко-
торые можно выделить.
Скорость седиментации каждого из компонентов определяется его раз-
мерами и формой и обычно выражается с помощью коэффициента седимен-
тации, обозначаемого S. Скорость вращения до 80 000 об/мин, так что на раз-
деляемые частицы действуют силы, превосходящие силу тяготения более чем
в 500 000 раз. Под действием столь больших сил даже сравнительно неболь-
шие макромолекулы, такие, как тРНК или простейшие ферменты, разделяют-
ся и распределяются в строгом соответствии со своими размерами. Измере-
ние коэффициента седиментации макромолекулярных комплексов обычно
используют для определения их общей массы и количество входящих в их
состав субъединиц.

ГЛАВА 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ЦЕЛЕВЫХ ПРОДУКТОВ
Современные проблемы и методы биотехнологии. Учеб. пособие 297
6
6
.
.
2
2
.
.
Г
Г
а
а
з
з
о
о
ж
ж
и
и
д
д
к
к
о
о
с
с
т
т
н
н
а
а
я
я
и
и
в
в
ы
ы
с
с
о
о
к
к
о
о
э
э
ф
ф
ф
ф
е
е
к
к
т
т
и
и
в
в
н
н
а
а
я
я
ж
ж
и
и
д
д
к
к
о
о
с
с
т
т
н
н
а
а
я
я
х
х
р
р
о
о
м
м
а
а
т
т
о
о
г
г
р
р
а
а
ф
ф
и
и
я
я
д
д
л
л
я
я
о
о
п
п
р
р
е
е
д
д
е
е
л
л
е
е
н
н
и
и
я
я
к
к
о
о
л
л
и
и
ч
ч
е
е
с
с
т
т
в
в
е
е
н
н
н
н
ы
ы
х
х
и
и
к
к
а
а
ч
ч
е
е
с
с
т
т
в
в
е
е
н
н
н
н
ы
ы
х
х
х
х
а
а
р
р
а
а
к
к
т
т
е
е
р
р
и
и
с
с
т
т
и
и
к
к
ц
ц
е
е
л
л
е
е
в
в
ы
ы
х
х
п
п
р
р
о
о
д
д
у
у
к
к
т
т
о
о
в
в
б
б
и
и
о
о
т
т
е
е
х
х
н
н
о
о
л
л
о
о
г
г
и
и
и
и
Приоритет открытия хроматографии принадлежит российскому учено-
му Михаилу Семеновичу Цвету. 21 марта 1903 г. М.И. Цвет прочитал свой
знаменательный доклад «О новой категории адсорбционных явлений и о
применении их к биологическому анализу» (Труды Варшавского общества
естествоиспытателей. Отд. биологии. 1903. Т. 14. С. 1–20). Эксперименты в
области адсорбции, приведшие в итоге к открытию хроматографии, ученый
начал двумя годами раньше – в возрасте 28 лет. Подробное изложение прин-
ципов и возможностей своего хроматографического метода он дал в 1906 г. в
двух статьях на немецком языке и в книге 1910 г. «Хромофиллы в раститель-
ном и животном мире». Однако вплоть до 40-х гг. хроматография не получи-
ла должного развития. Лишь в 1941 г. А. Мартин и Р. Синг открыли метод
распределительной хроматографии и показали его широкие возможности для
исследования белков и углеводов. А в 50-е гг. А. Мартин и американский
учёный А. Джеймс разработали метод газожидкостной хроматографии.
По экспертным оценкам, хроматография относится к 20 выдающимся
открытиям прошедшего столетия, которые в наибольшей степени преобразо-
вали науку, а через нее определили уровень развития техники и промышлен-
ности, цивилизации в целом. Хотя по образованию и роду занятий Цвет был
ботаником, результаты его открытия оказались столь значимы для всех есте-
ственных наук, что Федерация европейских химических обществ приводит
имя Цвета, наряду с четырьмя другими русскими именами – Ломоносова,
Менделеева, Бутлерова и Семенова, – в числе ста выдающихся химиков про-
шлого.
В настоящее время хроматография представляет собой:
– самый распространенный и совершенный метод разделения смесей
атомов, изотопов, молекул, всех типов изомерных молекул, включая и опти-
ческие изомеры, макромолекул (синтетических полимеров и биополимеров), ио-
нов, устойчивых свободных радикалов, комплексов, ассоциатов, микрочастиц;
– уникальный метод качественного и количественного анализа сло
ж-
ных многокомпонентных смесей;
– самостоятельное научное направление и важный физико-химический
метод исследования и измерения;
– препаративный и промышленный метод выделения веществ в чис-
том виде;
– мощную отрасль научного приборостроения.
Ни один аналитический метод не может конкурировать с хроматогра-
фией по универсальности применения и эффективности разделения самых
сложных многокомпонентных смесей. На современных газохроматографиче-
ских капиллярных колонках в одном эксперименте могут быть разделены бо-

ГЛАВА 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ЦЕЛЕВЫХ ПРОДУКТОВ
6.2. Газожидкостная и высокоэффективная жидкостная хроматография для опр-я кол-ых и кач-х характ-к целевых прод-в биотехнологии
Современные проблемы и методы биотехнологии. Учеб. пособие 298
лее 1 000 индивидуальных компонентов, например, в бензиновых фракциях
нефти; двумерный электрофорез позволяет увидеть до 2 000 белков в биоло-
гических объектах или пептидов в гидролизатах белков. Только благодаря
сочетанию разнообразных методов хроматографии и капиллярного электро-
фореза стала возможной расшифровка нуклеотидной последовательности
ДНК и завершение работ по программе «Геном человека».
Диапазон применения хроматографических методов огромен: от анали-
за атмосферы планет Солнечной системы до полного анализа содержимого
одной живой клетки. Исключительную роль хроматография играет в химиче-
ской, нефтехимической, газовой, пищевой, целлюлозно-бумажной и многих
других отраслях промышленности, прежде всего в технологическом контро-
ле и поддержании оптимального режима производства, в контроле исходного
сырья и качества готовой продукции, анализе газовых и водных сбросов про-
изводства.
В биотехнологии хроматография является основным процессом выде-
ления вирусов гриппа, энцефалита, бешенства и ящура, очистки вакцин, про-
мышленного производства инсулина, других белков и полипептидов. На
промышленную основу поставлено хроматографическое выделение фуллере-
нов, сапонинов, интерлейкина-2 человека, гистонов, плазмид, ДНК, антибио-
тиков и многих других ценнейших природных и синтезируемых веществ.
6
6
.
.
2
2
.
.
1
1
.
.
О
О
с
с
н
н
о
о
в
в
н
н
ы
ы
е
е
в
в
и
и
д
д
ы
ы
х
х
р
р
о
о
м
м
а
а
т
т
о
о
г
г
р
р
а
а
ф
ф
и
и
и
и
В зависимости от природы взаимодействия, обусловливающего рас-
пределение компонентов между элюентом и неподвижной фазой, различают
следующие основные виды хроматографии:
– адсорбционную;
– распределительную;
– ионообменную;
– эксклюзионную (молекулярно-ситовую);
– осадочную.
Адсорбционная хроматография основана на различии сорбируемости
разделяемых веществ адсорбентом (твёрдое тело с развитой поверхностью).
Распределительная хроматография – на разной растворимости компо-
нентов смеси в неподвижной фазе (высококипящая жидкость, нанесённая на
твёрдый макропористый носитель) и элюенте (следует иметь в виду, что при
распределительном механизме разделения на перемещение зон компонентов
частичное влияние оказывает и адсорбционное взаимодействие анализируе-
мых компонентов с твёрдым сорбентом).
Ионообменная хроматография – на различии констант ионообменного
равновесия между неподвижной фазой (ионитом) и компонентами разделяе-
мой смеси.
Эксклюзионная (молекулярно-ситовая) хроматография – на разной
проницаемости молекул компонентов в неподвижную фазу (высокопористый

ГЛАВА 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ЦЕЛЕВЫХ ПРОДУКТОВ
6.2. Газожидкостная и высокоэффективная жидкостная хроматография для опр-я кол-ых и кач-х характ-к целевых прод-в биотехнологии
Современные проблемы и методы биотехнологии. Учеб. пособие 299
неионогенный гель). Эксклюзионная хроматография подразделяется на гель-
проникающую (ГПХ), в которой элюент – неводный растворитель, и гель-
фильтрацию, где элюент – вода.
Осадочная хроматография основана на различной способности разде-
ляемых компонентов выпадать в осадок на твёрдой неподвижной фазе.
В соответствии с агрегатным состоянием элюента различают газовую и
жидкостную хроматографию. В зависимости от агрегатного состояния не-
подвижной фазы газовая хроматография бывает газо-адсорбционной (непод-
вижная фаза – твёрдый адсорбент) и газожидкостной (неподвижная фаза –
жидкость), а жидкостная хроматография – жидкостно-адсорбционной (или
твёрдо-жидкостной) и жидкостно-жидкостной. Последняя, как и газожидко-
стная, является распределительной хроматографией. К твёрдо-жидкостной
хроматографии относятся тонкослойная и бумажная.
6
6
.
.
2
2
.
.
2
2
.
.
О
О
с
с
н
н
о
о
в
в
н
н
ы
ы
е
е
з
з
а
а
к
к
о
о
н
н
о
о
м
м
е
е
р
р
н
н
о
о
с
с
т
т
и
и
х
х
р
р
о
о
м
м
а
а
т
т
о
о
г
г
р
р
а
а
ф
ф
и
и
ч
ч
е
е
с
с
к
к
о
о
г
г
о
о
р
р
а
а
з
з
д
д
е
е
л
л
е
е
н
н
и
и
я
я
в
в
к
к
о
о
л
л
о
о
н
н
к
к
е
е
Параметры удерживания. Время удерживания и удерживаемый
объем. Разделение в хроматографии основано на различной сорбируемости
анализируемых соединений при движении их по слою сорбента в колонке.
Если соединение не сорбируется, то оно не удерживается сорбентом в колон-
ке, и будет выходить из колонки со скоростью потока элюента. Если же ве-
щества сорбируются, то они удержатся в колонке, это будет определяться их
сорбционной способностью: чем сильнее сорбция соединения, тем дольше
оно будет удерживаться в колонке.
Параметры удерживания, по существу, характеризуют сорбционную
способность анализируемых соединений. Различие в сорбируемости в конеч-
ном итоге определяется различием межмолекулярных взаимодействий веще-
ство – сорбент. Время от момента ввода пробы в колонку до выхода макси-
мума пика называется временем удерживания t
R
(рис. 6.6). Оно складывает-
ся из двух составляющих: времени нахождения молекул соединения в элю-
енте (t
м
) и времени нахождения молекул соединения в сорбируемом состоя-
нии
(t
R
):
t
R
= t
м
+
t
R
. (6.4)
Рис. 6.6. Параметры удерживания

ГЛАВА 6. СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ЦЕЛЕВЫХ ПРОДУКТОВ
6.2. Газожидкостная и высокоэффективная жидкостная хроматография для опр-я кол-ых и кач-х характ-к целевых прод-в биотехнологии
Современные проблемы и методы биотехнологии. Учеб. пособие 300
Для газовой и жидкостной хроматографий время нахождения молекул
исследуемого соединения в элюенте зависит от доли пустот в колонке. В раз-
ных набивных колонках плотность набивки может изменяться, будет также
изменяться и величина t
м,
поэтому для характеристики истинной удержи-
вающей способности необходимо определять величину t'
R
– так называемое
приведенное время удерживания:
t
R
= t
м
−
t
R
. (6.5)
Величину t
м
определяют по времени выхода несорбируемого соедине-
ния (иногда называемого мертвым временем). Приведенное время удержи-
вания зависит от скорости элюента: чем больше скорость элюента, тем
меньше время удерживания, поэтому на практике удобнее использовать
удерживаемый объем V
R
– произведение времени удерживания на объемную
скорость элюента F
r
:
V
R
= t
R
· F
r
. (6.6)
Удерживаемый объем – это объем элюента, который необходимо про-
пустить через хроматографическую колонку, чтобы элюировать данное ана-
лизируемое соединение. Приведенный удерживаемый объем (V'
R
) соответст-
венно равен:
V'
R
= (t
R
– t
м
) F
r
= t
R
F
r
– t
м
F
r
= V
R
– V
d
, (6.7)
где V
d
– объем пустот в колонке (мертвый объем).
Объемную скорость элюента чаще всего измеряют на выходе из колон-
ки. Из-за сжимаемости элюента при повышении давления объемная скорость
неодинакова по длине колонки. В начале колонки она меньше, чем на выхо-
де, поэтому для определения средней скорости в колонке вводится специаль-
ная поправка j, учитывающая перепад давления:
2
10
3
10
(/) 1
3/2 ,
(/) 1
pp
j
pp
−
=
−
(6.8)
где p
1
– входное давление; p
0
– давление на выходе колонки.
Приведенный удерживаемый объем с поправкой на среднее давление
называется чистым удерживаемым объемом:
V
N
= V
R
· j. (6.9)
Чистый удерживаемый объем можно считать физико-химической кон-
стантой, так как он не зависит от скорости элюента при постоянной темпера-
туре и доли пустот в колонке.
