Ваган В.А. и др. Физика. В 3 ч. Часть 1. Механика. Молекулярная физика и термодинамика: Пособие для студентов вузов
Подождите немного. Документ загружается.

ТЕРМОДИНАМИКА
70
♦ Энтропия идеальных газов.
Для идеальных газов первый закон термодинамики:
V
QCdT PdVδ= + ⇒ ///
V
dS Q T C dT T PdV T
=
δ= + .
Из уравнения состояния
//PT RV=ν ⇒ //
V
dS C dT T R dV V
⋅
⋅
=
+ν .
Интегрируя, получаем ln ln
V
S
CTRVconst=+ν+.
Конечное изменение энтропии иде-
альных газов при переходе системы
из 1 состояния во 2 состояние:
21
S
SS
Δ
=−=
(
)
(
)
21 21
ln / ln /
V
CTT RVV=+ν.
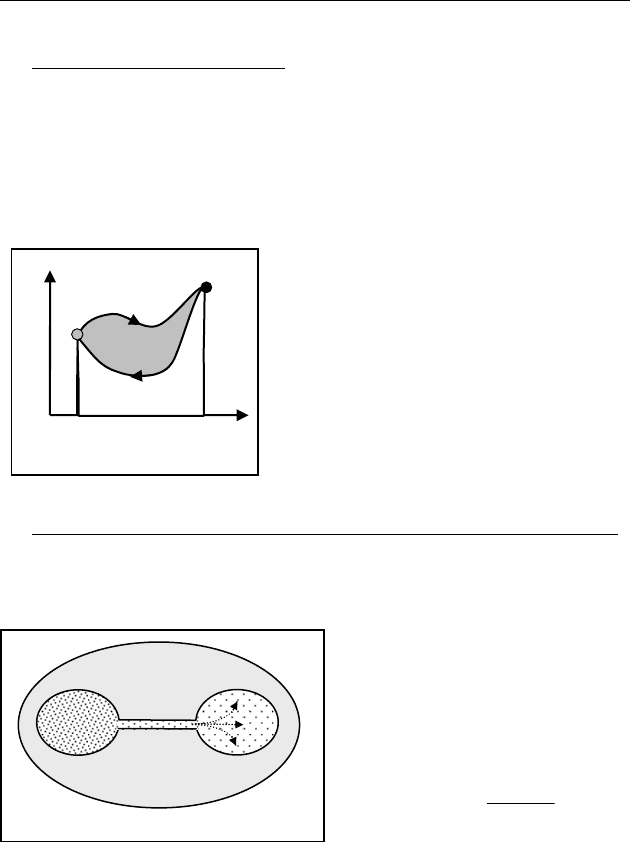
Для циклических (круговых) равно-
весных процессов (рис. 78):
0, 0SU
Δ
=Δ=.
♦ Принцип возрастания энтропии (второй закон термодинамики).
Рассмотрим изменение энтропии в процессах переноса в замкну-
той системе.
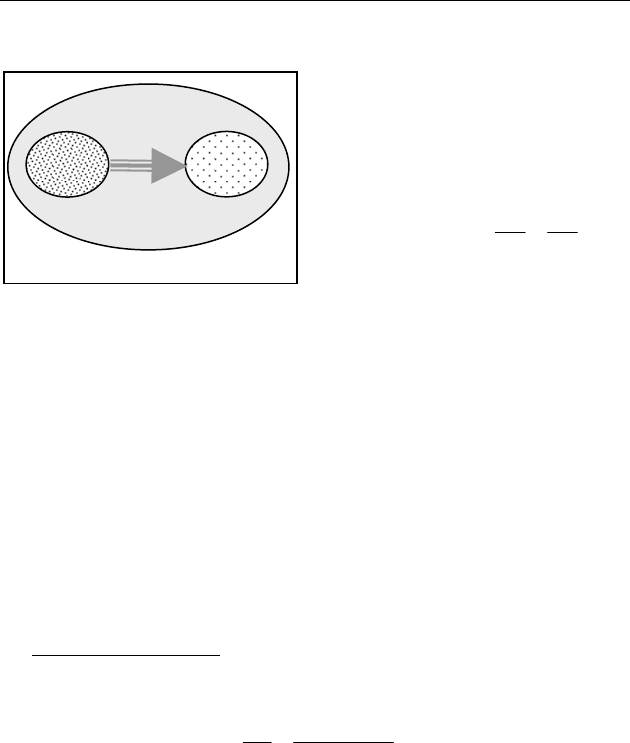
Диффузия. Пусть газ изотермически расширяется в пустоту в
системе, состоящей из:
1,2 — заполненной газом и
пустой полости,
3 — термостата (рис.79).
Изменение энтропии будет:
12
1
ln 0
VV
SR
V
+
Δ
=ν ⋅ >
.
В процессе диффузии энтро-
пия возрастает.
Рис. 78
0
V
P
1
V
Рис. 79
Термостат (3)
(1)
(2)
Замкнутая
система
ТЕРМОДИНАМИКА
71
Теплопроводность.
Первая подсистема имеет темпе-
ратуру
12
TT> и отдает теплоту
Q
δ
, вторая — принимает тепло-
ту
Q
δ
при температуре
2
T
(рис.
80):
12
12
0
QQ
SS S
TT
δ
δ
Δ
=Δ +Δ =− + > .
В процессе теплопроводности
энтропия возрастает.
Внутреннее трение.
В замкнутой системе за счет внутреннего
трения механическое движение переходит в тепловое хаотиче-
ское движение молекул, температура повышается, поэтому изме-
нение энтропии:
21
ln( / ) 0
V
SC TTΔ= >
, так как
21
TT>
.
В процессе внутреннего трения энтропия возрастает.
Таким образом, энтропия возрастает в процессах переноса. Так
как реальные процессы
всегда содержат процессы переноса, то
В замкнутой системе процессы проходят так, чтобы энтропия
не убывала:
0dS ≥ ( второй закон термодинамики).
Энтропия — мера хаоса в системе. Чем больше хаос, тем больше
энтропия.
♦ Энтропия и энергия
Если система не замкнута, то за счет внешней работы
()A−δ
можно понизить энтропию (увеличить порядок в системе):
(
)
0<
δ−+
=
δ
=
T
AdU
T
Q
dS
.
Например, сжимая и охлаждая газ, можно получить кристалличе-
ское тело с упорядоченным расположением атомов.
Из определения энтропии при обратимом изменении состояния
системы
QTdSδ= , при необратимом процессе QTdS
δ
< , или в
общем случае,
TdS dU A≥+δ.
Это неравенство объединяет оба закона термодинамики и являет-
ся их важнейшим следствием.
В частности, из неравенства для обратимого процесса следует:
Рис. 80
12
TT
Q
>
Δ
2
T
Замкнутая
система
1
T

ТЕРМОДИНАМИКА
72
() () ( )AdUTdS AdUTSSdTAdFSdTδ =− − ⇒δ =− − − ⇒δ =− + ,
где
F
UTS=− — свободная энергия, также являющаяся одно-
значной функцией состояния системы и мерой работы, которую
может совершить система в изотермическом процессе. Действи-
тельно, если
0dT =⇒AdF
δ
=−
. Из определения свободной
энергии
UFTS=+ . TS называют связанной энергией. Это часть
внутренней энергии, которая не может быть превращена в работу
в изотермическом процессе. Она увеличивается с ростом энтро-
пии — хаоса в системе.
♦ Статистический смысл второго закона термодинамики
Как показывает статистическая физика, энтропия является мерой
вероятности состояния системы:
ln
S
kz
=
,
где
k — постоянная Больцмана,
z
— среднее количество спосо-
бов реализации данного макроскопического состояния (статисти-
ческий вес).
В состоянии термодинамического равновесия энтропия достигает
максимального значения. Согласно второму закону термодина-
мики в этом случае реализуется наиболее вероятное состояние
системы.
9.4. Цикл Карно
♦ Круговые процессы или циклы — это процессы, в результате
которых система возвращается в исходное состояние. Если при
этом совершается положительная работа, цикл называется пря-
мым (по часовой стрелке, рис. 63), а если отрицательная — об-
ратным (против часовой стрелки, рис. 64).
Принцип действия тепловых двигателей
Тепловой двигатель превращает внутреннюю энергию топлива в
механическую энергию (работу). Примеры: паровой, турбинный,
двигатель внутреннего сгорания, двигатель Дизеля. Двигатель
состоит из нагревателя (котел, камера сгорания), холодильника
(теплообменник, атмосфера), рабочего тела (газ, пар).
ТЕРМОДИНАМИКА
73
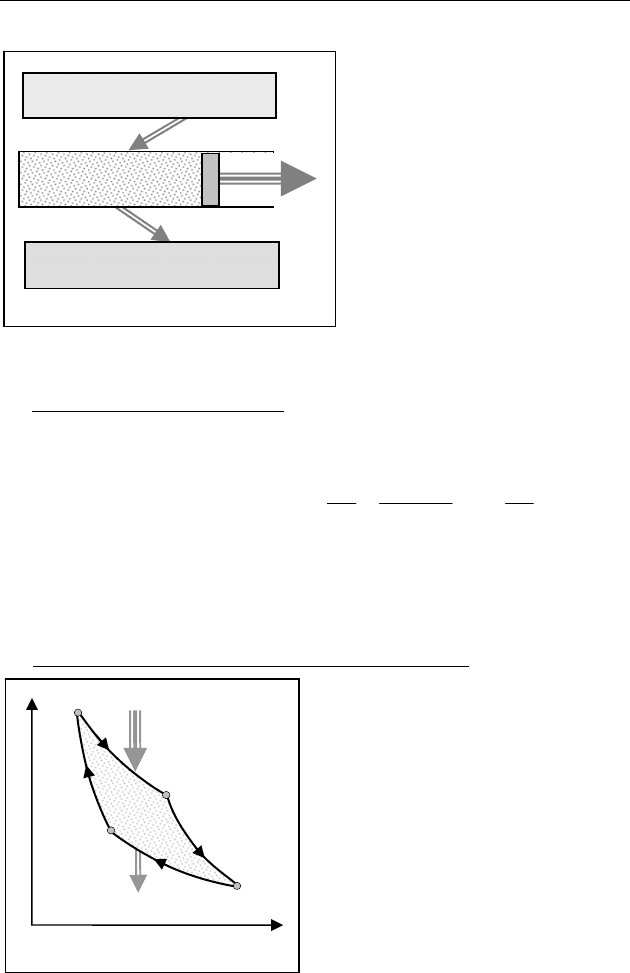
В рабочем цикле (рис. 81):
— рабочее тело получает от
нагревателя теплоту
Q
1
при
температуре
Т
1
;
— рабочее тело, расширя-
ясь, совершает работу
А
1
;
— для возвращения в на-
чальное состояние рабочее
тело отдает холодильнику
остаток теплоты
Q
2
при
температуре
Т
2
< Т
1
;
— внешние силы доводят
температуру и давление рабочего тела до начальных значений,
совершая работу
2
A .
♦ КПД теплового двигателя η определяется отношением полез-
ной работы
п 12
AAA=− к затраченной энергии Q
1
. Применяя
для рабочего тела закон сохранения энергии, получаем:
п 12
AQQ=−
, тогда
п 12 2
11 1
1
А QQ Q
QQ Q
−
η= = = −
Тепловые двигатели с обратными циклами называются холо-
дильниками. Для них
12 п
,0QQ А
<
< и
21
TT> . Противоестест-
венный ход тепла (от холодного к горячему) обеспечивается ра-
ботой внешних сил.
♦ Цикл Карно. Идеальный тепловой двигатель для построения
рабочего цикла использует об-
ратимые процессы. Например,
цикл Карно состоит из двух изо-
терм (1–1
/
, 2–2
/
) и двух адиабат
(1
/
–2, 2
/
–1), в которых теплота и
изменение внутренней энергии
полностью превращаются в ра-
боту (рис. 82).
Рассмотрим изменение энтро-
пии рабочего тела. Общее изме-
нение энтропии в цикле:
// / /
11 1 2 22 2 1
S
SSSS
Δ
=Δ +Δ +Δ +Δ
Рис. 81
Нагреватель,
1
T
Холодильник,
21
TT<
Рабочее тело (газ)
A
1
Q
2
Q
Рис. 82
1
1
′
2
′
2
1
0Q >
2
0Q <
V
0
P
П
0A >
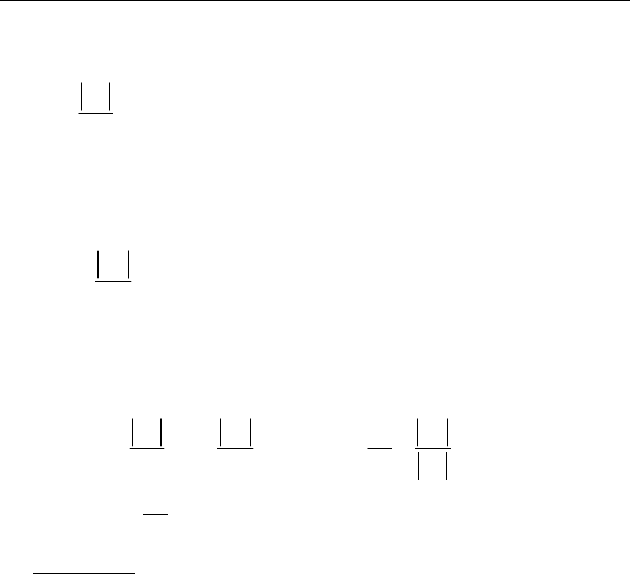
ТЕРМОДИНАМИКА
74
// / /
11 1 2 22 2 1
S
SSSSΔ=Δ +Δ +Δ +Δ Так как мы рассматриваем толь-
ко обратимые процессы, общее изменение энтропии
0S
Δ
= .
/
1
11
1
Q
S
T
Δ=
— изменение энтропии при изотермическом расши-
рении
1–1
/
.
1
0Q > (тело принимает теплоту).
/
12
0SΔ= — адиабатное расширение
(
)
0Q
δ
= с охлаждением до
температуры холодильника
2
T
.
/
2
22
2
Q
S
T
Δ=−
— изотермическое сжатие в контакте с холодиль-
ником.
2
0Q < (тело отдает теплоту).
/
21
0SΔ= — адиабатное сжатие
(
)
0Q
δ
= до начального состоя-
ния
111
,,
P
TV
. Общее изменение энтропии в равновесном цикле
12
12
000
QQ
S
TT
Δ
=+−+=⇒
2
2
11
Q
T
TQ
=
. Поэтому,
2
max
1
1
T
T
η=−
— максимальный кпд теплового двигателя.
♦ Следствия
1. КПД цикла Карно не зависит от рода рабочего тела.
2. КПД определяется только разницей температур нагревателя и
холодильника.
3. КПД не может быть 100% даже у идеальной тепловой маши-
ны, так как при этом температура холодильника должна быть
2
0T = , что запрещено законами квантовой механики и треть-
им законом термодинамики.
4. Невозможно создать вечный двигатель второго рода, рабо-
тающий в тепловом равновесии без перепада температур, т.е.
при
21
TT=
, так как в этом случае
max
0
η
=
.
5. Тепловые двигатели повышают энтропию замкнутой системы.
РЕАЛЬНЫЕ ГАЗЫ
75
Рис. 83
0
F
отталкивание
0
F
>
притяжение
0
F
<
Силы межмолекулярного
взаимодействия
равновесие
0F =
r
1
2
Глава 10
РЕАЛЬНЫЕ ГАЗЫ
10.1. Уравнение состояния реальных газов (уравнение Ван–дер–
Ваальса).
♦ Силы межмолекулярного взаимодействия
а) Молекулы идеального газа (упругие материальные точки) не
взаимодействуют друг с другом. Их внутренняя энергия не зави-
сит от расположения молекул и определяется только их кинети-
ческой энергией. Такая модель
описывает поведение весьма
разряженных реальных газов и
плохо работает в области боль-
ших давлений и фазовых пере-
ходов газ—жидкость.
б) Изучение упругих свойства
твердых тел и жидкостей пока-
зывает, что на близких расстоя-
ниях (
53
~
−
диаметров) моле-
кулы отталкиваются, на рас-
стояниях
75
~
−
диаметров—
притягиваются, на расстояниях
>9 диаметров взаимодействием
молекул можно пренебречь.
Силы межмолекулярного взаи-
модействия имеют электромаг-
нитную квантовую природу.
Примерная зависимость сил
взаимодействия двух молекул
(
1 и 2) от межмолекулярного
расстояния представлена на
рис. 83.
На рис. 84 показана зависи-
мость потенциальной энергии
двух молекул (
п
W ) от расстоя-
ния между молекулами (
r ).
Пунктирной линией отмечено
положение равновесия, в кото-
ром потенциальная энергия достигает минимума.
Рис. 84
0
притяжение
Потенциальная энергия
взаимодействия молек
у
л
равновесие
r
отталкивание
1
2
П
W
РЕАЛЬНЫЕ ГАЗЫ
76
Рис. 85
Граница раздела
1
n
2
n
Внутренняя энергия реального газа включает кинетическую энер-
гию молекул
K и потенциальную энергию их взаимодействия
п
W :
п V п
UKW CTW
=
+= +. Соотношение между потенциаль-
ной и кинетической энергией молекулы определяет агрегатное
состояние вещества (
п
KW>> у газа,
п
KW
≈
у жидкости,
п
KW<
у твердого тела).
♦ Уравнение состояния реальных газов
Уравнение состояния одного моля идеального газа
P
VRT
μ
=
справедливо и для реальных разряженных газов. Однако, при от-
носительно больших давлениях и низких температурах оно теря-
ет смысл.
а) Учтем конечный объем реальных молекул, обозначив его b .
Тогда свободный молярный объем уменьшится:
VVb
μμ
⇒−, сле-
довательно
()
P
VbRT
μ
−= . Так как при ,P →∞
()
0
RT
Vb
P
μ
−= →, Vb
μ
→ — собственный объем молекул.
б) Учтем взаимодействие молекул. За счет их взаимного притя-
жения давление на стенки сосуда уменьшится на
/
P
:
()
/
RT
P
P
Vb
μ
=−
−
или
(
)
(
)
/
P
PV b RT
μ
+−=.
Определим
/
P
. Для этого представим объем газа в виде двух час-
тей (рис. 85) с концентрациями
12
~1/nn V
μ
= . Силы притяжения пер-
вой и второй частей пропорциональны
концентрации молекул в поверхност-
ных слоях у границы раздела, поэтому
/2
/
P
aV
μ
= , где
a
— параметр,
зависящий только от природы газа. В результате, уравнение
Ван–дер–Ваальса принимает вид:
()
2
a
P
VbRT
V
μ
μ
⎛⎞
⎜⎟
+−=
⎜⎟
⎝⎠
.
РЕАЛЬНЫЕ ГАЗЫ
77
10.2.Изотермы реальных газов
♦ Идеальный газ
Изотермы идеальных газов были получены в
(9.2).
Газ находится в контакте с термостатом, обес-
печивающим постоянство температуры (рис.
86). При сжатии газа его объем уменьшается
обратно пропорционально давлению.
♦ Изотермы реальных газов. Эксперимент
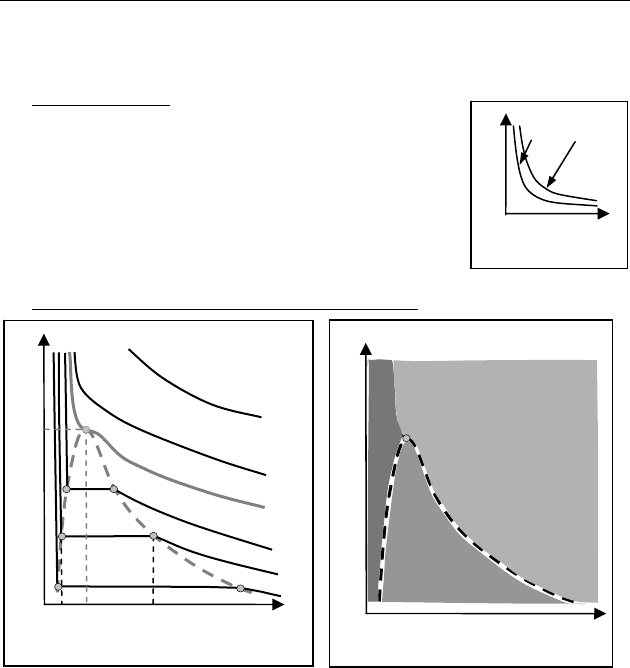
На рис. 87 приведены шесть экспериментальных изотерм реаль-
ных газов:
12 34K
TTTT T T
<
<< <<<.
Если
K
TT>> — изотерма близка к изотерме идеального газа.
Если
K
TT
<
— на изотерме появляется горизонтальный участок,
например
//
CB , на котором сжатие не сопровождается изменени-
ем давления. Работа внешней силы идет на изменение потенци-
альной части внутренней энергии. При этом изменяется фазовое
состояние вещества: газ конденсируется, превращаясь в жид-
кость. В области
//
BB KC C существует одновременно и жид-
кость и газ (пар). При изотермическом сжатии точки
/
C и
/
B оп-
Рис. 86
12
TT
<
V
P
Рис. 87
К
T
3
T
4
T
2
T
1
T
T
P
К
P
B
B
′
C
C
′
К
V
B
V
′
C
V
V
K
Рис. 88
P
V
ККК
(,,)
K
PV T
1
2
3
РЕАЛЬНЫЕ ГАЗЫ
78
ределяют начало и конец конденсации, а при изотермическом
расширении — конец и начало кипения.
Точка
K называется критической точкой. Для изотерм с
K
TT>
кинетическая энергия молекул так велика, что силы притяжения
не могут удержать молекулы вместе. Таким образом, на диаграм-
мах изотерм выделяется три области (рис. 88)
:
1 — область, в которой вещество существует в виде газа;
2 — область фазового перехода, где газ (пар) существует одно-
временно с жидкостью;
3 — область, в которой вещество существует только в виде жид-
кости.
В критической точке с параметрами
KKK
,,
P
VT теряется разли-
чие между газом и жидкостью.
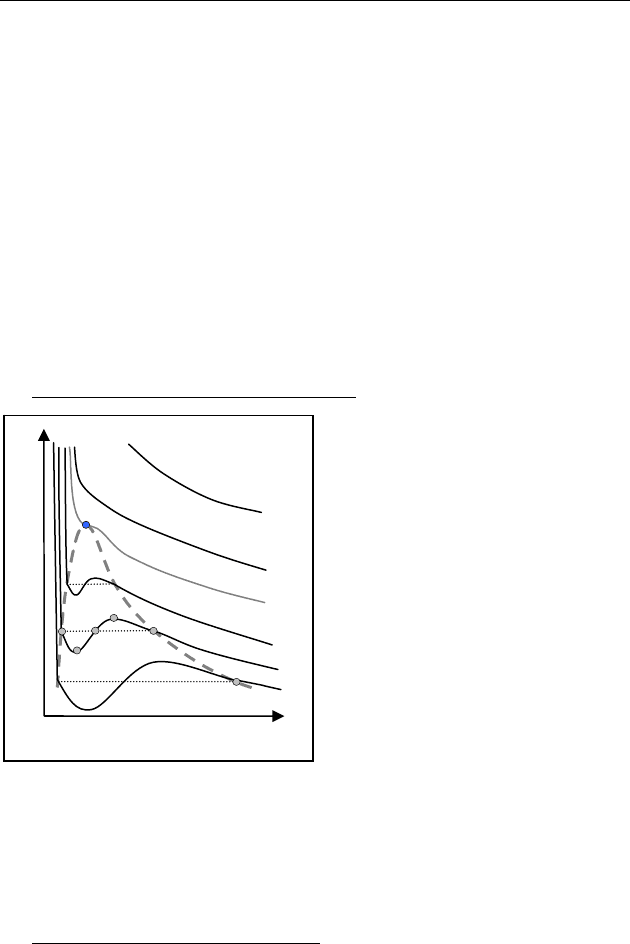
♦ Изотермы реальных газов. Теория
На рис. 89 представлены гра-
фики изотерм, полученных из
уравнения Ван–дер–Ваальса.
Сравнение с изотермами ре-
альных газов показывает, что
теория хорошо описывает экс-
перимент не только в области
газообразного состояния, но
также в областях двухфазного
и жидкого состояний. Участок
BD изотермы
T
соответству-
ет жидкости, нагретой выше
температуры кипения (
пере-
гретой жидкости
), участок
CF — пересыщенному пару.
Это метастабильные состояния, реализующиеся в
однородной
жидкости или паре. При введении центров конденсации (кипе-
ния) происходит бурный фазовый переход. Участок изотермы
D
EF практически неосуществим.
10.3. Эффект Джоуля — Томсона. Сжижение газов.
♦ Эффект Джоуля — Томсона. Для перехода молекул газа в
жидкое состояние надо газ охладить до
K
TT
<
и изотермически
сжать (рис. 89).
Рис. 89
К
T
3
T
4
T
2
T
1
T
T
P
D
B
C
E
V
K
F
РЕАЛЬНЫЕ ГАЗЫ
79
Критические температуры
K
T для газов достаточно низки:
He
268tC=− ° ,
2
H
240tC=− ° ,
Ne
229tC
=
−°. Охладить газ можно
за счет адиабатных процессов, в которых работа газа
A
δ
совер-
шается за счет уменьшения его внутренней энергии
AdU
δ
=− .
Например, в теплоизолированной системе газ двигает поршень
или вращает турбину. Оказывается, что и без совершения газом
полезной работы в адиабатном процессе температура газа может
меняться.
Изменение температуры газа при адиабатном расширении газа
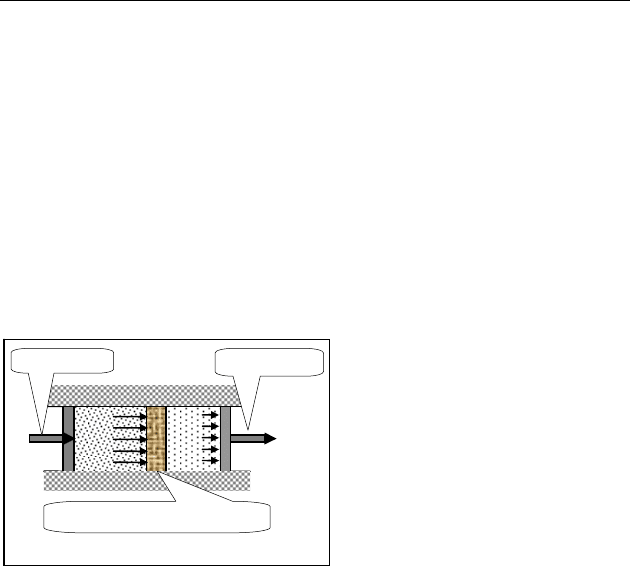
через пористую мембрану
(дроссель) без совершения
работы называется эф-
фектом Джоуля — Томсона
(рис. 90).
Для идеального газа, молеку-
лы которого не взаимодейст-
вуют, внутренняя энергия
определяется только кинети-
ческой энергией молекул:
V
dU C dT
=
. По первому закону тер-
модинамики для адиабатного процесса
AdU
δ
=− , поэтому в слу-
чае
0Aδ=⇒
V
0dU C dT==⇒
0dT
=
. Изменения температуры
газа не происходит.
Для реального газа
V п
0dU C dT dW
=
+=⇒
п V
/dT dW C=−
—
температура газа меняется. Если в процессе дросселирования по-
тенциальная энергия газа переходит в кинетическую
—
0dT >
,
газ нагревается (отрицательный эффект Джоуля — Томсона).
Если кинетическая энергия переходит в потенциальную—
0dT < , газ охлаждается (положительный эффект Джоуля —
Томсона).
Рис. 90
1
P
2
P
12
P
P>
поршень
по
р
шень
дроссель (из пробки)
