Ваган В.А. и др. Физика. В 3 ч. Часть 1. Механика. Молекулярная физика и термодинамика: Пособие для студентов вузов
Подождите немного. Документ загружается.

УПРУГИЕ ВОЛНЫ
50
x
Рис. 49
(,)
y
xt
xct
′
=
A
o
♦
Связь длины волны λ со скоростью ее распространения v
Длина волны равна расстоянию, которое проходит волна за вре-
мя, равное периоду колебаний источника волн:
;T
λ
=⋅ λ⋅ν=cc
.
♦ Звуковые волны — упругие волны в слышимом диапазоне частот:
инфразвук, 16 Гц < слышимый диапазон < 20 000 Гц, ультразвук.
Громкость (сила) звука определяется квадратом амплитуды ко-
лебаний частицы среды.
Высота тона определяется частотой звуковых колебаний: чем
больше частота, тем выше тон.
7.2. Уравнение волны. Волновое уравнение
♦
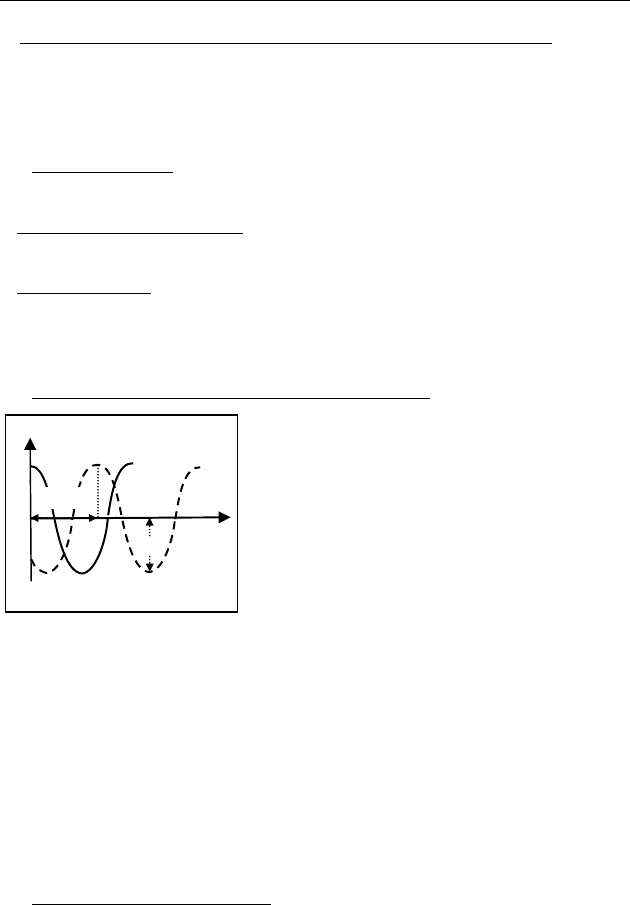
Уравнение плоской синусоидальной волны, распространя-
ющейся вдоль оси ОХ.
Определим смещение
(
)
y точек
среды в волне в любой точке
(
)
x луча
ОХ в любой момент времени
()
t .
Источник гармонических колебаний
(
)
(
)
0
,cosyx t A t
=
ω находится в точке
0
0x = . Отклонение (,)yxt в т. x в момент времени t совпадает
с отклонением источника колебаний в момент времени
tt
′
−
,
0
(, )yx t t
′
−
. t
′
— время движения волны от до
0
xx. Так как
/xt tx
′′
=⇒=
cc(рис. 49). Таким образом, самый общий вид
уравнения бегущей волны:
0
(,) ( , /)yxt yx t x
=
− c .
В случае
плоской синусоидальной волны (,) cos ( /)yxt A t x
=
ω− c .
♦ Период колебаний волны T , частота
ν
, циклическая частота
ω , совпадает с периодом, частотой и циклической частотой ко-
лебаний источника волн. Действительно, фиксируя точку наблю-
дения
1
x , получаем гармоническое колебание точки среды
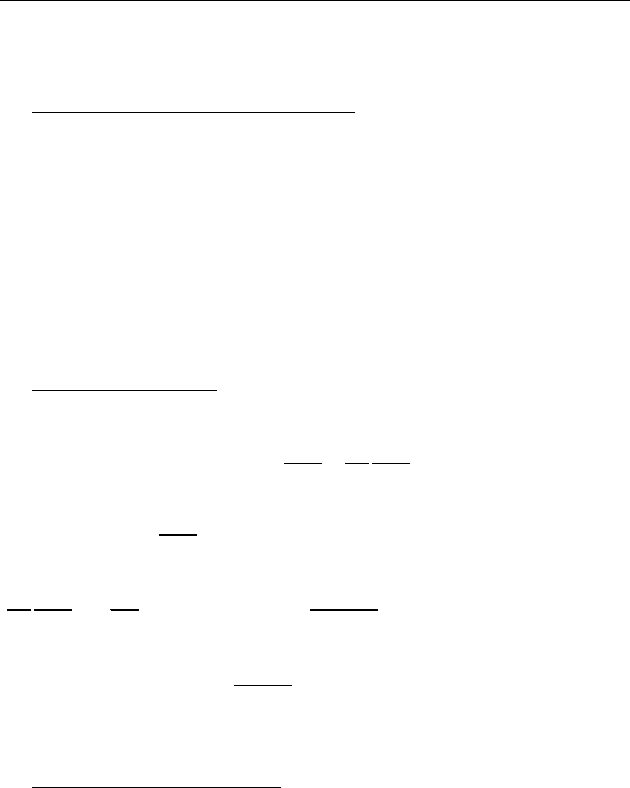
УПРУГИЕ ВОЛНЫ
51
где
1111
(,) cos( ), , /yx t A t x const=ω−ϕ ϕ=ω=c .
Причем,
22/Tω= πν= π .
♦ Пространственный период волны определяет длина волны λ .
Фиксируя время наблюдения
1
t , получаем
11
( , ) cos( / )yxt A t x
=
ω−ω c .
Из определения длины волны
11 2 1
(, ) ( , )yxt yx t
=
+λ , тогда
()/ /2xxω+λ −ω =π⇒cc
2 Tλ=πω= ν=⋅c/ c/ c .
Уравнение плоской синусоидальной волны обычно записывается в
виде:
(,) cos( )yxt A t kx=ω−, где 2/k
=
πλ — волновое число.
♦ Волновое уравнение
Уравнение плоской синусоидальной волны является решением
волнового уравнения:
22
222
1yy
xt
∂
∂
=
∂
∂c
.
Действительно,
2
2
2
cos( )
y
kA t kx
x
∂
=− ω −
∂
,
()
2
22
22 2 2
2
1
cos( ) cos( )
y
Atkx Atkx
t
πν
∂ω
=
− ω−=− ω−=
∂
cc c
()
2
2
2
2
cos( ) cos( )
AtkxkAtkx
π
=− ω − =− ω −
λ
.
7.3. Энергия волны
♦ Плотность энергии волны
Волновое движение переносит энергию из одного места про-
странства в другое. Однако, точки среды, участвующие в переда-
че энергии, колеблются около положения неизменного равнове-
сия. Все точки тела участвуют в колебании. Поэтому
средняя
плотность энергии волны (энергия единицы объема), равна
УПРУГИЕ ВОЛНЫ
52
0
/2w =ρ
2
v , где
ρ
— плотность,
0
A
=
ωv
— амплитудное значе-
ние скорости колебаний (6.2) точек среды. Поэтому,
22
/2wA=ρω .
♦ Интенсивность волны. I , Вт/м
2
— это энергия, переносимая
волной за единицу времени (мощность)
через единицу площади заданной по-
верхности (рис. 50).
Скорость переноса энергии называется
групповой скоростью u .
Для синусоидальной волны фазовая и
групповая скорости совпадают:
uc
=
.
За единицу времени волна переносит энергию на расстояние
u в
объем цилиндра единичной площади и длиной
u (рис. 50). Так
как
w это плотность энергии, то значение интенсивности волны
будет равно:
Iwu
=
⋅
Интенсивность волны имеет смысл
потока энергии, проходящего
через единицу площади в единицу времени.
Поток энергии изображают вектором, направленным вдоль рас-
пространения энергии и величиной, равной интенсивности вол-
ны. Этот вектор называют
вектором Умова.
Рис. 50
м,lu=
2
1,мS =
3
мV,u=
энергия
ОСНОВЫ МОЛЕКУЛЯРНО–КИНЕТИЧЕСКОЙ ТЕОРИИ
53
ЧАСТЬ 2
МОЛЕКУЛЯРНАЯ ФИЗИКА
И ОСНОВЫ ТЕРМОДИНАМИКИ
Глава 8
ОСНОВЫ МОЛЕКУЛЯРНО–КИНЕТИЧЕСКОЙ ТЕОРИИ
8.1. Основные понятия и определения
♦ Опытное обоснование основных положений молекулярно-
кинетической теории. Молекулярно–кинетическая теория объяс-
няет строение и свойства тел движением и взаимодействием ато-
мом, молекул и ионов, из которых состоят тела.
1) Все тела состоят из атомов или молекул. Подтверждается хи-
мическими реакциями, прямыми микроскопическими наблюде-
ниями, диффузией (проникновением молекул и атомов одних
веществ в промежутки между молекулами и атомами других
веществ).
2) Атомы и молекулы находятся в непрерывном хаотическом
движении. Подтверждается диффузией и броунов-
ским движением — хаотическим движением мик-
рочастиц под
действием беспорядочных соударе-
ний молекул жидкости или газа. На рис.51 изо-
бражена траектория броуновской частицы.
3) Молекулы и атомы взаимодействуют между
собой. На близких расстояниях отталкиваются, при увеличении
расстояния притягиваются, на расстоянии, намного большем
диаметра молекул, практически не взаимодействуют. Подтвер-
ждается упругими свойствами твердых тел, жидкостей и газов.
♦ Моль
ν
, моль — мера количества вещества в СИ.
В одном моле содержится
N
А
= 6,02 10
23
моль
–1
(постоянная Аво-
гадро) молекул или атомов.
Молярная масса μ , кг/моль — масса одного моля вещества,
0A
mN
μ
= .
0
m
— масса одной молекулы.
μ
определяется по таблице Мен-
делеева, например, для углерода
3
() 1210C
−
μ=⋅ кг/моль.
Масса одной молекулы
0
26
/10
A
Nm
−
≈=μ
кг.
Рис. 51
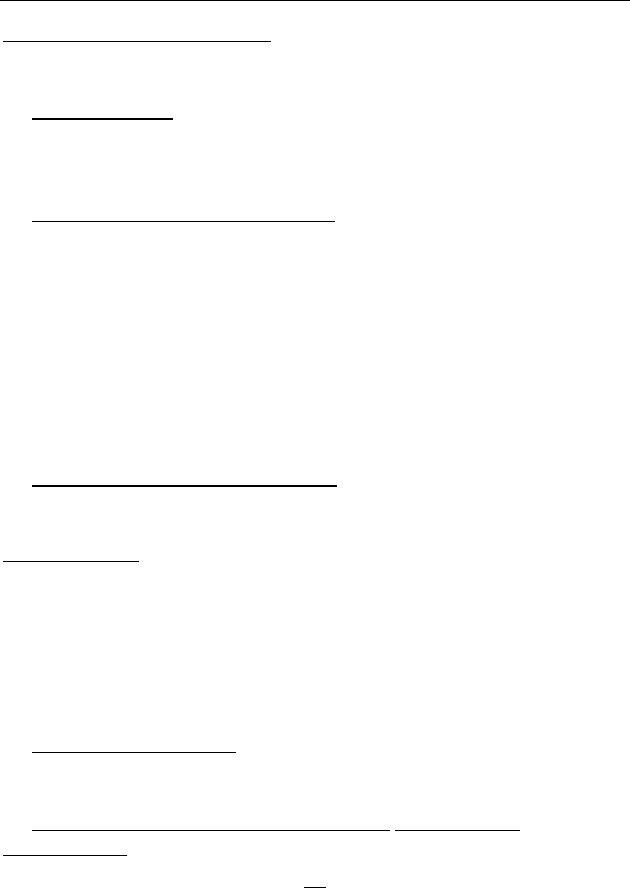
ОСНОВЫ МОЛЕКУЛЯРНО–КИНЕТИЧЕСКОЙ ТЕОРИИ
54
Размеры молекул и атомов определяются размерами орбиталей
внешних электронов и составляют, примерно,
10
–10
м = 1 Å( анг-
стрем).
♦ Идеальный газ. Считается, что молекулы такого газа состоят
из материальных точек, и не взаимодействуют друг с другом на
расстоянии. Соударения таких молекул являются абсолютно уп-
ругими.
♦ Термодинамические параметры определяют состояние газа.:
Р, Па — давление газа на стенки сосуда (
n
/
P
FS
=
, где
n
F
—
сила нормального давления,
S
— площадь действия силы.);
V,
м
3
— объем, занимаемый газом;
Т, К (кельвин) — термодинамическая, абсолютная температура.
Температура по шкалам Кельвина и Цельсия связаны между со-
бой:
Т,К = 273 К + t °C.
Абсолютная температура является мерой средней кинетической
энергии молекул.
♦ Термодинамическое равновесие — состояние системы, при
котором температура и давление в любой точке системы одина-
ковы.
Равновесными
называются термодинамические процессы, при
которых в любой момент времени в любой точке объема темпе-
ратуру и давление можно считать одинаковыми.
Термометры — приборы для измерения температуры. Использу-
ют зависимость давления, объема, электрического сопротивления
и др. параметров от изменения температуры.
8.2.Уравнение состояния идеального газа
♦ Уравнение состояния определяет связь термодинамических
параметров в состоянии термодинамического равновесия и в рав-
новесных термодинамических процессах.
♦ Уравнение состояния идеального газа (Менделеева-
Клапейрона) определяет связь термодинамических параметров
для идеального газа:
m
P
VRT=
μ
,
где Дж/(моль К)
8,31R =⋅ — универсальная газовая постоянная,
m — масса газа; μ — молярная масса газа.
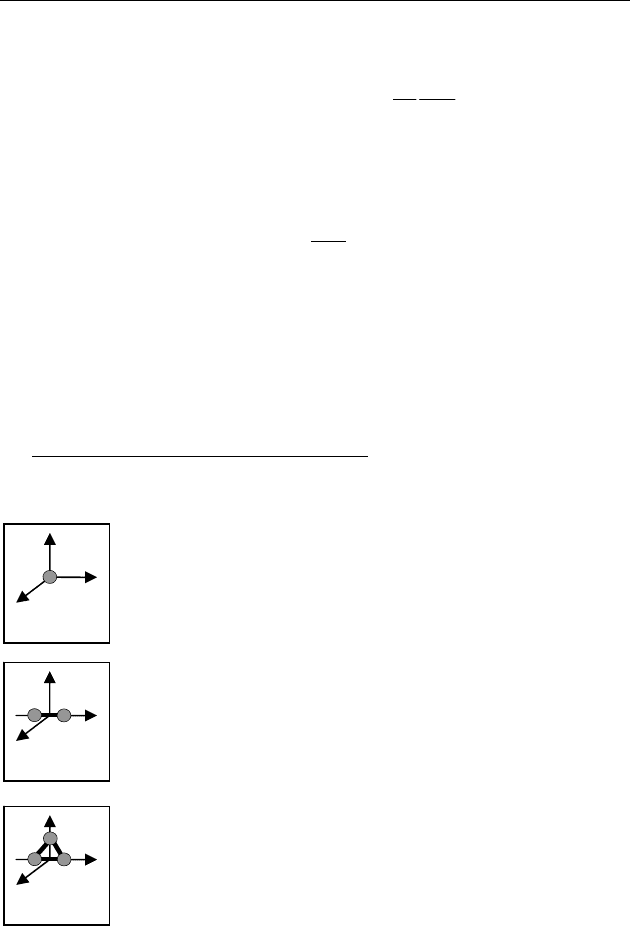
ОСНОВЫ МОЛЕКУЛЯРНО–КИНЕТИЧЕСКОЙ ТЕОРИИ
55
Рис. 54
x
y
z
Этому уравнению можно придать другой вид, вводя постоянную
Больцмана
23
A
/1,3810kRN
−
==⋅Дж/К, тогда
A
NR
PT
VN
=
⇒
P
nkT
=
,
где
/nNV= — концентрация молекул.
Плотность идеального газа можно определить по формуле:
P
RT
μ
ρ= .
8.3. Основное уравнение молекулярно–кинетической теории
идеального газа (основное уравнение МКТ)
позволяет определить макроскопические термодинамические па-
раметры (
,
P
T ), исходя из микроскопических представлений о
строении и поведении молекул.
♦ Число степеней свободы молекулы
i
— это количество неза-
висимых координат, необходимое для определения положения
молекулы в пространстве.
Одноатомный газ имеет молекулы, состоящие из
одной материальной точки (рис. 52). Материальная
точка обладает тремя степенями свободы (
3i
=
), так
как может двигаться вдоль осей X,Y,Z.
Двухатомный газ имеет молекулы, состоящие из
двух жестко связанных материальных точек (рис.
53) и обладает пятью степенями свободы (
5i = ):
может двигаться вдоль осей X,Y,Z и вращаться во-
круг осей X,Z. (Относительно оси Y
момент инер-
ции молекулы равен нулю).
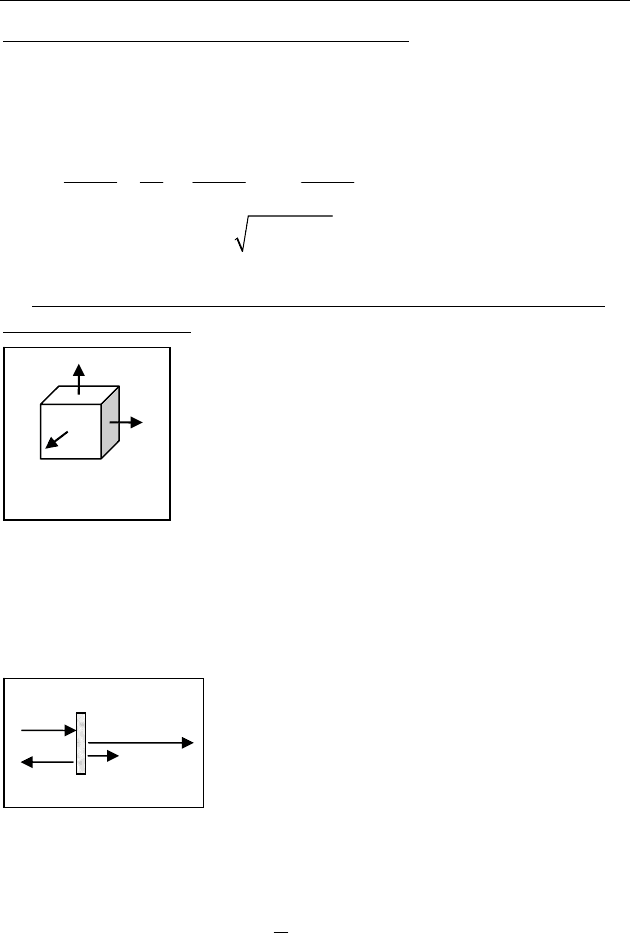
Многоатомный газ имеет молекулы, состоящие из
трех и более жестко связанных между собой
материальных точек (рис. 54). Такая молекула, как
любое абсолютно твердое тело, обладает шестью
степенями свободы (
6i
=
) — тремя
поступательными и тремя вращательными.
Рис. 52
x
y
z
Рис. 53
x
y
z
ОСНОВЫ МОЛЕКУЛЯРНО–КИНЕТИЧЕСКОЙ ТЕОРИИ
56
Средняя квадратичная скорость молекулы u (м/с).
За счет хаотичности движений и столкновений кинетиче-
ские энергии молекул газа близки по значениям. Будем считать,
что любая молекула идеального одноатомного газа обладает
средней кинетической энергией:
22
00
1
22
i
mu m
E
N
==〈〉
∑
v
, где
2
0
2
i
m v
— кинетическая энергия i –
ой молекулы, тогда
2
/
i
uN=
∑
v — средняя квадратичная ско-
рость молекулы.
♦ Вывод основного уравнения молекулярно–кинетической тео-
рии идеального газа
Рассмотрим движение
n
молекул иде-
ального одноатомного газа, находящихся в
кубическом сосуде (рис. 55) объемом
1V = м
3
,
тогда
n
— численно равно концентрации мо-
лекул газа. Считаем, что:
1) молекулы между столкновениями со стен-
ками сосуда движутся равномерно со средней
квадратичной скоростью
u
;
2) вследствие хаотичности движения молекул вдоль каждой оси
координат движется
/3n молекул;
3) удар молекул о стенку сосуда — абсолютно упругий.
По закону сохранения импульса при каждом упругом соударе-
нии молекула передает стенке (
0,5y = )
импульс (рис. 56):
00 0 0
()2mu mu mu mu
Δ
=−− =
r
rrr
.
За одну секунду молекула совершает /2u
таких передач, а переданный импульс ста-
нет равным по величине
2
0
mu .
Вдоль каждой оси координат движется
/3n молекул, которые за
одну секунду передадут
1м
2
поверхности грани куба импульс
2
0
1
3
nm u .
Рис. 55
x
z
м1
м1
y
м1
Рис. 56
0
mu
r
0
mu−
r
0
()muΔ
r
y
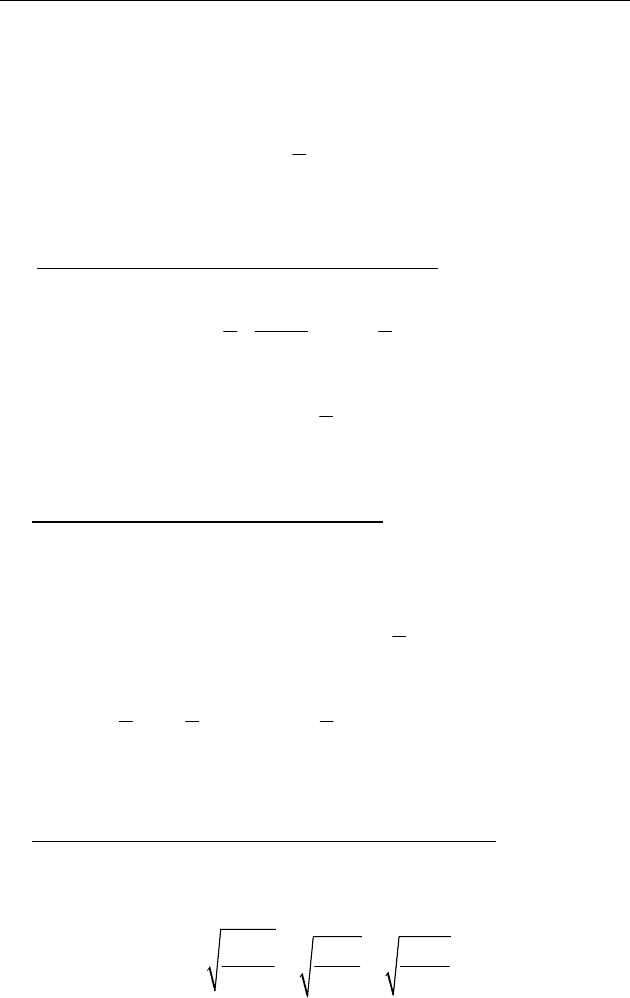
ОСНОВЫ МОЛЕКУЛЯРНО–КИНЕТИЧЕСКОЙ ТЕОРИИ
57
По второму закону Ньютона изменение импульса грани куба в
единицу времени равно средней силе давления частиц. Так как
площадь грани
0,5y = равна 1м
2
, эта сила численно равна давле-
нию газа. Поэтому, основное уравнение МКТ
2
0
1
3
P
nm u= ,
где /nNV= — концентрация молекул газа,
0
m , u — масса и средняя квадратичная скорость молекулы.
♦ Средняя энергия молекулы и температура
Основное уравнение МКТ можно переписать в виде:
2
0
22
32 3
mu
P
nPnE=⇒=
〈
〉
Сравнивая с уравнением состояния
P
nkT
=
, получаем
3
2
E
kT〈〉= .
Таким образом, абсолютная температура является мерой средней
кинетической энергии поступательного движения
молекулы.
♦ Внутренняя энергия идеального газа U , Дж — это кинетиче-
ская энергия поступательного и вращательного движения его мо-
лекул. В классической физике вводится
закон равнораспределе-
ния,
согласно которому на каждую степень свободы молекулы
приходится одинаковая энергия, равная
1
2
kT
. Поэтому, в общем
случае многоатомных молекул внутренняя энергия идеального
газа:
()
A
22 2
ii i
UNkT NkT RT
==ν =ν, где i — число степеней
свободы молекулы.
8.4. Закон распределения молекул по скоростям
♦ Распределение молекул по скоростям Максвелла. В параграфе
8.3 мы ввели понятие средней квадратичной скорости, справед-
ливо считая, что скорости конкретных молекул отличаются друг
от друга даже в состоянии термодинамического равновесия:
2
0
33
i
kT RT
u
Nm
===
μ
∑
v
.
ОСНОВЫ МОЛЕКУЛЯРНО–КИНЕТИЧЕСКОЙ ТЕОРИИ
58
Максвелл установил закон, определяющий число молекул dn из
общего их числа в единице объема
0
n , которые обладают при
данной температуре
T скоростями поступательного движения в
интервале от
v до d+vv:
2
0
3
2
2
0
2
0
4
2
m
kT
m
dn n e d
kT
−
⎛⎞
=⋅⋅π
⎜⎟
π
⎝⎠
v
vv , где
0
m — масса молекулы,
k
— постоянная Больцмана.
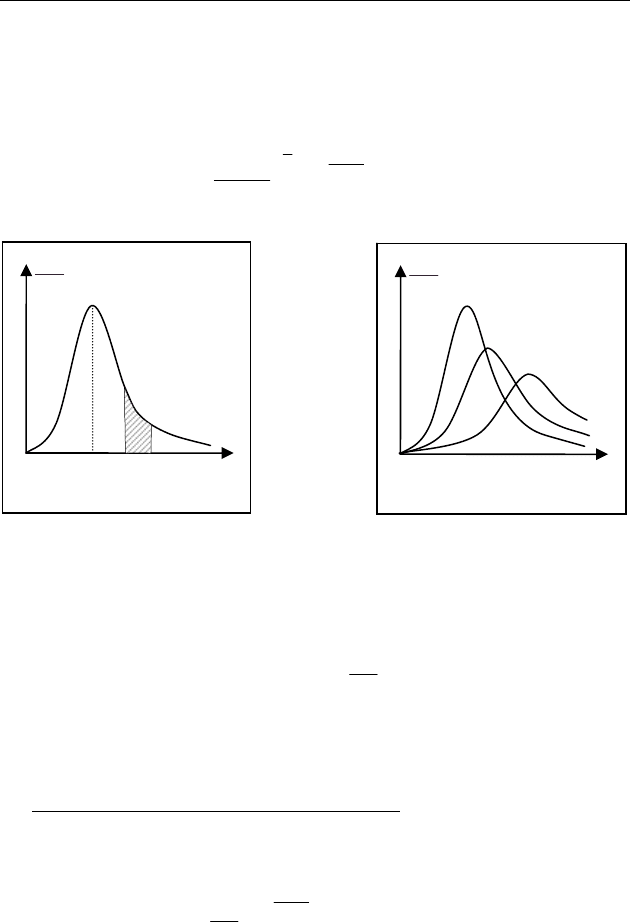
На рис.57 приведена кривая распределения молекул по скоро-
стям. Число частиц
dn со скоростями в интервале от v до
d+vv равно площади криволинейной трапеции. Очевидно, что
вся площадь, ограниченная кривой
dn
dv
, равна концентрации мо-
лекул газа
0
n . С увеличением температуры газа максимум кри-
вой смещается в сторону больших скоростей, а его высота
уменьшается (рис. 58).
♦ Наиболее вероятная скорость молекул
Из закона распределения молекул по скоростям
можно опреде-
лить наиболее вероятную скорость молекул
B
u . Решая задачу на
экстремум функции
2
0
В
2
2
0
m
kT
u
d
e
d
−
=
⎡⎤
⎛⎞
⎢⎥
⎜⎟
⋅
=
⎢⎥
⎜⎟
⎢⎥
⎝⎠
⎣⎦
v
v
v
v
,
Рис. 57
dn
dv
0
В
u
v
d+vv
dn
v
Рис. 58
dn
dv
0
v
123
TTT
<
<
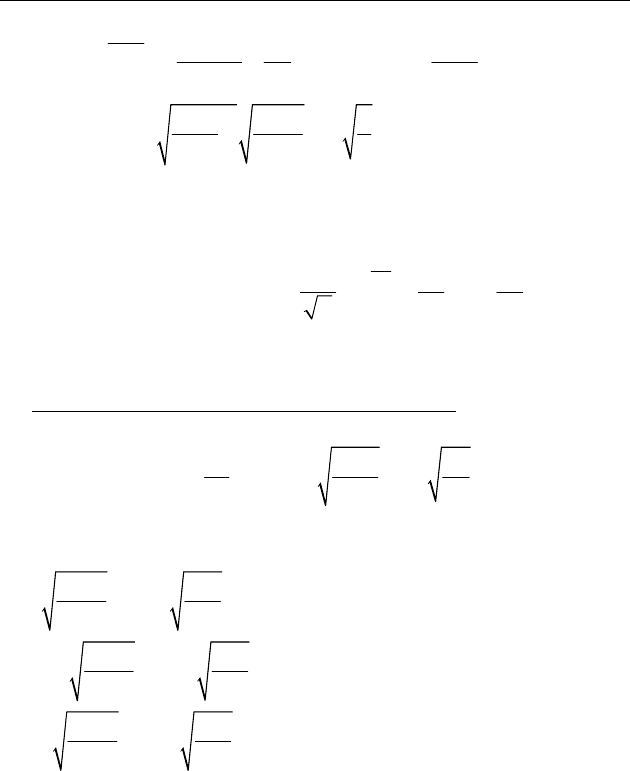
ОСНОВЫ МОЛЕКУЛЯРНО–КИНЕТИЧЕСКОЙ ТЕОРИИ
59
В
В
В
В
2
0
2
2
0
2
2
0
2
m
kT
m
e
kT
−
⎛⎞
−+=
⎜⎟
⎝⎠
u
u
u
u
В
2
0
2kT
m
⇒=u ,
получаем
в
0
22 2
3
kT RT
uu
m
===
μ
. Таким образом наиболее
вероятная скорость молекул меньше средней квадратичной и за-
висит только от температуры и массы (молярной массы) молекул.
Закон максвелловского распределения молекул по скоростям мо-
жет быть записан в виде:
ВВ
2
2
В
2
0
4
u
n
dn e d
uu
−
⎛⎞⎛⎞
=⋅ ⋅
⎜⎟⎜⎟
π
⎝⎠⎝⎠
v
vv
, где ско-
рости молекул
v рассматриваются в единицах наиболее вероят-
ной скорости
В
u .
♦ Средняя арифметическая скорость молекул определяется ин-
тегралом
0
0
0
1
n
nu d
n
〈〉=
∫
v
88
3
RT
u
==⋅
π
μπ
.
Таким образом, существуют три скорости, характеризующие со-
стояние газа:
3
1,73
RT RT
u
==
μ
μ
— средняя квадратичная скорость;
u〈〉
8
1,60
RT RT
==
πμ μ
— средняя арифметическая скорость;
В
2
1,41
RT RT
u
==
μ
μ
— наиболее вероятная скорость.
8.5. Барометрическая формула
В реальных земных условиях на молекулы газа всегда действует
сила тяжести. Тяготение и тепловое движение приводят к тому,
что концентрация молекул и давление убывают с высотой. Най-
дем закон изменения давления газа с высотой. По формуле Пас-
каля при увеличении высоты на бесконечно малую величину
dh ,
давление газа понизится на
dP :
dP g dh
=
−ρ ⋅ .
