Тутельян В.А. и др. Селен в организме человека
Подождите немного. Документ загружается.


Глава 1
Селен в природе
и живом организме
Селен в окружающей среде
Селен — элемент VI группы главной подгруппы периодической
системы Менделеева, во многом повторяющий химические свойства
серы. В природе он, как правило, сопутствует соединениям серы и меди
и выделяется в чистом виде при переработке медных руд. Селен ис-
пользуется в промышленности — в производстве полупроводников,
цветного стекла и некоторых красок, а также в множительной технике.
Селен поступает в организм человека из почвы с продуктами рас-
тениеводства и животноводства, что определяет зависимость уровня обес-
печенности микроэлементом от геохимических условий проживания.
Кларк селена в земной коре составляет 1-5х10
-б
?ъ [1]. Среди при-
родных минералов селена наиболее распространены селениды метал-
лов, имеющих большой порядковый номер (свинец, ртуть, серебро,
медь, никель). Эти селениды образуются в основном в гидротермаль-
ных условиях (термальные источники, активная вулканическая дея-
тельность). Такие соединения часто встречаются в сульфидных и ура-
новых месторождениях.
Предельно допустимая концентрация селена в воздухе состав-
ляет IO
-5
мг/м
3
, в питьевой воде — 1 мкг/л.
Кларк селена в океанской воде составляет 10~
8
%, среднее содер-
жание селена в речной воде — около 0.2 мкг/л. В родниках, скважи-
нах и соленых озерах селена несколько больше. Так, в Венесуэле уро-
Ii

ГЛАВА 1. СЕЛЕН В ПРИРОДЕ И ЖИВОМ ОРГАНИЗМЕ
вень селена в водах, протекающих через пласты с высокой селеновой
минерализацией, достигает 1 мг/л, в США — 9 мг/л. В России выявле-
ны 3 гидрогеохимические провинции с повышенным содержанием
селена в грунтовых водах — Уральская, Тувинская и Алтайская [2]. Боль-
шая часть природных источников бедна селеном, что определяет их
незначительную роль в формировании селенового статуса растений,
животных и человека.
Селеновый пул почвы складывается из неорганических соедине-
ний микроэлемента и органических форм, попадающих в почву вместе
с умершими растениями и животными организмами. Под действием
микрофлоры почвы происходит, с одной стороны, образование форм,
доступных для растений, а с другой — высвобождение селена в атмо-
сферу в результате реакции метилирования (рис. 1). Антропогенное
воздействие, в первую очередь связанное со сжиганием ископаемого
топлива, резко увеличивает долю атмосферного селена таким образом,
что последний, наряду с депонированными в земле формами, становится
важным источником селена для растений.
Диметилселенид
(испаряется, разбавляется и диспергируется)
Д
'
1
Атмосфера
Почва
Метилирование
Ингибируется:
высокими
концентрациями
Mo, Hg, Pb, Cr
Катализируется:
пектином,
белками,
аэрацией,
ирригацией,
повышенными
температурами
Усвоение и восстановление
под действием микрофлоры
Неорганический
селен
(Na
i
SeO
41
Na
i
SeO,)
Органический
селен
(5>е-содержащие
аминокислоты
и белки)
Иммобилизация
Рис. 1. Метаболизм селена микробами почвы.
12

СЕЛЕН В ОКРУЖАЮЩЕЙ СРЕДЕ
Не весь селен почвы доступен для растений. Так, в кислых, силь-
но заболоченных почвах биодоступность микроэлемента низка, хотя
общее содержание может быть и значительным. Здесь большое значе-
ние имеет образование нерастворимых комплексов четырехвалент-
ного селена с железом. В аэробных щелочных условиях большая
часть селена находится в окисленной форме (Se
6+
) и легко доступна
для растений.
По способности накапливать селен и противостоять токсичес-
кому действию микроэлемента растения подразделяются на аккумуля-
торов и неаккумуляторов селена. К первым относятся некоторые виды
астрагалов, к последним — большая часть зерновых и зеленных куль-
тур, используемых человеком.
Судьба микроэлемента, поступающего из почвы в такие расте-
ния, различна. Неаккумуляторы способны синтезировать селенсо-
держащие аминокислоты и из них — соответствующие белки, что
при высоких концентрациях селена приводит к дезактивации зна-
чительной части ферментов и, как следствие, гибели растения. Ак-
кумуляторы селена также используют селен в биосинтезе аминокис-
лот, однако последние не участвуют в образовании белков, а акку-
мулируются в вакуолях, делая таким образом селен безвредным для
растения (рис. 2). Естественно, что поедание животными растений
подобных видов может сопровождаться токсикозахми.
SeOi
т
SeOi ... в корнях^
ч
Бе-цистеин _
т
± <
Se-UHCTaTHOH Se-HiicTiiH Se-HivraTHOH
А
* T
Se-MeTnoHHH T
А т Se-MeTtw-Se-HHCTeiiH
у у ^ (растения-аккумуляторы)
БЕЛОК Se-MeTiM-Se-MeTHOHHH
(растения-
неаккумуляторы)
Рис. 2. Метаболизм селена в растениях.
Двойная стрелка — важнейший путь у растений-неаккумуляторов, тонкая стрелка — второстепенный
путь у растений-неаккумуляторов, пунктирная — медленная реакция. *Механизм не установлен.
13

ГЛАВА 1. СЕЛЕН В ПРИРОДЕ И ЖИВОМ ОРГАНИЗМЕ
В биосфере, таким образом, миграция селена осуществляет-
ся по пищевой цепи: из почвы в растения, далее в организм жи-
вотных, а первые и вторые служат источником селена для чело-
века (рис. 3).
Селен Селен ^^ Селен
почвы ^^ растений ^^ животных
Селен Jj
человека
Рис. 3. Пищевая цепь переноса селена.
Такая взаимосвязь определяет решающую роль почвы в форми-
ровании селенового статуса живых организмов. Данные табл. 1 хо-
рошо иллюстрируют географические различия накопления селена
растениями.
В пшенице содержание селена в зависимости от места произра-
стания может варьировать в пределах 4-21 400 мкг/кг, в люцерне — в
пределах 10-5000 мг/кг 11]. В США и Канаде содержание селена в пше-
нице составляет около 600 мкг/кг, в районах токсикоза — до 2 мг/кг,
в России — 80-120 мкг/кг, в селендефицитных биогеохимических про-
винциях Китая — до 5 мкг/кг, в селендефицитной Читинской облас-
ти — 6-28 мкг/кг.
Географические различия в поступлении селена из почвы в рас-
тения, а из них в организм сельскохозяйственных животных и пти-
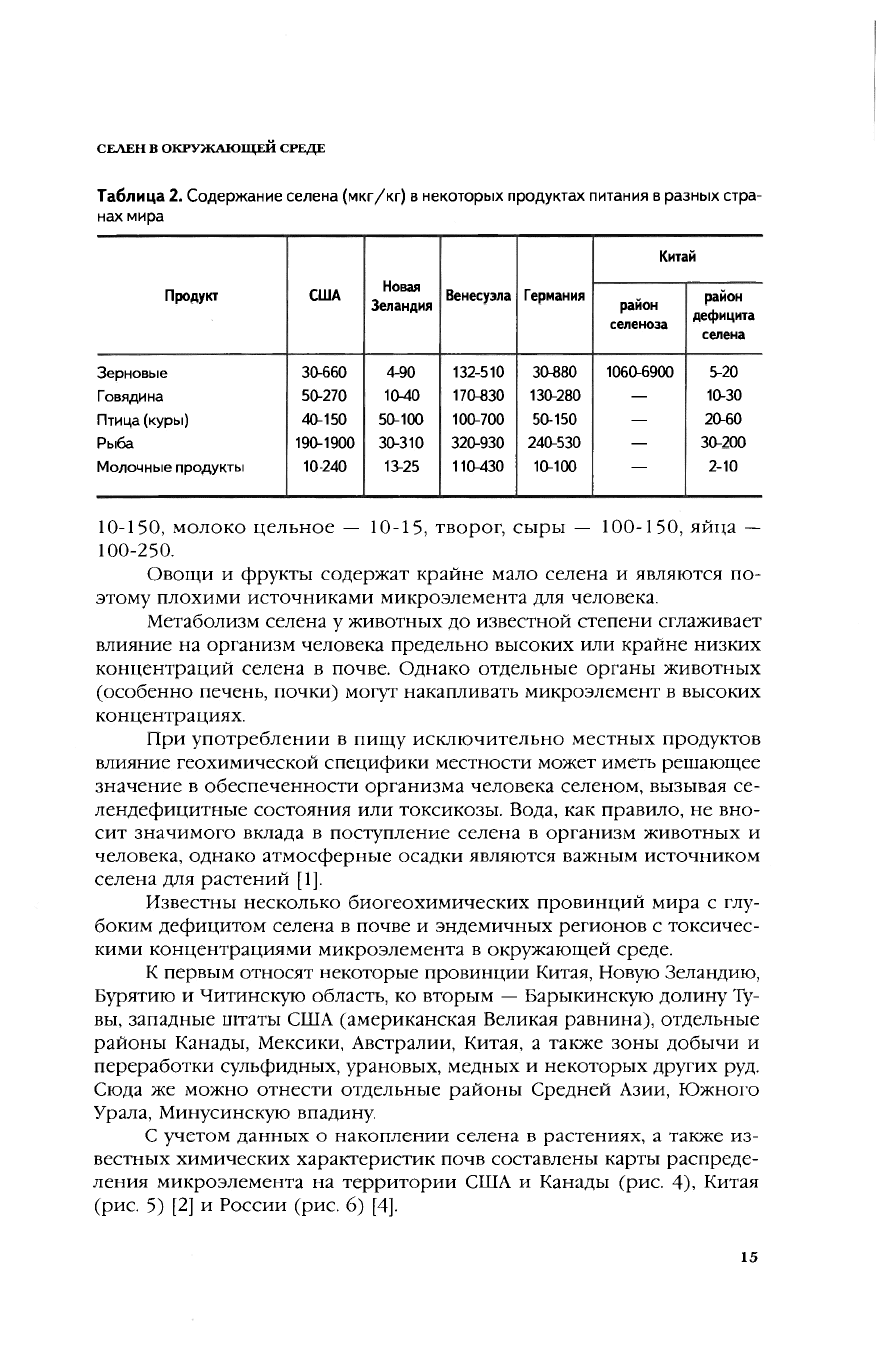
цы для некоторых других стран мира представлены в табл. 2. Как вид-
но из приведенных данных, наименее подвержено географической за-
висимости содержание селена в рыбе.
Содержание селена в продуктах питания городов России (с уче-
том привозных продуктов) колеблется в пределах (в мкг/кг): мука
пшеничная — 80-600, мука ржаная — 6-70, крупы — 10-200, хлеб
пшеничный и ржаной (в пересчете на сухую массу) — 60-400 и
50-300 соответственно, говядина — 100-400, колбасы — 60-200, цып-
лята — 200, рыба 150-450, морепродукты — 300-600, молоко сухое —
Таблица 1. Содержание селена (мкг/кг) в некоторых зерновых Китая [3]
Характеристика района
Кукуруза Рис
Соя
Токсические концентрации селена в почвах 8100
4000 11900
Нормальные условия произрастания 36
35 69
Селендефицитный район 5
7 10
14
СЕЛЕН В ОКРУЖАЮЩЕЙ СРЕДЕ
Таблица 2. Содержание селена (мкг/кг) в некоторых продуктах питания а разных стра-
нах мира
Продукт США
Новая
Зеландия
Венесуэла
Германия
Китай
Продукт США
Новая
Зеландия
Венесуэла
Германия
район
селеноза
район
дефицита
селена
Зерновые
30-660
4-90
132-510 30-880 1060-6900 5-20
Говядина 50-270 10-40
170-830 130-280 —
10-30
Птица (куры) 40-150 50-100 100-700 50-150 —
20-60
Рыба 190-1900 30-310
320-930 240-530
—
30-200
Молочные продукты 10-240 13-25 110-430 10-100
—
2-10
10-150, молоко цельное — 10-15, творог, сыры — 100-150, яйца —
100-250.
Овощи и фрукты содержат крайне мало селена и являются по-
этому плохими источниками микроэлемента для человека.
Метаболизм селена у животных до известной степени сглаживает
влияние на организм человека предельно высоких или крайне низких
концентраций селена в почве. Однако отдельные органы животных
(особенно печень, почки) могут накапливать микроэлемент в высоких
концентрациях.
При употреблении в пищу исключительно местных продуктов
влияние геохимической специфики местности может иметь решающее
значение в обеспеченности организма человека селеном, вызывая се-
лендефицитные состояния или токсикозы. Вода, как правило, не вно-
сит значимого вклада в поступление селена в организм животных и
человека, однако атмосферные осадки являются важным источником
селена для растений [1].
Известны несколько биогеохимических провинций мира с глу-
боким дефицитом селена в почве и эндемичных регионов с токсичес-
кими концентрациями микроэлемента в окружающей среде.
К первым относят некоторые провинции Китая, Новую Зеландию,
Бурятию и Читинскую область, ко вторым — Барыкинскую долину Ту-
вы, западные штаты США (американская Великая равнина), отдельные
районы Канады, Мексики, Австралии, Китая, а также зоны добычи и
переработки сульфидных, урановых, медных и некоторых других руд.
Сюда же можно отнести отдельные районы Средней Азии, Южного
Урала, Минусинскую впадину.
С учетом данных о накоплении селена в растениях, а также из-
вестных химических характеристик почв составлены карты распреде-
ления микроэлемента на территории США и Канады (рис. 4), Китая
(рис. 5) [2] и России (рис. 6) [4].
15

ГЛАВА 1. СЕЛЕН В ПРИРОДЕ И ЖИВОМ ОРГАНИЗМЕ
Рис. 4. Содержание селена в зерновых США и Канады.
/ — около 80% зерновых содержат селена менее 100 мкг/кг, 2— около 50% зерновых содержат
селена более 100 мкг/кг, 3 — 80% зерновых содержат селена более 100 мкг/кг.
0
Рис. 5. Содержание селена в зерновых Китая.
1 — дефицит селена (менее 25 мкг/кг), 2 — пониженное содержание (25-40 мкг/кг), 3 — умерен-
ное содержание (40-70 мкг/кг), 4— высокое содержание (более 70 мкг/кг), 5— данные отсутству-
16

ХИМИЧЕСКИЕ ФОРМЫ СЕЛЕНА
В
ЖИВЫХ ТКАНЯХ
Рис. 6. Содержание селена в растениях и почве России.
1 —- выраженный дефицит селена, 2 — умеренный недостаток селена, 3 — относительно нормаль-
ный уровень селена в среде, 4 — повышенное содержание селена в растениях и среде, 5 — участки
селеновых аномалий и потенциальных биогеохимических гиперпровинций.
Литература
1. Сиделъпикова В Д. Геохимия селена в биосфере // Проблемы биогеохимии и
геохимической экологии. M.: Наука, 1999- Т. 23. С. 81-99-
2. Ермаков ВВ., Ковальский ВВ. Биологическое значение селена. M.: Наука, 1974.
3. Селен. Гигиенические критерии состояния окружающей среды. Женева:
ВОЗ, 1989.
4. Ермаков ВВ. Геохимическая экология как следствие системного изучения
биосферы // Проблемы биогеохимии и геохимической экологии. M.: Наука,
1999. Т. 23. С. 152-182.
Химические формы селена
и живых тканях
У растений важнейшей химической формой селена является се-
ленометионин (Se-Met). Большая часть селена в животных тканях при-
сутствует в виде Se-Met и селеноцистеина — Sec (рис. 7). Первый вклю-
чается на место метионина в различные белки, второй участвует в об-
разовании активного центра целого ряда селенсодержащих белков
(СБ) — глутатионпероксидаз (GPX), йодтирониндейодиназ (ID) и се-
ленопротеина P (SelP). Могут присутствовать и другие формы, т.к. се-
лен тканей до сих пор полностью не охарактеризован.
17

ГЛАВА
1.
СЕЛЕН
В
ПРИРОДЕ И ЖИВОМ ОРГАНИЗМЕ
Селенометионин
Селенометиониновый
пул организма
(селенометионин
тканевых белков)
Селеноцистеин
Селенит
Селенат
*
Селеноцистеин
белков Транспортная
форма
Экскретируемые
формы
Рис. 7. Утилизация диетического селена.
Se-Met не синтезируется в организме, не регулируется селеновым
статусом животного и может рассматриваться как нерегулируемый за-
пас селена. Когда потребление диетического селена прекращается, по-
требность организма в микроэлементе обеспечивается за счет круго-
оборота пула Se-Met. Действительно, при смене района высокого по-
требления на район селенового дефицита уровень селена в крови
у мигрантов снижается очень медленно [1] при сохранении активности
селензависимой GPX эритроцитов.
Sec — форма селена, ответственная за биологическую активность
микроэлемента, поскольку присутствует в активном центре всех изве-
стных в настоящее время СБ [2]. Регулирование этого высокореакцион-
ного соединения, необходимое, чтобы свести к минимуму его участие
в биохимических реакциях вне клетки, происходит на клеточном
уровне. В настоящее время отсутствуют данные о возможности заме-
щения цистеина на Sec в белках, как это происходит с Se-Met. Посколь-
ку Sec включается в тРНК, не исключена возможность существования
других биологически активных форм микроэлемента [3].
Литература
1. Robinson
MJF.
The moonstone: more about selenium // J. Hum. Nutr. 1976. Vol. 30.
Р. 79-91.
2. Gladyshev KJV, Hatfield DL. Selenocysteine-Containing proteins in mammals
// J.
Bio-
med. Sci. 1999. Vol. 6, N 3. Р. 151-160.
3.
Wittwer
Af Ching W-M. Selenium-Containing tRNA and tRNA Lys from Escherichia coii: ри-
rification, codon specificity and translational actiVity // Biofactors. 1989. Vol. 2. Р. 27-34.
Селене о держащие белки
Биохимические функции селена определяются СБ. Недостаток
микроэлемента может приводить к нарушению клеточной целостнос-
18

СЕЛЕНСОДЕРЖАЩИЕ БЕЛКИ
ти, изменению метаболизма тиреоидных гормонов, активности био-
трансформирующих ферментов, усилению токсического действия тя-
желых металлов, повышению концентрации глутатиона в плазме [1,2].
Характерной особенностью СБ млекопитающих является то, что они,
по-видимому, связаны с окислительно-восстановительными процесса-
ми, происходящими внутри клетки и вне ее [3]. К настоящему време-
ни охарактеризованы 12 СБ, к числу которых относятся ферменты —
GPX, ID, тиоредоксинредуктаза (TR) и селенфосфатсинтетаза (SPS)
1
со-
держащие в активном центре Sec [4]. Данные изотопного анализа и ре-
зультаты теоретических исследований позволяют предполагать, что в
организме млекопитающих может насчитываться от 20 до 100 СБ [5].
GPXl (cGPX) — клеточная GPX [6] — является наиболее распро-
страненным СБ крыс и, по-видимому, присутствует во всех клетках
организма млекопитающих, локализуясь в цитозоле. Присутствие этого
фермента особенно важно в эритроцитах и печени, где образуется
значительное количество свободных радикалов. Молекула cGPX со-
стоит из 4 одинаковых субъединиц с молекулярной массой 22 кД, каж-
дая из которых содержит по одному остатку Sec [7]. Предполагают, что
фермент может не только служить в качестве антиоксиданта, восста-
навливая гидроперекиси в присутствии восстановленного глутатиона
(GSH), но и использоваться организмом как селеновое депо [8]. Так,
при дефиците селена у лабораторных животных активность cGPX со-
ставляет менее 1% от исходного уровня, однако это не приводит к
видимым изменениям в клеточном метаболизме [9]. У мышей, не об-
ладающих геном cGPX, оксидантные условия не приводили к каким бы
то ни было генотипическим изменениям [10]. С другой стороны, необ-
ходимость cGPX для предотвращения у мышей вирусиндуцированного
миокардита предполагает важную роль фермента в защите клеток от
стресса [11]. По-видимому, в обычных условиях функция cGPX может
быть компенсирована другими клеточными компонентами.
Существует гипотеза, согласно которой cGPX определяет хемо-
защитные свойства селена. Экспрессия этого фермента в больных
клетках часто нарушена [12]. Показано, что в некоторых раковых клет-
ках активность GPXl и TR регулируется особыми механизмами [13].
6РХ2 (GPX-GI), в отличие от cGPX, которая найдена во всех
клетках, характерна только для эпителия желудочно-кишечного тракта
[14]. ОРХ2 обладает субстратной специфичностью, аналогичной тако-
вой GPXl, и состоит из 4 идентичных субъединиц. ОРХ2 обнаружи-
вается в цитозоле и содержит, так же как и cGPX, по одному остатку
Sec в каждой белковой цепи. Сходство в структуре этих двух фермен-
тов, однако, весьма ограниченное, поскольку антитела к GPX-GI не
взаимодействуют с cGPX [15]. В желудочно-кишечном тракте актив-
ность GPX-GI составляет около 50% от общей глутатионпероксидазной
активности [16]. Установлено, что фермент синтезируется в печени и
19

ГЛАВА 1. СЕЛЕН В ПРИРОДЕ И ЖИВОМ ОРГАНИЗМЕ
ободочной кишке [7], что указывает на его участие в первичной защите
от оксидантов, поступающих с пищей [17].
ОРХЗ (pGPX) — межклеточная GPX, или GPX плазмы, представ-
ляет собой гликопротеин, восстанавливающий свободные и этерифи-
цированные гидроперекиси и перекиси жирно-кислотных остатков
фосфолипидов в присутствии GSH, контролируя таким образом уро-
вень перекисей вне клетки [18]. Поскольку GSH в плазме крайне мало,
предполагают, что донорами электронов могут служить тиоредоксин,
TR или глутаредоксин [19], а сам фермент имеет относительно низкую
активность по сравнению с другими GPX [20]. ОРХЗ секретируется
почками, печенью и тканями легких [21]. По своей структуре фермент
сходен с cGPX и GPX-GI: содержит четыре одинаковых субъединицы,
в каждой из которых имеется по одному остатку Sec [15]. Окончатель-
но функциональная роль этого фермента не ясна. Поскольку актив-
ность pGPX восстанавливается быстрее, чем активность cGPX, то, по-
видимому, функциональная значимость первого фермента выше [22].
ОРХ4 (PHGPX) — фосфолипид гидропероксид GPX — в отли-
чие от GPXl и СРХ2 является мономером (молекулярная масса око-
ло 19 кД) и представляет собой одну из субъединиц cGPX или pGPX
[23,24]. Локализуется преимущественно в семенниках, но найдена во
многих тканях во фракции мембран и в свободном виде в цитозоле
[25]. Этот фермент осуществляет восстановление гидроперекисей жир-
но-кислотных остатков фосфолипидов без предварительного гидро-
лиза фосфолипазой А [26] и является единственной GPX, выполняю-
щей такую функцию. Действительно, это единственный липофильный
фермент из группы GPX, проявляющий высокую аффинность по отно-
шению к мембранам [27]. Кроме того, функционирование этого фер-
мента не требует участия GSH, поскольку в реакцию могут вовлекаться
другие тиольные соединения [24]. PHGPX также может восстанавливать
гидроперекиси холестерина, его эфиров и фосфолипидов [27]. В ус-
ловиях дефицита селена последний включается в первую очередь в
ОРХ4 и только затем — в cGPX. Интенсификация синтеза йРХ4 в се-
менниках после пубертатного периода предполагает, что этот фер-
мент, наряду с другими СБ, может играть важную роль в репродуктив-
ной системе мужчин [28].
ID — группа из трех оксидоредуктаз, регулирующих активность
тироксина путем каталитического дейодирования 5- или 5'-колец это-
го гормона. Эти ферменты, обладают рядом общих свойств, хотя и
играют различную роль в активации и дезактивации тироксина. Ос-
таток Sec расположен в активном центре каждого белка и, по-видимо-
му, участвует в переносе йода. Каждая йодиназа представляет собой
мембранный белок и содержит гидрофобную аминокислотную после-
довательность на Ы-конце белковой цепи [29]. В экспериментах на жи-
вотных показано, что одновременный дефицит селена и йода приво-
20
