Шендрик А.Н. Химия белка. Структура, свойства, методы исследования
Подождите немного. Документ загружается.

72
флуориметр с длиной волны возбуждения 340 нм и эмисии - 450 нм (стоксово
смещение полосы).
Флуорескамин - очень дорогое и нестабильное в водных средах соедине-
ние, поэтому применяется редко. Его с успехом можно заменить и заменяют
орто-фталевым альдегидом (ОФА). Флуоресцирующее производное ОФА ами-
нокислот имеет полосу возбуждения с максимумом полосы поглощения 360 нм,
эмиссии - 455 нм. Это производное легко образуется при рН=9-11. Некоторые
осложнения в детектировании аминокислот с ОФА возникают при анализе цис-
теина, цистина, пролина, гидроксипролина. Чувствительность определения
аминокислот с ОФА - 5пмоль (для сравнения, с нингидрином - 100 пмоль).
2. Предколоночная модификация. Постколоночная модификация амино-
кислдот - сложная и трудоемкая процедура. Необходимо постоянно (с некото-
рой периодичностью) отбирать аликвоты (пробы) элюэнта, обрабатывать соот-
ветствующими реагентами и фотоколориметрировать или анализировать мето-
дом флуорометрии. Проще провести предколоночную модификацию всех ами-
нокислот непосредственно после проведения гидролиза, а полученную после
этого смесь модифицированных аминокислот разделить (проанализировать)
методом тонкослойной, колоночной, жидкостной, высокоэффективной жидко-
стной (ВЭЖХ) и т. д. хроматографии. По воспроизводимости этот способ не-
сколько уступает методу постколоночной модификации. Наиболее распростра-
ненный способ предколоночной модификации - это превращение аминокислот
в фенилтиогидантоиновые производные по реакции с реактивом Эдмана (см.
раздел 1.1.6).
Для облегчения и интенсификации массовых (серийных) анализов амино-
кислот созданы и производятся приборостроительной промышленностью авто-
матические анализаторы аминокислот. Это достаточно сложные приборы, в ос-
нову работы которых положен метод высокоэффективной жидкостной хрома-
тографии.
73
Газожидкостная хроматография (ГЖХ). В этом варианте хроматогра-
фического анализа смесей аминокислот их превращают в легколетучие произ-
водные. Известен метод одностадийной модификации - триметилсилилирова-
ние по группам NH
2
, COOH, OH, SH. Недостаток: некоторые аминокислоты
дают при хроматографировании мультиплетные пики.
Более удачными являются варианты двухстадийной модификации. 1 ста-
дия - этерификация карбоксильных групп. Вторая - ацилирование других реак-
ционноспособных функциональных амино-, сульфгидрильных, гидрокси-, гуа-
нидино- групп.
Метод ГЖХ обеспечивает удовлетворительные качественные результаты
анализа, но получить корректные количественные данные удается с большим
трудом. Возникают к тому же осложнения с определением гистидина, аргини-
на, цистина. Последние разрушаются на некоторых неподвижных фазах. С по-
явлением автоматических анализаторов аминокислот метод ГЖХ утратил свою
ценность и применяется все реже.
Полный неспецифичный гидролиз белка (пептида) позволяет установить
только его брутто состав, т.е. какие аминокислоты входят в пептидную цепь и в
каких количественных соотношениях (пропорциях). Однако, полученный ре-
зультат не несет в себе никакой информации о том, в какой последовательности
соединены между собой эти аминокислоты. Для решения этой задачи проводят
так называемое секвенирование пептидной цепи. Составной частью этой про-
цедуры является установления структуры N- и C-концевых аминокислот.
2.1.2 Установление структуры С- концевых остатков пептидных цепей
Секвенирование пептидной цепи начинают с установления структуры
концевых аминокислот. В линейном (цепочечном) пептиде таких аминокислот
всего две на каждую макромолекулу. Это N- и C-концевые аминокислоты. В
74
белках с разветвленной пептидной цепью их может быть больше. Для опреде-
ления С-концевого остатка используют следующие приемы.
¾ Обрабатывают белок (пептид) гидразином. Он реагирует с карбонильной
группой каждой пептидной связи, расщепляя ее с образованием ацилгидразид-
ных производных всех аминокислотных остатков за исключением С-концевого.
С-концевой остаток не подвергается модификации, поскольку его α-СООН
группа не входит в пептидную связь.
H
R
3
H
COOHCN
O
R
2
N
R
1
O
CNCNH
2
NH
2
NH
2
смесь ацилгидразидов +
NH
2
C COOH
H
R
3
Для идентификации С-концевую α-аминокислоту (кислоты) экстрагиру-
ют из смеси ацилгидразидов и устанавливают ее структуру методами физико-
химического анализа. Можно использовать и другой прием. Обработать рас-
твор бензальдегидом. Он образует с ацилгидразидами нерастворимые в воде
основания Шиффа, которые выпадают в осадок, а свободные аминокислоты ос-
таются в растворе.
¾ Ферментативное отщепление С-концевой аминокислоты с помощью кар-
боксипептидазы - пищеварительного фермента, выделяемого из желудочного
сока млекопитающих. Этот фермент избирательно отщепляет С-концевые ос-
татки в пептидных цепях. Для установления структуры С-концевой аминокис-
лоты этим способом исследуют кинетику процесса накопления образовавшихся
в процессе ферментативного расщепления аминокислот в продуктах реакции.
Поскольку фермент отщепляет все концевые аминокислоты (не только те, что

75
имеются в исходном белке, но и вновь образующиеся после отщепления), то
определить структуру С-концевой аминокислоты в исходной пептидной цепи
можно по скорости ее накопления или по количеству образовавшейся амино-
кислоты в начальный момент времени. В идеальном случае с максимальной
скоростью будет накапливаться аминокислота, являющаяся С-концевой в ис-
ходном белке (концентрация максимальна). С меньшими скоростями будут на-
капливаться вторая со стороны С-конца, третья и т.д. аминокислоты.
NH
2
CHR (CO NH)nCHR'COOH
NH
2
CHR (CO NH) C HR''COOH
NH
2
CHR (CO NH) C HR'''COOH
n-1
n-2
NH
2
CHR'COOH
NH
2
CHR''COOH
+
+
И т. далее
Таким образом удается
установить последова-
тельность из нескольких
(до 10 и более) амино-
кислотных остатков в
пептидной цепи со сто-
роны ее С-концевой
аминокислоты.
Метод был пред-
ложен Ленсоном в
1949г. Он имеет ряд не-
достатков, которые час-
то затрудняют установ
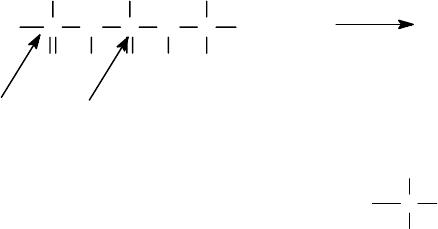
Время деградации ПП-цепи
Концентрация а/к
→
Концевая а/к
n-1 а/к
n-2 а/к

76
ление структуры С-концевых аминокислот. Основными среди этих недостатков
есть.
¾ Различия в скоростях отщепления разных аминокислот при прочих равных
условиях. Наиболее легко отщепляются ароматические, затем следуют ами-
нокислоты с длинной алифатической цепью и затем с короткой цепью.
¾ Очень медленно отщепляются дикарбоновые и диаминовые аминокислоты.
¾ Совсем не отщепляются пролин и оксипролин.
¾ Скорость отщепления зависит от структуры предконцевой аминокислоты и
общей структуры молекулы белка.
Все это требует в ряде случаев дополнительной проверки полученных
карбоксипептидазным методом данных. Так например, если фермент не отщеп-
ляет С-концевую аминокислоту, то нельзя сказать блокирована она или это
пролин (оксипролин).
2.1.3 Установление структуры N- концевых остатков пептидных цепей
Структуру N-концевого остатка пептидных цепей можно можно устано-
вить следующими методами.
¾ С помощью реагента Сенджера (Сенгера) (предложен в 1945г.) - 2,4-
динитрофторбензол (ДНФ). Свободная непротонированная аминогруппа N-
концевой амино-
кислоты полипеп-
тида реагирует с
ДНФ в щелочной
среде с образова-
нием окрашенных
в желтый цвет 2,4-
динитрофениль
NH
2
F NO
2
NO
2
NH
NO
2
NO
2
HF
NO
2
NH
NO
2
CHHOOC
R
+
Смесь свободных аминокислот

77
ных производных (ДНФ-производное аминокислоты). Это производное устой-
чиво в процессе кислотного гидролиза пептида и легко выделяется из смеси
аминокислот по завершению расщепления. Структура N-концевой аминокисло-
ты устанавливается по «свидетелю» при хроматографировании ДНФ-
производных эталонных аминокислот .
Первую стадию реакции проводят при Т = 25 - 37
0
С, рН=7 - 8. Вторая
стадия - обычный кислотный гидролиз белка (110
0
С, в среде 6н HCl).
Метод обладает ограниченной специфичностью. ДНФ реагирует не толь-
ко с α-аминогруппой концевой аминокислоты, но и с ε-аминогруппами лизина,
SH-группами цистина, ОН-группами тирозина, имидазольными группами гис-
тидина. Тем не менее, ε-ДНФ-лизин легко отличить с помощью специального
свидетеля, а все остальные побочные ДНФ-производные бесцветны и не меша-
ют проведению анализа на N-концевую аминокислоту.
Вместо ДНФ для определения N-концевой аминокислоты можно исполь-
зовать пипсилхлорид (п-иодфенилсульфофенилхлорид), который образует сле-
дующий продукт присоединения к N-концевой аминокислоте:
J
SO
2
Cl
NH
2
CHRCO
J
SO
2
NHCHRCOOH
Особенность этого метода в том, что в пипсилхлорид вводят в качестве метки
радиоактивный иод и определяют пипсилпроизводное радиометрически.
¾ Более удобный метод определения N-концевой аминокислоты - это метод
Эдмана. В нем используется фенилизотиоцианат (ФИТЦ) - реагент Эдмана.
ФИТЦ реагирует с N-концевой аминокислотой пептида с образованием фенил-
тиокарбамоильного производного. При дальнейшей обработке кислотой проис
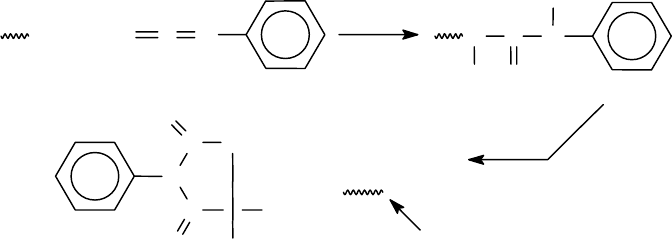
78
ходит его циклизация с образованием фенилтиогидантоина N-концевой амино-
кислоты. В процессе циклизации эта аминокислота отщепляется от пептидной
цепи. Вся остальная цепь пептида сохраняется неизменной. Таким образом, по
методу Эдмана модифицированный N-концевой остаток отщепляется без раз-
рушения полипептидной цепи.
Схема реакции с фенилизотиоцианатом:
NH
2
+
SCN
NCN
H
H
S
N
CNH
S
CCR
H
O
+
Фенилтиогидантоиновое
производное N-концевой аминокислоты
Остаточная пептидная цепь
¾ Иногда, для определения N-концевого остатка используют аминопептида-
зы. Эти ферменты последовательно отщепляют аминокислоты со стороны N-
конца пептидной цепи. Наиболее изученным ферментом этого типа является
лейцинаминопептидаза. Ее выделяют из почек свиньи. С помощью этого энзи-
ма были установлены, в частности, N-концевые аминокислоты в инсулине и
рибонуклеазе. Фермент плохо отщепляет концевые аминокислоты, если они со-
единены с лизином, аргинином и ароматическими аминокислотами.
После
установления структуры N- и C-концевых аминокислот приступают
к выяснению аминокислотной последовательности полипептидной цепи.
2.1.4 Фрагментация белковых цепей
Химическое расщепление коротких пептидов или фрагментов белковых
цепей по Эдману является на сегодняшний день единственным прямым мето
79
дом секвенирования пептидов путем отщепления и идентификации (в виде тио-
гидантоинового производного) последовательно по одному аминокислотному
остатку с N-конца цепи. Однако, даже с помощью автоматического секвенато-
ра, максимальное число операций (последовательного отщепления) по Эдману
ограничено в настоящее время 20-40 а/к остатками. Имеются сообщения об ус-
пешном проведении операции секвенирования пептидных фрагментов, содер-
жащих 40-60 аминокислот в цепи. Полипептидные цепи многих белков сущест-
венно длиннее. Например α-цепь гемоглобина человека содержит 141 остаток,
гормон роста - 181, фермент глицеральдегиддегидрогеназа - 332. Такие длин-
ные цепи нельзя непосредственно проанализировать методом Эдмана. Поэтому,
применяется следующая стратегия. Большие пептидные цепи расщепляют на
относительно короткие фрагменты, каждый из которых выделяют и секвени-
руют по Эдману. Основная проблема при таком подходе заключается в обеспе-
чении селективности расщепления пептидной цепи по определенным пептид-
ным связям. Такая специфичность достигается использованием ферментов или
специальных химических агентов.
2.1.4.1 Ферментативная фрагментация
Наиболее часто для ферментативного расщепления белков на фрагменты
используются пищеварительные ферменты млекопитающих. Такие, например,
как трипсин, химотрипсин и некоторые другие. В отличии от амино- и карбок-
сипептидаз, которые действуют на концевые аминокислоты пептидных цепей и
получили название экзопиптидаз, трипсин, химотрипсин и другие аналогич-
ные ферменты расщепляют пептиды во внутренних звеньях цепи. Их называют,
поэтому, эндопептидазами.
Все эти ферменты не обладают абсолютной специфичностью к природе
расщепляемой связи, но в тщательно подобранных условиях они расщепляют
все же предпочтительно определенные связи, т.е. проявляют так называемую

80
«сайт-специфичность». Данные по специфическому гидролизу петидных це-
пей некоторыми ферментами приведены в табл. 2.1.
Таблица 2.1
Специфическая активность некоторых ферментов при расщеплении
пептидных цепей.
Протеазы с высокой специфичностью
Фермент рН Основной тип
гидролиза
Побочный
тип
гидролиза
Не затраги-
ваемые
связи
Трипсин 7-9
Лиз-↓-Х, Арг-↓-Х,
Лиз-Про
Тромбин 8
Арг-↓-Х (Х=Гли, Ала,
Вал, Цис, Арг, Асп
Протеаза V8 из
Staphylococus
aureus (S.aureus)
4
и
7.8
Глу-↓-Х Асп-↓-Х
Глу-Про
Гли-Глу
Клострипаин 7.7
Арг-↓-Х Лиз-↓-Х
Протеаза,
из подчелюстной
желзы мыш
7.5
8
Арг-↓-Х
Арг-Вал
Арг-Арг
Протеаза
A.mellea
8
Лиз-↓-Х Арг-↓-Х
Х-Про
Протеаза
myxobacter AL1
9
Х-↓-лиз
Постпролинспе-
цифичная протеаза
7.5
8
Про-↓-Х
Про-Про
Протеазы с широкой специфичностью
Химотрипсин 7-9
Н-↓-Х (Н=Тир,Фен,Три,Лей)
Н-Про
Термолизин 7-8
Х-↓-Н (Н=Вал,Лей,Иле,Фен,Тир,Три) Х↓*Н-Про
α-Протеаза
Crotalus Atrox
7.5-8
Х-↓-Н (Н=Вал,Лей,Иле,Фен,Тир,Три)
Пепсин 2
Х↓Н↓Y, X↓Глу↓Y (H=ароматический или
объемный алифатический остаток)
Папаин 5-
7.5
Фен-Х↓Y. Идет гидролиз и некоторых
других пептидных связей.
Эластаза 7-9
N-↓-Y (N=небольшой нейтральный или гид-
рофобный остаток Сер,Ала,Гли,Вал,Лей)
α-Литическая про-
теаза
7-8
N-↓-Y (Аналогично эластазе)

81
Подбор оптимальных условий для ферментативного гидролиза сводится в
общем случаю к оптимизации:
¾ состава буфера;
¾ соотношения фермент:субстрат;
¾ температуры;
¾ времени проведения процесса.
Буферные системы. Обычно используют легко летучие буферные смеси.
Например 1% бикарбонат аммония и 100 мМ N-этилморфолилацетат.
Соотношение фермент:субстрат - на уровне 1:50-100.
Температура - в большинстве случаев -20-37
0
С. Только два фермента -
термолизин и протеаза из миксобактерий сохраняют высокую активность при
температурах > 40
0
С.
Продолжительность гидролиза, как правило, 2-4часа. Если связь трудно
расщепляемая увеличивают время до 16-24 ч.
Торможение ферментативной реакции гидролиза по истечению заданного
промежутка времени можно осуществить путем:
¾ замораживания;
¾ изменения рН среды;
¾ введением специфичных ингибиторов.
Протеолитические ферменты подразделяются на три основных класса:
¾ сериновые протеазы;
¾ сульфгидрильные протеазы;
¾ металлоферменты.
Специфическими ингибиторами сериновых протеаз являются диизопро-
пилфторфосфат (ДФФ) и
фенилметилсульфофторид (ФМСД).
Последний предпочтительнее, поскольку
ДФФ высоко токсичен.
CH
H
3
C
H
3
C
OPOCH
CH
3
CH
3
F
O
