Семиохин И.А., Страхов Б.В., Осипов А.И. Кинетика химических реакций
Подождите немного. Документ загружается.


Если
Р
больше
или
«меньше единицы,
то
соответствующие
реакции
называются быстрыми
или
медленными. Обычно
мед-
ленных (некаталитических) «реакций
в
растворах больше,
чем
быстрых.
Применимость теории столкновений
к
реакциям
в
растворах
определяется
тем,
насколько реальные размеры молекул
(г
А
и
гв)
дают
сходимость
с
опытными значениями констант
ско-
рости. Например,
для
реакции
C
2
H
6
ONa+
C
2
H
6
I
кинетические эксперименты
дают
(г
А
+г
в
)~5
А, что
хорошо
согласуется
с
молекулярными параметрами этих молекул.
В
том
случае, когда реакция может протекать
и в
газовой
фазе
и в
растворе, обычно сравнивают энергии активации
и
предэкспоненциальные множители
А.
Так,
для
реакции распада
дийодэтана
в
газовой фазе
и в
растворе данные
по
зависимости
\gk от
1/Т ложатся
на
одну
и ту же
прямую
(рис.
12.3). Однако,
как
будет
показано ниже, имеется много реакций,
в
которых весь-
ма существенное влияние оказывают растворители.
§
6. Применение теории активированного комплекса
1.
Соотношение между константами скорости.
Эйринг
и
Уинн-Джонс первыми применили уравнение теории активиро-
ванного комплекса:
к
а
=
%—е***'*е-иР'*
т
=K—KZ
(12.23)
h
h
к
реакциям различных порядков
в
конденсированных фазах.
Особенно широкое применение
это
уравнение нашло
в
физиче-
ской
органической химии.
В уравнении
(12.23)
истинная константа равновесия опреде-
ляется уравнением
/(*=—=
-^
£- =
**-£_,
(12.24)
а
А
а
в
с
А
с
в
Y
A
V
B
*° Y
A
Y
B
l
где
щ и у» —
активности
и
коэффициенты активности реаген-
тов соответственно.
Из
уравнений
(12.23)
и
(12.24)
получаем
выражение
для
константы скорости:
) (12.25)
Если требуется сравнить теперь константы скорости неко-
торой реакции
в
двух
различных
средах,
то для
этоГо надо
знать
(или
определить) коэффициенты активности.
Так,
если
181

сравнивать константы скорости реакции в разных (растворите-
лях
или в растворе и в газовой
фазе,
то коэффициенты актив-
ности
в растворе следует определять по уравнению
у
*L
^^ ^ 1L *L
=CO
nst
JIL
9
(12.26)
где tji и Xi — мольные доли растворенного вещества в паре
над
растворам и в растворе соответственно.
Если
коэффициенты активности в растворе определены по
отношению к идеальному газу при давлении 1 атм, выбранному
в качестве стандартного состояния, то константа скорости ре-
акции в растворе приобретет выражение
(12.26а)
При
изучении кинетики реакций в растворах часто пользу-
ются
в качестве стандартного состояния чистой жидкостью.
В
этом случае коэффициенты активности определяются по от-
клонениям свойств растворов от идеальных, т. е. соотношением
yi
= a
t
/c
h
(12.27)
а
константа скорости реакции в реальном растворе будет иметь
ввд
?AYB
(12.27а)
Для
двух различных .растворителей, обозначаемых индекса-
ми I и II, получаем
Jj_
=
(YAYB/Y
^ .
(12.28)
*и
(Y
A
Y
B
/Y*)
H
Это
уравнение можно переписать в иной форме, если учесть,
что отношение коэффициентов активности для двух раствори-
телей
равно отношению парциальных давлений растворенных
веществ в
этих
растворах, т. е.
(12.28а)
где я — отношение парциальных давлений в растворителях I
и
II при соответствующих концентрациях.
2.
Энергия активации в газовой
фазе
и в растворе. Для
сравнения воспользуемся уравнением Ленгмюра, дающим зави-
симость коэффициентов активности от температуры:
У1
=
№
1/2
е~
АН
''«
т
,
(12.29)
где р, — постоянная (для неассоциированных жидкостей, рав-
ная ~
5); Д#,-
—<
теплота испарения вещества.
182
С
учетом уравнения Ленгмюра уравнение
(12.26а)
приобре-
тает
следующую форму:
Краств
—
*г
НВ
TV2
T
I/z
exp
-
,
+
^
B
-
W
)
(12.30)
или
с
Р
аств=
X
kT
RT.
(12.31)
Величина
(ДЯ
А
+ ЛЯ
В
—АЯ
Ф
) вряд ли превышает несколько кило-
джоулей
при значении Е
о
в несколько десятков килоджоулей,
т.
е. в Ъбщем случае энергия активации реакции в растворе
мало
отличается от энергии активации
этой
же .реакции в га-
зовой
фазе.
Это
справедливо
лишь
при отсутствии взаимодей-
ствия
между молекулами растворителя и растворенных ве-
ществ.
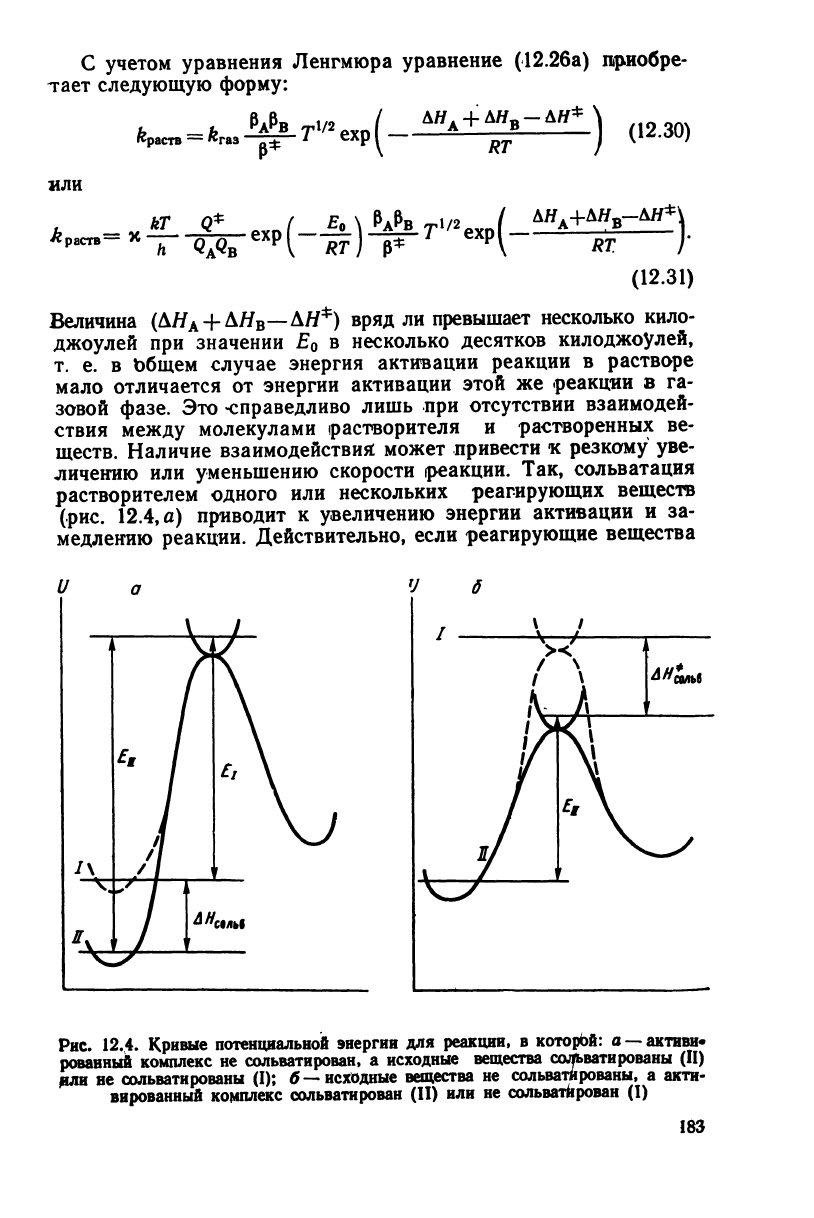
Наличие взаимодействия:
может
привести к резкому уве-
личению или уменьшению скорости (реакции. Так, сольватация
растворителем
одного или нескольких реагирующих веществ
(рис.
12.4,
а) приводит к увеличению энергии активации и за-
медлению
реакции. Действительно, если реагирующие вещества
Рис.
12.4. Кривые потенциальной энергии для реакции, в которой: а — активы*
рованный комплекс не сольватирован, а исходные вещества сольватированы (II)
эли
не сольватированы (I); б—исходные вещества не сольватированы, а акти-
вированный комплекс сольватирован (II) или не сольватирован (I)
183

окружены оболочкой из молекул растворителя, они не могут
достаточно
сблизиться, чтобы началось образование активиро-
ванного комплекса, пока хотя бы одна молекула растворителя
не
отделится от каждой из них. Энергия, требуемая для удале-
ния молекулы воды от ионов, значительна, например, для иона
гидроксила она составляет 88 кДж/мрль.
При
сольватации активированного комплекса энергия акти-
вации уменьшается (см. рис.
12.4,6)
-и скорость реакции уве-
личивается. По-видимому, этим объясняется сильная зависи-
мость скорости медленных реакций) Меншуткина:
>-R
4
NHal
от
природы растворителя.
§
7. Ионные реакции. Уравнение Бренстеда—Бьеррума
Ионные
реакции в растворах можно подразделить на два
типа. К первому типу относятся реакции между элементарны-
ми ионами, сопровождающиеся значительным
выигрышем
сво-
бодной
энергии. Их кинетика определяется частотой столкно-
вений или скоростью, с которой ионы одного или другого ви-
да
частично десольватируются. Скорость реакций такого типа,
например реакций
лимитируется диффузией и хорошо описывается уравнением
Де-
бая
(12.19).
Анализ таких (быстрых) реакций будет проведен
ниже.
В
этом параграфе мы рассмотрим ионные реакции второго
типа, такие как
Г +
СН
2
ВгСОСГ
-*
Вг-
+
ОЦСОСГ,
которая аналогична реакции
Г+СН,Вг-*Вг-+СН
3
1
и
отличается от нее только тем, что при атоме С имеется за-
ряженная СОО-, которая непосредственно «в реакции не участ-
вует. При использовании метода активностей анализ таких
процессов
особой
трудности не представляет.
По
Бренстеду, первая стадия реакции между ионами А и
В
в растворе состоит в образовании комплекса С, который на-
ходится
в равновесии с ионами А и В:
±С.
(12.32)
184

Если
промежуточный комплекс превращается затем в про-
дукты, то скорость реакция будет равна
dc
c
dc
p
dt
dt
(12.33)
Константу
равновесия реакции
(12.32)
можно выразить через
активности:
*.-.-^—-5£-.*
(12.34)
Д
А
а
В
С
А
С
В WB
откуда
(1£±)
(12.34а)
Из
уравнений
(12.33)
<и
(12.34а)
получаем выражение для ско-
рости
реакции:
Наблюдаемая
константа скорости бимолекулярной реакции
будет
равна
JL±(lb)
(12.36)
Поскольку
при
c
t
-+0
YAYB/YC=1, обозначим
йг,с=о
=
*г.
В этом
случае получаем выражение для константы скорости ионной
реакции, аналогичное выражениям. (1£.26а) и
(12.27а):
(12.37)
Теория
Дебая—Хюккеля дает следующее выражение для
логарифма коэффициента активности:
In
у*
=
—z]#%l2tkT.
(12.38)
Здесь
1/х — радиус ионной атмосферы, а х равна
г
4*2,(1^)
1
(12.38а)
или с учетом соотношения
Л,=#АС/1000
получаем
(12
.39)
Из
уравнений
(12.37)
«
(12.38)
можно найти, что
(12.40)
185
откуда
1/2
(12.42)
Учитывая,
(12.39),
получаем
\а
Аг-
=
—-—
I
— I
S
k°
r
2,Зе*Г
\
100ШГ
)
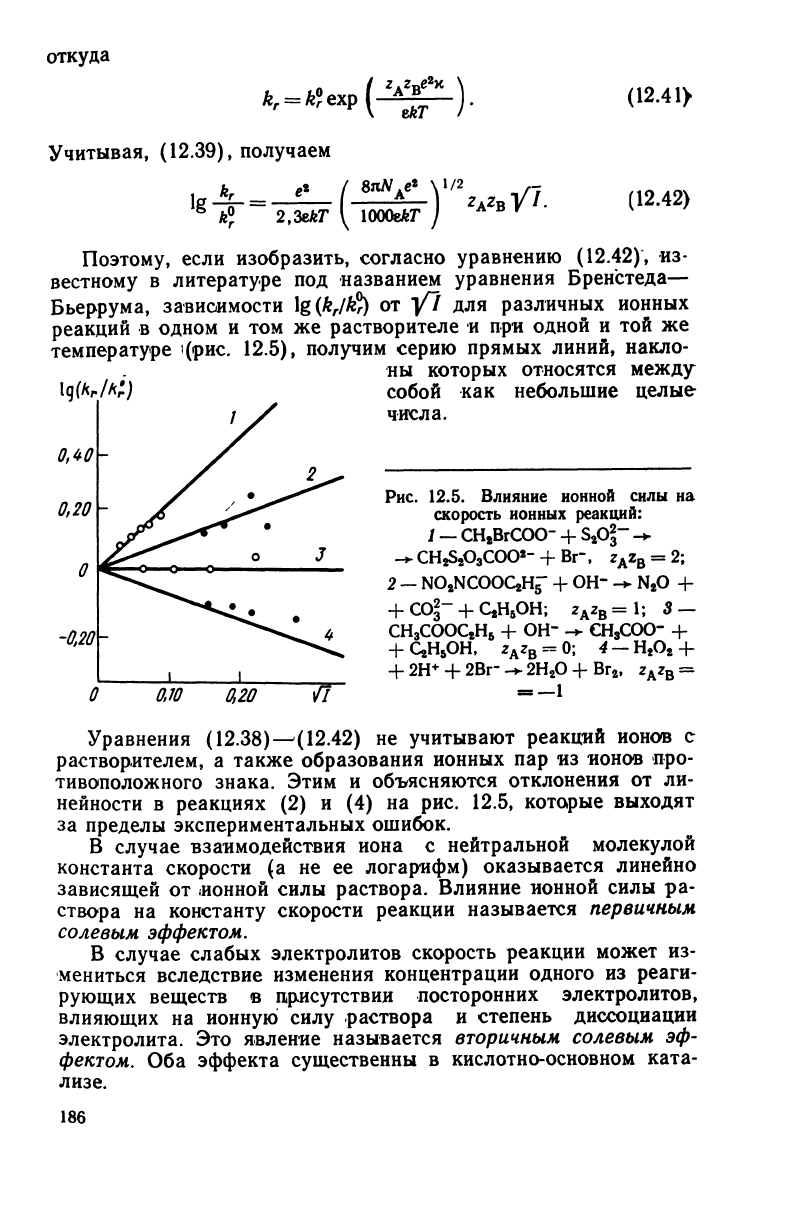
Поэтому,
если изобразить, согласно уравнению
(12.42),
из-
вестному в литературе под названием уравнения Бренстеда—
Бьеррума, зависимости
\g(k
r
l$)
от
Y~I
для различных ионных
реакций в одном и том же растворителе и при одной и той же
температуре
'(рис.
12.5),
получим
серию
прямых
линий, накло-
ны которых относятся между
собой
как небольшие целые
/
X числа.
Рис.
12.5. Влияние ионной силы на
скорость ионных реакций:
1
—
сн*вгсоо-
+
s
2
o£-
-*
-*
СНДОзСОО*-
+ Вг~, z
A
z
B
= 2;
2
-
NOaNCOOQHg-
+
ОН"
-+
N
2
O +
+
СО2-
+
С,Н
6
ОН;
2
A
z
B
=l;
3-
СН
3
СООС
2
Н
6
+ ОН" -+
СН
3
СОО-
+
+
QHsOH,
z
A
z
B
= 0; 4 -
Н
2
О
2
+
+
2Н
+
+
2Вг-
-+
2Н
2
О
+ Вг
2
, z
A
z
B
=
0,70
0,20 7Г
Уравнения
(12.38)^(12.42)
не
учитывают
реакций ионов с
растворителем, а также образования ионных пар из ионов про-
тивоположного знака. Этим и объясняются отклонения от ли-
нейности в реакциях (2) и (4) на рис. 12.5, которые выходят
за
пределы экспериментальных ошибок.
В
случае взаимодействия иона с нейтральной молекулой
константа скорости (а не ее логарифм) оказывается линейно
зависящей от «ионной силы раствора. Влияние ионной силы ра-
створа на константу скорости реакции называется первичным
солевым
эффектом.
В
случае слабых электролитов скорость реакции может из-
мениться вследствие изменения концентрации одного из реаги-
рующих веществ в присутствия посторонних электролитов,
влияющих на ионную силу раствора и степень диссоциации
электролита. Это явление называется
вторичным
солевым эф-
фектом.
Оба
эффекта
существенны в кислотно-основном ката-
лизе.
186

Глава 13
БЫСТРЫЕ
РЕАКЦИИ В РАСТВОРАХ
§
1. Введение
До
сравнительно недавнего времени наиболее быстрыми ре-
акциями, скорость которых можно было измерить, были реак-
ции с временами прлупревращения порядка минуты или, в
лучшем случае, секунды. Многие реакции, особенно ионные,
протекают значительно быстрее и их нельзя было исследовать
кинетически. Однако за последние десятилетия были разрабо-
таны методы, позволяющие значительно расширить диапазон
измеряемых скоростей реакций.
При
использовании простых традиционных методов нельзя
точно измерить скорости реакций первого порядка с периодом
полупревращения, много меньше 10 с. Некоторыми новыми ме-
тодами
удается измерить периоды полупревращения от 10~
7
—
10~
9
с. Таким образом, интервал доступных измерений скоро-
стей
реакций расширился примерно на 10 порядков. Такие же
соотношения
имеют место и для реакций второго «порядка.
На
рис. 13.1 для наглядности представлены интервалы ско-
ростей
реакций, измеряемых обычными и специальными мето-
дами.
Обычные
методы
Специальные
методы
для
быстрых
реакций
W*
ьо
10*
1
10*
W
6
1
1
1
1
.О'
6
W* Ю'
г
/,0 10
2
10* 10* Ю
8
к
я}
л-моль'
1
с'
1
Рис.
13.1. Интервалы констант скорости, измеряемых
обычными
и
специальными
методами для быстрых реакций
Наименьшие периоды полупревращения (порядка 10~
9
с)
были измерены релаксационными ультразвуковыми методами,
а
также методом флуоресценции.
Затем
следуют методы ЭПР,
релаксационные методы температурного скачка и электрическо-
го импульса
(т
1/2
—
10""
8
—10~
6
с) и флешфотолиз
(TI
/2
~
10~~
б
с).
Ближе
к нижним границам находятся электрохимические ме-
тоды
и метод
ЯМР
(TI/2~
Ю~
4
с) я различные варианты струе-
вых методов
(TI
/2
~
10~
3
С).
187

§
2.
Энергетика быстрых реакций
1. Критическая энергия. Можно сказать,
что для
описания
быстрых реакций специальных теорий
не
требуется.
Они
укла-
дываются
в
рамки обычной теории столкновений:
k
=
z
o
e~
E
*
/RT
,
(13.1)
только энергия активации этих реакций очень мала
(£
а
<
<:40 кДж/моль). Ниже показано,
как
меняются величины
кон-
стант скорости бимолекулярных реакций
при
изменении энер-
гии активации. Частотный множитель предполагается постоян-
ным
и
равным 2о=1О
п
л
•
моль"
1
•
с"
1
лри 298 К.
Е
а
>
k, Л
кДж/моль
•МОЛЬ"
1
• С"
1
58,6
10
52,3
10*
41,8
10*
29
К
,3
}«
16,7
108
(0)
(10")
В последнем столбце числа взяты
в
скобки шотому,
что при
нулевой энергии активации скорость реакции лимитируется
диффузией, которая сама
требует
небольшой энергии актива-
ции
(4—13
кДж/моль), вследствие чего скорость реакции слег-
ка
увеличивается при повышении температуры.
Если рассматривать активацию
f,
внутренних степеней
сво-
боды,
то
вместо уравнения
(13.1)
для
константы скорости
сле-
дует
рассматривать выражение
k
= z
0
<
£//?r
>
f
e-
£
/*
r
. (13.2)
Теория активированного комплекса приводит
к
следующему
уравнению:
k
х
е
ен*/ят
(13.3)
h
Экспериментально трудно отличить теоретические выражения
(13.1)
и
(13.3)
от
эмпирического уравнения Аррениуса
*=Ле"
Е
^
Г
.
(13.4)
Они
интерпретируют эффективную энергию активации
Е
А
как
критическую энергию, просто связанную
с
энергией активации
Е
а
и
теплотой активации
*
(13.5)
Величина критической энергии обусловлена вкладами несколь-
ких различных факторов, которые
будут
рассмотрены ниже.
2.
Вклады
различных
факторов в критическую энергию.
Эксперимент показывает,
что
критическая энергия
в
значитель-
188
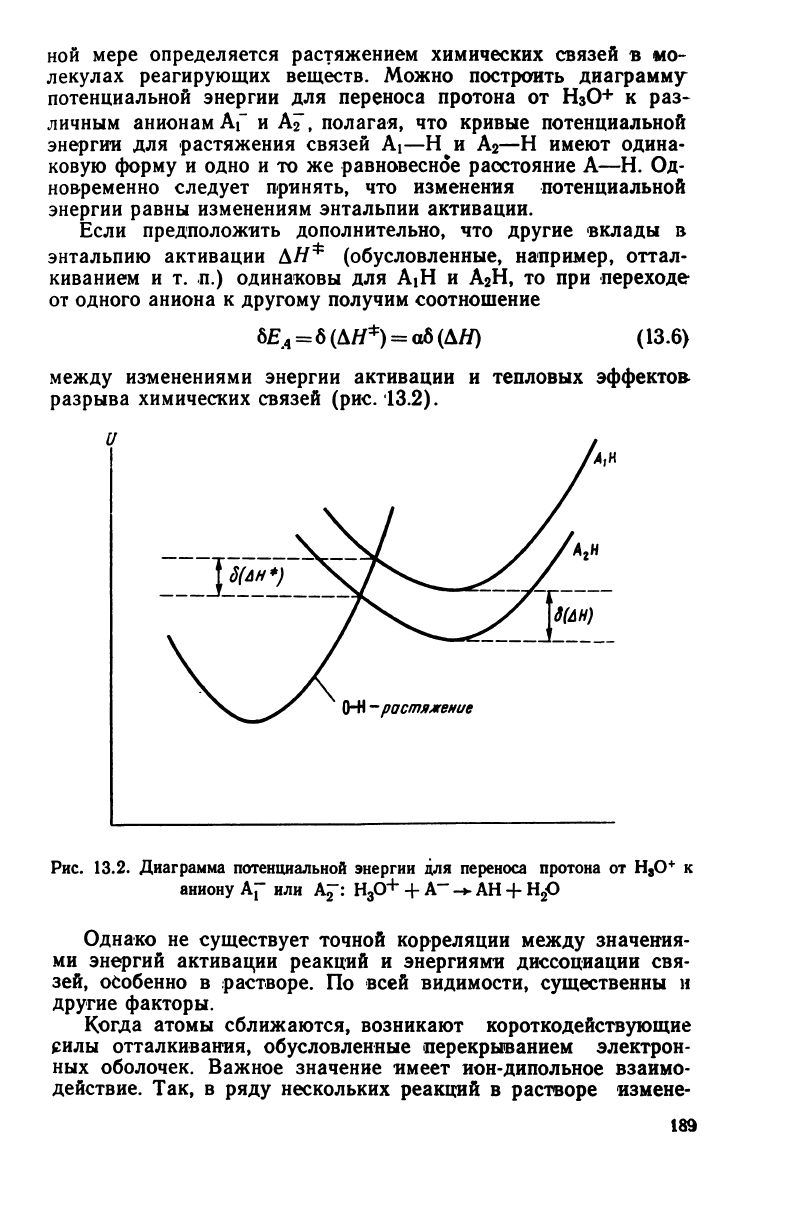
ной мере определяется растяжением химических связей в мо-
лекулах реагирующих веществ.
Можно
построить диаграмму
потенциальной энергии для переноса протона от
Н
3
О+
к раз-
личным
анионам Af и А^~, полагая, что
кривые
потенциальной
энергии для растяжения связей Ai—Н и Аг—Н имеют одина-
ковую форму и одно и то же равновесное расстояние А—Н. Од-
новременно следует принять, что изменения потенциальной
энергии
равны
изменениям энтальпии активации.
Если
предположить дополнительно, что другие вклады в
энтальпию активации Д#
ф
(обусловленные, например, оттал-
киванием и т. п.) одинаковы для AiH и А
2
Н, то при переходе
от
одного аниона к другому получим соотношение
6£
4
=
6(Д//
ф
)
=
а6(Д#) (13.6)
между
изменениями энергии активации и тепловых эффектов-
разрыва химических связей (рис.
13.2).
и
0-Н
-растяжение
Рис.
13.2.
Диаграмма
потенциальной
энергии
для переноса
протона
от
Н
8
О
+
к
аниону
Af или А£":
Н
3
О+
+ А"" -* АН + Н
2
О
Однако
не существует точной корреляции между значения-
ми энергий активации реакций и энергиями диссоциации свя-
зей,
особенно в растворе. По всей видимости, существенны и
другие факторы.
Когда
атомы сближаются, возникают короткодействующие
силы отталкивания, обусловленные перекрыванием электрон-
ных оболочек.
Важное
значение имеет ион-дипольное взаимо-
действие.
Так, в ряду нескольких реакций в растворе измене-
189

ния
ЕА ДО 29 кДж/моль можно скоррелировать с изменениями
дипольных моментов реагирующих веществ.
Эффекты
сольватации можно отнести к общей разнице в
сольватации исходных веществ и активированного комплекса
(см.
рис. 12.4).
Наконец,
для реакций, лимитируемых диффузией, значение
ЕА
определяется температурной зависимостью коэффициента
диффузии согласно формуле Стокса—Эйнштейна:
(13.7)
т. е. зависит от изменения параметра
Т/у\
с температурой (т) —
вязкость
среды). Для малых атомов и молекул (г~10~
8
см) в
обычных растворителях это приводит к значению
Е
А
~4—
13 кДж/моль.
Исследование быстрых реакций позволяет оценить значение
перечисленных энергетических факторов, которые становятся
особенно
важными в тех
случаях,
когда величина Е
А
относи-
тельно мала.
§
3.
Реакции,
лимитируемые
диффузией
1.
Диффузия
нейтральных
частиц.
Согласно закону Фика,
число частиц л, пересекающих поверхность S в 1 с, пропорцио-
нально
площади поверхности и градиенту концентрации частиц
в
направлении потока:
S-.
(13.8)
dt dr
При
центрально-симметричной диффузии в стационарном ре-
жиме концентрация частиц растворенного вещества на расстоя-
нии
г от поверхности равна
с, =
с(1—г«/г),
(13.9)
где с —. объемная концентрация частиц
(с
г
=с
при
г-+оо).
Оче-
видно,
что с
г
=0 при
г=г
0
и —с---££•.
в
Число частиц, пересе-
аг г
2
кающих сферическую поверхность 4яг
2
в 1 с в направлении
увеличения г, определяется уравнением
— = — 4лОсг
0
,
(13.10)
dt
а число частиц, достигающих поверхности за 1 с, — уравнением
4ncr
0
.
(13.10а)
dt
Число
частиц
типа
А,
которые
в
процессе
диффузии
дости-
гают
за 1с
сферическую
поверхность
с
радиусом
()
равно
190
