Новицкий В.С., Писчик Л.М. Коррозионный контроль технологического оборудования
Подождите немного. Документ загружается.


контролируемого объекта и граничных его значений на показывающий прибор,
расположенный на передней панели сигнализатора, а также на вторичный регистрирующий
прибор с уровнем выходного сигнала от 10 до 100 мВ. Разработанный сигнализатор
применен для контроля качества травления нержавеющих сталей.
Высокоомный милливольтметр
Высокоомный милливольтметр используется для настройки и проверки правильности
функционирования систем контроля коррозионного состояния промышленного
оборудования. Он также может быть применен для периодического контроля потенциала
коррозии поверхности аппаратов и трубопроводов или в системах, где не используется
светозвуковая сигнализация [148].
Милливольтметр построен по мостовой схеме, образованной резисторами и полевым
транзистором, включенным по схеме токового повторителя. В исходном состоянии (вход
прибора замкнут «накоротко») мост сбалансирован и в диагонали ток отсутствует. При
изменении потенциала электрода происходит нарушение баланса моста, что фиксируется
прибором, отградуированным в милливольтах.
Основные характеристики прибора:
пределы измерения потенциала, мВ — 0 ± 3000;
точность измерения потенциала, мВ — ± 20;
входное сопротивление, Ом — не ниже 10
7
;
напряжение питания, В — 4,5;
габариты, мм — 250 х 120 х 60;
масса, кг — 0,5.
Конструктивно милливольтметр выполнен в виде переносного прибора с автономным
питанием, что обеспечивает удобство при измерении потенциалов на промышленных
объектах.
В автоматических системах контроля и регулирования потенциала коррозии сигнал
о смещении последнего ниже допустимого уровня поступает на регулирующий прибор,
который включает поляризующее устройство или (через блок управления) установку подачи
ингибитора в раствор.
1.17.4. АВТОМАТИЧЕСКИЕ СИСТЕМЫ КОНТРОЛЯ
ПОТЕНЦИАЛА КОРРОЗИИ И ЗАЩИТЫ
ОБОРУДОВАНИЯ
1.17.4.1. Электрохимическая защита
Система контроля и регулирования скорости коррозии
оборудования в растворах роданидов
В производстве синтетических волокон, в частности нитрона, в качестве растворителей
мономеров используются 50—54%-е растворы роданида натрия, которые получают
упариванием 6—10%-и 20—30%-х растворов.Установка упаривания разбавленного
раствора NaCNS каждой из четырех технологических линий состоит из выпарных
аппаратов I и II ступеней, работающих под разрежением 50 кПа, и четырех кипятильников,
подсоединенных по два к каждому аппарату. Выпарные аппараты I и II ступеней
отличаются лишь размерами; их поверхности, контактирующие с растворителем,
составляют соответственно 15 и 20 м
2
. На вход выпарного аппарата I ступени поступает
раствор концентрацией 8—10 %, где упаривается до концентрации 28—30 %, после чего
подается на II ступень упаривания. На выходе выпарного аппарата II ступени
концентрация NaCNS в растворе повышается до 50—55 %.
Одна из основных проблем в производстве нитрона — высокая агрессивность среды,
что приводит к коррозионному разрушению оборудования и загрязнению растворов
ионами железа (Ш), которые уменьшают степень конверсии мономеров и снижают
качество продукции. Содержание Fe
3+
в технологических средах строго регламентируется
(<0,0005 %).
Применение легированной стали 10Х17Н13МЗТ в качестве конструкционного
материала для оборудования установки упаривания не решает проблемы, поскольку—
скорость коррозии стали при 120 °С достигает 0,1 г/(м
2
• ч). Наиболее эффективным спосо-
бом продления срока службы оборудования, экономии сырья, по вышения качества
продукции является уменьшение скорости коррозии аппаратуры путем применения
надежных методов защиты от коррозии.
Исследования электрохимического поведения стали 10Х17Н13МЗТ, а также
экономнолегированной стали 08Х21Н6М2Т в производст венных 54%-х растворах
роданида натрия показали, что обе стали имеют область устойчивой пассивности и не
подвержены питтингу, что характерно для хромистых и хромоникелевых сталей.
Плотность тока анодного растворения сталей (120 °С) при смещении потенциала в область
пассивного состояния снижается в 8—10 раз и это дает возможность применить анодную
защиту оборудования. Электрохимические параметры обеих сталей близки. При
значениях потенциала положительнее Е
kop
сталей на 0,6 В происходят окисление роданида
и окрашивание раствора в оранжевый цвет. Таким образом, зона регулирования
защитного потенциала ограничена значением окислительно-восстановительного потен-
циала NaCNS. Это предъявляет более высокие требования к контролю потенциала
порерхности оборудования при анодной защите [156, 157].
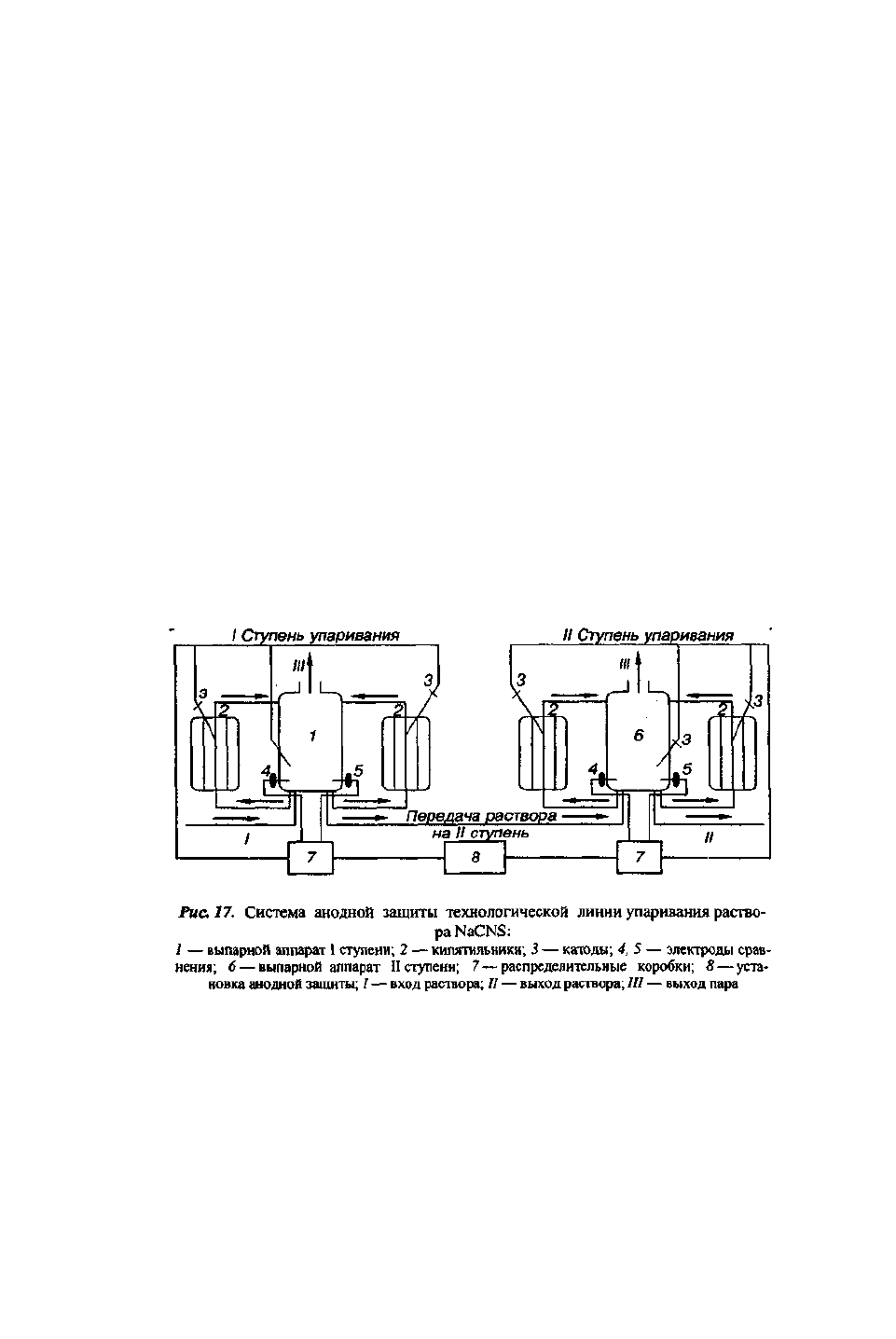
При установке системы коррозионного контроля и анодной защиты двух
выпарных агрегатов (рис. 17) были решены следующие технические вопросы [157]:
• на основании результатов исследований коррозионной стойкости ряда
сталей и титана при катодной поляризации и в условиях саморастворения был
подобран материал катодов для системы сталь 10Х17Н13МЗТ — растворы роданидов, а
также определены их размеры и местоположение;
• определена дальность действия анодной защиты и уста новлено, что
при выбранной схеме установки катодов вся поверхность кипятильников и
выпарного аппарата находится под защитой;
• выбран материал электрода сравнения — никель [155], разработана его
конструкция, определены необходимое количество электродов сравнения и места их
установки;
• разработан технический проект системы противокоррозионной защиты

выпарных аппаратов с использованием автоматической системы регулирования
и контроля потенциала.
В 50%-м растворе роданида натрия при 120 °С значение Е
кор
поверхности аппарата
достигало защитных потенциалов через 5—6 часов после включения анодной
поляризации. Эффективность системы анодной защиты оценивалась по уменьшению
содержания ионов железа (III) в растворе в результате ее применения.
Накопление Fe
3+
определяли в процессе упаривания технологического раствора по
разности его концентрации на входе и выходе выпарного агрегата. Данные анализов
показали, что применение анодной защиты лишь части аппаратов выпарного агрегата
позволило снизить содержание ионов железа (Ш) в 14 раз. Система контроля
и регулирования потенциала промышленных выпарных аппаратов дает возможность не
только уменьшить коррозионный износ оборудования, но и улучшить качество продукции
за счет снижения содержания железа, увеличить степень конверсии мономеров.
Контроль анодной защитил реакторов
нитрофоски
В производстве сложных удобрений наблюдается интенсивная питтинговая коррозия
реакторов и сборников, вызываемая хлоридами, содержащимися в пульпе. Через три года
реакторы выходят из строя полностью, и их приходится заменять новыми. Изготовление
реакторов из высоколегированного сплава 06ХН28МДТ не позволяет решить проблему,
поскольку и он также подвергается питтинговой коррозии.
В растворах хлоридов с достаточной концентрацией нитрат-, хлорат-
и перхлоратионов питтингообразование на нержавеющих сталях может подавляться и при
анодной поляризации, если достигается потенциал ингибирования питтингов. Наличие
пассивной области при потенциалах, положительнее потенциала ингибирования (Е
кор
),
определяет принципиальную возможность применения анодной защиты сталей против
питтинговой коррозии в этих средах.
Проведенные исследования [158] показали, что на значения Е
кор
нержавеющих сталей
существенно влияет соотношение концентраций ингибирующего и активирующего
анионов. Увеличение этого соотношения сужает область питтингообразования, смещая
Е
кор
в сторону более отрицательных значений. При достаточно высоком соотношении
концентраций ингибирующего и активирующего анионов питтингообразование на сталях
отсутствует. Зависимость потенциала ингибирования сталей 12Х18Н10Т
и 10Х17Н13М2Т от соотношения концентраций нитрата и хлорида калия при постоянном
их суммарном содержании в растворе 1,5 н имеет вид степенной функции и описывается
уравнением:
2 0.5
3
[ ]
[ ]
ин
NO
E K
Cl
Коэффициент К зависит от температуры и состава стали. Кривые зависимости
потенциала ингибирования от соотношения при постоянной температуре разделяют
области потенциалов, при которых возможно питтингообразование и где оно подавляется.
Это позволяет прогнозировать питтинговую коррозию в исследуемых условиях.
С повышением температуры в интервале 30—90 °С потенциал ингибирования сталей-
линейно смещается в сторону более положительных значений, затрудняя подавление
питтинга ингибирующими анионами при анодной поляризации.
В интервале рН 5—11 Е
кор
стали 12Х18Н10Т в хлорид-нитратном растворе имеет
практически постоянное значение, при снижении рН до 1 потенциал ингибирования
несколько смещается в сторону более положительных значений.
Увеличение содержания хрома в стали приводит к смещению Е
кор
в сторону более
отрицательных значений, температурные пределы проявления эффекта подавления

питтингообразования нитрат-, хлорат- и перхлорат-ионами при анодной поляризации рас-
ширяются. Легирование стали молибденом также сужает область питтингообразования.
Однако с повышением температуры положительное влияние молибдена снижается.
Предполагается, что величина Е
кор
определяется значительными локальными изменениями
приповерхностной концентрации ингибирующих анионов за счет резкого различия
скоростей их электрохимического восстановления на пассивной поверхности и ее активных
микроучастках, а также за счет их химического восстановления ионами металлов
переменной валентности. При уменьшении концентрации ингибирующих анионов ниже
некоторого критического значения, не обеспечивающего адсорбционное вытеснение хлорид-
ионов, ингибирование питтинга прекращается. снижение количества марганецсодержащих
сульфидов в хромоникелевых сталях может расширять диапазон концентраций анионов,
ингибирующих питтинг, и потенциалов ингибирования даже больше, чем легирование
сталей молибденом.
В пульпе сложных удобрений с высокими концентрациями нитрат-, хлорид-, сульфат-
ионов и добавками фторидов при 105 °С область питтингообразования нержавеющих сталей
также ограничена с двух сторон и ширина ее зависит от состава стали. Наиболее широкую
область питтингообразования из исследуемых сталей имеет сталь 12Х18Н10Т, наиболее
узкую — 06ХН28МДГ. После продолжительной выдержки защищаемой поверхности стали
при потенциалах, положительное потенциала ингибирования, питтинги в ней отсутствуют,
что указывает, на эффективность анодной защиты стали в пульпе.
Полученные результаты позволили провести работу по промышленному применению
анодной защиты реакторов в производстве сложных удобрений.
Реакторный блок для производства нитрофоски представляет собой две
технологические линии по 20 реакторов каждая. В них происходит последовательное
разложение апатита азотной и серной кислотами, аммонизация пульпы, в 17—20-й реакторы
подается хлорид калия.
Реакторы (рис. 18) — аппараты U-образной формы с полезным объемом 2м
3
— имеют
по две мешалки каждый (n = 200 об/мин) и водяную рубашку для поддержания необходимой
температуры. Предусмотрена также подача в реактор острого пара и аммиака для
аммонизации пульпы и поддержания заданного рН (4,0—5,0). Температура в последних
реакторах обеих технологических линий равна 105—110°С.
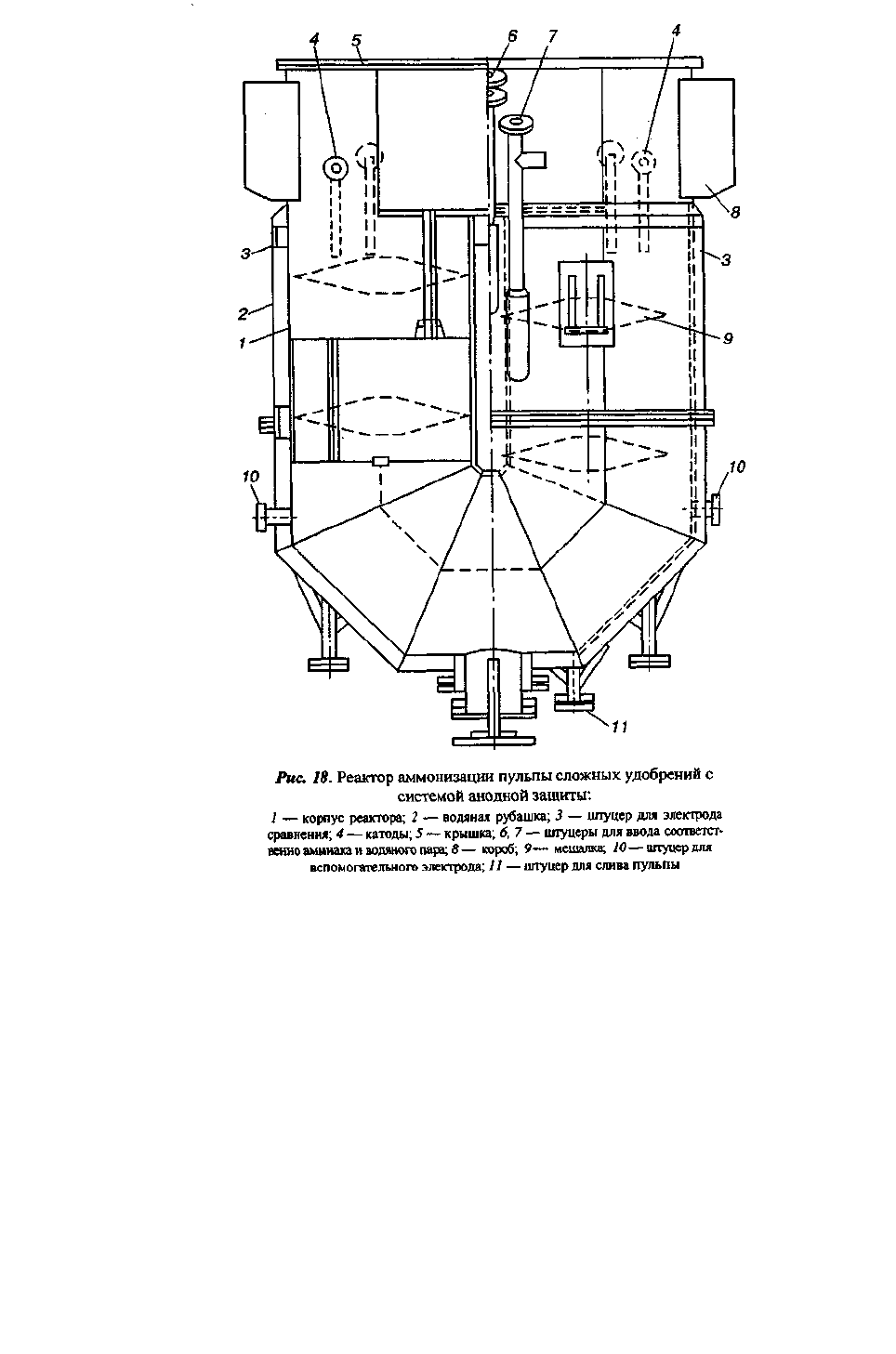
В качестве катодов использованы цилиндрические стержни из стали 06ХН28МДТ. Для
увеличения надежности работы анодной защиты в верхней части защищаемого аппарата
дополнительно установлены два вспомогательных электрода. Электроды сравнения —
хлорсеребряные, состоящие из фторопластового корпуса, внутри которого находится
серебряная проволока (d = 1мм, l = 50 мм). Свободный объем корпуса заполнен асбестовой
ниткой и запит насыщенным при 100°С раствором CaCl
2
. Снизу отверстие закрыто
фторопластовой пробкой, имеющей резьбу. Контакт с пульпой осуществляется через
асбестовую прокладку между корпусом электрода и пробкой. Сверху корпус электрода
имеет резьбу, посредством' которой соединяется с трубкой из стали 06ХН28МДТ.
Серебряная проволока предварительно была анодно обработана в 0,1н НС1 током 15 мА/см
2
в течение двух часов. Величина потенциала при 25 °С составляет ~ 170 мВ и не зависит от
рН.
Как указывалось выше, поверхность реакторов можно защитить поддержанием
значения защитного потенциала стали как по-ложительнее потенциала ингибирования, так
и отрицательнее потенциала репассивации. Возможность образования и развития питтингов
в интервале потенциалов Е
рп
— Е
ин
*
выдвигает жесткие требования по контролю значения
защитного потенциала поверхности оборудования. Надежность защиты реакторов
поддержанием потенциала в области Е
защ
> Е
ин
подтверждена как лабораторными

испытаниями, так и длительной работой системы в режиме, обеспечивающем защитный
потенциал.
Система контроля локальной коррозии
и электрохимической защиты оборудования
хлорного производства
В производстве хлора и каустической соды оборудование, изготовленное из стали
12Х18НЮТ, подвержено интенсивной локальной коррозии. В отделении вывода сульфатов
цеха выпаривания хлорного производства через 2—3 месяца эксплуатации в аппаратах
и трубопроводах появляются течи вследствие питтинговой коррозии и коррозионного
растрескивания. В местах ослабления уплотняющих элементов и на участках, покрытых
твердым слоем солей, наблюдается щелевая коррозия.
Коррозионные испытания хромоникелевых и хромоникельмо-либденовых сталей
в технологических растворах показали, что они корродируют незначительно, скорость
коррозии не превышает 0,001г/(м
2.
ч).
Однако при анодной поляризации все стали подвержены питтингу, а анодные
потенциодинамические кривые имеют гистерезис прямого и обратного хода, характерный
для питтинго-образования.
Устойчивость пассивного состояния сталей зависит от внешних условий (состав
раствора, температура, движение среды), состояния металла (сварка, термообработка)
и конструкции аппарата (наличие зазоров). Развитие локальной коррозии для хромоникеле-
вых и хромоникельмолибденовых сталей почти равновероятно. Исследования стали
12Х18Н10Т, применяющейся в качестве конструкционного материала оборудования
хлорного производства (в состоянии поставки мелкозернистая; после провоцирующего
нагрева при 650°С в течение двух часов и последующего охлаждения на воздухе; со сварным
швом, выполненным электродуговым способом и имеющим аустенитно-ферритную
структуру с ферритной составляющей в виде прожилок), в концентрированных
и разбавленных технологических средах стадии вывода сульфатов показали, что для
исследуемой системы характерно одновременное протекание питтинговой, щелевой
коррозии и коррозионного растрескивания.
При исследовании питтинговой коррозии стали 12Х18Н10Т было установлено, что
в концентрированном хлоридном растворе значения граничных потенциалов
питтингообразования (Е
ПО
), питтинговой коррозии (Е
пк
) и репассивации (Е
ра
) близки,
а снижение концентрации NaCl или повышение концентрации щелочи в обоих растворах
увеличивает разницу между ними.
Введение в растворы щелочи приводит к симбатному смещению граничных
потенциалов питтинговой коррозии в сторону отрицательных значений. Стимуляция
питтинга на стали 12Х18Н10Т малыми концентрациями гидроксил-ионов подтверждается
и опытами с добавлением щелочи при потенциостатической выдержке в нем образцов при
Е = Е
по
= 0,125 В.
Облегчение питтингообразования, вероятно, связано с участием гидроксил-ионов
в растворении металла при его анодном активировании, что наблюдали и для железа
в хлоридном растворе.
Начиная с определенной минимальной концентрации щелочи, зависящей от
концентрации хлорида, проявляется ингибирующее действие ОН ионов. Однако
в концентрированном хлорид-сульфатном растворе при 30 °С введение 2 н NaOH смещает
потенциал питтингообразования всего на 0,125 В, т. е. ингибирующее действие гидроксил-
ионов невысоко.
Так как активирование и пассивация металла в щелочных хло-ридных растворах
определяется не только значением потенциала, но и соотношением C
OH-
/C
Cl
-были определены
предельные соотношения содержания щелочи и хлорида, при достижении которых
прекращается активация стали 12Х18Н10Т хлорид-ионами во всем интервале потенциалов
вплоть до потенциала выделения водорода в исследуемых щелочных хлоридных растворах.

В условиях работы хлорного производства достижение предельных соотношений
содержания щелочи и хлоридов (Сон-/Са-)
пред
, обеспечивающих предотвращение питтинга,
возможно лишь на стадии отмывки аппаратов от концентрированного щелочного хлорид-
сульфатного раствора. Дополнительное введение NaOH в рабочий раствор приводит
к нарушению технологии процесса, и такой метод защиты оборудования от питтинговой
коррозии неприемлем для исследуемой системы.
Повышение температуры растворов от 30 до 90 °С вызывает смещение критических
потенциалов питтингообразования в сторону более отрицательных значений, увеличивая
вероятность возникновения питтинговой коррозии стали 12Х18Н10Т. При этом наличие
сварного шва, провоцирующий нагрев при 600 °С в течение двух часов также повышает
склонность стали к питтингу.
Учитывая неудовлетворительную воспроизводимость значений Е
пк
в исследуемой
системе, для оценки и прогнозирования вероятности развития питтинговой коррозии
в промышленных условиях в качестве основного критерия использовали разность
ДЕ
рп
= Е
рп
- Е
кор
, в качестве дополнительного —
Е
по
= Е
по
- Е
кор
. Сопоставление значений
потенциала коррозии стали 12Х18Н10Т и области вероятностных значений E
рп
и E
по
в концентрированном растворе показывает, что в присутствии щелочи (>0,5 н) потенциал
коррозии не достигает значений потенциала питтингообразования, однако может превышать
потенциал репассивации, особенно при высокой температуре.
При низких концентрациях NaOH значение потенциала коррозии превышает £
по
. Эти
данные свидетельствуют о высокой вероятности возникновения и развития питтингов
в исследованных интервалах температур и концентраций щелочи в хлорид-сульфатном
растворе.
Действительно, в производственных условиях через 2—3 месяца эксплуатации
наблюдается перфорация аппаратов и трубопроводов, а значение потенциала коррозии
оборудования смещается со временем к более положительным значениям, т. е. питтин-
гообразование облегчается.
Контролируя и поддерживая значение потенциала коррозии оборудования,
отрицательнее потенциала репассивации, можно предотвратить питтинговую коррозию.
Потенциостатические испытания (100 ч — при Е
рп
и 500 ч — при — 0,5 В) цельных и свар-
ных образцов стали 12Х18Н10Т в щелочных хлорид-сульфатных растворах различного
состава при 90 °С подтвердили отсутствие питтингов.
В случае, когда значение потенциала коррозии превышает Е
рп
, можно ожидать развитие
щелевой коррозии (при наличии щелей), а в концентрированном щелочно-хлоридном
растворе от образующихся питтингов на напряженном металле происходит зарождение
и развитие трещины.
Наиболее часто коррозионное растрескивание под напряжением возникает в сварных
соединениях оборудования, так как наличие высоких остаточных напряжений,
гетерогенность поверхности сварного соединения создают условия для развития КРН.
Установлено также, что из всех факторов, сочетание которых необходимо для
возникновения коррозионного растрескивания под напряжением, наиболее сильное влияние
оказывает температура.
Результаты исследований влияния на потенциал репассивации степени развития
трещины, которая качественно оценивалась по относительному удлинению (
0
/l l
)напряженного образца и влияния катодной поляризации на рост трещины, показали, что при
(
0
/l l
)= 1 • 10
-4
... 5 • 10
-2
катодная поляризация при Е = Е
рт
= - 0,15 В останавливает рост
трещин и разрушение образца не наблюдалось в течение 500 часов. При потенциалах
положительное E
рт
разрушение происходило в течение нескольких часов даже при мини-
мальном предварительном (
0
/l l
).
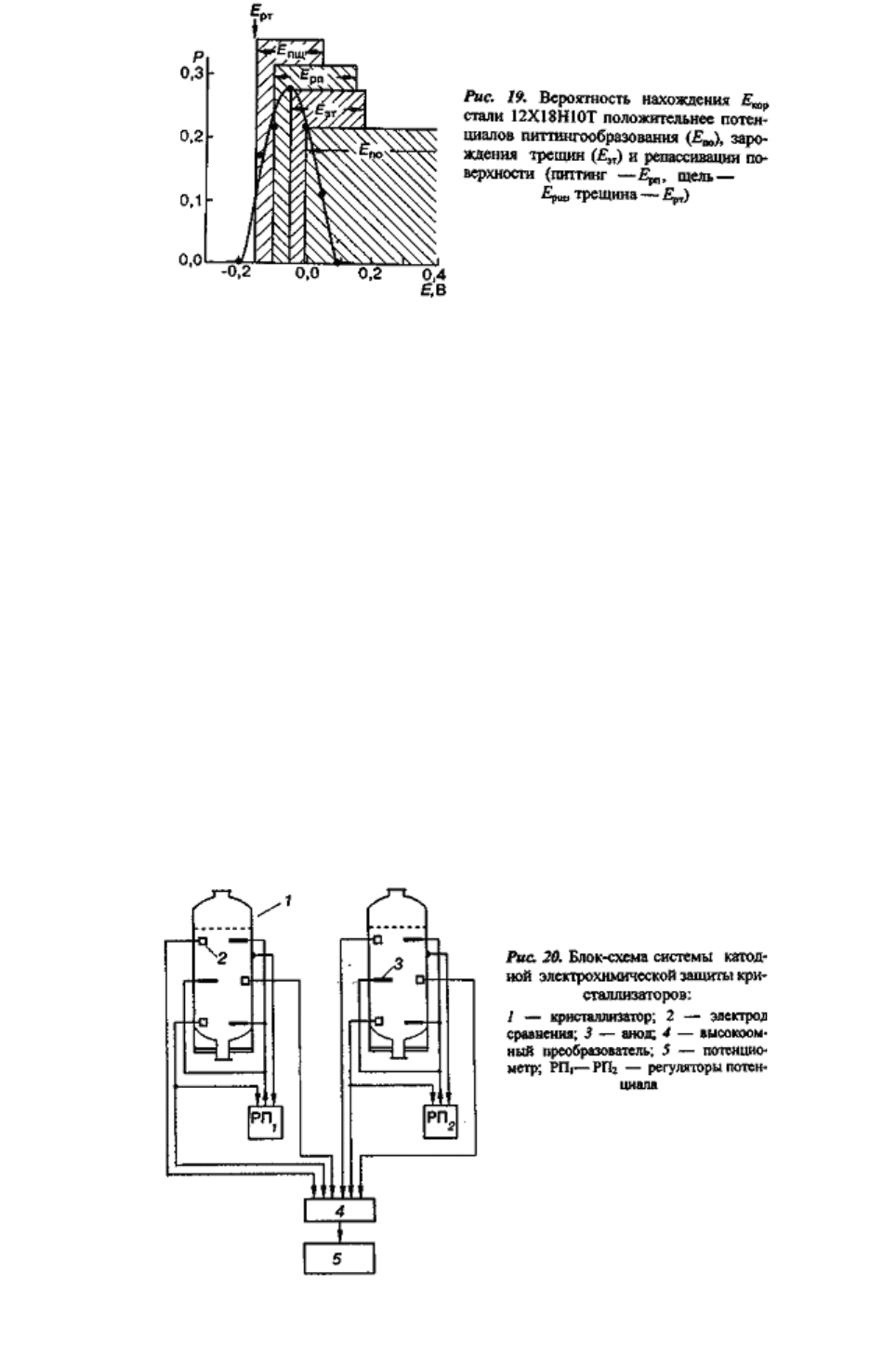
Анализ данных о вероятных значениях потенциала коррозии и граничных потенциалах
питтингообразования, щелевой коррозии и коррозионного растрескивания под напряжением
(рис.19) показал, что без специальных методов защиты сталь обладает низкой стойкостью
против локальных видов коррозии.
Эффективным методом защиты может служить поддержание с помощью катодной
поляризации потенциала поверхности оборудования ниже самого отрицательного значения
граничного потенциала репассивации локального процесса.
С учетом данных исследований была разработана система противокоррозионной
защиты двух кристаллизаторов в отделении вывода сульфатов хлорного производства [161].
В кристаллизаторе — вертикальном цилиндрическом аппарате диаметром 1200 мм
и высотой 5040 мм — при нагревании щелочного концентрированного хлоридно-
сульфатного раствора до 100—105 °С происходит выделение кристаллов КагЗОд, которые
вместе с раствором откачивают в напорный бак, а затем подают на центрифугу.
В кристаллизаторе поддерживается атмосферное давление.
Нагрев раствора происходит в выносной греющей камере за счет теплоты конденсации
греющего пара, подаваемого под давлением 0,3 МПа в межтрубное пространство. Подача
раствора в греющую камеру и перемешивание раствора в кристаллизаторе осуществляется
с помощью циркуляционного насоса. В технологической схеме вывода сульфатов имеются
два кристаллизатора, которые работают поочередно. Режим работы кристаллизатора:
упаривание сульфатного раствора при 100—105 °С — 24 ч; отмывка аппарата от рабочего
раствора путем заполнения его горячим (до 100 °С) конденсатом — 12ч; слив загрязненного
конденсата и нахождение аппарата в резерве — 12ч.
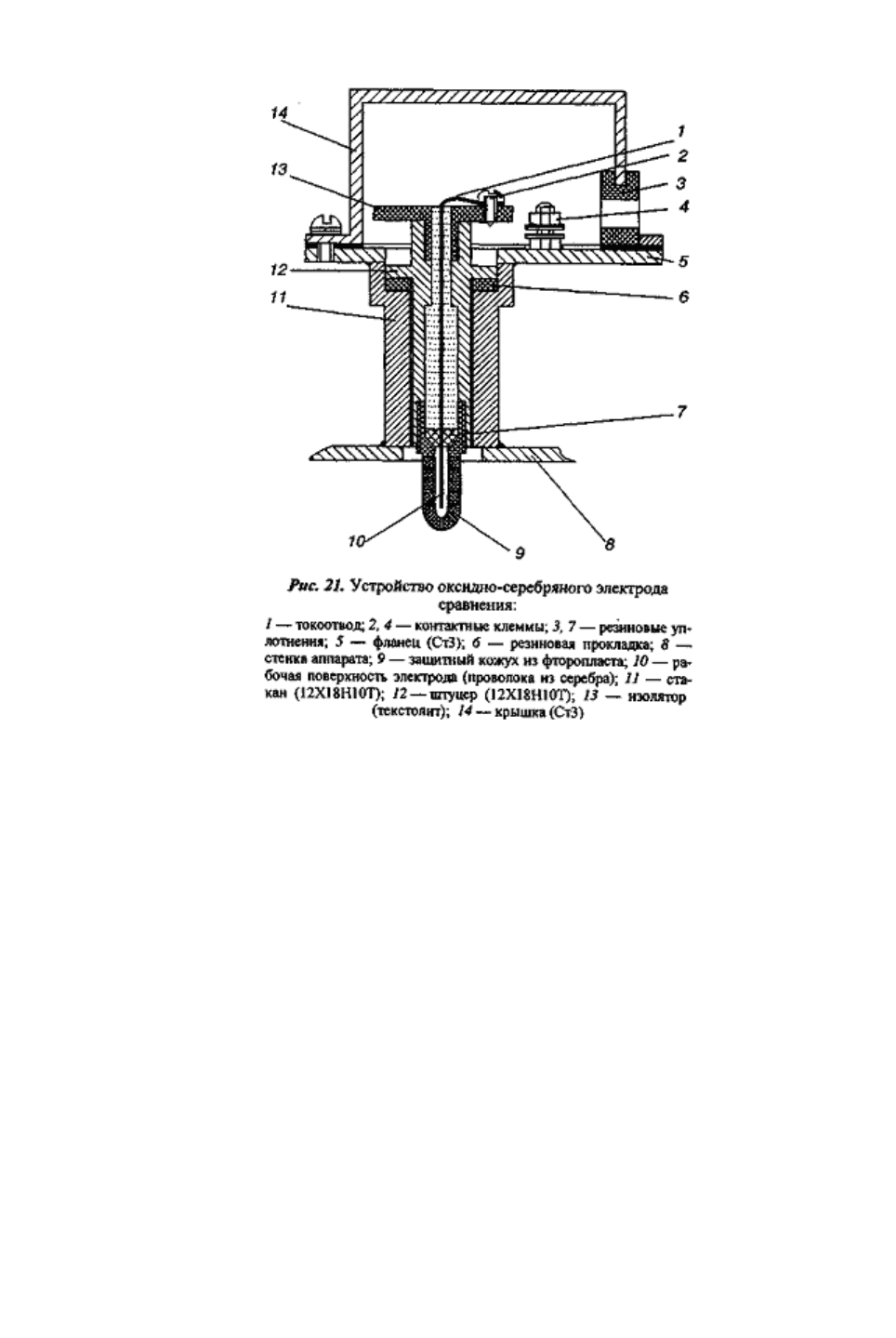
На рис. 20 представлена блок-схема системы катодной защиты кристаллизатора,
которая обеспечивает автоматический контроль и поддержание заданного потенциала
поверхности аппарата.
Разработаны узлы так называемых проходных анодов, которые устанавливаются
в плоскостях, перпендикулярных боковой поверхности аппарата. На каждом из
кристаллизаторов было смонтировано по три проходных анода. Результаты измерений
потенциала поверхности кристаллизатора в точках ЭС
1
ЭС
2
, ЭС
3
при работе системы
катодной защиты показали, что такое количество анодов и схема их расположения
обеспечивают равномерное распределение защитного потенциала поверхности аппарата.
Непрерывный контроль за распределением потенциала по защищаемой поверхности
аппарата осуществляется с помощью многоточечного потенциометра, к которому через
высокоомный преобразователь подключены электроды сравнения.
Электроды сравнения — оксидно-серебряные (рис. 21). Монтаж электрода сравнения на
аппарате осуществляется ввариванием стакана из стали 12Х18Н10Т в корпус аппарата, после
чего в стакан ввинчивается сам электрод. Рабочая поверхность электрода защищена от
механических повреждений перфорированным защитным кожухом из фторопласта.
При необходимости электрод сравнения легко может быть заменен на новый или
вместо него в стакан может быть ввинчена заглушка.
В течение всего периода эксплуатации система контроля функционировала нормально,
обеспечивая надежную электрохимическую защиту аппарата из стали от локальной
коррозии.

Коррозионный контроль
и защита теплообменного оборудования
в сернокислотных средах
В сернокислотных средах в последние десятилетия широко применяется анодная
защита оборудования от коррозии [152], в том числе и аппаратов сложной конфигурации —
кожухотрубных холодильников с большой поверхностью теплообмена (65—525 м
2
).
Промышленному применению анодной защиты теплообменников предшествуют
систематические исследования влияния температуры, концентрации, состава и скорости
движения сернокислотных технологических сред на коррозионно-электрохимическое
поведение конструкционных сталей [162—165], а также изучение распределения потенциала
и тока при анодной поляризации аппарата. Важен также выбор типа и конструкции датчиков
потенциала для промышленных систем электрохимической защиты и коррозионного
контроля оборудования сложной конфигурации.
Кожухотрубные холодильники из нержавеющих сталей, имеющие высокие технико-
экономические и экологические показатели, в промышленных растворах промывной
и сушильной серной кислоты подвержены интенсивной коррозии и требуют
противокоррозионной защиты. Как показывает анализ имеющихся данных, наиболее
эффективным методом противокоррозионной защиты кожухотрубных холодильников
сернокислотных производств является их пассивирование с помощью внешней поляризации
и поддержание потенциала поверхности аппарата в области пассивного состояния малыми
токами. Получение количественных зависимостей граничных значений поляризующего тока
и потенциала от параметров коррозионной системы позволяет выбирать оптимальные
решения по режиму пассивирования и поддержания пассивного состояния аппаратов
сложной конфигурации и большой поверхности, по рациональному размещению катодов
и определению их количества, а также выбрать оптимальные условия коррозионного
контроля в конкретных условиях работы тештообменного оборудования сернокислотных
производств.
В 20%-м растворе серной кислоты (промывная) при повышении температуры кислоты
от 25 до 40 °С наблюдается увеличение скорости коррозии сталей, что вызвано смещением
значения потенциала коррозии в область активного растворения. Ухудшаются также
пассивационные характеристики сталей: увеличивается критическая плотность тока
пассивации, i
кр
и плотность тока в пассивном состоянии i
п
сужается область устойчивого
пассивного состояния, однако протяженность ее остается значительной и при 80°С
составляет 1 В.
Увеличение скорости движения со аэрированной кислоты, практически не влияя на
потенциал коррозии хромоникелевых сталей, повышает скорость их коррозии, облегчает
пассивацию и способствует сохранению пассивного состояния хромоникельмо-либденовых
сталей. На параметры анодной защиты движение среды отрицательного влияния не
оказывает. Зависимость скорости анодного растворения i
a
хромоникелевых сталей от со
имеет максимум в интервале 400—1000 об/мин при потенциалах переходной области, что
указывает на влияние растворенного кислорода на процесс пассивации вращающегося
электрода. В целом движение аэрированного 20%-го раствора серной кислоты благоприятно
влияет на пассивацию и устойчивость пассивного состояния исследованных сталей.
