Морган Э.Дж., Мэгид С. Михаил Клиническая анестезиология: книга 2-я
Подождите немного. Документ загружается.


Клиническая
Анестезиология
книга вторая
Дж. Эдвард Морган-мл.
Мэгид С. Михаил
Перевод с английского под редакцией
академика PAMH
А. А. Бунятяна,
канд. мед. наук A.
M. Цейтлина
Издательство БИНОМ
Москва
Невский Диалект
Санкт-Петербург
2000

Перевод с английского: канд. мед. наук Горелов В. Г., Добродеев А. С., канд. мед. наук Селезнев M. H.,
канд. мед. наук Цейтлин A. M., Шатворян Б. P.
Дж. Эдвард Морган-мл., Мэгид С. Михаил
М79 Клиническая анестезиология: книга 2-я.— Пер. с англ. — M.-СПб.: Издательство БРШОМ-Невский
Диалект, 2000. 366 с., ил.
В книге рассмотрены физиологические основы проведения анестезии у пациентов с сопутствующими
заболеваниями сердечно-сосудистой системы, органов дыхания, нервными и психическими расстройствами,
нарушениями водно-электролитного баланса и кислотно-основного состояния. В отдельных главах
представлены методы проведения анестезиологического пособия в пред-, интра- и постоперационном пе-
риодах при хирургических вмешательствах на сердце и сосудах, легких и трахее, пищеводе, головном и
спинном мозге и позвоночнике, почках и других органах мочевыделительной системы. Детально освещены
вопросы проведения инфузионной терапии — показания, методы, виды растворов, осложнения и аль-
тернативные варианты.
Для врачей-анестезиологов, реаниматологов, студентов медицинских учебных заведений.
Все права защищены. Никакая часть этой книги не может быть воспроизведена в любой форме или любыми
средствами, электронными или механическими, включая фотографирование, магнитную запись или иные средства
копирования или сохранения информации, без письменного разрешения издательства.
ISBN 5-7989-0165-3 (Издательство БИНОМ)
ISBN 5-7940-0044-9 (Невский Диалект) ISBN
0-8385-1470-7 (англ.)
Издание на русском языке: © Издательство
БИНОМ, Невский Диалект, перевод,
оформление, 2000.
Original edition copyright
© 1996, All Rights Reserved.
Published by arrangement with the Original Publisher,
Appleton & Lange a Simon & Schuster Company
УДК 616-089.5
ББК Р451
М79

Раздел IV
Анестезиологическое
пособие
Физиология кровообращения л Q
и анестезия
Анестезиолог должен иметь фундаментальные
знания по физиологии кровообращения, которые
необходимы как для понимания научных основ
специальности, так и для практической работы. В
этой главе обсуждаются вопросы физиологии
сердца и большого круга кровообращения, а также
патофизиологии сердечной недостаточности.
Малый (легочный) круг кровообращения рассмат-
ривается в главе 22, физиология крови и обмен ве-
ществ — в главе 28.
Система кровообращения состоит из сердца и
кровеносных сосудов. Она предназначена для
снабжения тканей кислородом и питательными ве-
ществами и удаления продуктов метаболизма.
Сердце перекачивает кровь через две сосудистые
системы. В малом круге кровообращения кровь
обогащается кислородом и избавляется от угле-
кислого газа. В большом круге — доставляет кис-
лород к тканям и поглощает продукты метаболизма,
которые затем элиминируются через легкие, почки
или печень.
Сердце
Анатомически сердце представляет собой единый
орган, но функционально оно делится на правый и
левый отделы, каждый из которых состоит из
предсердия и желудочка. Предсердия служат как
проводниками для крови, так и вспомогательными
насосами для заполнения желудочков. Желудочки
выполняют роль главных насосов, перека-
чивающих кровь. Правый желудочек получает
дезоксигенированную кровь из большого круга
кровообращения и перекачивает ее в малый круг.
Левый желудочек получает оксигенированную
кровь из малого круга кровообращения и перека-
чивает ее в большой круг. Четыре клапана обеспе-
чивают однонаправленный поток крови через
каждую камеру. Насосная функция сердца обес-
печивается сложной последовательностью элект-
рических и механических явлений.
Сердце состоит из специализированной
попе-речнополосатой мышечной ткани,
заключенной в соединительнотканный каркас.
Клетки сердечной мышцы — кардиомиоциты —
подразделяются на предсердные, желудочковые,
водителей ритма и проводящей системы.
Способность кардиомиоцитов к самовозбуждению
и их уникальная организация позволяют сердцу
функционировать как высокоэффективному
насосу. Последовательные соединения между
отдельными кардиомиоцитами (вставочные
диски), имея низкое сопротивление, обеспечивают
быстрое и упорядоченное распространение
электрического импульса в каждой камере сердца.
Волна возбуждения распространяется от одного
предсердия к другому и от одного желудочка к
другому по проводящим путям. Связь между
предсердиями и желудочками осуществляется не
непосредственно, а через АВ-узел, поэтому
возбуждение передается с задержкой. За счет
этого происходит наполнение желудочка при
сокращении предсердия.

Потенциалы действия
кардиомиоцитов
Мембрана кардиомиоцита проницаема для ионов
К
4
, но относительно непроницаема для ионов Na'.
Мембраносвязанная Ка
+
/К
4
-зависимая АТФ-аза
перекачивает ионы K
+
внутрь клетки, а ионы Na"
из клетки (глава 28). Концентрация К
4
внутри
клетки выше, чем во внеклеточном пространстве.
Концентрация Na', наоборот, выше во
внеклеточном пространстве, чем внутри клетки.
Относительная непроницаемость мембраны для
кальция поддерживает высокий градиент концен-
трации кальция между внеклеточным простран-
ством и цитоплазмой. Выход K
+
из клетки по гра-
диенту концентрации приводит к потере
суммарного положительного заряда внутри клетки.
Анионы не сопровождают ионы К
4
, поэтому
возникает электрический потенциал, причем
внутренняя поверхность клеточной мембраны за-
ряжается отрицательно по отношению к наружной.
Таким образом, мембранный потенциал покоя
формируется в условиях равновесия между
ДВУМЯ
противоположными силами: движением K
+
по
градиенту концентрации и электрическим
притяжением отрицательно заряженным внутри-
клеточным пространством положительно заря-
женных ионов К".
В норме мембранный потенциал покоя кардио-
миоцита желудочка варьируется от -80 до -90 мВ.
Если мембранный потенциал становится менее от-
рицательным и достигает пороговой величины, то
в кардиомиоците, как и в клетках других возбу-
димых тканей (нерв, скелетная мышца), возникает
потенциал действия, т. е. происходит деполяризация
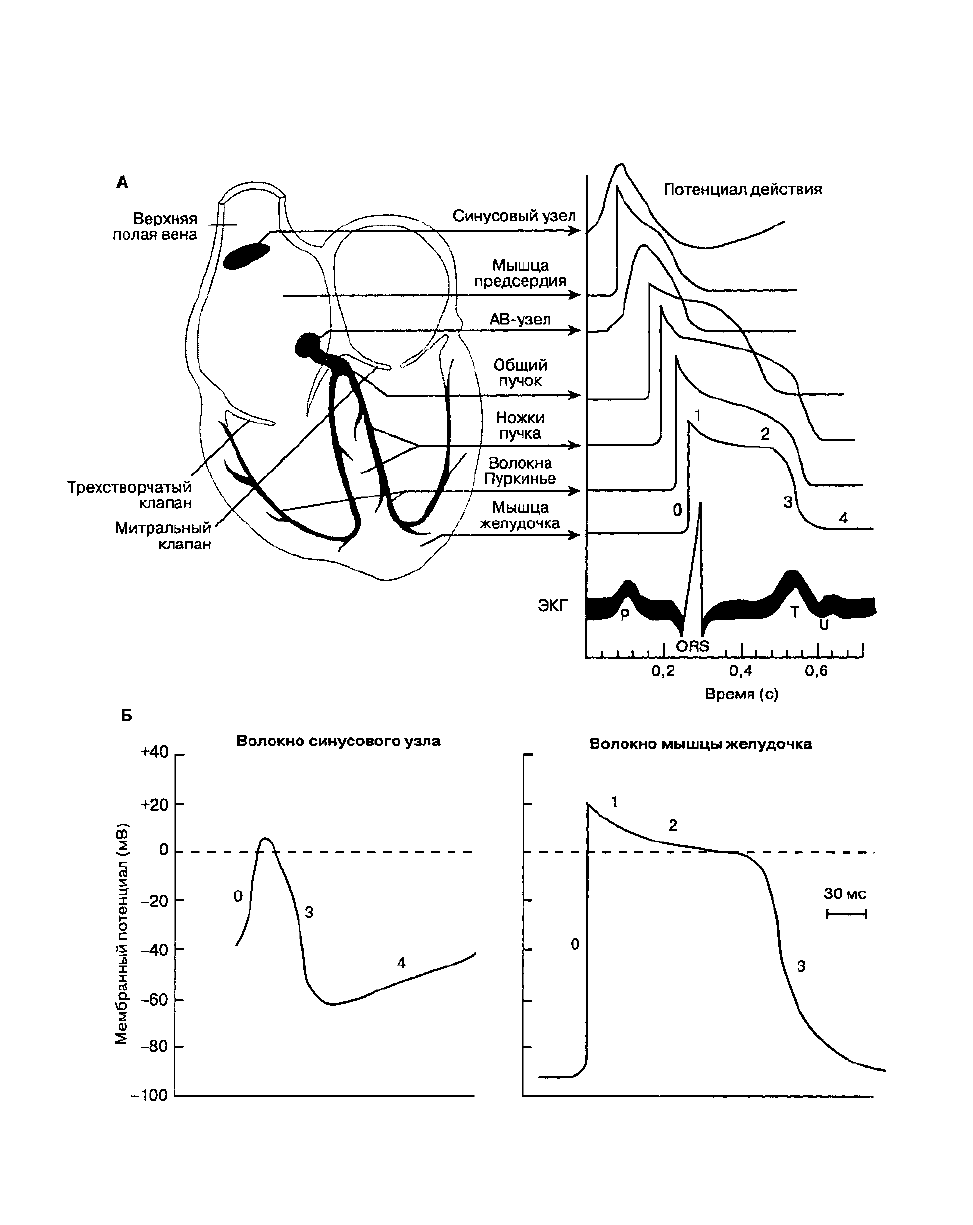
(рис. 19-1 и табл. 19-1). Потенциал действия
вызывает преходящее увеличение мембранного
потенциала кардиомиоцита до +20 мВ. В отличие
от потенциала действия нейрона (гл. 14), в потен-
циале действия кардиомиоцита за пиком следует
фаза плато, которая длится 0,2-0,3 с. Потенциал
действия скелетной мышцы и нерва обусловлен ла-
винообразным открытием быстрых натриевых ка-
налов мембраны, потенциал действия кардиомио-
цита вызывается открытием как быстрых
натриевых каналов (фаза начальной быстрой
репо-ляризации), так и медленных кальциевых
каналов (фаза плато). Кроме того, деполяризация
сопровождается преходящим уменьшением
проницаемости мембраны для калия. В
последующем проницаемость мембраны для калия
восстанавливается, натриевые и кальциевые каналы
закрываются и мембранный потенциал возвращается
к исходному уровню.
После деполяризации клетки рефрактерны
(невосприимчивы) к деполяризующим стимулам
до наступления 4-й фазы. Эффективный
рефрак-терный период равен минимальному
интервалу между двумя импульсами, вызвавшими
распространение возбуждения. В
быстропроводящих кар-диомиоцитах эффективный
рефракторный период практически равен
продолжительности потенциала действия. В
медленнопроводящих кардиомио-цитах, напротив,
эффективный рефрактерный период может
превышать продолжительность потенциала
действия.
Возникновение и распространение
сердечного импульса
В норме электрические импульсы в сердце выра-
батываются синусовым узлом — группой специа-
лизированных клеток, расположенных в стенке
правого предсердия впереди от отверстия верхней
полой вены. Мембрана этих клеток характеризу-
ется повышенной проницаемостью для натрия и,
ТАБЛИЦА 19-1. Потенциал действия кардиомиоцита
Фаза
Название
Событие
Движение ионов
О
Деполяризация
Активация (открытие) быстрых Na^-каналов
и снижение
проницаемости мембраны для Ю
Na^ поступает в клетку
1
Начальная быстрая
реполяризация
Инактивация Na'-каналов и преходящее увеличение
проницаемости мембраны для К
4
К* выходит из клетки
2
Плато
Активация медленных Са
2+
-каналов
Ca
2+
поступает в клетку
3
Конечная быстрая
реполяризация
Инактивация Са
2+
-каналов и увеличение проницаемости
мембраны для K
+
K
+
выходит из клетки
4
Потенциал покоя или
Восстановление исходной проницаемости мембраны
кардиомиоцитов предсердий и желудочков
К* выходит из клетки
Диастолическая
деполяризация
Медленный ток Na
+
и, возможно, Ca
2+
внутрь клеток,
приводящий к спонтанной деполяризации
Na
+
поступает в клетку
? Ca
2+
поступает в клетку
возможно, кальция. Медленный ток натрия при-
водит к снижению потенциала покоя клеток сину-
сового узла (-50— -60 мВ против -80— -90 мВ в
кардиомиоцитах желудочков) и имеет три важных
следствия: постоянную инактивацию быстрых
натриевых каналов; потенциал действия
с порогом -40 мВ, обусловленный в первую оче-
редь движением ионов через медленные кальциевые
каналы; регулярную спонтанную деполяризацию. В
диастолу поступление натрия в клетку приводит к
тому, что мембрана клетки постепенно становится
все менее отрицательной; когда дости-
Рис. 19-1. Потенциалы действия сердца. А. Характеристика потенциалов действия различных отделов сердца. Б. Клетки
пейсмекера синусового узла характеризуются отчетливой спонтанной диастолической деполяризацией, в них значи-
тельно слабее выражены четкие фазы потенциала действия, в отличие от клеток миокарда предсердия или желудочка.
Смотрите табл. 19-1 для объяснения различных фаз потенциала действия. (С изменениями. Из: Ganong W. F. Review of
Medical Physiology, 16th ed. Appleton & Lange, 1993.)

гается пороговый потенциал, то открываются
кальциевые каналы, уменьшается проницаемость
мембраны для калия и развивается потенциал
действия. Восстановление нормальной проницае-
мости для калия возвращает клетки синусового
узла в состояние покоя.
Импульс, возникший в синусовом узле, в нор-
мальных условиях быстро распространяется по
предсердиям PI к АВ-узлу. Специализированные
волокна проводят возбуждение как к левому
предсердию, так и к АВ-узлу. АВ-узел расположен с
правой стороны межпредсердной перегородки,
впереди от отверстия венечного синуса и над пере-
городочной створкой трехстворчатого клапана. В
АВ-узле выделяют три отдельные области: верхнюю,
среднюю и нижнюю. Средняя область АВ-уз-ла не
обладает внутренней спонтанной активностью
(автоматизмом), в то время как верхняя и нижняя
области способны вырабатывать импульсы. В
физиологических условиях водителем ритма
является синусовый узел, потому что частота его
спонтанной диастолической деполяризации выше,
чем в верхней и нижней областях АВ-узла, где она
составляет 40-60 мин"
1
. Любой фактор,
уменьшающий частоту деполяризации синусового
узла или увеличивающий автоматизм верхней и
нижней областей АВ-узла, способствует возникно-
вению АВ-узлового ритма.
Импульсы из синусового узла в норме достигают
АВ-узла через 0,04 с и покидают его через по-
следующие 0,11 с. Эта задержка связана с низкой
скоростью проведения возбуждения в тонких во-
локнах внутри АВ-узла, что в свою очередь опре-
деляется активацией медленных кальциевых ка-
налов. Напротив, проведение импульса между
примыкающими друг к другу клетками в предсер-
диях и желудочках определяется активацией и
инактивацией быстрых натриевых каналов. Во-
локна, отходящие от нижней части АВ-узла, обра-
зуют пучок Гиса. Эта специализированная группа
волокон проходит в межжелудочковую перего-
родку, а затем разделяется на левую и правую
ножки, разветвляющиеся в сложную сеть волокон
Пуркинье, которые деполяризуют оба желудочка.
Волокна Гиса-Пуркинье разительно отличаются
от ткани АВ-узла: они имеют наиболее высокую
скорость проведения в сердце, что приводит к почти
одновременной деполяризации эндокарда обоих
желудочков (в норме это занимает 0,03 с).
Распространение возбуждения от эндокарда к
эпикарду через миокард требует еще 0,03 с. Таким
образом, импульсу, возникающему в синусовом
узле, в нормальных условиях необходимо менее 0,2
с для деполяризации всего сердца.
Галотан, энфлюран и изофлюран угнетают авто-
матизм синусового узла. С другой стороны, данные
препараты оказывают лишь весьма умеренное
непосредственное влияние на АВ-узел, увеличивая
время проведения возбуждения и рефрактерность.
Сочетание этих эффектов позволяет объяснить
высокий риск возникновения AB-узловой тахикардии
в тех случаях, когда на фоне ингаляционной анестезии
для лечения синусовой брадикардии применяют
холиноблокаторы: скорость водителей ритма в
АВ-узле возрастает в большей степени, чем таковая в
синусовом узле. Электрофизиологические эффекты
ингаляционных анестетиков на волокна Пуркинье и
миокард желудочков имеют сложный характер
из-за участия в процессе вегетативной нервной
системы. Описаны как антиаритмические, так и
аритмогенные свойства анестетиков. Первые могут
быть обусловлены прямым подавлением потока
Ca
2+
внутрь клетки, вторые — потенцированием
действия катехоламинов (гл. 7). Для возникновения
аритмогенного эффекта необходима активация как
Q
1
-, так и (3-адренорецепторов.
Токсическая концентрация местных анестетиков
в крови сопряжена с риском развития электро-
физиологических нарушений в сердце. Лидокаин
способен оказывать антиаритмическое действие
при низкой концентрации в крови (гл. 48). При
высокой концентрации в крови местные
анестети-KU подавляют проведение возбуждения в
сердце, связываясь с быстрыми натриевыми
каналами. Самые мощные местные анестетики —
бупивакаин и, в меньшей степени, этидокаин и
ропивакаин, по-видимому, оказывают наиболее
сильное влияние на сердце, особенно на волокна
Пуркинье и миокард желудочков. Бупивакаин
связывается с инак-тивированными быстрыми
натриевыми каналами (и затем медленно
диссоциирует), что приводит к возникновению
тяжелой синусовой брадикардии, остановки
синусового узла, а также опасной для жизни
желудочковой аритмии.
Антагонисты кальция представляют собой орга-
нические химические соединения, которые блоки-
руют ток кальция внутрь клетки через медленные
каналы. Антагонисты кальция из группы
дигидро-пиридинов (нифедипин) перекрывают канал,
а вера-памил и, в меньшей степени, дилтиазем
связываются с деполяризованным
инактивированным каналом.
Механизм сокращения
Клетки миокарда сокращаются в результате взаи-
модействия двух сократительных белков — актина
и миозина. Эти белки фиксированы внутри
клетки как во время сокращения, так и при рас-

слаблении. Сокращение клетки происходит, когда
актин и миозин взаимодействуют и скользят друг
относительно друга (рис. 19-2). Это взаимодействие
в норме предотвращается двумя регулирующими
белками: тропонином и тропомиозином.
Молекулы тропонина присоединены к молекулам
актина на одинаковом расстоянии друг от друга.
Тропомиозин располагается в центре актиновых
структур. Увеличение концентрации внутрикле-
точного кальция (приблизительно с 10~
7
до 10~
5
моль/л) приводит к сокращению, поскольку ионы
кальция связывают тропонин. Кальций изменяет
конформацию тропонина, что обеспечивает открытие
активных участков у молекул актина, способных
взаимодействовать с миозиновыми мостиками.
Активные участки на миозине функционируют
как Mg-зависимая АТФ-аза, чья активность воз-
растает при увеличении концентрации кальция
внутри клетки. Мостик миозина последовательно
соединяется и разъединяется с новым активным
участком актина. При каждом соединении потреб-
ляет ся АТФ.
Сопряжение возбуждения с сокращением
Количество кальция, необходимое для запуска
механизма сокращения, превышает таковое, по-
падающее в клетку через медленные каналы во
время 2-й фазы потенциала действия. То неболь-
шое количество кальция, которое входит в клетку
(через медленные каналы и механизм двунаправ-
ленного ЫауСа
2+
-трансмембранного обмена), за-
пускает процесс высвобождения гораздо большего
количества кальция, хранящегося в клетке
(кальцийзависимое высвобождение кальция).
Запасы связанного кальция находятся внутри
цистерн саркоплазматического ретикулума и, в
меньшем количестве, в Т-трубочках. Сила со-
кращения прямо пропорциональна величине на-
чального потока кальция внутрь клетки. Во время
расслабления, когда медленные каналы закрыты,
внутриклеточный кальций снова поглощается
саркоплазматическим ретикулумом; это активный
процесс, требующий участия АТФ-азы мембраны
(фосфоламбан). Кроме того, кальций удаляется из
клетки посредством трансмембранного обмена
внутриклеточного кальция на внеклеточный
натрий, а также с помощью активного транспорта
АТФ-азой мембраны. Таким образом, процесс
расслабления сердечной мышцы также требует
АТФ.
Количество доступного внутриклеточного Ca
2+
,
скорость его доставки и удаления определяют, со-
ответственно, максимальное развиваемое напря-
жение, скорость сокращения и скорость расслабле-
ния. Симпатическая стимуляция увеличивает силу
сокращения: катехоламины, взаимодействуя с
Pi-адренорецепторами, изменяют активность
стимулирующего G-белка (глава 18), что вызывает
увеличение внутриклеточной концентрации цАМФ
(глава 12), а это, в свою очередь, повышает
концентрацию внутриклеточного Ca
2+
. Увеличение
внутриклеточной концентрации цАМФ приводит к
рекрутированию дополнительных открытых
кальциевых каналов. Более того, адреномиметики
ускоряют расслабление, потенцируя эффекты
фосфоламбана. Ингибиторы фос-фодиэстеразы
(теофиллин и амринон), предотвращая метаболизм
внутриклеточного цАМФ, действуют аналогично.
Дигиталис повышает внутриклеточную
концентрацию кальция, ингибируя
мембраносвязанную Ка
+
/К
+
-зависимую АТФ-азу; в
результате происходит незначительное увеличение
внутриклеточной концентрации Na
+
, что
способствует прохождению через механизм транс-
мембранного натрий-кальциевого обмена большего
количества Ca
2+
. Глюкагон, активируя спе-
цифические норадренергические рецепторы,
увеличивает сократимость за счет повышения
уровня внутриклеточного цАМФ.
Высвобождение ацетилхолина, сопряженное со
стимуляцией блуждающего нерва, наоборот,
снижает сократимость, увеличивая уровень цГМФ и
ингибируя аденилатциклазу: эти эффекты опо-
средованы ингибирующим G-белком. При ацидозе
блокируются медленные кальциевые каналы и, со-
ответственно, подавляется сократимость сердца
из-за неблагоприятного влияния на внутриклеточ-
ную кинетику кальция. Предполагают, что ингаля-
ционные анестетики подавляют сократимость,
уменьшая поступление Ca
2
" в клетки во время де-
поляризации, изменяя кинетику его высвобождения
и поглощения саркоплазматическим ретикулумом,
а также снижая чувствительность сократительных
белков к кальцию. По силе воздействия на
кинетику кальция ингаляционные анестетики
располагаются в следующем порядке: галотан >
энфлюран > изофлюран > закись азота. Механизм
прямого угнетающего действия неингаляционных
анестетиков на сократимость миокарда до конца не
изучен, но предполагают, что он аналогичен
описанному выше.
Иннервация сердца
Парасимпатические волокна иннервируют главным
образом предсердия и проводящую систему.
Ацетилхолин взаимодействует со специализиро-
ванными м-холинорецепторами сердца (M
2
), что
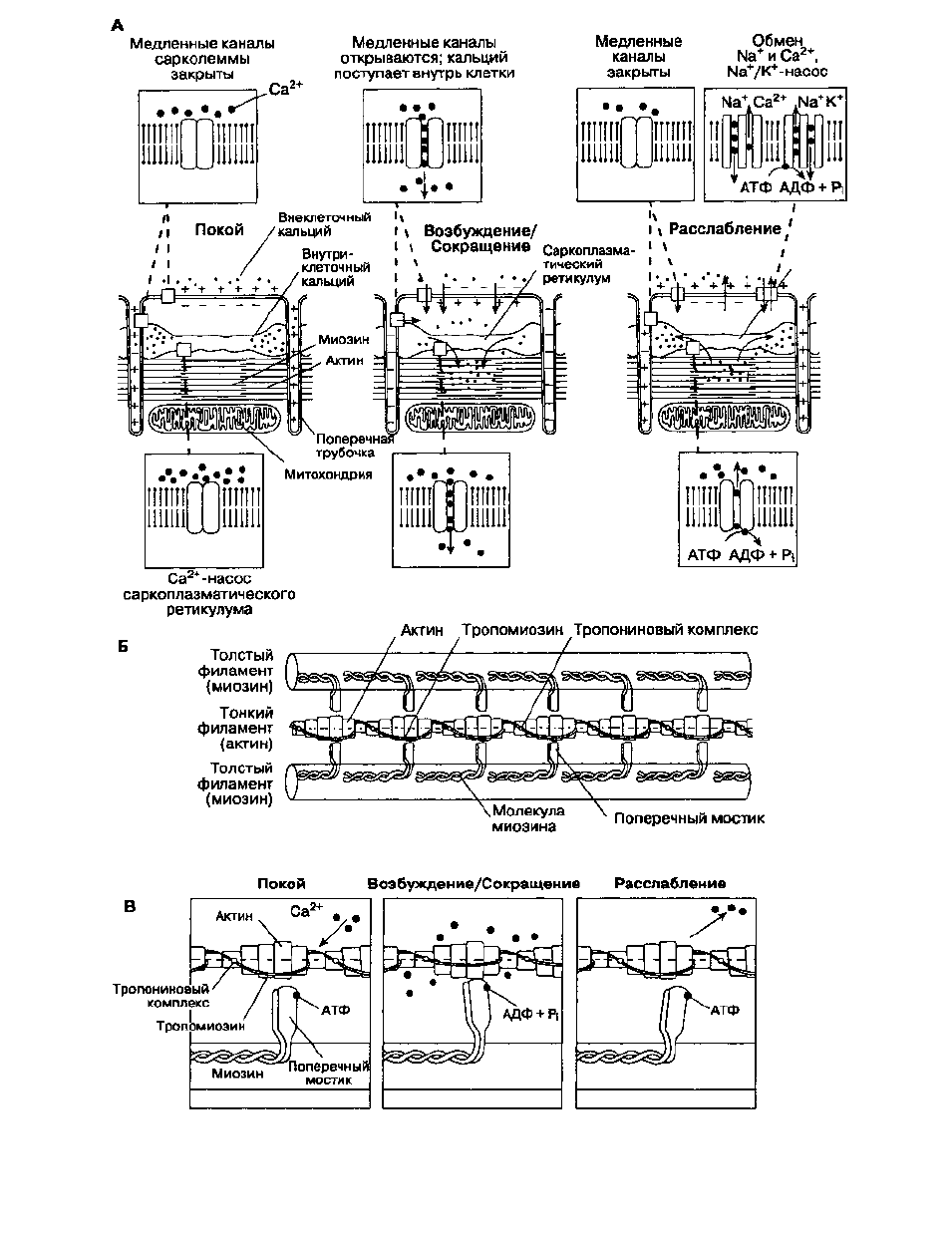
Рис. 19-2. Сопряжение возбуждения с сокращением и взаимодействие актина с миозином. А. Деполяризация мембраны
клетки сердечной мышцы позволяет кальцию проходить в клетку и освобождает кальций, накопившийся в
сарко-плазматическом ретикулуме. Б. Структура актомиозинового комплекса. В. Кальций связывает тропонин, давая
возможность актину и миозину взаимодействовать друг с другом. (С изменениями. Из: Katz A. M., Smith V. E. Hosp. pract,
1985; 19: 69. Braunwald E. The Myocardium: Failure and Infarction. HP Publishing, 1974.)

вызывает отрицательный хронотропныи,
дромо-тропный и инотропный эффекты.
Симпатические волокна распределены в сердце
более широко. Преганглионарные симпатические
волокна начинаются в грудных сегментах спинного
мозга (T
1
-Tj), достигают шейных узлов
симпатического ствола (в том числе звездчатого
узла), где переключаются на постганглионарные
волокна, формирующие сердечные нервы.
Высвобождение норадреналина из окончаний
симпатических сердечных нервов вызывает
положительный хронотропныи, дромотропный и
инотропный эффекты, главным образом путем
активации (З
г
адреноре-цепторов. Число
(3
2
-адренорецепторов гораздо меньше, и они
находятся в основном в предсердиях; их активация
увеличивает ЧСС. Стимуляция
ссгадренорецепторов вызывает положительный
инотропный эффект.
Вегетативная иннервация сердца имеет четко
выраженное разделение на правую и левую часть:
правые симпатические и правый блуждающий нервы
влияют главным образом на синусовый узел, в то
время как левые симпатические и левый блуждающий
нервы преимущественно воздействуют наАВ-узел.
Влияния блуждающего нерва часто проявляются
очень быстро и так же быстро разрешаются.
Симпатическое влияние, напротив, обычно
постепенно нарастает и так же исчезает. Синусовая
аритмия — это циклическое изменение ЧСС,
которое зависит от дыхания (ЧСС увеличивается
при вдохе и уменьшается при выдохе); данный фе-
номен обусловлен циклическими изменениями то-
нуса блуждающего нерва.
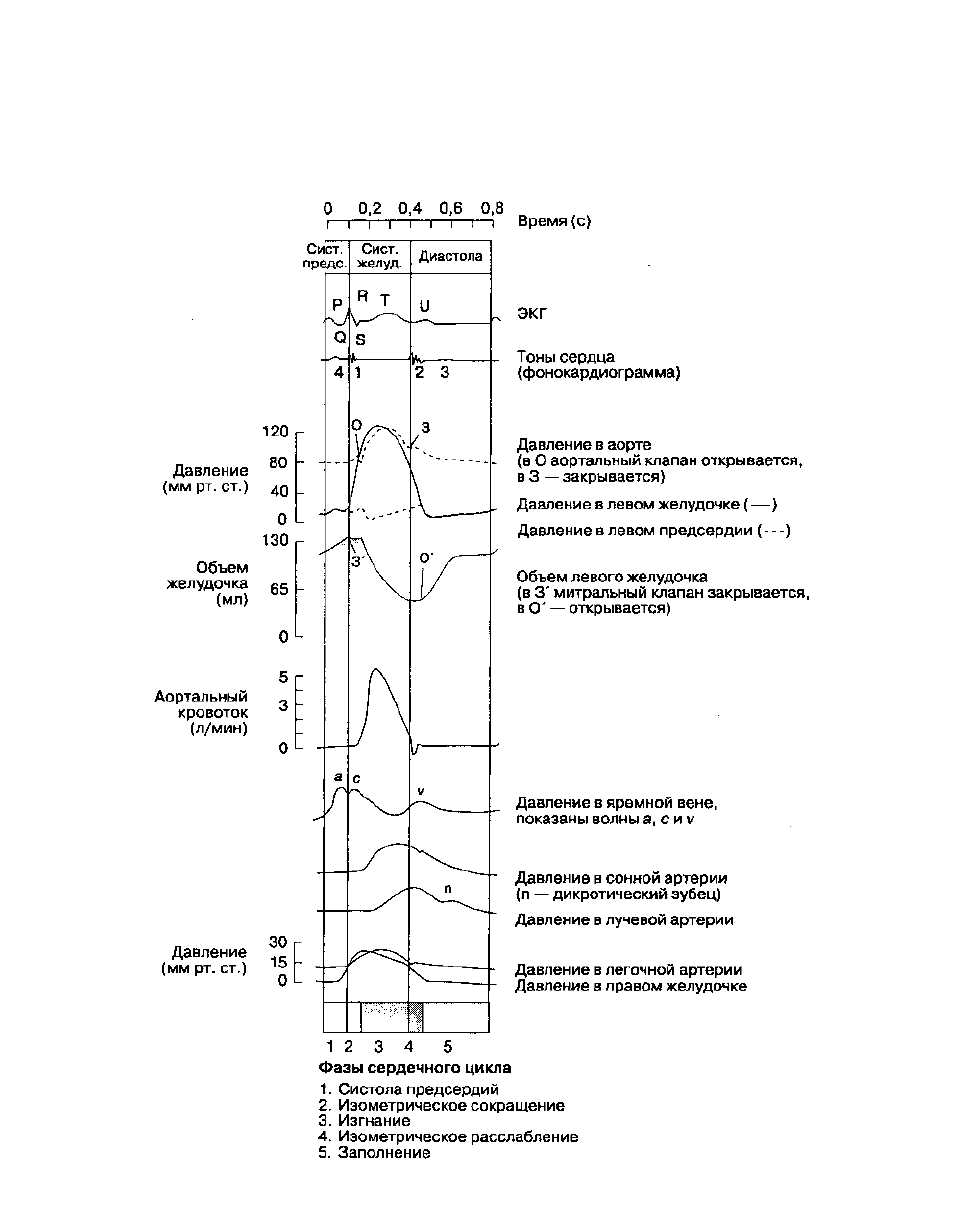
Сердечный цикл
Сердечный цикл — это череда электрических и ме-
ханических явлений (рис. 19-3). Сокращение сердца
называется систолой, расслабление — диастолой.
Диастолическое наполнение желудочков происходит
главным образом пассивно, еще до сокращения
предсердий. Сокращение предсердий в физиологи-
ческих условиях обеспечивает 20-30 % от
конечно-диастолического объема желудочков. На
кривой давления в предсердии выделяют три волны
(рис. 19-3). Волна а обусловлена систолой
предсердий. Волна с совпадает с систолой
желудочка, считается, что ее вызывает выбухание
атриовентрикулярного клапана в предсердие. Волна
v, регистрируемая перед открытием
атриовентрикулярного клапана, вызвана
нарастанием давления в предсердии, обусловленным
притоком крови из вен. Отрицательная волна х
представляет собой снижение давления в
промежутке между волнами с и г;. Ее происхожде-
ние связывают с опусканием предсердия в сторону
верхушки сердца при сокращении желудочков. При
недостаточности правого или левого атриовентри-
кулярного клапана волна х с этой стороны сердца
исчезает, что приводит к появлению сливной волны
Cv. За волной v следует отрицательная волна у,
обусловленная падением давления в предсердии
при открытии атриовентрикулярного клапана. Зубец
на кривой давления в аорте называется инцизу-рой и
отражает кратковременный обратный поток крови в
левый желудочек непосредственно перед
закрытием аортального клапана.
Факторы, влияющие
на функцию желудочков сердца
При обсуждении функции желудочков в качестве
модели чаще рассматривают левый желудочек, но
те же положения распространяются и на правый.
Допущение о раздельном функционировании
желудочков ошибочно, так как доказана их тесная
взаимозависимость. Выделяют факторы, влияю-
щие на систолическую (изгнание) и
диастоличес-кую (заполнение) функцию
желудочков.
Систолическую функцию желудочков чаще всего
отождествляют с сердечным выбросом, который
может быть определен как объем крови, перекачи-
ваемый сердцем за одну минуту. В физиологичес-
ких условиях сердечный выброс левого и правого
желудочков одинаков, потому что они соединены
последовательно. Величина сердечного выброса
(CB) описывается следующим уравнением:
CB = YOXHCC,
где УО — ударный объем (объем крови, выбрасы-
ваемый сердцем за одно сокращение); ЧСС — час-
тота сердечных сокращений. Для сравнения сер-
дечного выброса у людей с неодинаковым ростом и
массой тела, используют сердечный индекс (СИ):
СИ = СВ/(площадь поверхности тела).
Площадь поверхности тела определяют по номо-
грамме, учитывающей рост и массу тела человека. В
норме СИ колеблется от 2,5 до 4,2 л/мин/м
2
. В
силу широкого диапазона нормы СИ не является
достаточно чувствительным показателем функции
желудочка. СИ снижается лишь при тяжелой
дисфункции желудочка. Изменение сердечного
выброса при физической нагрузке позволяет оце-
нить функцию желудочка точнее. Если при физи-
ческой нагрузке сердечный выброс не увеличива-
ется для обеспечения возросшего потребления
кислорода, то SvO
2
снижается (гл. 22). Уменьшение
SvO
2
при возрастании потребности в кислоро-
де обычно отражает неадекватную перфузию тка-
ней. Таким образом, в отсутствие гипоксии или
тяжелой анемии, SvO
2
(или PvO
2
) является наиболее
точным показателем адекватности сердечного
выброса (т. е . систолической функции левого же-
лудочка).
1. ЧАСТОТА СЕРДЕЧНЫХ СОКРАЩЕНИЙ
В известных пределах сердечный выброс прямо
пропорционален ЧСС (рис. 19-4). ЧСС определя-
ется автоматизмом синусового узла (т. е. его спон-
танной диастолической деполяризацией), который
модулируется вегетативными, гуморальными
Рис. 19-3. Сердечный цикл в норме. Обратите внимание на соответствие между электрическими и механическими
явлениями. (С изменениями. Из: Ganong W. F. Review of Medical Physiology, 16th ed. Appleton & Lange, 1993.)
