Лесникова Н.П. Физическая химия. Самостоятельное решение задач по химической термодинамике, электрохимии и кинетике
Подождите немного. Документ загружается.

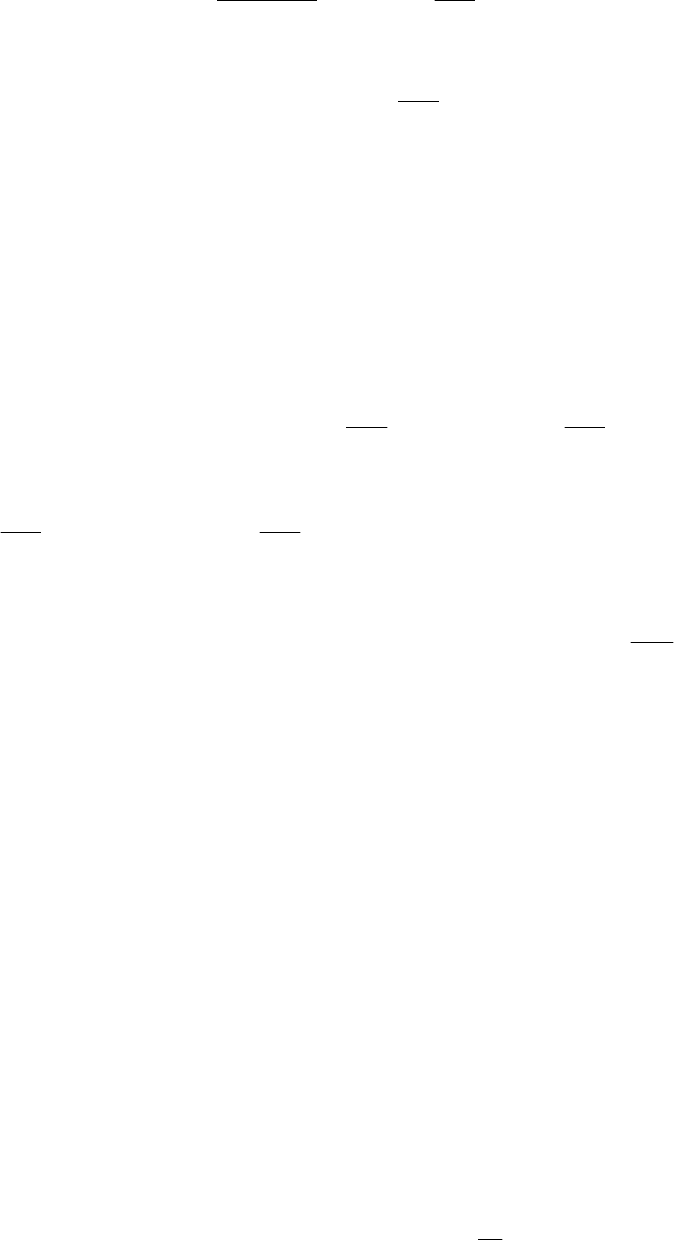
51
В последнем уравнении разницу двух интегралов можно заме-
нить повторным интегралом, тогда
.
,
298
298
2
0
298
0
298
0
298298
2
298298
dTC
T
dT
TSTHG
dTC
T
dT
T
T
dTC
TdTC
T
P
T
T
T
P
TT
P
T
P
(1.64)
Для более точного расчета изменения энергии Гиббса от тем-
пературы, в уравнение (1.64) следует подставить температурный ряд
теплоемкости и разбить повторный интеграл на алгебраическую
сумму повторных интегралов
.
,
298
2
298
2
298
2
298
2
298298
2
298298
2
0
298
0
298
0
22
dTT
T
dT
cdTT
T
dT
c
TdT
T
dT
bdT
T
dT
aTSTHG
TccTbTaC
TTTT
TTTT
T
P
(1.65)
Обозначим в полученном уравнении ,
298
298
2
dTT
T
dT
M
T
n
T
n
то-
гда уравнение (1.65) можно представить в виде:
.
2210
0
298
0
298
0
MccMbMaMTSTHG
T
(1.66)
В этом уравнении значения коэффициентов М
n
зависят
только от температуры и не зависят от природы веществ. Вели-
чины справочные, что позволяет с достаточной точностью выпол-
нять необходимые расчеты. Метод Темкина – Шварцмана также
широко используется для вычисления констант равновесия химиче-
ских реакций.
Пример 22. Определить изменение энергии Гиббса и измене-
ние энергии Гельмгольца для изотермического обратимого расши-
рения 1 моля газа от объема V
1
до объема V
2
при температуре Т, ес-
ли уравнение состояния газа )1(
V
B
RTpV .
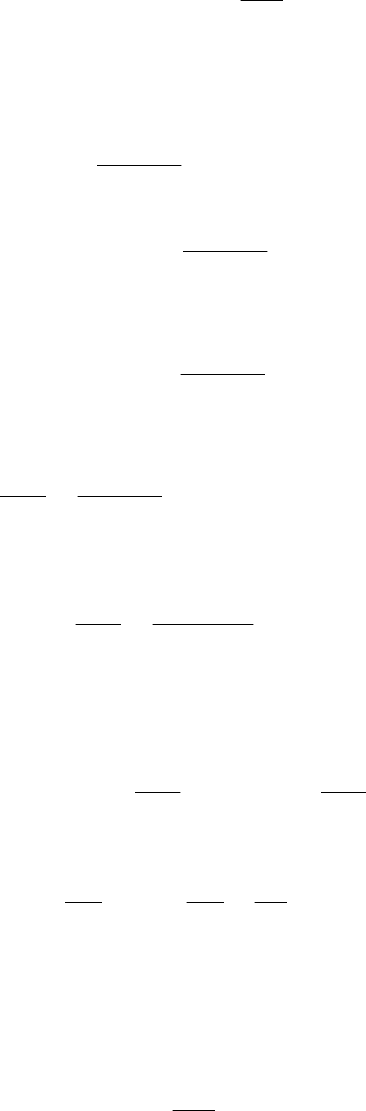
52
Решение. Из уравнения (1.48):
dp
V
dT
S
dG
при изотер-
мическом расширении получим:
.V
p
G
илиdpVGd
T
T
(а)
Запишем в дифференциальной форме данное в условии урав-
нение состояния газа, предварительно раскроем скобки:
.
,
2
dV
V
BRT
dpVdVp
V
BRT
RTpV
(б)
Выразим из этого уравнения
,
2
dV
V
BRT
dVpdpV
(в)
а из данного в условии уравнения состояния газа – давление,
,
2
V
BRT
V
RT
p
(г)
которое подставим в уравнение (в) и получим:
.
2
2
dV
V
BRT
V
RT
dpV
(д)
Это уравнение следует подставить в уравнение (а) для определения
изменения энергии Гиббса:
.
11
2ln
2
121
2
2
2
1
2
1
2
1
VV
B
V
V
RT
dV
V
RT
BdV
V
RT
dpVG
V
V
V
V
V
V
T
Для определения изменения энергии Гельмгольца воспользу-
емся выражением
dV
p
dT
S
dA
, которое при изотермическом
расширении имеет вид:
.p
V
A
илиdVpAd
T
(е)
Подставим в это уравнение из выражения (г) значение давле-
ния, после интегрирования получим:
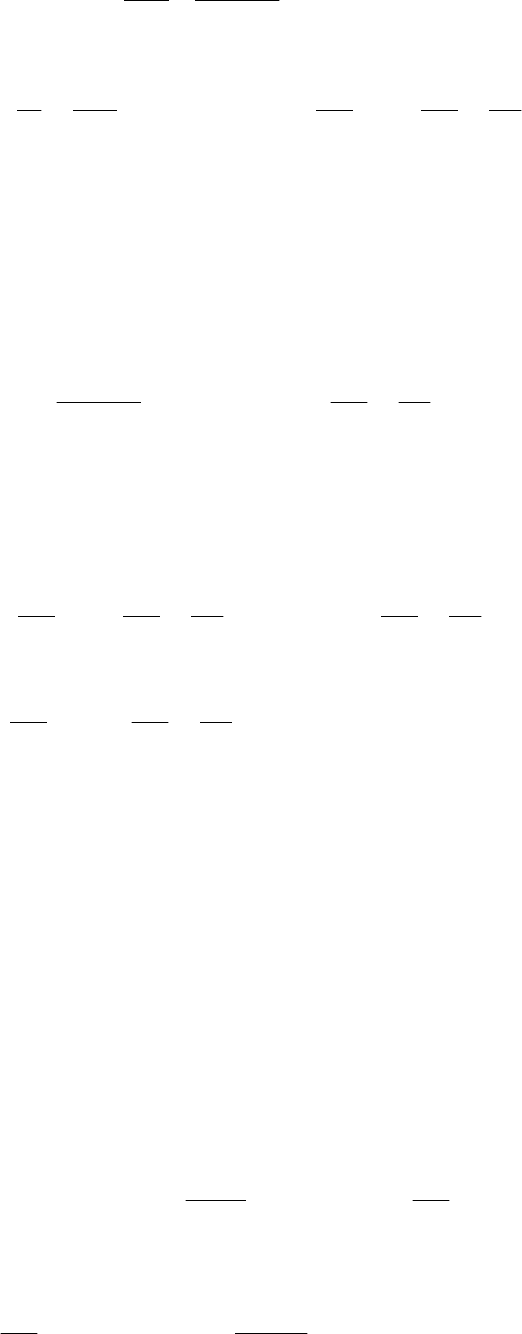
53
.
11
ln
1
121
2
2
2
2
1
2
1
2
1
VV
B
V
V
RTdV
V
B
V
RT
dV
V
BRT
V
RT
dVpA
V
V
V
V
V
V
T
(ж)
Выражение изменения энергии Гельмгольца можно использо-
вать для определения энергии Гиббса. Для этого воспользуемся
уравнением связи между термодинамическими потенциалами:
.VpARTnAG
Из заданного в условии задачи и выражения (б) получим:
.
11
12
2
2
1
VV
BRTdV
V
BRT
Vp
V
V
(з)
Тогда, после подстановки соответствующих значений величин
(ж) и (з) в уравнение изменения энергии Гиббса, будем иметь:
.
11
2ln
1111
ln
121
2
12121
2
VV
B
V
V
RT
VV
BRT
VV
B
V
V
RTG
T
Пример 23. Давление насыщенного пара над жидкой водой и
надо льдом при 268 Κ соответственно равны 421,7 и 401,7 Па. Рас-
считать изменение энергии Гиббса при переходе одного моля жид-
кой воды в лед при 268 Κ.
Решение. Процесс перехода одного моля жидкой воды в лед
проходит при постоянной температуре. Поэтому, уравнение (1.48)
VdP
SdT
dG
при T = const имеет вид:
,ln
,
1
2
2
1
2
1
P
P
nRTdP
P
nRT
VdPG
тогдаVdPdG
P
P
P
P
T
T
n = 1моль, поэтому:
.54,108
7,401
7,421
ln26831,8ln
1
2
Дж
P
P
RTG
T

54
Пример 24. Рассчитать изменение энергии Гиббса при изоба-
рическом нагревании 1 моль газообразного хлороформа от 310 до
360 Κ, пользуясь справочными данными и считая температурный
коэффициент энергии Гиббса величиной постоянной в этом интер-
вале температур.
Решение. Температурным коэффициентом энергии Гиббса яв-
ляется мера изменения энергии Гиббса от температуры, т. е. умень-
шение энтропии: .S
T
G
P
Согласно условию задачи, темпера-
турный коэффициент в интервале 310 Å 360 Κ является величиной
постоянной.
Определим из справочника значения
0
298
S и
)(298 газ
P
C для хло-
роформа:
./7,65;/6,295
298
0
298
KмольДжCKмольДжS
газ
P
При изменении состояния хлороформа от 298 до 310 Κ абсо-
лютное значение энтропии станет равным:
./67,304
298
310
ln7,656,295
.
298
310
ln
0
310
0
298
310
298
0
298
0
310
KмольДжS
CSdT
T
C
SS
p
газp
Изменение энергии Гиббса определим, решая уравнение:
./6,1523331036067,304
,
,
0
12
0
2
1
мольДжG
TTSdTSG
dT
S
dG
T
T
T
Пример 25. При температуре кипения 329,7 Κ и давлении
1,0133∙10
5
Па испаряется 1 моль ацетона, а затем изотермически
расширяется до давления 1,0133∙10
4
Па. Определить изменение
энергии Гиббса в этом процессе.
Решение. Изменение энергии Гиббса при указанных условиях
можно определить по уравнению:
,
2
1
GGG

55
где
1
G
- изменение энергии Гиббса для процесса фазового перехо-
да (испарение), при постоянной температуре 0
1
G ;
2
G
– изме-
нение энергии Гиббса в результате изотермического расширения.
Это значение энергии Гиббса определим из уравнения (1.48), учиты-
вая, что процесс расширения протекает при
const
T
, тогда:
.6300
100133,1
100133,1
ln7,32931,81
;ln
,
;
,
0
,
5
4
2
1
2
2
1
2
1
ДжG
p
p
nRTdp
p
nRT
VdpG
V
p
G
иV
p
G
Vdp
dG
dT
Vdp
SdT
dG
p
p
p
p
TT
Общее изменение энергии Гиббса будет равно:
.630063000
2
1
ДжGGG
Пример 26. Определить возможность получения серебра при
стандартных условиях Т = 298 Κ и Р = 1,013∙10
5
Па по следующей
реакции:
.22
2 твтвтвтв
PbClAgAgClPb
Как изменится вероятность прохождения реакции в указанном
направлении при повышении температуры до 700 Κ? Считать, что в
указанном интервале температур теплоемкость участников реакции
не изменяется.
Решение. Для определения возможности получения серебра,
согласно предложенной реакции и условий ее протекания, следует
определить химическое сродство (изменение энергии Гиббса) реа-
гирующих веществ.
По уравнению (1.62):
000
T
T
T
STHG определим измене-
ние энергии Гиббса, где:
.;
298
0
298
0
298
0
298
0
dT
T
C
SSdTCHH
T
pr
rTr
T
prrTr
Изменения энтальпии, энтропии и теплоемкости для всех уча-
стников реакции с учетом стехиометрических коэффициентов и аг-

56
регатного состояния при Т = 298 Κ согласно справочных данных,
равно:
./5,18
;/19,36
;106260
298
0
298
0
298
KмольДжC
KмольДжS
ДжH
pr
r
r
Химическое сродство (изменение энергии Гиббса) при 298 Κ,
определенное по уравнению (1.62), составляет:
.9547519,36298106260
0
298
0
298
0
298
ДжSTHG
rrr
Отрицательное значение энергии Гиббса указывает, что при
стандартных условиях реакция протекает в прямом направлении,
следовательно, получение серебра термодинамически возможно.
Для ответа на вопрос о влиянии температуры на возможность
получения серебра, определим значения следующих термодинами-
ческих величин по вышеприведенным уравнениям:
.7730599,51700113697
./99,5185,05,1819,36
298
700
ln
;1136972987005,18106260
298700
0
700
0
700
0
700
298
0
298
0
700
298
0
298
0
700
Дж
STHG
KмольДж
CSS
Дж
CHH
rrr
prrr
prrr
Согласно полученным результатам с ростом температуры
0
700
0
298
GG
rr
. Это означает, что глубина превращения в процес-
се восстановления хлорида серебра до металлического серебра с
увеличением температуры уменьшается.
Пример 27. Определить изменение энергии Гиббса при сжатии
1 кмоль жидкого толуола от 1,013∙10
5
Па до 10,13∙10
5
Па при 291 Κ.
Сжимаемостью в указанном интервале давлений пренебречь (V =
const). Плотность толуола 867 кг/м
3
.

57
Решение. Энергию Гиббса при постоянных T и V определяем
по уравнению (1.51):
Vdp
dG
, которое после интегрирования при-
нимает вид:
.968901010013,11013,10
856
1014,92
,
355
3
12
ДжG
ppVG
ЗАДАЧИ
1.40. Определить
G
A
H
S
W
Q
,
,
,
,
,
при обратимом процес-
се парообразования 1 моль воды при р = 0,7 бар (1 бар = 10
5
Па).
Теплоемкость воды С
р
= 4,184 Дж/(г∙Κ), теплоемкость пара
./2255;/102,90079,086,36
026
гДжHKмольДжТТС
р
Ответ: 41082 Дж/моль; 3013 Дж/моль; 113,308 Дж/(моль∙Κ);
410820Дж/моль; -3013 Дж/моль; 0.
1.41. Определить изменение энергии Гиббса при изотермиче-
ском переходе 1 моль растворенного вещества от концентрации рав-
ной 0,05 моль/л к концентрации равной 0,01 моль/л при 17
0
С.
Ответ: -3876,1 Дж/моль.
1.42. При 298 Κ энтропия ромбической серы равна 31,88, а эн-
тропия моноклинной серы 32,55 Дж/(моль∙Κ). Теплоты сгорания со-
ответственно равны -296813 и -297148 Дж/моль. Определить ΔG
0
и
ΔA
0
для процесса:
.
моноклромб
SS
Определить, какая форма се-
ры будет более устойчивой.
Ответ: 135,2 Дж/моль.
1.43. Для реакции
23
COFeOFeCO
изменение энергии
Гиббса как функция температуры определятся уравнением:
.10862,510426,48ln28,4802,12673626
15230
TTTTTG
T
r
Определить
0
500
H и
0
500
S .
Ответ: 88002 Дж; 175,94 Дж/Κ.
1.44. Вычислить стандартное изменение энергии Гиббса при
298 Κ для реакции
58
твтвтвтв
CdClAgAgClCd
2
22
по стандартным значениям изменения энтальпий образования и аб-
солютных энтропий химических соединений.
Ответ: - 122520 Дж.
1.45. Определить стандартное изменение энергии Гиббса по
стандартным значениям изменений энтальпий образования и абсо-
лютных энтропий химических соединений при 298 Κ для реакции в
газовой фазе:
.3
266126
HHCHC
Определить для этой же реакции при 500 Κ изменение энергии
Гиббса по методу Темкина-Шварцмана, учитывая зависимость теп-
лоемкости от температуры реагирующих веществ.
1.46. Изменение энергии Гиббса при 298 K и давлении 1 бар
равно
ДжG 67885
0
298
1
для реакции
.65
1252 г
НСНС
Как изменится энергия Гиббса равновесной системы при мгно-
венном повышении давления до 10 бар?
Ответ:
.96423
2
0
298
ДжG
1.47. Для реакции возгонки золота
гтв
AuAu
известны
значения:
.1019,568,23;/92,20
;/338904;/378652
3
0
298
0
298
ТСмольДжС
мольДжGмольДжН
твАигАи
РР
В
ывести уравнение зависимости
0
T
G от температуры и определить
.
0
1000
G
Ответ: .43.1531059.2lg351.6379706
230
TTTTG
T
1.48. Вычислить изменение энергии Гиббса, сопровождающее
изотермическое сжатие 5 л кислорода, взятого при 0
0
С и 0,1 бар, до
давления 1 бар.
Ответ: 116,44 Дж.
59
1.3. Химическое равновесие
Состояние химического равновесия определяется следующими
признаками:
если система находится в состоянии равновесия, то состав ее
с течением времени при постоянных внешних условиях не изменя-
ется;
если система, находящаяся в состоянии равновесия, будет
выведена из этого состояния вследствие внешних воздействий, то с
прекращением их действия она возвратится к прежнему состоянию;
при постоянной температуре и давлении скорости прямой и
обратной реакций в результате изменения концентраций реагирую-
щих веществ постепенно выравниваются, и в момент достижения
химического равновесия становятся равными друг другу;
в состоянии равновесия количества всех веществ участвующих
в реакции не являются независимым параметром, а связаны между
собой законом действия масс: при постоянной температуре отно-
шение произведений равновесных концентраций (или равновесных
парциальных давлений) продуктов реакции к произведению равно-
весных концентраций (или равновесных парциальных давлений) ис-
ходных веществ есть величина постоянная.
Исследования показали, что теоретически все химические ре-
акции являются обратимыми. Обратимость химических реакций
означает, что если есть возможность протекания реакции слева на-
право между исходными веществами, то обязательно в любой мо-
мент времени реакции есть возможность взаимодействия между
продуктами с получением исходных веществ.
Понятие обратимости химических реакций отличается от по-
нятия термодинамической обратимости и необратимости процесса.
Обратимость химической реакции означает, что она идет с опре-
деленной скоростью и, конечно, представляет собой термодинами-
ческий необратимый процесс. Любая химическая реакция проходит
до положения химического равновесия, которое является динамиче-
ским равновесием.
Рассмотрим в общем виде реакцию, протекающую в газовой
фазе, при постоянном давлении и постоянной температуре:
dD
cC
bB
aA
Допустим, что в момент приготовления реакционной смеси
имеются все реагирующие вещества (исходные и продукты). Обо-

60
значим, n
0i
– начальное число молей реагирующих веществ; n
i
- ко-
нечное число молей реагирующих веществ. При протекании реак-
ции слева направо количества исходных веществ будут уменьшать-
ся, а количества продуктов реакции – увеличиваться. Изменение
количества реагирующего вещества в процессе реакции определяет-
ся выражением:
.
,
0
0
ii
ii
nnn
nnn
i
i
(1.67)
В каждый момент времени система характеризуется опреде-
ленным набором концентраций реагирующих веществ и продуктов
реакции. Поэтому, необходимо дать количественную оценку изме-
нения состава и зависимости от времени течения процесса, характе-
ризующие степень его завершенности. В качестве меры, опреде-
ляющей какая бы доля исходных веществ прореагировала, был вве-
ден параметр
, изменяющийся от нуля до единицы. Его называют
химической переменной, координатой реакции, числом пробега
или степенью продвижения реакции.
Установлено, что изменения количеств реагирующих веществ
(в молях) пропорциональны стехиометрическим коэффициентам ре-
акции и связаны между собой соотношением:
).(,
,
ii
i
i
D
C
BA
n
n
d
n
c
n
b
n
a
n
(1.68)
Подстановка полученного соотношения в уравнение (1.67), позволя-
ет количество молей реагирующего вещества представить в виде
).(
,
0
ddn
nn
ii
ii
i
(1.69)
Если выведенное соотношение (1.69) подставить в уравнение
изменения термодинамического потенциала, характеризующего
равновесное состояние системы при постоянном давлении и темпе-
ратуре, то получим:
,0
ddndG
i
i
i
i
Реакция идет,
0
d
, поэтому, при химическом равновесии соблю-
дается условие:
0)(
i
i
. (1.70)
