Лесникова Н.П. Физическая химия. Самостоятельное решение задач по химической термодинамике, электрохимии и кинетике
Подождите немного. Документ загружается.


91
Для нахождения константы (постоянной) интегрирования не-
обходимо знать константу равновесия хотя бы при одной темпера-
туре, например при 298 Κ. Воспользуемся уравнением изотермы:
.87,12
29831,8
73408
lg
7340817,131298112510298
0
298
298
0
298
0
298
0
298
TR
G
K
ДжSHG
r
p
rrr
Определим константу интегрирования В:
.86,7
29831,83,22
1005,6
31,83,22
2981095,6
298lg
31,8
05,2
29831,83,2
115457
87,12
3,22
3,22
lg
3,2
lg
2
53
2
0
298
TR
c
T
R
b
T
R
a
TR
H
KB
p
Составляем уравнение зависимости константы равновесия от темпе-
ратуры (температурный ряд константы):
.86,7
10158,0
1081,0lg247,0
7,6031
lg
2
5
3
T
TT
T
K
p
Пример 40. Определить тепловой эффект реакции
г
ОНСННСО
32
2
, (1)
если известны зависимости константы равновесия от температуры
для реакций:
ОНСНСООНСНН
332
22
(2)
.;43,5
3149
lg
1
1,1,
атмK
T
K
pp
СООНСНСООНСН
г 33
(3)
.;61,6
1835
lg
1
2,2,
атмK
T
K
pp
Решение. Выводим для реакции (1) зависимость константы
равновесия
xp
K
,
от температуры. Для этого складываем уравнения
(2) и (3). Для определения
xp
K
,
производим аналогичное арифмети-
ческое действие со стандартными изменениями энергии Гиббса:

92
.lg3,2:3
:lg3,2:2
;lg3,2:1
,
0
2,
0
2
1,
0
1
xpx
p
p
KRTGреакциидля
KRTGреакциидля
KRTGрекакциидля
Из этих уравнений следует, что ,
0
2
0
1
0
GGG
x
или
.lg3,2lg3,2lg3,2
2,1,, ppxp
KRTKRTKRT
Преобразуем, полученное выражение и продифференцируем
его по температуре:
.
49843,2
04,12
4984
3,2
ln
;04,12
4984
lglglg
2
,
2,1,,
T
TdT
d
dT
Kd
T
KKK
xp
ppxp
Тепловой эффект реакции определим из уравнения изобары
(1.101)
.9525931,8
49843,2
ln
2
2
2
,
0
ДжT
T
RT
dT
K
d
H
xp
r
Пример 41. Вычислить константу равновесия по методу Тем-
кина – Шварцмана для реакции в газовой фазе при 1200 K
,22
2
2
4
НСОСОСН
если для этой реакции известны значения:
./1020,7
;/10614,8;/10117,1
;/1078,54;/79,49
;/2,256;/247350
9
66
3
0
298
0
298
KмольДжd
KмольДжcKмольДжc
KмольДжbKмольДжa
KмольДжSмольДжH
rr
Полученное значение константы равновесия сравнить с табличным
.5407,3lg
p
K
Решение. Уравнение для определения константы равновесия
по методу Темкина – Шварцмана имеет вид:
.
3,2
1
3,23,2
lg
32
210
0
298
0
298
MdMc
McMbMa
R
S
TR
H
K
rr
p

93
По таблицам Темкина – Шварцмана (в справочнике) находим
значения:
.10137,0;10318,0
;10203,0;10339,0;641,0
9
3
5
2
6
2
3
10
ММ
МММ
Подставим в уравнение константы равновесия все известные
теперь величины:
.5006,3
986,0739,2
227,057,1893,31
31,83,2
1
31,83,2
2,256
120031,83,2
247350
lg
p
K
Тогда,
.10473,3;10166,3
33
)1200(
экспpp
KK
Расхождение между рассчитанными и табличными данными
составляет:
%.8,8
10473,3
10166,310473,3
3
33
Пример 42. Вычислить по приведенным энергиям Гиббса кон-
станту равновесия газофазной реакции при 1000
0
С:
2
2
4
22 НСОСОСН
.
Решение. Из справочника для всех веществ участвующих в ре-
акции выписываем значения
T
HG
0
0
0
и
0
0
H при 1000 и 1500 K. В
таблице приведены значения
T
HG
0
0
0
при 1000 и 1500 K. В усло-
вии задачи требуется рассчитать константу равновесия при 1000
0
С,
т.е. при 1273 K; необходимые значения находим интерполяцией:
Реагенты
Kмоль
Дж
T
HG
i
,
0
0
0
мольДжH
i
/,
0
,0
СО 210939 -113880
Н
2
143483 0
СН
4
211123 -66965
СО
2
235990 -393229
94
Для данной реакции изменение
T
HG
0
0
0
и
0
0
H равно:
.233374393229669650
113880222
0
0
0
0
0
0
0
0
0
0
242
моль
Дж
ННННН
СОСННСО
./261731235990
21112314348322109392
22
2
42
0
0
0
0
0
00
0
00
0
00
0
0
KмольДж
T
HG
T
HG
T
HG
T
HG
T
HG
CO
CHHCO
Ра
ссчитаем константу равновесия по уравнению:
.1031,110013,110274,1
10274,1;105,4
12731,19
233374
1,19
261731
lg
ln
1454
24
0
0
0
0
0
ПаK
атмKK
T
H
T
HG
KR
p
pp
p
ЗАДАЧИ.
1.61. Рассчитать стандартную энтальпию реакции, для которой
константа равновесия:
а) увеличиться в два раза;
б) уменьшиться в два раза при изменении температуры от 298
Κ до 308 Κ.
Ответ: ./0,53;/0,53
00
молькДжHмолькДжH
r
r
1.62. Оксид ртути диссоциирует по реакции
.22
2 ггтв
OHgHgO
При 420
0
С давление газов равно 5,16·10
4
Па, а при 450
0
С 10,8·10
4
Па. Определить константы равновесия при этих температурах и эн-
тальпию диссоциации на моль HgO.
95
Ответ:
./77,2;1794,0;0196,0
0
450420
молькДжHKK
rpp
1.63. Зависимость константы равновесия газофазной реакции
844263
2 НСНСНС
от температуры между 300 Κ и 600 Κ описывается уравнением
.
1051,11088
04,1ln
2
5
T
T
K
Определить
000
,, SHG
r
r
r
при 400 Κ.
Ответ:
K
моль
Дж
S
молькДжHмолькДжG
r
rr
5,16
;/77,2;/37,9
0
00
1.64. При диссоциации NH
4
Cl при 427
0
С давление пара со-
ставляет 608 кПа, при увеличении температуры до 459
0
С давление
пара возрастает до 1115 кПа. Определить константу равновесия и
000
,, SHG
r
r
r
(все функции при 427
0
С). Принять, что пар ведет
себя как идеальный газ, а
00
, SH
r
r
не зависят от температуры в
указанном интервале.
Ответ:
.249;/5,161
;/9,12;24,9
00
0
KмольДжSмолькДжH
молькДжGK
r
r
rp
1.65. Для реакции
)(2)()(2)(4
3
гггг
НСООНСН
зависи-
мость константы равновесия от температуры выражается уравнени-
ем
.4,111096,118,8
9876
3
TIgT
T
IgK
p
Определить тепловой эффект данной реакции при 1000 Κ.
Ответ: 219,33 кДж.
1.66. Зависимость константы равновесия от температуры для
реакции
23)(22
3462 ONHOHN
г
выражается уравнением
2,575,1
66250
TIg
T
KIg
p
.

96
Определить тепловой эффект и стандартное изменение энергии
Гиббса при 2000 Κ.
Ответ: 1228,8 кДж; 1686,6 кДж.
1.67. Пользуясь данными справочника, рассчитайте по методу
Темкина-Шварцмана константу равновесия К
Р
реакции
2
22 CINONOCI
при 1000 Κ.
1.68.Вычислить константу равновесия реакции при 1000 Κ
кДжSOOSO 5,18822
322
,
если при 900 Κ Κ
Р
= 2,3¶10
-7
Па
-1
.
Ответ: 1,848·10
-8
Па.
1.69. Константа равновесия реакции
)(222
22
г
ОНОН
мо-
жет быть выражена уравнением
,08,11065,9335,1
24900
5
TTIg
T
KIg
c
а для реакции
)(22
2
г
HCICIH
:
.16,244,0
9585
TIg
T
KIg
c
Определить константу равновесия реакции
222
224 СIOHOHCI
при 800 K , а также тепловой эффект при
постоянных объеме и давлении и той же температуре.
Ответ: lg K
c
= 2,68; – 111,45 кДж ; – 118,1 кДж.
1.70. Зависимость константы равновесия от температуры для
реакции ОНСОНCO
222
выражается уравнением
113,01072,9917,0
2117
4
TTIg
T
KIg
p
.
Рассчитать степень превращения углекислого газа при 1000 Κ,
если в замкнутый сосуд постоянного объема введено 44 кг СО
2
и 2
кг Н
2
.
1.71. Зависимость константы равновесия от температуры для
реакции СОСОС
т
2
2)(
выражается уравнением

97
,67,210083,1475,2
8750
3
TIgT
T
KIg
p
а для реакции
ОНСОНСО
2
2
2
уравнением
113,01075,9917,0
2117
4
TIgT
T
KIg
p
.
Вывести уравнение зависимости IgK
p
от Т для реакции
22)(
НСООНС
т
и определить тепловой эффект этой реакции
при 900 Κ.
Ответ: .55,136
0
900
кДжH
r
1.72. Для реакции
2)(2)(
НСООНС
гт
зависимость кон-
станты равновесия от температуры выражается уравнением
565,61011,057,1
6630
3
TTIg
T
KIg
p
.
Определить тепловой эффект реакции при 1000 Κ и равновес-
ный состав газовой фазы при 1000 Κ под общим давлением
1,013ּ10
5
Па.
Ответ: 137,75 кДж/моль; 46,21; 46,21; 7,58 мол.%.
1.73. При нагревании СО
2
под давлением 1,013·10
5
Па до 1400
Κ обнаруживается термическая диссоциация на 1,5·10
-2
%, а при
температуре 1498 Κ и том же давлении – на 4,7·10
-2
%. При этом ус-
танавливается равновесие
22
22 СООСО
. Определить тепловой
эффект реакции в этом температурном интервале и степень диссо-
циации СО
2
при 1478 Κ и 1,013·10
5
Па.
1.74. Константа равновесия Κ
Р
реакции
)(22
)(
газ
ОНСаООНСа
при 772 Κ равна 0,4·10
5
Н/м
2
, а при 807 Κ равна 0,8·10
5
Н/м
2
.
Определить константу равновесия этой реакции при 750 Κ.
Ответ: 0,250·10
5
Н/м
2
.
1.75. Определить тепловой эффект реакции, степень диссоциа-
ции SO
2
CI
2
и химическое сродство при 400 Κ и 1,013·10
5
Па, если
для реакции
2222
CISOCISO
98
2,275,1
2250
IgT
T
IgK
p
.
Ответ: .96,0;84,44
0
400
кДжH
r
1.76. Определить температурный коэффициент константы рав-
новесия и возможность протекания реакции при 1000 Κ, а также
0
T
r
S , если для реакции
232
5464 ONHOHNO
7,875,1
47500
TIg
T
KIg
p
.
1.77. Для реакции
)(422)(
22
гт
НСНC
)1(,04,1310025,1589,5
2413
3
TTIg
T
KIg
p
а для реакции
62242
НСННС
)2(.344,2107668,0961,2
6366
3
TTIg
T
KIg
p
Вывести уравнение )(TfKIg
p
для реакции
)3(.622)(
32 HCHC
т
Определить константу равновесия Κ
Р
и тепловой эффект реак-
ции (3) при 1000 Κ.
Ответ: – 112,4 кДж.
1.78. По справочным данным о приведенном изобарно-
изотермическом потенциале
T
HG
0
0
0
и значении
0
0
H рассчитать
константу равновесия при 1000 Κ для реакции
.2
2
2
NOON
Ответ: .107,1
9
p
K

99
ГЛАВА 2. ЭЛЕКТРОХИМИЯ
2.1. Активность электролитов
Электролитами называются вещества, способные в рас-
творе или в расплаве самопроизвольно частично или полностью
распадаться на ионы - заряженные частицы, способные к само-
стоятельному существованию.
Все растворы электролитов обнаруживают отклонения от зако-
нов разбавленных растворов. Практика показала, что отношение по-
вышения температуры кипения (или понижения температуры замер-
зания) электролита и неэлектролита при одинаковых концентрациях
растворов обычно значительно больше единицы. Аналогично, боль-
ше единицы и отношение понижения давления насыщенного пара,
осмотическое давление растворов электролитов и неэлектролитов.
Поэтому, во все формулы, относящиеся к этим явлениям, в
приложении к растворам электролитов вводится изотонический ко-
эффициента i (коэффициент Вант-Гоффа). Этот коэффициент
учитывает увеличение соответствующих свойств растворов элек-
тролитов по сравнению с растворами неэлектролитов.
.
.
.
.
.
.
..
.
.
.
неэл
эл
неэл
эл
неэл
к
элк
неэл
з
элз
р
р
Т
Т
Т
T
Значение изотонического коэффициента для раствора электро-
лита значительно больше единицы Вант–Гофф объяснил ростом
общего числа частиц электролита при диссоциации его молекул на
ионы. Поэтому для растворов электролитов осмотическое давление
равно π = icRT.
Диссоциация молекул на ионы является неполной, т.е. не все
молекулы электролита, а лишь их доля α (степень диссоциаци)
распадается на ионы. Доля молекул, равная (1 – α), остается недис-
социированной. Если при диссоциации одной молекулы электроли-
та образуется ν ионов, то концентрация ионов в растворе равна ναс;
концентрация недиссоциированных молекул равна (1 – α) с. Связь
между степенью диссоциации α, числом образовавшихся ионов ν и
коэффициентом Вант – Гоффа ί выражается уравнением:
)1(1
i
(2.1)
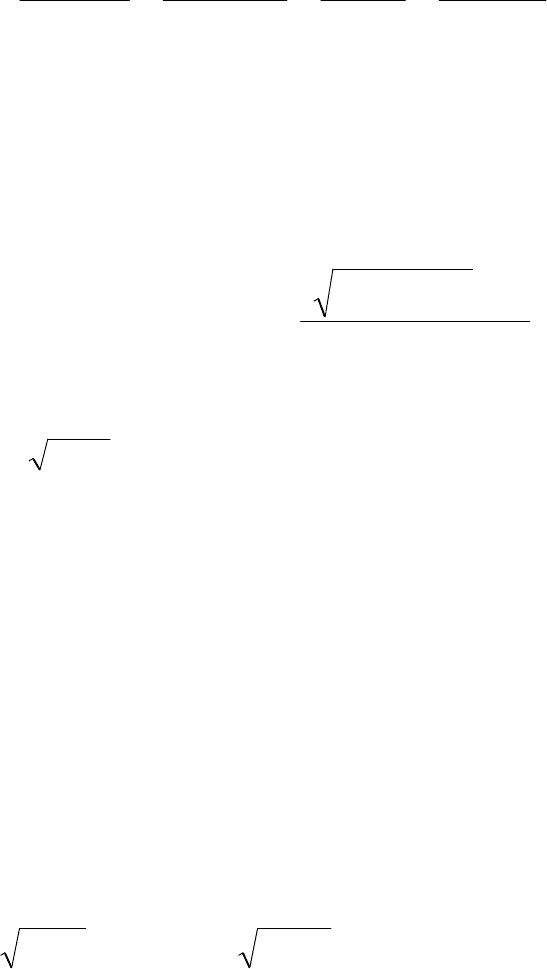
100
Поскольку,
,
0
,
1
то i > 1, это объясняет, почему колли-
гативные свойства растворов электролитов отличаются от свойств
растворов неэлектролитов.
К процессу электролитической диссоциации применим закон
действия масс. Так, если в результате диссоциации молекулы элек-
тролита МА получается один катион и один анион, т.е.
.][][),1(][, cAMcMAтоAMMA
zzzz
Константа электролитической диссоциации Κ будет равна:
.
)1()1()1(][
][][
22
V
c
c
cc
MA
AM
K
(2.2)
Обратная величина молярной концентрации V = 1/c, называет-
ся разведением; уравнение (2.2) соответствуют закону разведения
Оствальда.
Константа диссоциации постоянная для данного электролита
величина. Из решения квадратного уравнения, учитывая, что
.
> 0,
получим значение степени диссоциации электролита:
.
2
)4(
0
2
2
c
KKcK
KKc
(2.3)
Если α→1, электролит считается полностью диссоциирован-
ным. При малых константах диссоциации и при не очень низких
концентрациях, cK /
.
Если электролит имеет несимметричный валентный тип или
имеется смесь электролитов, то математические соотношения, опи-
сывающие закон действующих масс, согласно теории Аррениуса, и
вытекающие из них следствия усложняются
Теория Аррениуса очень широко применяется к объяснению
закономерностей в различных реакциях с участием кислот и основа-
ний. Предполагается, что реакция нейтрализации всегда сводится к
взаимодействию ионов Н
+
и ОН
-
и в разбавленных растворах силь-
ных кислот и оснований должна характеризоваться постоянством
теплового эффекта независимо от природы кислоты и щелочи. Из
понятий о константе диссоциации кислоты Κ
А
и основания Κ
В
было
получено
,lg;;
HpHcKOHcKH
BA
(2.4)
где – логарифм концентрации ионов водорода, взятый с обратным
знаком, называется рН раствора (водородный показатель).
