Кубота Н. Твердые ракетные топлива и взрывчатые вещества
Подождите немного. Документ загружается.

121
Гл а в а 5
Горение кристаллических и полимерных
материалов
5.1 Горение кристаллических материалов
5.1.1 Перхлорат аммония (ПХА)
5.1.1.1 Термическое разложение
Были выполнены экспериментальные исследования термического разложе-
ния и процессов горения ПХА и их детальные механизмы неоднократно рассмат-
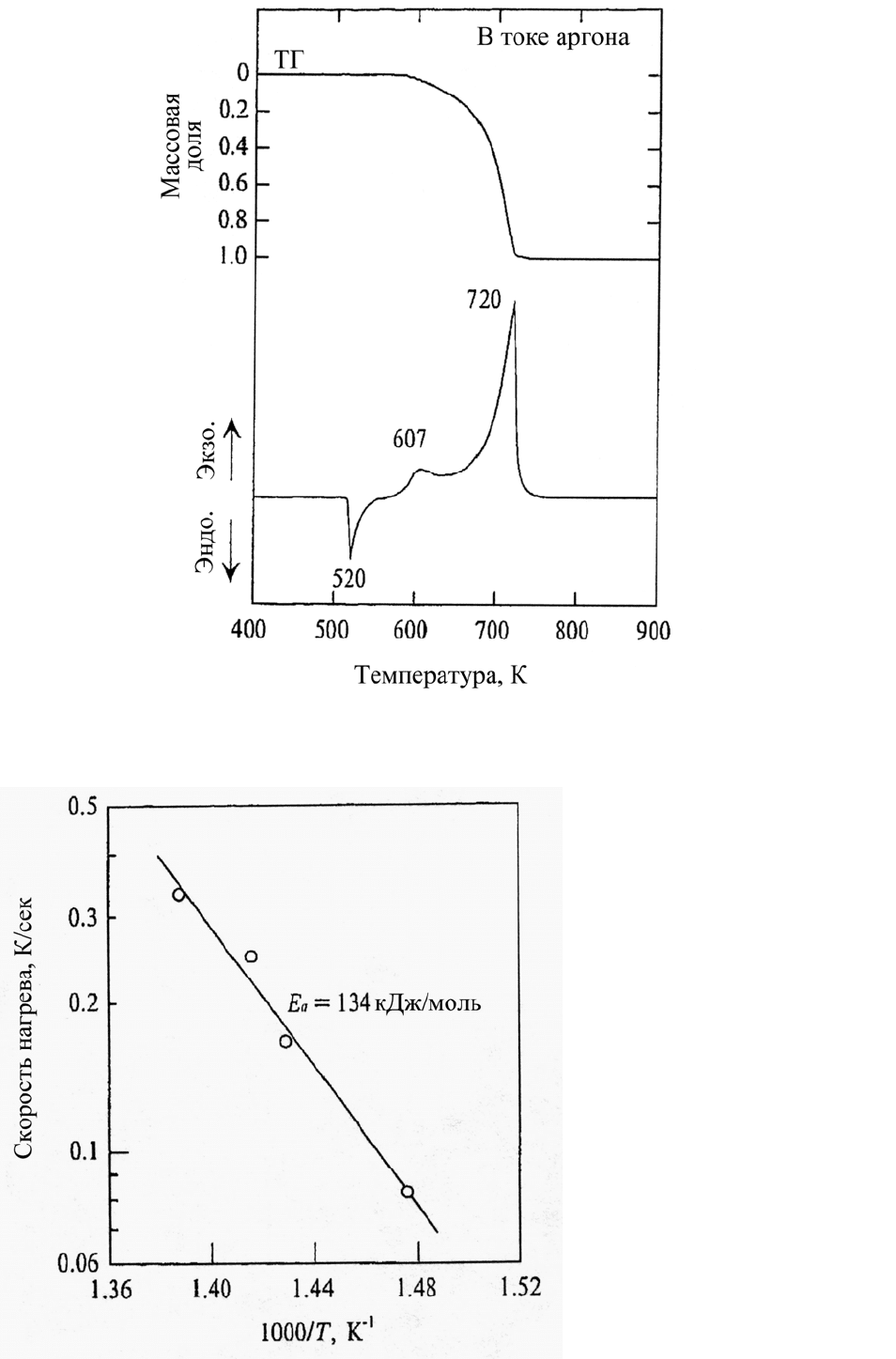
ривались [1-12]. На рис. 5.1 показано термическое разложение ПХА, полученное с
помощью дифференциального термического анализа (ДТА) и термогравиметрии
(ТГ) при скорости нагрева 0,33 К/с. При 520 К наблюдается эндотермический пик,
который связан с фазовым переходом орторомбической
структуры кристалла в
кубическую, при этом теплота реакции составляет –85 кДж/кг без потери массы.
Экзотермическая реакция имеет место между 607 и 720 К, сопровождается поте-
рей массы и протекает по следующей схеме [1, 2]:
NH
4
ClO
4
→NH
3
+ HClO
4
HClO
4
→HCl + 2O
2
При этом выделяется избыточный кислород, являющийся окислителем. Эк-
зотермический пик смещается в направлении более высоких температур при по-
вышении скорости нагрева.
На рис. 5.2 представлена зависимость обратной температуры от скорости
нагрева; изображенная прямая линия определяет энергию активации для экзотер-
мической реакции газификации. Энергия активации составляет 134 кДж/моль.
Однако реакция разложения включает процессы
сублимации и плавления, кото-
рые не могут быть идентифицированы с помощью данных ДТА и ТГ. Диссоциа-
тивная сублимация происходит тогда, когда скорость нагрева достаточно медлен-
ная по сравнению со скоростью нагрева при нормальном горении [5]. Этот про-
цесс сублимации является эндотермическим в пределах 2,1 MДж/кг и является ре-
акцией нулевого порядка
относительно давления. Плавление ПХА происходит в
более высокотемпературной зоне, причем при высокой скорости нагрева, превы-
шающей 725 К.
122
Рис. 5.1. Процесс термического разложения ПХА, измеренный методом
термогравиметрии (ТГ) и с помощью термического дифференциального анализа
Рис. 5.2. Определение
энергии активации разло-
жения ПХА
123
5.1.1.2 Скорость горения
Механизм разложения ПХА был впервые изучен Bircumshaw и Newman [3].
Они обнаружили, что ниже 570 К степень разложения составляет около 30%, а ос-
тавшиеся 70% представляют собой пористый твердый остаток, химически иден-
тичный начальному ПХА, который в дальнейшем не реагирует, когда давление и
температура очень низкие. Свыше 670 К твердого остатка не остается. Когда дав-
ление увеличивается, чистая
сублимация замедляется и реакция разложения уси-
ливается. Разложение ПХА включает первый этап: диссоциативную сублимацию
рыхло упакованного комплекса NH
3
HСlO
4
и получение газообразных NH
3
и
HСlO
4
. Горение частиц ПХА поддерживается за счет теплоты, генерируемой на
поверхности горения, и обратного переноса из газовой фазы теплоты, генерируе-
мой за счет реакции между молекулами HClO
4
и NH
3
. Реакция в газовой фазе яв-
ляется реакцией второго порядка, а адиабатическая температура пламени состав-
ляет 1205 К.
Скорость горения прессованного столбика ПХА как функция давления об-
суждалась Арденом [1], Леви и Фридманом [2]. Нижний предел давления при го-
рении ПХА составляет около 2,7 МПа, и скорость горения увеличивается при
увеличении давления выше этого нижнего
предела. Полнота реакции в газовой
фазе NH
3
/HClO
4
менее чем 100 мк при 100 МПа; она уменьшается с повышением
давления, время реакции обратно пропорционально давлению (МПа), выражен-
ному как 6,5×10
–7
/р секунд [8].
5.1.1.3 Структура волны горения
При горении прессованного столбика ПХА в газовой фазе создается высо-
кая температура пламени, обусловленная протеканием экзотермической реакции
между NH
3
и HClO
4
. Митани и Нииока измерили структуру газовой фазы над
убывающей поверхностью гранулы ПХА и обнаружили двухступенчатое пла-
мя [12]. Теплопроводность от пламени к горящей поверхности обеспечивает на-
грев твердой фазы от начальной температуры до температуры поверхности. На
горящей поверхности кристаллы ПХА переходят из орторомбической в кубиче-
скую форму. Этот эндотермический (80 кДж/кг)
переход происходил при темпе-
ратуре около 513 К. Танака и Бекстад сделали расчет структуры конденсирован-
ной фазы и газовой фазы ПХА, предполагая протекание 107 ступеней реакции и
наличие 32 газообразных продуктов [14]. Температура поверхности горения и
толщина расплавленного слоя были также рассчитаны как функции давления. Ус-
тановили, что энергия активации реакции на поверхности составляет примерно
63 кДж моль
–1
, а показатель степени n в законе скорости горения ~ 0,77 при дав-
лении между 2,7 и 10 МПа [14].
5.1.2 Нитрат аммония (НА)
5.1.2.1 Термическое разложение
Нитрат аммония плавится при 443 К и начинает газифицировать при темпе-
ратуре выше 480 К. Процесс разложения НА зависит от температуры. При низких
температурах (около 480 К) процесс газификации НА является эндотермически
(–178 кДж/моль) обратимой реакцией, которую можно представить [15]
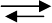
124
NH
4
NO
3
NH
3
+HNO
3
Процесс разложения смещается в сторону экзотермической (37 кДж/моль)
реакции газификации по мере увеличения температуры:
NH
4
NO
3
→N
2
O +2H
2
O
и полная реакция разложения НА может быть представлена как
NH
4
NO
3
→N
2
+2H
2
O+1/2O
2
Эта реакция является сильно экзотермической (119 кДж/моль) и в результа-
те ее выделяются молекулы кислорода, действующие как окислитель. Хотя вос-
пламенение НА довольно трудно из-за протекания эндотермической реакции на
начальной стадии, НА становится легко воспламеняемым в области высоких дав-
лений и детонационноспособным при нагреве выше 550 К. Кроме того, характе-
ристики
воспламеняемости НА зависят от примесей и добавок.
5.1.3 Октоген
5.1.3.1 Термическое разложение
Детальный обзор литературы и обсуждения термического разложения окто-
гена был сделан Боггсом [16], и общая картина процесса разложения октогена
может быть понята из этого обзора [15-24]. Когда октоген медленно нагревается,
то наблюдается одностадийный процесс потери массы: потеря массы начинается
при 550 К, а быстрая реакция газификации имеет место при 553 К. При темпера-
туре выше
553 К твердого остатка не остается. Наблюдаются два эндотермиче-
ских пика и один экзотермический: первый эндотермический пик при 463 К ха-
рактеризует фазовый переход из β- в δ-форму, а второй эндотермический пик при
550 К связан с фазовым переходом из твердого состояния в жидкое. Экзотермиче-
ский пик при 553 К вызван реакцией, сопровождающей
протекание газофазной
реакции.
Термически разложившийся образец октогена, который получается в ре-
зультате прерывания процесса разложения при условии 50% потери массы (нагрев
останавливается при 552 К, и затем образец охлаждается до комнатной темпера-
туры, 293 К), идентифицируется как перекристаллизованный материал [17]. Реак-
ция газификации термически разложившегося октогена начинается при 550 К, и
затем происходит быстрое разложение
при 553 К, что свидетельствует об эквива-
лентности термического процесса разложения с исходным октогеном. Однако эн-
дотермический пик при 463 К не наблюдается у частично разложенного октогена.
Результаты инфракрасного анализа (ИА) β, δ и частично разложенного октогена
показывают, что последний эквивалентен δ-форме октогена, что свидетельствует
о том, что эндотермическая реакция фазового изменения
при переходе из твердо-
го состояния в жидкое, наблюдаемая при 550 К, вызвана δ-формой октогена.
5.1.3.2 Скорость горения
Так как октоген является мелкокристаллическим веществом, то трудно из-
мерить его линейную скорость горения. Когда воспламеняется большой монокри-
сталл октогена (размером приблизительно 10х10х20 мм) электрически нагревае-
125
мой проволокой, которая касается вершины кристалла, кристалл октогена вос-
пламеняется и затем мгновенно разрушается на фрагменты из-за термических на-
пряжений, создаваемых в кристалле. В результате этого стабильное горение кри-
сталла невозможно и линейной скорости горения для октогена не существует, по-
тому что скорость теплопроводности от воспламененной поверхности внутрь кри-
сталла
выше, чем скорость поверхностной регрессии (скорость горения). Проис-
ходит разрушение структуры кристалла октогена вследствие воздействия терми-
ческих напряжений, вызванных разницей температур в кристалле.
Когда прессованная таблетка делается из порошкообразного октогена и
воспламеняется сверху, она горит устойчиво без разрушения. Термические на-
пряжения, создаваемые в объеме прессованной таблетки, релаксируют на поверх-
ности
раздела частиц октогена в таблетке. Кроме того, плотность прессованной
таблетки составляет, в лучшем случае, 95% от теоретической плотности октогена,
и термические напряжения, создающиеся в кристалле, абсорбируются в пустотах
между частицами октогена. Скорость горения образца октогена, сделанного из
прессованной таблетки, показана на рис. 5.3. Прессованная таблетка представляет
собой смесь частиц октогена β-формы, 33% которых
имели размер 20 микрон, а
67% – 200 микрон. Таблетки имели диаметр 8 мм и длину 7 мм, плотность –
1700 кг/м
3
, которая составляет 89% теоретической максимальной плотности (1900
кг/м
3
). Скорость горения таблеток октогена увеличивается линейно в логарифми-
ческих координатах: ln p от ln r. Показатель степени в законе скорости горения
составляет 0,66 при исходной температуре 293 К.
Рис. 5.3. Скорости горения октогена и триаминогуанидиннитрата,
свидетельствующие, что скорость октогена ниже, чем ТАГН

126
5.1.3.3 Газофазная реакция (Реакция в газовой фазе)
Общая реакция разложения октогена может быть записана в следующем ви-
де [18, 19]:
3(CH
2
NN0
2
)
4
→4NO
2
+4N
2
O+6N
2
+12CH
2
O
Так как двуокись азота довольно быстро реагирует с формальдегидом [16,
20, 25], то газофазная реакция может быть представлена следующим образом:
7NO
2
+5CH
2
O →7NO+3CO+2CO
2
+5H
2
O
и эта реакция является, вероятно, доминирующей реакцией и сразу же следует за
реакцией начального разложения. Реакция между NO
2
и СН
2
О является сильно эк-
зотермической и протекает быстрее, чем в случае реакции с другими газообраз-
ными компонентами.
Продукты, выделяющиеся в процессе реакций, показанных выше, на по-
следней стадии снова реагируют, то есть NO и NO
2
действуют как окислители, а
Н
2
и СО – как горючие. Реакции с участием NO и NO
2
могут быть представлены
[25]:
2NO+2H
2
→N
2
+ 2H
2
O
2NO+CO→N
2
+2CO
2
2N
2
O→2NO + N
2
Все реакции, включающие NO и N
2
О, протекают медленно и являются три-
молекулярными, поэтому скорость реакции является очень медленной при низком
давлении и увеличивается быстро по мере увеличения давления.
5.1.3.4 Структура волны горения и теплопередача
Типичные структуры пламени таблеток октогена показаны на рис. 5.4 как
функции давления.
Рис. 5.4. Фотографии пламени октогена при трех различных давлениях:
(а) 0,18 МПа; (b) 0,25 МПа и (с) 0,30 МПа
Тонкая светящаяся полоска пламени отстоит на некотором расстоянии от
горящей поверхности, а выше этой светящейся полосы образуется красноватое
пламя. Эта полоска пламени приближается к горящей поверхности по мере уве-
личения давления [17]. Когда давление менее 0,18 МПа, светящаяся
полоска пла-
127
мени выдувается из горящей поверхности, как показано на рис. 5.4 (а). По мере
увеличения давления полоска светящегося пламени быстро приближается к по-
верхности горения. Однако оно становится очень нестабильным выше поверхно-
сти горения, и образуется волнообразная полоса пламени в диапазоне давлений
между 0,18 и 0,30 МПа, как показано на рис. 5.4 (b). При дальнейшем увеличении
давления
выше 0,30 МПа светящаяся полоса пламени становится стабильной и
одномерной лишь выше поверхности горения, как показано на рис. 5.4 (с). Волна
горения октогена делится на три зоны: кристаллическую твердую фазу (зона I),
твердую или жидкую конденсированную фазу (зона II) и газовую фазу (зона III).
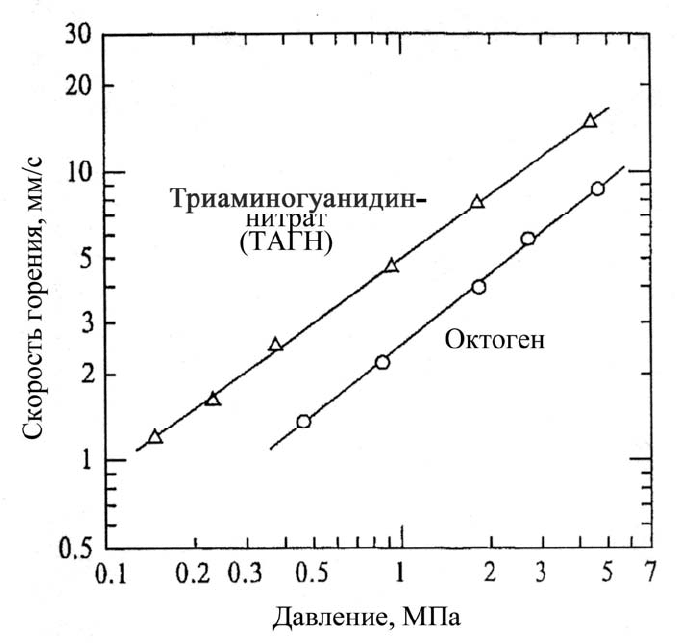
Схематичное представление процесса теплопередачи волны горения пока-
зано на рис. 5.5. В
зоне I температура увеличивается от начальной температуры Т
0
до температуры разложения Т
u
без реакции. В зоне II температура увеличивается
от Т
u
до температуры горящей поверхности Т
s
(на границе раздела конденсиро-
ванной и газовой фазы). В зоне III температура увеличивается быстро от Т
s
до
температуры светящегося пламени (полоса пламени на рис. 5.4). Так как реакци-
онная зона конденсированной фазы является очень тонкой (~0,1 мм), то Т
s
при-
близительно равна Т
u
.
Рис. 5.5. Модель теплопередачи волны горения энергетического материала
Тепловой поток, передаваемый обратно из зоны III в зону II, составляет
Λ
III
=
III
III
dx
dT
⎟
⎠
⎞
⎜
⎝
⎛
=λ , (5.1)
а тепловой поток, создаваемый в зоне II, Θ
II
равен
Θ
II
= ρ
I
rQ
II
, (5.2)
где Q
II
является теплотой реакции в зоне II. Уравнение теплового баланса на по-
верхности горения описывается следующим образом:
Θ
II
= ρ
I
rc
I
(T
S
- T
0
) – Λ
III
(5.3)
128
Температурный градиент в зоне III (dT/dx)
III
увеличивается по мере увели-
чения давления и описывается зависимостью (dT/dx)
III
~ p
0,7
. Однако Т
s
остается
относительно постоянной (~700 K) в диапазоне давлений между 0,1 и 0,5 МПа.
Используя физические параметры октогена ρ
1
= 1700 кг/м
3
, с
1
= 1,30 кДж/кг К и
λ
III
= 8,4·10
–5
кВт/м К, получаем Q
II
= 300 кДж/кг.
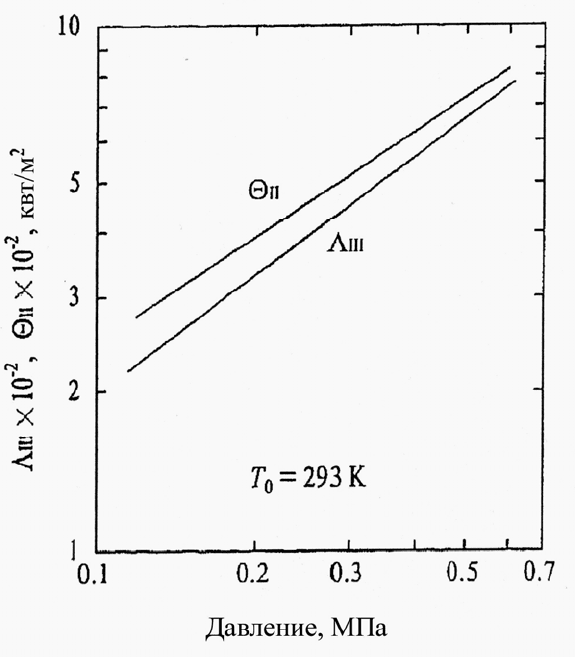
На рис. 5.6 показан тепловой поток, получаемый в зоне II, и тепловой поток,
передаваемый обратно из зоны III в зону II, как функция давления.
Рис. 5.6. Тепловой поток, передаваемый обратно от газовой фазы к поверхности
горения, и тепловой поток, создаваемый на поверхности горения
Θ
II
приблизительно равен Λ
Ш
, и оба тепловых потока увеличиваются с уве-
личением давления, при этом Λ
Ш
~ p
0,75
и Θ
II
~ p
0,65
. Из уравнения (5.2) очевидно,
что чувствительность к давлению Θ
II
приблизительно равна чувствительности к
давлению скорости горения. Тогда чувствительность к давлению скорости горе-
ния октогена (~ p
0,66
) зависит от Λ
Ш
, то есть чувствительность к давлению газо-
фазной реакции [17].
5.1.4 Триаминогуанидиннитрат
5.1.4.1 Термическое разложение
Фрагмент окислителя (HNO
3
) в ТАГН связывается водородной связью в мо-
лекулярной структуре, а физико-химические процессы горения ТАГН отличаются
от физико-химических процессов горения октогена и гексогена, фрагмент окисли-
теля которых (–N–NO
2
) связывается ковалентной связью в их молекулярных
структурах. Хотя температура пламени ТАГН ниже температуры пламени октоге-
на на 1200 К, значение термодинамического параметра (T
f
/M
g
)
1/2
, по всей вероят-
129
ности, одинаковое для обоих материалов. Основными продуктами сгорания ТАГН
являются N
2
, H
2
и H
2
O, а октогена – N
2
, CO и H
2
O. Молекулярная масса M
g
ТАГН
составляет 18,76 кг кмоль
–1
, а октогена – 24,24 кг кмоль
–1
. ТАГН образует водород
высокой концентрации, который увеличивает значение термодинамического па-
раметра, даже если температура пламени низкая.
На рис. 5.7 показаны микрофотографии поверхности ТАГН до горения (а) и
после гашения (b), полученные с помощью сканирующего электронного микро-
скопа. Потухшую поверхность получали путем быстрого понижения давления в
прутковой камере, как описано в приложении В.
Рис. 5.7. Микрофотографии поверхности ТАГН до горения (а) и после га-
шения (b) при давлении горения 1,0 МПа, полученные с помощью сканирующего
электронного микроскопа
На потухшей поверхности обнаруживается тонкоизмельченный рекристал-
лизованный материал, гомогенно диспергированный по ней (поверхности). Оче-
видно, что ТАГН образует расплавленный слой, а затем разлагается с образовани-
ем при горении реакционных
газообразных веществ на поверхности горения.
Термическое разложение ТАГН включает три стадии тепловыделения и
процесс потери массы и измеряется методами дифференциального термического
анализа и термогравиметрии, как показано на рис 5.8 [26]. Первая стадия соответ-
ствует быстрой экзотермической реакции между отсутствием потери массы
(488 К) и 27% потерей массы (498 К), вторая стадия соответствует относительно
медленной эндотермической
реакции между 27% (498 К) и 92% потерей массы
(573 К), а третья стадия соответствует очень медленной эндотермической реакции
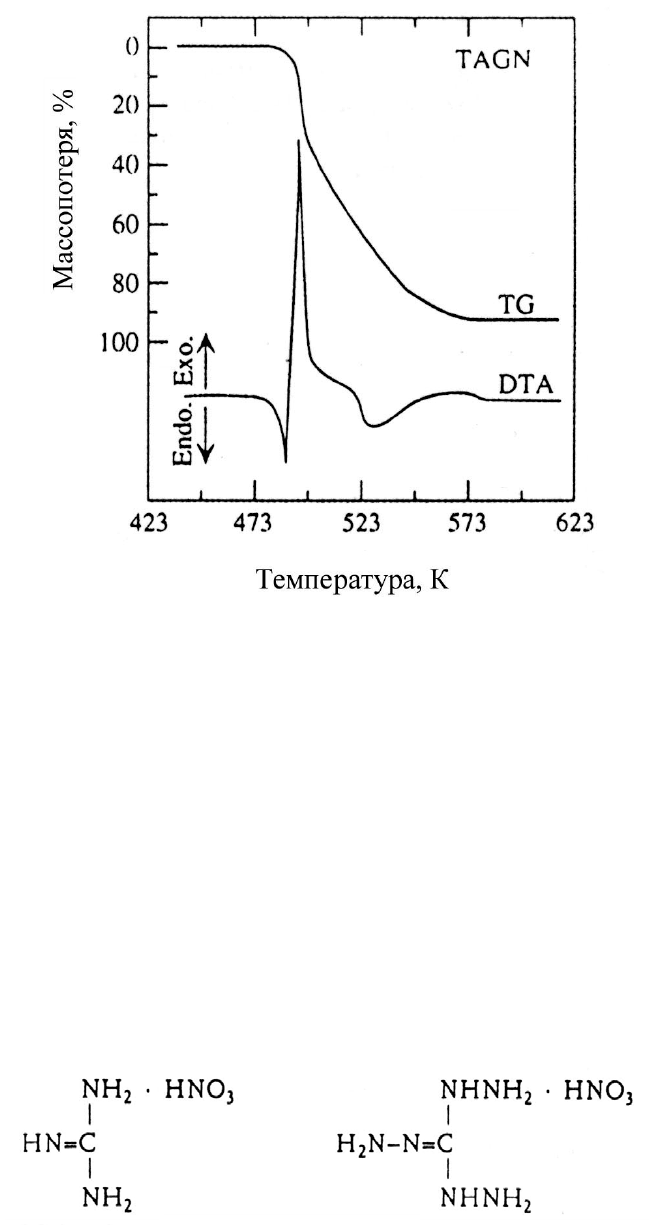
130
между 92% (573 К) и 100% потерей массы (623 К). Эндотермический пик при
488 К вызван фазовым изменением при переходе из твердого состояния в жидкое.
Экзотермическая быстрая реакция на первой стадии является процессом, характе-
ризующим природу энергетики ТАГН.
Рис. 5.8. Результаты DTA и TG ТАГН, показывающие быструю
экзотермическую реакцию на первой стадии процесса разложения
Термически обработанный ТАГН, который получается прерыванием разло-
жения при 27% потере массы, разлагается без экзотермического пика, наблюдае-
мого на первой стадии разложения ТАГН. Как показано на рис 5.9 (пунктирные
линии), реакция газификации начинается при температуре 498 К, а реакция раз-
ложения завершается при температуре 553 К. Экзотермический пик, наблюдае-
мый на первой стадии процесса разложения ТАГН, показанный на рис. 5.8, пол-
ностью отсутствует. Это показывает, что основной энергетический фрагмент
ТАГН используется на первой стадии реакции разложения, сопровождаемой 27%
потерей массы.
Молекулярная структура гуанидиннитрата (ГН: СН
6
N
4
O
3
) подобна структу-
ре ТАГН, за исключением трех аминогрупп:
Молекулярная структура ГН Молекулярная структура ТАГН
