Горбунова В.Н., Савельева-Васильева Е.А., Красильников В.В. Молекулярная неврология. Заболевания нервно-мышечной системы
Подождите немного. Документ загружается.


разработаны очень эффективные методы диагностики
делеций в гене DMD, основанные на мультиплексной (мно-
жественной) полимеразной цепной реакции (Chamberlain et
al., 1988а; 1990; Beggs et al., 1989; 1990;. Abbs et al., 1991).
Одновременная амплификация 18 экзонов и промоторной
части гена позволяет выявить до 98% всех протяженных де-
леций гена (рис. 3). На этом рисунке у пациентов под номе-
рами 1—5 делетированы соответственно экзоны 51-60, 42-
44,47-52,43-60 и 13-19. Идентификация делеций в гене DMD
у больного является бесспорным подтверждением диагноза
миодистрофии Дюшенна/Беккера. Кроме того, в семьях с ге-
нотипированной делецией возможна прямая пренатальная
диагностика заболевания, которая обычно проводится в пер-
вом триместре беременности. В некоторых случаях делеций
в DMD находят у пациентов, клинически отнесенных к дру-
гим формам миопатии: аутосомно-рецессивной миодистро-
фии Фукуяма (Arahata et al., 1989; Francke et al., 1989), спи-
нальной амиотрофии (Clarke et al., 1989), тазовопоясной ми-
одистрофии Лейдена-Мебиуса (Arikawa et al., 1991). Во всех
этих случаях проводится корректировка диагноза в пользу
миодистрофии Дюшенна/Беккера.
ГЧ I с о м 14 О Э
Ри
с 3. Идентификация делеций в гене дистрофина методом
множественной полимеразной цепной реакции
Однако для обнаружения гетерозиготного носительства
делеции у матери больного ребенка метод мультиплексной ПЦр
не может быть использован. В ряде случаев носительство деле-
ции удается установить по появлению фрагментов ДНК необыч-
ного размера (junction fragments) при проведении блот гибриди-
зации рестрицированной геномной ДНК с внутригенными кДНК-
зондами. Однако такие фрагменты обнаруживаются не более
чем в 17% случаев делеций в гене DMD. Для выявления гетеро-
зиготного носительства делеций, дупликаций или инсерций в гене
DMD в общем случае был разработан метод обратной ПЦР (RT
PCR), основанный на изоляции специфической мРНК, обрат-
ной транскрипции и использования образовавшейся кДНК в
качестве матрицы для проведения мультиплексной амплифи-
кации всей кодирующей области гена (Roberts et al., 1990). По-
сле электрофоретического разделения продуктов амплифика-
ции фрагменты ДНК необычного размера образуются при лю-
бых структурных внутригенных перестройках, находящихся как
в гемизиготном, так и в гетерозиготном состоянии. Таким обра-
зом, обратная ПЦР является наиболее эффективным методом
молекулярной диагностики делеций не только у пациентов с
миодистрофией Дюшенна/Беккера, но и у их родственников.
Ген миодистрофии Дюшенна может быть вовлечен так-
же в другие структурные перестройки (Ни et al., 1989). Так, у
5% пациентов наблюдаются дупликации одного или несколь-
ких экзонов. В относительно небольшом проценте случаев у
больных обнаружены микроделеции, захватывающие от 1 до
нескольких нуклеотидов, а также много нонсенс-мутаций, по-
видимому, из-за присутствия в гене DMD большого количе-
ства глютаминовых триплетов, мутации в которых часто при-
водят к образованию стоп-кодонов. Крайне редки миссенс-
мутации (Roberts et al., 1992а; 1992b).
Молекулярная диагностика мутаций неделеционного типа
чаще всего осуществляется косвенными методами. В началь-
ный период исследований для этих целей использовали внутри-
генные полиморфные сайты рестрикции (табл. 3 и 4). В даль-
нейшем в гене миодистрофии Дюшенна были обнаружены мно-
42

^численные микросателлитные гипервариабельные последо-
аательности, отличающиеся очень высоким уровнем информа-
тивности (Beggs, Kunkel, 1991; Feener et al., 1991). В табл. 5 пред-
ставлена характеристика полиморфных микросателлитных по-
второв, локализованных в гене DMD. Наиболее удобными для
пренатальной диагностики миодистрофии Дюшенна являются
аллельные варианты динуклеотидных СА повторов в интронах
49 и 50 — STR-49; STR-50 (Chen et al., 1989; Abbs et al., 1990;
1991;Beggs etal., 1989; 1990; 1991; Clemens etal., 1991;Oudet
etal., 1991; Евграфов, Макаров, 1991).
Таблица 5
Микросателлитные полиморфные
маркеры гена дистрофина
Маркер
Повтор
Локализация
Уровень
гетерози-
готности
(PIC)
DYSI
DYSII
DYSIII
DYSIV
(ТА)11(СА)6
(СА)23
(ТА)11(СА)10
TACA(TG)5(TA)4TG
5'-нетранслируемая
область
0.586 - 0.786
DYSMSB
(TG)29
5'-нетранслируемая
область
0.25
DYSMSA
(TG)21
интрон 1
0.57
DMD-44
(CA)n
интрон 44
>0.8
DMD-45
(CA)n
интрон 45
>0.8
UMD-49
(CA)n
интрон 49
>0.8
(CA)n
интрон 50
>0.8
(CA)n
З'-нетранслируемая
область
0.35
(CA)8TA(CA)7
З'-нетранслируемая
область
0.46
(TTGA)n
З'-нетранслируемая
область
0.17

Для всех представленных в табл. 5 вариабельных по*
второв разработана простая и эффективная система их ге*
нотипирования с помощью ПЦР, то есть для всех этих сайтов
подобраны системы праймеров из уникальных смежных об*
ластей ДНК. Для того чтобы избежать ошибок косвенной ди-
агностики, связанных с возможностью внутригенной реком-
бинации, необходимо использовать несколько полиморфных
маркеров, фланкирующих ген DMD.
4. Структура и функции дистрофина
Основным продуктом гена DMD в мышцах является
структурный белок с молекулярной массой в 427 кД — дис-
трофин, имеющий стержневидную форму с длиной около 125
нм. Это полифункциональный белок, участвующий в форми-
ровании нейромышечного синапса и в поддержании целост-
ности мембраны мышечного волокна при его сокращении
(Sealock, Froehner, 1994).
Дистрофин относится к числу минорных белков, его со-
держание по отношению к общему белку мышц составляет
всего 0.002% и поднимается до 5% среди мембранных бел-
ков цитоскелета. В мышцах дистрофин локализован на цито-
плазматической поверхности сарколеммы. В нейромышеч-
ных соединениях он является компонентом постсинаптичес-
кой мембраны и участвует в синаптогенезе. В мышечно-су-
хожильных соединениях дистрофин ко-локализован с тали-
ном, винкулином и утрофином — продуктом аутосомного го-
молога гена DMD (см. ниже).Мышечно-сухожильные соеди-
нения являются основным сайтом силовой трансмиссии. Это
также место локализации контакта между актиновым цитос-
келетом и внеклеточным матриксом, при этом дистрофин и
утрофин концентрируются именно в точках данных специа-
лизированных контактов.
Дистрофин принадлежит к спектрин/ос-актининовому
суперсемейству белков цитоскелета (Koenig et al., 1988).
Он состоит из 4 отдельных доменов (рис. 4), обнаружива-
ющих много общих черт со спектрином и ос-актинином. Так,
44

isl-концввой домен дистрофина имеет сходство с большим
семейством актинсвязывающих белков, и в частности — с
isi-концевыми доменами а-актинина и р-спектрина. Во всех
типах клеток эти белки выполняют структурную роль при
физиологических, статических и динамических клеточных
процессах. Наиболее крупный домен, обеспечивающий
гибкость молекулы, имеет структуру трехгранного стерж-
ня. Он образован 24 слегка повторяющимися сегментами,
каждый из которых содержит около 110 аминокислотных
остатков, а-актинин содержит четыре подобных повтора,
а спектрины — 17 или более. Следующий за стержневым
участком цистеин-богатый домен, состоящий из 150 ами-
нокислот, сходен с СООН-фрагментом А-актинина и содер-
жит два неполных Са
2+
-связывающих мотива. Для послед-
него 420-аминокислотного С-концевого домена не найде-
но гомологии с другими белками. Последовательности ци-
стеин-богатого и С-концевого доменов дистрофина высо-
коконсервативны, что указывает на их особую функцио-
нальную значимость. В С-концевом домене обнаружены
многочисленные потенциальные сайты фосфорилирования,
в том числе для МАР-киназы, p34cdc2-, СаМ- и казеино-
вой киназы. Это предполагает возможность участия дис-
трофина в трансдукции сигналов через сарколемму мы-
шечного волокна (Michalak et al., 1996).
Рис. 4. Модель молекулы дистрофина
После расшифровки аминокислотной последовательно-
ст
и белка была предложена схема его функционирования,
45
согласно которой дистрофин в цитоплазме клетки распоп^
гается под сарколеммой мышечного волокна в виде перепле*
тенного антипараллельного димера (рис. 5). N-конец дистро.
фина связан с цитоплазматическим актином, причем имеет
большее сродство (аффинитет) не с саркомерным, а с немы*
шечным F-актином. Таким образом, дистрофин не связан
напрямую с сократительным аппаратом мышечного волок-
на, а соединен с субмембранной сетью цитоплазмы, образо-
ванной немышечным актином (Ervasti, Campbell 1991;
Monaco, 1989). Точнее, дистрофин взаимодействует с G-ак-
тиновыми мономерами и способствует G->F актиновой транс-
формации, которая стимулируется Са
+
-зависимым присутст-
вием кальмодулина (Fabbrizio et al., 1995b). Дистрофин явля-
ется якорным белком для актина и таким образом он вовле-
чен в контроль деформации поверхности клеточной мембра-
ны и в развитие F-актиновой сети, обеспечивающей жест-
кость цитоскелета миотубул.
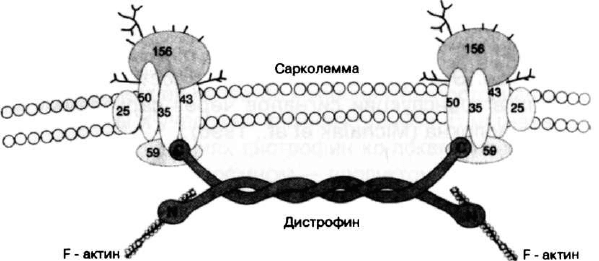
Рис. 5. Расположение дистрофина под сарколеммой
мышечного волокна
С-конец дистрофина соединен с трансмембранным
комплексом, состоящим из белков с молекулярными веса-
ми 156, 59, 50, 43, 35 и 25 кД (Ervasti, Campbell, 1991). Эти
46
* ки получили название дистрофин-ассоциированных
белков (DAP) или дистрофин-ассоциированных гликопро-
теинов (DAG). Дистрофин-гликопротеиновый комплекс уча-
ствует в регуляции внутримышечного уровня кальция, обес-
печивая связь кальциевого комплекса с цитоскелетом клет-
ки, и не исключено, что сам этот комплекс является каль-
циевым каналом. 156DAG, 50DAG, 43DAG и 35DAG содер-
жат аспарагин-связанные олигосахариды, то есть являют-
ся гликопротеинами. 156DAG дополнительно содержит тер-
минально сиализированные серин/треонин-связанные оли-
госахариды, что, по-видимому, обеспечивает его повышен-
ную устойчивость к действию протеаз. При этом сам дис-
трофии и 59DAP относятся к элементам цитоскелета,
156DAG располагается на внешней стороне мембраны, в
то время как остальные белки комплекса интегрированы с
мембраной. У больных с миодистрофией Дюшенна/Бекке-
ра и с другими аутосомно-рецессивными дюшенно-подоб-
ными миодистрофиями, а также с некоторыми формами
конечностно-поясных миодистрофии этот комплекс оказы-
вается частично или полностью разрушенным.
Дистрофии способен взаимодействовать с рядом дру-
гих белков, не входящих в описанный выше комплекс. Так,
лигандом для дистрофина служит ацикулин — неэнзимати-
ческий белок, родственный фосфоглюкомутазе первого
типа. В мышцах ацикулин ведет себя подобно типичному
дистрофин-связанному белку, располагаясь в сарколемме.
Недавно было показано, что дистрофии ассоциирован так-
же с синтетазой окиси азота нейронального типа — nNOS
(Brenman et al., 1995). В скелетных мышцах nNOS соеди-
няется с сарколеммой через дистрофин-гликопротеиновый
комплекс белков. Еще одним ассоциированным с дистро-
Фином белком является мышечный кавеолин-3 — сарко-
леммный белок, являющийся главным компонентом каве-
0Л
плазменных мембран.
Сконструированы антитела на различные антигенные
Детерминанты дистрофина, нашедшие широкое примене-
47

а.
Рис. 6. Иммуно-
гистохимический
анализ дистрофина
в мышечных
клетках
а — норма,
б — миодистрофия
Дюшенна,
в — гетерозиготы
(стрелками
показаны зоны
отсутствия
дистрофина).
ние для его иммунодетекции непо-
средственно в белковом лизате мышц
и на гистологических препаратах
(Hoffman et al., 1989а; 1989b; Arahata
et al., 1989). В последнем случае спе-
цифическая окраска на дистрофин
располагается по периферии клеток
(рис. 6). Как правило, у больных с ми-
одистрофией Дюшенна либо вовсе не
обнаруживается иммунореактивных
форм белка, либо мутантный белок
обнаруживается лишь при использо-
вании определенных антисывороток,
чаще всего на аминотерминальную
часть белка. В мышцах гетерозигот
наблюдаются локальные области от-
сутствия иммуноокрашивания на дис-
трофин. При форме Беккера биохими-
ческие аномалии дистрофина выявля-
ются в виде прерывистого характера
окрашивания мышц, что свидетельст-
вует о дефектах в структуре цитоске-
лета миофибрилл. Иммунологический
анализ является наиболее простым
способом диагностики гетерозиготно-
го носительства мутаций в гене DMD
у родственниц пробанда. Однако для
его осуществления необходимо про-
водить биопсию мышц. В настоящее
время иммуногистохимические мето-
ды анализа с применением антисыво-
роток на разные районы дистрофина
активно используются не только при
медико-генетическом консультирова-
нии и проведении пренатальной диа-
гностики (Bieber et al., 1989; Ginjaar
48

etal., 1989; Bulman et al., 1991), но и при изучении молеку-
лярных основ патогенеза миодистрофии (Hurko etal., 1989).
У некоторых пациентов с миопатией Дюшенна при им-
муногистохимическом окрашивании мышц обнаруживают-
ся редкие дистрофин-положительные волокна. При этом в
случае использования антител с антигенными детерминан-
тами, кодируемыми делетированным участком гена, окра-
шивания не происходит, и это позволяет отвергнуть гипо-
тезу соматического мозаицизма. Наиболее вероятный
механизм такого явления — возникновение второй сома-
тической делеций в мышечной ткани, компенсирующей
едвиг рамки считывания, происходящий вследствие основ-
ной делеций. В результате мутантный локус может цели-
ком транскрибироваться и транслироваться с образовани-
ем стабильного, хотя и аномального дистрофина (Klein et
al., 1992).
5. Регуляция транскрипции и сплайсинга гена DMD. апо-
дистрофины
В соответствии с современными представлениями ог-
ромный ген DMD находится под контролем сложной системы
регуляции транскрипции и сплайсинга (Ahn, Kunkel, 1993).
Показано, что транскрипция DMD осуществляется со сред-
ней скоростью 2.4 кб в минуту, так что для образования пол-
норазмерного РНК-транскрипта требуется 16 часов (Tennyson
et al., 1995). Одновременно до окончания синтеза РНК, то
есть ко-транскрипционно, начинается сплайсирование пер-
вичного РНК-транскрипта. При этом скорость накопления
"Фанскриптов на З'-конце гена уменьшается по сравнению с
бЧонцом, возможно, за счет преждевременной терминации
транскрипционных комплексов.
По крайней мере, восемь независимых промоторов
осуществляют альтернативную специфическую транскрипцию
°MD В разных тканях и на разных стадиях эмбрионального
Развития (табл. 6).

Таблица 6
Изоформы
дистрофина
Размер
мРНК(кб)
Локализаци
промотора
Экспрессия
мышечный
14
5'-UTR область
сердечная и скелетные
мышцы
мозговой
14
1 интрон
кора и гиппокамп
мозговой
14
1 интрон клетки Пуркинье
1
- Dp71
4.5-4.8
63 интрон
повсеместно,
кроме мышц
2-Dp116
5.5
56 интрон
периферические нервы
3 - Dp40
2.2
повсеместно,
кроме мышц
Dpi
40
7.5
44 интрон эмбриональные нейроны
Dp260
сетчатка
Один промотор мышечного типа (М) и два мозгового,
активные в кортикальном отделе мозга (С) и в клетках Пур-
кинье (Р) соответственно, экспрессируют полноразмерную
молекулу дистрофина, в то время как пять других промото-
ров (среди них R, ВЗ, S, G) обеспечивают экспрессию по-
следних доменов взаимоисключающим способом, главным
образом в немышечных и в немозговых тканях. Основным
продуктом DMD в сердечной и скелетных мышцах является
14-кб РНК-транскрипт. В различных отделах мозга продуци-
руются три полноразмерные формы дистрофина с разных
промоторов, а соответствующие транскрипты различаются по
первому экзону (Chamberlain et al., 1988b; Nudel et al., 1989;
Boyce et al., 1991). Один из промоторов мозгового типа (С)
расположен в первом интроне DWD на расстоянии более 90
кб от мышечного промотора (Celly et al., 1990; Gorecki et al.,
1992). 14-кб мРНК — продукты дистрофинового гена мышеч-
50
Изоформы дистрофина
