Горбунова В.Н., Савельева-Васильева Е.А., Красильников В.В. Молекулярная неврология. Заболевания нервно-мышечной системы
Подождите немного. Документ загружается.


Не исключено, что разрушение дистрофин-ассоцииро-
ванного комплекса белков может происходить не только в
оезультате генетических дефектов, но и вследствие вирус-
ных инфекций. Это, в частности, доказано в отношении виру-
са Коксаки, способного разрушать дистрофии и ассоцииро-
ванный с ним комплекс белков в кардиомиоцитах, и это, по-
видимому, является одним из начальных молекулярных ме-
ханизмов патогенеза наиболее частой приобретенной фор-
мы дилатационной кардиомиопатий.
Учитывая особую значимость миодистрофии Дюшен-
на и дистрофинопатий среди нервно-мышечных заболеваний,
мы постарались дать наиболее полный обзор молекулярно-
генетических исследований, проводимых в последние годы в
этой области неврологии. На примере дюшенно-подобных
миодистрофии особенно отчетливо может быть прослежена
связь между открытием гена и расшифровкой молекулярных
основ патогенеза, а значит, и разработкой методов точной
диагностики (включая пренатальную), профилактики и тера-
пии моногенных заболеваний.
а) Псевдогипертрофическая мышечная дистрофия
Дюшенна/Беккера (MIM: 310200)
1. Клиническая характеристика заболевания
Х-сцепленная рецессивная псевдогипертрофическая
мышечная дистрофия Дюшенна, впервые подробно описан-
ная G.Duchenne в 1868 г., — одна из наиболее частых и зло-
качественных форм нервно-мышечной патологии детского
возраста, характеризующаяся началом клинических прояв-
лений в первом пятилетии жизни, прогредиентным течением
заболевания с последующей инвалидизацией и летальным
исходом, как правило, в конце второго — начале третьего
Десятилетия жизни. Обобщенные данные о распространен-
н
°сти миодистрофии Дюшенна в разных популяциях указы-
вают на относительно высокую частоту этой формы, колеб-
лющуюся от 9,7 до 32,6 случаев на 100 000 родившихся жи-
вь,
ми мальчиков. Для Санкт-Петербурга она составляет не
31
менее 18,9 на 100 ООО (Красильников, 1989). Примерно 1/з
единичных случаев миодистрофии Дюшенна должна быть
обусловлена вновь возникшими мутациями (при условии ра-
венства частоты мутирования в мужских и женских гаметах,
а также нулевой фертильности больных). Последнее обсто-
ятельство имеет принципиальное значение для оценки по-
вторного риска при медико-генетическом консультировании
соответствующих семей. Долгое время в литературе обсуж-
дался вопрос о взамоотношении миодистрофии Дюшенна и
мышечной дистрофии Беккера (Беккера-Кинера), впервые
описанной в 1955 г. (Becker, Kiener, 1955), протекающей со
сходной клинической картиной, но отличающейся относитель-
но доброкачественным течением. К настоящему времени
получены данные, однозначно указывающие на то, что обе
формы являются результатом мутаций в одном и том же ло-
кусе. Так называемые женские случаи миодистрофии Дюшен-
на/Беккера возможны у девочек с Х-аутосомной транслока-
цией либо числовой аномалией Х-хромосомы (моносомия X).
Сходные с миодистрофией Дюшенна клинические проявле-
ния могут отмечаться у лиц женского пола с дюшенно-по-
добными аутосомно-рецессивными формами миопатии (см.
ниже). В части случаев субклинические проявления мио-
дистрофии Дюшенна/Беккера в виде «малой болезни» от-
мечаются у гетерозиготных носительниц мутантного гена.
На наличие «малых признаков» у женских родственников
больных миодистрофией Дюшенна указывал еще С. Н.
Давиденков (Давиденков, 1934). Клиническая симптоматика
носительства может проявляться умеренным снижением мы-
шечной силы и сухожильных рефлексов, утолщением (за счет
псевдогипертрофии) икроножных мышц, поясничным гипер-
лордозом, варусной деформацией стоп, другими симпто-
мами. Данное обстоятельство хорошо объясняется гипо-
тезой Лайон, предполагающей случайную инактивацию
одной из Х-хромосом в женском зачатке в раннем эмбрио-
генезе и соответственно преобладанием в подобных слу-
32
чаях среди функционально активных Х-хромосом, несущих
м
утантный аллель.
Клиническая картина миодистрофии Дюшенна достаточ-
но хорошо изучена (Дрознина, 1970; Гринио, 1976). Заболева-
ние характеризуется сравнительно ранним началом и относи-
тельно быстрым прогрессированием процесса. Первые призна-
ки заболевания в виде мышечной слабости появляются в воз-
расте 2—5 лет. У части детей отмечается задержка темпов мо-
торного развития уже на 1—2-м году жизни. Дети начинают ис-
пытывать затруднения при ходьбе по лестнице, вставании с пола,
перестают бегать. Очень типичной становится переваливающа-
яся («утиная») походка, заключающаяся в раскачивании в та-
зобедренных суставах. Рано возникают псевдогипертрофии за
счет разрастания жировой и соединительной ткани, захватыва-
ющие главным образом икроножные, дельтовидные и ягодич-
ные мышцы. В последующем постепенно появляются гипотро-
фии мышц бедер и тазового пояса, нередко внешне скрытые
из-за развитой подкожной жировой клетчатки. Процесс носит
отчетливо восходящий характер: мышечная слабость и гипотро-
фии распространяются на мышцы спины, плечевого пояса, про-
ксимальных отделов верхних конечностей. Характерны «кры-
ловидные лопатки», симптом «свободных надплечий». Из-за уси-
ливающейся слабости к 9—12 годам дети, как правило, пере-
стают ходить, постепенно превращаясь в «кресельных пациен-
тов». Становятся заметными вторичные деформации скелета,
усиливаются атрофии и сухожильные ретракции. Наиболее ран-
ние изменения обнаруживаются в ахилловых сухожилиях, при-
водящие в последующем к патологической деформации стоп.
Возможны контрактуры в локтевых, коленных и тазобедренных
оуставах. Первым из глубоких рефлексов исчезает коленный,
затем—рефлексы с двуглавой и трехглавой мышц. Дольше дру-
гих сохраняется ахиллов рефлекс. Для миодистрофии Дюшен-
н
а типично поражение сердечной мышцы в виде кардиомиопа-
^и. При ЭКГ-исследовании обнаруживаются углубление зубца
'
Пат
ология зубца R, блокада ножки пучка Гиса. Особеннос-
тью данной формы миопатии является нередко наблюдаемая
Заказ № ПО
33

умственная отсталость, как правило, неглубокая. Причиной ле-
тального исхода являются обычно пневмонии, которые боль-
ные не в силах перенести из-за включения в процесс дыхатель-
ной мускулатуры. Лабораторная диагностика миодистрофии Дю-
шенна/Беккера включает использование различных методов:
электрофизиологических, биохимических, гистологических, а в
последние годы — гистохимических и молекулярно-генетичес-
ких. Электромиографическое исследование, а также изучение
мышечных биоптатов обнаруживает признаки первично-мышеч-
ного поражения. Удобным и информативным тестом является
определение сывороточной креатинкиназы, уровень активнос-
ти которой в случае миодистрофии Дюшенна в десятки раз пре-
вышает нормальные значения. Следует подчеркнуть, что дан-
ный тест может быть использован в до- или субклинической ста-
дии заболевания.
2. Картирование и идентификация гена DMD
Ген миодистрофии Дюшенна — DMD (Duchenne muscular
dystrophy) — один из первых генов человека, идентифициро-
ванных методами позиционного клонирования. Успешному кло-
нированию гена предшествовало описание достаточно редких
пациентов, имеющих в области локализации гена цитогенети-
чески идентифицируемые структурные перестройки — транс-
локации и делеции. Так, в частности, у нескольких девочек, стра-
дающих заболеванием, сходным по клинике с миодистрофией
Дюшенна, были обнаружены различные реципрокные Х-ауто-
сомные транслокации, причем во всех случаях точка разрыва
Х-хромосомы оказалась локализована в области р21 (Burghes
et al., 1987; Boyd et al., 1988; Bodrug et al., 1989). Было высказа-
но предположение, нашедшее подтверждение в последующих
исследованиях, что клиника миодистрофии Дюшенна у этих де-
вочек развивается вследствие разрушения транслоцированно-
го гомолога DMD-гена, локализованного в области Хр21, в со-
четании со специфическим характером лайонизации нормаль-
ной Х-хромосомы. На следующем этапе изолированные после-
довательности ДНК, примыкающие к точкам разрывов Х-хро-
34

мосомы при транслокациях или отсутствующие у пациентов с
делециями, были использованы в качестве зондов для поиска и
анализа полиморфных сайтов рестрикции, сцепленных с геном
миодистрофии Дюшенна. Одним из первых таких зондов была
последовательность RC8, локализованная методами соматиче-
ской гибридизации в области Хр22.3-р21 на расстоянии около
10сМ от DMD-гена (Murrey et al., 1982). В дальнейшем была изо-
лирована целая серия подобных последовательностей ДНК.
Среди них фрагмент гена орнитинтранскарбомилазы (ОТС),
зонды р754, XJ1-8, а также внутригенные зонды серии pERT
(Francke et al., 1985; Bakker et al., 1985; Kunkel et al., 1985). С
помощью этих ДНК-зондов было обнаружено большое число
полиморфных сайтов рестрикции, ассоциированных с DMD-re-
ном, и определены генетические расстояния между ними. В
табл. 3 показано расположение некоторых полиморфных мар-
керов относительно DMD-гена и суммированы результаты не-
скольких исследовательских групп по оценке частот рекомби-
нации между этими локусами (Murray et al., 1982; Boyd et al.,
1988; Chen et al., 1989; Abbs et al., 1990).
Таблица 3
Расположение полиморфных сайтов рестрикции,
сцепленных с геном дистрофина
Локус
ДНК-зонд
Границы гена
Расстояния в сМ
DXS84
р754
DXS206
рХЛ-8
3.7 + 0.6
DYS MSA *)
DXS142
PERT84
5' DMD
1.0 +0.4
DXS164
PERT87
МР1Р *)
DXS41
р99-6
3' DMD 1.9+ 0.6
DXS270
J-Bir
DXS28
12.0 + 1.1
*) микросателлитные маркеры, фланкирующие ген дистрофина.

Описание большого количества полиморфных марке-
ров, сцепленных с DMD-геном, и точное физическое карти-
рование области его локализации способствовало изоляции
специфической мРНК из скелетных мышц плода, клонирова-
нию и секвенированию полноразмерной кДНК длиной в
14 тысяч пар нуклеотидных оснований (Koenig et al., 1987;
Monaco, Kunkel, 1988). DMD — самый крупный из известных
в настоящее время генов, его размер 2.5 миллиона пар ос-
нований, и он занимает около 2% Х-хромосомы. Кодирую-
щая часть гена DMD разделена на 79 экзонов и составляет
менее 1% геномной области (Roberts et al., 1992с; 1993).
3. Мутации в гене DMD и их диагностика
Более чем в 60% случаев у больных мальчиков с мио-
дистрофией Дюшенна/Беккера обнаруживаются протяженные
делеции в гене DMD, захватывающие от одного до несколь-
ких соседних экзонов и сосредоточенные обычно в двух «го-
рячих» районах — в области 5'-конца гена (экзоны 6—19) и в
З'-конце (экзоны 40—53), при этом 30% делеций локализо-
ваны в проксимальной части гена и 70% — в дистальной
(Koenig et al., 1989; Dunnen et al., 1989; Liechti-Gallati et al.,
1989; Oudet et al., 1992). Считается, что в 30% семей с еди-
ничными случаями миодистрофии Дюшенна/Беккера болезнь
развивается вследствие спонтанного возникновения в гаме-
тах мутаций в DMD-гене и матери таких больных не являют-
ся гетерозиготными носителями этих мутаций. В подобных
семьях риск повторного рождения больного ребенка мини-
мален и не превышает общепопуляционной частоты. В ос-
тальных 70% семей матери больных мальчиков гетерозигот-
ны по мутациям DMD-гена, и при каждой беременности та-
ких женщин риск повторного рождения больного сына состав-
ляет 50%. Очень часто концы делеций локализованы в цент-
ральной части гена DMD. Так, в интроне 44, протяженностью
160—180 кб, расположено около 40% точек разрыва всех де-
леций. Проксимальные делеции возникают, по-видимому, в
раннем эмбриогенезе и имеют больше шансов стать «семей-
36
ными» мутациями. Дистальные делеции возникают позднее
и чаще встречаются как изолированные случаи. Считается,
что повторный риск рождения больного ребенка с прокси-
мальной вновь возникшей делецией составляет 30%, тогда
как с дистальной — только 4% (Passos-Bueno et al., 1992).
По-видимому, значительная часть делеций в гене DMD
возникает при мейотической рекомбинации. Частота мейо-
тической рекомбинации в гене дистрофина составляет 10%,
что в 4 раза больше, чем можно было ожидать на основании
длины гена (Qudet et al., 1992). С использованием 10 внутри-
генных полиморфных маркеров показано существование двух
горячих точек рекомбинации в гене DMD. Одна из них между
экзонами 44 и 51 с пиком в 44-м интроне, другая между ни-
троном 7 и 5'-концом DMD. Локализация горячих точек ре-
комбинации очень сходна с распределением точек разрывов
делеций у пациентов с миодистрофией Дюшенна/Беккера. Эти
результаты дают основание предполагать участие одного и
того же молекулярного механизма, лежащего в основе об-
разования делеций и повышения частоты рекомбинации в
гене DMD.
В нескольких случаях показано, что один из концов де-
леций, локализованных в интроне 43, расположен внутри ТНЕ-
1 элемента, принадлежащего семейству ретротранспозонов
(Pizzuti et al., 1992). Эти элементы, размером 2.3 кб, фланки-
рованные 350-нуклеотидными длинными терминальными по-
вторами (LTR), встречаются в геноме человека около
10 ООО раз. Гипотеза о том, что нестабильность гена DMD вы-
звана присутствием транспозоно-подобного элемента, при-
влекается также для объяснения нескольких случаев обна-
ружения различий в молекулярном дефекте у пациентов, при-
надлежащих одной и той же родословной, у которых предпо-
ложительно должна быть мутация общего происхождения
(Miciak et al., 1992). В некоторых случаях удалось проследить
присутствие Alu-элементов, локализованных в точках разры-
вов внутригенных структурных перестроек. Так, при секве-
стровании концевых участков дупликаций в гене DMD в 2 слу-
37
чаях из 8 были обнаружены Alu-элементы (Ни et al., 1989). В
остальных 6 случаях рекомбинация осуществлялась между
негомологичными последовательностями.
Делеции в гене DMD часто возникают в процессе про-
лиферации зародышевых клеток, следствием чего является
гонадный мозаицизм — появление нескольких генераций
половых клеток (ооцитов) с мутантными и нормальными ал-
лелями (Darras et al., 1988; Bakker et al., 1989). Гонадный мо-
заицизм представляет серьезную проблему для диагностики
гетерозиготного носительства и, следовательно, для медико-
генетического консультирования семей с миодистрофией
Дюшенна. Предполагается, что такие мутации могут возни-
кать еще на уровне первичных половых клеток, то есть на
ранних стадиях внутриутробного развития будущей матери.
По ориентировочным оценкам примерно 6—7% всех спора-
дических случаев являются следствием гонадного мозаициз-
ма у матери. Оценить величину аберрантного клона ооцитов
практически не представляется возможным. В связи с этим
прогноз в отношении здоровья следующего ребенка в семь-
ях, в которых у матери больного миодистрофией Дюшенна не
удается определить гетерозиготное носительство, весьма
затруднен. Эмпирически определено, что при наличии спо-
радического случая рождения ребенка с миодистрофией
Дюшенна и при отсутствии прямых молекулярных доказа-
тельств гетерозиготного носительства мутации в гене дистро-
фина у матери риск повторного рождения больного ребенка
может достигать 14% (Essen et al., 1992). Мутации возникают
преимущественно в оогенезе (Bakker et al., 1989), несмотря
на то, что теоретическая вероятность отцовского происхож-
дения делеций в гене дистрофина выше за счет большего
числа репликаций ДНК, происходящих в процессе созрева-
ния мужских половых клеток (Giannelli, 1988).
Отмечены особенности паттерна делеций в разных
европейских популяциях (Beggs et al., 1990; Abbs et al., 1991)
и в популяциях России и стран СНГ (Baranov etal., 1993). Так,
в результате объединенных межлабораторных исследований
38
показано, что соотношение делеций в 3'- и в 5'-районах «го-
оячих» точек возникновение мутаций в различных популя-
циях Западной Европы составляет 3.5:1, тогда как в России
только 2:1. У некоторых пациентов может быть делетирован
не только весь ген дистрофина, но достаточно протяженные
соседние области. Прямой корреляции между тяжестью те-
чения заболевания и длиной делеций не отмечается, но раз-
личия между формами Дюшенна и Беккера в общем случае
связаны с наличием или отсутствием сдвига рамки считыва-
ния (Malhotra et al., 1988; Koenig et al., 1989). При миодистро-
фии Дюшенна делеций сопровождаются сдвигом рамки счи-
тывания и вследствие этого преждевременной терминацией
трансляции, тогда как при форме Беккера такого сдвига не
происходит. Поэтому у пациентов с миопатией Дюшенна про-
дукт гена либо полностью отсутствует, либо деградирует вско-
ре после синтеза. У больных с формой Беккера такой белок,
как правило, присутствует, хотя и в измененном, чаще всего
в укороченном виде. Эта гипотеза оказалась справедливой
для 94% делеций с картированными точками разрывов. Ис-
ключения из этого правила связаны со сложным характером
экспрессии гена DMD.
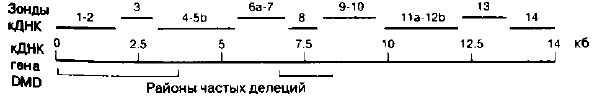
Рис. 1. Расположение кДНКовых зондов гена дистрофина
После клонирования гена появилась возможность ис-
пользовать кДНКовые зонды для анализа изменчивости вну-
т
Ригенных полиморфных сайтов рестрикции. На рис. 1 пока-
зано расположение этих зондов относительно кДНК-гена дис-
т
Рофина. кДНКовые зонды явились прекрасными маркера-
ми для выявления делеций в DMD-гене (Dunnen et al., 1989).
табл. 4 указаны некоторые полиморфные сайты рестрик-
Чии
»
выявляемые
с помощью этих кДНК-овых зондов. Распо-
39

ложение относительно гена DMD геномных районов, гибри-
дизующихся с некоторыми геномными и кДНКовыми зонда-
ми, после рестрикции ДНК редкощепящей эндонуклеазой Sfj
I изображено на рис. 2.
Рис. 2. Расположение относительно гена дистрофина
геномных районов, гибридизирующихся с некоторыми
геномными и кДНКовыми зондами, после рестрикции ДНК
редкощепящей эндонуклеазой Sfi 1
Таблица 4
кДНКовые полиморфные сайты рестрикции
Районы кДНК
Рестриктаза
Аллели (кб)
Районы кДНК
Рестриктаза
мажорная
минорная
0-2а
Xmn1
2.0
2.1
ЗЬ-5а
EcoR1
9.4
9.7
5Ь-7
EcoRY
7.3
10
EcoR1
10.5
13
Xmn1
4.7
4.4
9 -10
EcoRY
12
14
Pvu11
9.3
11
Taq1
2.1
1.7
