Горбунова В.Н., Савельева-Васильева Е.А., Красильников В.В. Молекулярная неврология. Заболевания нервно-мышечной системы
Подождите немного. Документ загружается.


дящихся под контролем одних и тех же механизмов, прини-
мающих участие в регулировании тканеспецифической экс-
прессии генов.
В табл. 2 представлены данные по локализации генов,
ответственных за наследственные миопатии, указаны пер-
вичные биохимические дефекты и дана краткая функциональ-
ная характеристика этих белков.
Таблица 2
Молекулярно-генетическая характеристика
наследственных миодистрофий и миопатии
Нозологическая форма,
MIM
Ген,
локализация
Белок, функции
Миодистрофия Дюшенна;
-Беккера, Х-сцепленная,
310200
DMD
Хр21.2
дистрофии - сарколеммный
белок цитоскелета, связы-
вающий актин с экстракле-
точным матриксом через
дистрофин-ассоцииро-
ванный комплекс белков;
аподистрофины
Миодистрофия врожден-
ная, прогрессирующая с
умственной отсталостью,
тип Фукуяма, аутосомно-
рецессивная, 253800
FCMD,
MUSC?
9q31-q33
рецепторная
тирозинкиназа?
Миодистрофия
конечностно-поясная,
аутосомно-
доминантная 1А, 159100
LMNB1?
5q22.3-q31.3
ламин В1? -
белок ядерной ламины
Миодистрофия
конечностно-поясная,
аутосомно-
доминантная 1В
LMNA?
1q11-q21
ламин А/С? -
белок ядерной ламины
Миодистрофия
конечностно-поясная,
аутосомно-
доминантная 1С
CAV3
Зр25
кавеолин-3 - дистрофин-
ассоциированный белок
мышечных кавеол
Миодистрофия
конечностно-поясная,
аутосомно-
рецессивная 2А, 253600
CAPN3
15q15.1-q21 1
кальпаин-3 - мышечная
протеаз
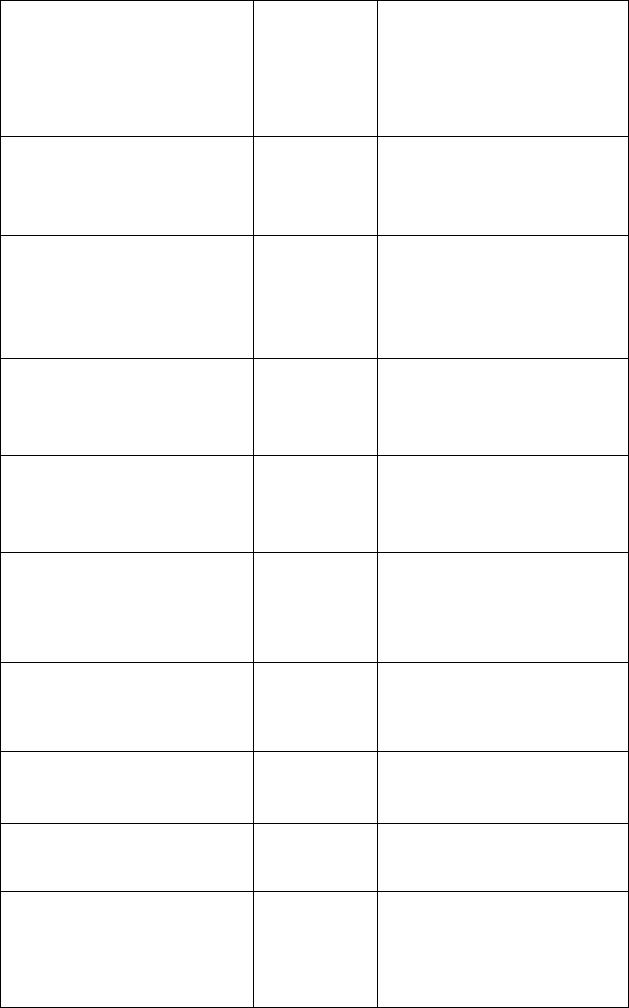
Продолжение Табл.2
Миодистрофия
конечностно-поясная,
аутосомно-рецессив-
ная 2В, 253601; миопатия
дистальная Миоши,
254130
DYSF, ММ
2р13.3-2р13.1
дисферлин - цитоплазмат
ческий белок, взаимодей-
ствующий с ядерной и
плазменными мембранами
Миодистрофия
конечностно-поясная,
аутосомно-рецес-
сивная 2С, 253700
SGG, ySG
13q12
у-саркогликан
белок дистрофин-
ассоциированного
комплекса
Миодистрофия конеч-
ностно-поясная, ауто-
сомно-рецессивная 2D,
253700; первичная адха-
линопатия, 600119
ADL, DAG2,
SGA, ctSG
17q21
а-саркогликан,
адхалин -
белок дистрофин-
ассоциированного
комплекса
Миодистрофия конеч-
ностно-поясная,
аутосомно-рецес-
сивная 2Е, 600900
SGB, PSG
4q12
р-саркогликан -
белок дистрофин-
ассоциированного
комплекса
Миодистрофия конеч-
ностно-поясная, ауто-
сомно-рецессивная 2F,
601411
SGD, 8SG
5q33
8-саркогликан-
белок дистрофин-
ассоциированного
комплекса
Миодистрофия плечевого
и тазового пояса с
буллезным эпидермоли-
зом, аутосомно-
рецессивная,226670
PLEC1
8q24.13-qter
плектин - белок
соединяющий цитоскелет
клетки с мембраной
Лице-лопаточно-плечевая
миодистрофия Ландузи-
Дежерина, аутосомно-
доминантная IA, 158900
FSHD1
4q35-qter
Миодистрофия Эмери-
Дрейфуса,
Х-сцепленная, 310300
EMD, STA
Xq28
эмерин - ядерный ламина-
ассоциированный белок
Миодистрофия Эмери-
Дрейфуса, аутосомно-
доминантная, 181350
EDMD-AD,
LAMA
1q11-q23
ламин А/С- белок
ядерной ламины
Миодистрофия врожден-
ная мерозин-дефицитная,
аутосомно-рецессивная,
156225
LAMA2
6q22-q23
мерозин, ламинин 2 -
белок базальной ламины,
связанный с дистрофин-
ассоциированным
комплексом белков

Продолжение Табл.2
Миопатия врожденная,
интегрина7рЮ-
дефицитная, аутосомно-
рецессивная
ITGA7
12q13
интегрин p1D, ot7 - рецептор
ламинина 2
Миопатия немалиновая,
волокнистая, аутосомно-
рецессивная, 256030
NEB
2q21.2-q22
небулин - интегральный
компонент тонких и толстых
нитей саркомера
Миопатия немалиновая,
волокнистая, аутосомно-
доминантная, 161800
NEM1, TPM3
1q23-q25.1
тропомиозин-3 - главный
белковый компонент
латеральных Z-дисков
Миопатия немалиновая,
аутосомно-доминантная;
миопатия актиновая
АСТА1
1q42
а-актин - основной белковый
компонент тонких нитей
саркомера
Болезнь центрального
стержня; злокачествен-
ная гипертермия,
аутосомно-доминантная,
117000
RYR1
19q12-q13.2
рецептор 1 рианодина -
кальций высвобождающий
канал саркоплазмати-
ческого ретикулума
скелетных мышц
Миопатия миотубуляр-
ная 1, Х-сцепленная,
310400
MTM1,
CG2
Xq28
миотубулярин - мышечная
тирозин-серин-фосфатаза
Миопатия Бетлема,
аутосомно-доминантная,
158810;
(120220; 120240; 120250)
COL6A1,
COL6A2
COL6A3,
21q22.3, 2q37
а 1, 2 и 3 субьединицы
микрофибриллярного кол-
лагена VI типа мышц,
выполняющего роль моста
между клетками
и внеклеточным матриксом.
Миопатия окулофа-
рингеальная, аутосомно-
доминантная, 164300
OPMD,
PABP2
14q11.2-q13
поли(А)-связывающий
белок 2
Миопатия дистальная с
накоплением десмин
вых включений, аут
сомно-доминантная,
125660
DES
2q35
десмин - белок семейства
промежуточных филамент
типа III
Миопатия десмин-
Родственная, аутосомно-
Доминантная,601419
CRYA
11q21-q23
аВ-кристаллин - мажорный
белок хрусталика,
присутствующий в мышцах
Миопатия с инклюзион-
ными тельцами, ауто-
сомно-рецессивная,
601073
IBM2
9p1-q1

Продолжение Табл.2
МакАрдла болезнь, ауто-
сомно-рецессивная;
гликогеноз V типа, 232600
PYGM
11q13
фосфорилаза
мышечная
Миопатия, обусловленная
СРТ-дефицитом ауто-
сомно-рецессивная; ги-
пераммониемия 255110
СРТ1
1р13-р11
карнитин-палмитоил-
трансфераза 1
Миоаденилат дезаминазы
дефицит, аутосомно-
доминантная;
миопатия напряжения,
102770
AMPD1
1р21-р13
АМФ-дезаминаза-1,
мышечная
Миопатия, обусловленная
PGAM М-дефицитом,
аутосомно-рецессивная,
261670
PGAMM,
PGAM2
7р13-р12.3
фосфоглицератмутаза,
мышечная М
Значительная часть генов, связанных с наследствен-
ными болезнями мышщ, кодирует белки, ассоциированные с
мембранами мышечных волокон. Одной из основных функ-
ций подобных белков является стабилизация мембраны за
счет связывания цитоскелета мышечной клетки с внеклеточ-
ным матриксом. Это, в первую очередь, относится к стерж-
невидному белку дистрофину, дефектному при миодистофи-
ях Дюшенна и Беккера, получивших общее название дистро-
финопатий. Дистрофии — полифункциональный белок, при-
надлежащий к спектрин/ос-актининовому суперсемейству бел-
ков цитоскелета. Он участвует в поддержании целостности
мембраны мышечного волокна при его сокращении и в фор-
мировании нейромышечного синапса. Дистрофин является
якорным белком для актиновых филамент, обеспечивающих
жесткость цитоскелета миотубул. Располагается дистрофин
под сарколеммой мышечного волокна. Его связь с экстра-
клеточными белками осуществляется через комплекс транс-
мембранных дистрофин-ассоциированных белков. При мио-
дистрофии Дюшенна/Беккера, так же как при аутосомно-ре-
цессивных дюшенно-подобных и при некоторых формах ко-
нечностно-поясных миодистрофий происходит разрушение
24
дистрофин-ассоциированного комплекса белков, причем в по-
следних двух случаях первичным биохимическим дефектом
часто оказывается один из белков дистрофин-ассоциирован-
ного саркогликанового субкомплекса: у-, а-, р- или 8-сарко-
гликан. Подобные миодистрофии объединяют в группу сар-
когликанопатий.
Следует подчеркнуть, что разрушение дистрофинового
комплекса является одним из центральных звеньев в этио-
логии дилатационных кардиомиопатий. При этом наследст-
венные формы подобных заболеваний могут быть связаны с
определенными дефектами как в гене дистрофина, так и в
других генах, кодирующих белки дистрофин-ассоциирован-
ного комплекса, такие как а-дистрогликан, а- и у-саркогликаны
(Towbin, 1998). Не исключено, что и приобретенные формы
дилатационной кардиомиопатий, индуцированные энтерови-
русами, в определенной степени обусловлены нарушением
нормальной работы дистрофина и ассоциированного с ним
комплекса белков (Badorf et al., 1999). Все эти факты свиде-
тельствуют о центральной роли дистрофин-ассоциированного
комплекса белков в функционировании миоцитов и кардио-
миоцитов.
Еще одна тяжелая форма миодистрофии плечевого и
тазового пояса обусловлена дефектом другого белка,
ассоциированного с дистрофином и также локализованного
в сарколемме мышечных волокон — кавеолина-3. Мутации в
гене CAV3 нарушают образование кавеол в плазматической
мембране мышечных клеток. Неожиданным оказалось
обнаружение не структурного, а энзиматического дефекта в
специфической мышечной протеазе — кальпаине-3 — при
более мягкой форме данной миодистрофии. Наиболее
простым объяснением может быть возможность участия этой
протеазы в деградации или дестабилизации структурных
компонентов цитоскелета, экстраклеточного матрикса или
Дистрофинового комплекса. Не исключается также вероятная
роль этого белка в слиянии миобластов и в контроле генной
экспрессии. При другой мягкой форме конечностно-поясной
25
миодистрофии дефектным оказывается дисферлин —
цитоплазматический белок с неизвестной функцией,
способный взаимодействовать с ядерной мембраной и с
мембранами сарко- и эндоплазматического ретикулума.
Нарушение работы плектина — большого структурного
якорного белка, соединяющего в кератиноцитах и в скелетных
мышцах цитоскелет клетки с мембраной, приводит к
необычной форме миодистрофии, сочетающейся с буллёзным
эпидермолизом.
В предлагаемом руководстве в отдельную группу
заболеваний выделены миопатии, обусловленные
дефектами белков, ассоциированных с ядерной ламиной.
Эмерин — белок, ассоциированный с ламинином ядерной
мембраны, оказывается дефектным при Х-сцепленной
форме мышечной дистрофии с контрактурами Эмери-
Дрейфуса. Более редкая аутосомно-доминантная форма
этого заболевания связана с дефектом в гене LMNA,
кодирующим два белка ядерной ламины — ламин А и С.
Эти белки являются продуктами альтернативного
сплайсинга гена LMNA и они активно взаимодействуют с
эмерином.Не исключено, что аутосомно-доминантная
форма мышечной дистрофии Эмери-Дрейфуса является
аллельным вариантом одной из доминантных форм
конечностно-поясной миодистрофии, ген которой LGMD1B
картирован в той же области 1q11-q23, где расположен ген
LMNA. Активно обсуждается возможность участия гена
LMNB1, кодирующего еще один белок семейства ядерных
ламинов — В1, в контроле другой аутосомно-доминантной
формы конечностно-поясной миодистрофии — LGMD1A,
так как оба мутантных гена расположены в одной и той же
области 5q23.3-q31.3. Миопатии, обусловленные
дефектами белков ядерной ламины, иногда объединяют в
группу эмеринопатий.
В самостоятельную клиническую группу выделяют врож-
денные непрогрессирующие миопатии, при которых дефект-
ными, как правило, оказываются гены, экспрессирующиеся
26
в раннем эмбриогенезе и кодирующие белки, участвующие в
процессах роста, дифференцировки и пролиферации мио-
бластов. Две из них обусловлены дефектами белков базаль-
ной ламины. Так, в основе развития врожденной миопатии,
сочетающейся с гипомиелинизацией белого вещества моз-
га, лежит дефект мышечного белка ламинина 2, связанного с
субсаркомерным цитоскелетом посредством олигомерного
комплекса дистрофин-ассоциированных белков. Еще одна
редкая форма врожденных миопатии связана с недостаточ-
ностью рецептора ламинина в мышцах.
Патологические процессы при некоторых врожден-
ных миопатиях сопровождаются накоплением в клетках не-
растворимых включений. Так, при немалиновой миопатии
в мышечных клетках пациентов присутствуют нитеобраз-
ные патологические фибриллярные структуры, причиной
образования которых является латеральная экспансия Z-
дисков. Эти экспансии могут возникать вследствие дефек-
тов различных белковых компонентов тонких и толстых
нитей саркомера скелетных мышц. Одна из доминантных
форм заболевания связана с мутациями в гене тропомио-
зина В. Наиболее частая аутосомно-рецессивная медлен-
но прогрессирующая немалиновая миопатия обусловлена
мутациями в гене гигантского интегрального белка сарко-
мера — небулина. При наиболее тяжелых доминантных
формах заболевания, часто заканчивающихся летальным
исходом в младенческом возрасте, дефектным оказыва-
ется ген мышечного ос-актина.
Определенные гистологические аномалии в мышеч-
ных клетках характерны также для пациентов с болезнью
Центрального стержня и с миотубулярной миопатией. В
обоих случаях дефектными оказываются белки, участвую-
щие в контроле дифференцировки мышечных волокон.
Мембранным мышечным белком является рецептор риа-
нодина 1, нарушение работы которого приводит к разви-
тию болезни центрального стержня/злокачественной гипер-
термии. Рецептор рианодина функционирует как кальций-
27
высвобождающий канал саркоплазматического ретикулу.
ма скелетных мышц. Он необходим для нормального раз*
вития и созревания мышц, а также его функции связаны с
сокращением-расслаблением миофибрилл. Первичным
биохимическим дефектом при миотубулярной миопатии,
также сопровождающейся нарушениями нормального про-
цесса созревания мышц, является миотубулярин — один
из новых членов семейства тирозинфосфатаз, участвую-
щих в регуляции роста, пролиферации и дифференциров-
ки клеток. Различные варианты миопатии Бетлема обус-
ловлены дефектной структурой микрофибриллярного кол-
лагена VI типа, выполняющего в эндомизии и перимизии
скелетных мышц роль моста между клетками и внеклеточ-
ным матриксом. Предполагается, что дефекты коллагена
типа VI могут оказывать влияние на процессы дифферен-
цировки миобластов либо, что более вероятно, на струк-
турную организацию внеклеточного матрикса.
При целом ряде миопатии причиной дистрофических
процессов является накопление в цитоплазме и/или в ядрах
мышечных клеток гистологически идентифицируемых
включений, молекулярные механизмы формирования
которых могут быть совершенно различными. Так при
окулофарингеальной миопатии тубулофиламентные
включения образуются за счет небольшого увеличения
полиаланиновой цепочки в поли(А)-связывающем белке 2,
присутствующем в клетках главным образом в димерной или
в олигомерной формах. Показано, что полиаланиновые
олигомеры чрезвычайно устойчивы к химической денатурации
и энзиматической деградации. Возможно, олигомеры поли(А)-
связывающего белка 2, составленные из достаточного числа
мутантных молекул, могут накапливаться в ядрах в качестве
филаментных включений и вызывать гибель клеток. Подобная
агрегация мутантных белков с удлиненными полиглютами-
новыми треками обнаружена в ядрах нейронов по крайней
мере при четырех нейро-дегенеративных заболеваниях,
обусловленных экспансией CAG-повтора: при хорее
28
Гентингтона, двух формах спиноцеребеллярной атаксии и при
денторубральной паллидо-люисовой атрофии (данные
нозологические формы будут рассмотрены во второй части
монографии).
Накопление в саркоплазме сердечной и скелетных
мышц плотных гранулофиламентных агрегатов, содержащих
десмин, является причиной развития аутосомно-доминант-
ной миопатии, дебютирующей во взрослом возрасте слабос-
тью проксимальных и дистальных мышц конечностей в соче-
тании с кардиомиопатией и катарактой. Десмин принадлежит
семейству промежуточных филамент типа III, участвующих в
поддержании структурной целостности мышц. Образование
патологических десмин-содержащих агрегатов может быть
следствием аномалий в самом десмине или во взаимодей-
ствующем с ним белке — аВ-кристаллине. Это мажорный бе-
лок хрусталика, присутствующий также в сердечной и в ске-
летных мышцах. Описаны и другие формы миопатии с фила-
ментными включениями в мышечных волокнах. Однако мо-
лекулярная природа образования этих включений остается
пока неизвестной.
Мутации мтДНК, в том числе делеции и дупликации,
приводящие к дефициту одного или нескольких ферментов в
митохондриальной респираторной цепи, а также мутации в
генах тРНК ответственны за наследственные заболевания,
получившие название митохондриальных энцефаломиопатий.
Мышечная слабость часто выступает в качестве одного из
ведущих симптомов при этих болезнях, которые, как прави-
ло, носят мультисистемный характер. Митохондриальные
энцефаломиопатий не обязательно обусловлены дефектами
в
мтДНК, а могут быть связаны как с доминантными, так и с
рецессивными мутациями в аутосомных генах.
И наконец, недостаточность активности ряда мышеч-
ных ферментов служит причиной развития относительно до-
брокачественных метаболических миопатии.
Остановимся более подробно на каждом из перечис-
ленных выше заболеваний.
29
1.2. Миодистрофия Дюшенна/Беккера
и дюшенно-подобные
аутосомно-рецессивные миопатии
Миодистрофия Дюшенна и аллельный ей вариант мио-
дистрофии Беккера — наиболее частая и хорошо изученная
форма тяжелой нервно-мышечной патологии. Ген, ответст-
венный за эти два заболевания, был открыт методами обрат-
ной генетики около 15 лет тому назад. Это открытие сопро-
вождалось не только идентификацией белка, дефектного при
миодистрофии Дюшенна/Беккера и получившего название
дистрофин, но и выявлением целой серии его укороченных
изоформ — апо-дистрофинов, способных выполнять в раз-
личных типах клеток спецализированные функции, отличные
от функций дистрофина. Вслед за открытием дистрофина было
описано более десятка других до этого неизвестных белков,
тесно связанных с дистрофином и образующих так называе-
мый дистрофин-ассоциированный комплекс. Оказалось, что
основной причиной развития патологических процессов при
дюшенно-подобных миопатиях является разрушение транс-
мембранного дистрофин-ассоциированного комплекса бел-
ков. Подобная деструкция может происходить вследствие
генетических дефектов либо в самом дистрофине, как это
наблюдается у больных с миодистрофией Дюшенна/Беккера,
либо в других белках дистрофин-ассоциированного комплек-
са и это в свою очередь может явиться причиной развития
гораздо более редких аутосомно-рецессивных дюшенно-по-
добных миопатии. Однако мутации в генах, кодирующих бел-
ки дистрофин-ассоциированного комплекса, сопровождающи-
еся, как правило, частичным или полным его разрушением,
не всегда реализуются в форме таких миопатии, а часто мо-
гут приводить к различным вариантам конечностно-поясных
и некоторых других мышечных дистрофий, о чем речь пой-
дет ниже. В большинстве случаев точная диагностика ауто-
сомно-рецессивных дюшенно-подобных миопатии возможна
только на базе молекулярно-генетического анализа.
30
