Горбунова В.Н., Савельева-Васильева Е.А., Красильников В.В. Молекулярная неврология. Заболевания нервно-мышечной системы
Подождите немного. Документ загружается.

липептида с делецией в домене VI ламинина-2, не способно-
го, по-видимому, обеспечить достаточную стабильность мышц
при раундах сокращения и расслабления.
б) Миопатия врожденная, обусловленная
недостаточностью а 7 интегрина (J1D
Аутосомно-рецессивная непрогрессирующая врожден-
ная миопатия с задержкой моторного развития (самостоя-
тельная ходьба после 2 лет), сочетающаяся с мышечной ги-
потонией, нередко — кривошеей.
В развитии и функционировании скелетных мышц кри-
тическую роль играет базальная ламина мышечных волокон.
Рецептором ламинина в мышцах является а 7 субъединица
интегрина (31D. Интегрины — семейство гетеродимерных
мембранных гликопротеинов, опосредующих широкий спектр
межклеточных и клеточно-матриксных взаимодействий. Из-
вестно 16 а- и 8 р-цепей интегринов. В свою очередь а-цепи
делятся на 2 группы различающиеся по наличию инсерции
около 180 аминокислот в экстраклеточном домене.
Для того чтобы проанализировать роль а 7 субъеди-
ницы интегрина p1D в патогенезе болезней мышц, прово-
дили иммуногистохимическое исследование биоптатов
мышц 117 пациентов с неклассифицированными форма-
ми врожденных миопатии. У трех пациентов было обнару-
жено отсутствие иммунореактивных форм исследуемого
белка при нормальном уровне экспрессии а2 ламинина
(Mayer et al., 1997). Оказалось, что у всех трех пациентов
имеются мутации в кодирующей части гена а7 интегрина |J1 D
— ITGA7 (integrin alpha 7), локализованного в области 12q13
(Wang et al., 1995). Один пациент был компаунд-гетерозиго-
той по двум сплайсинговым мутациям, одна из которых при-
водила к инсерции 7 аминокислот в консервативном цисте-
ин-богатом районе белка, другая сопровождалась делецией
98 нуклеотидов. Эта же делеция в компаунде с делецией 1
нуклеотида была обнаружена у другого неродственного
больного. У третьего пациента было резко снижено содер-
жание мРНК-транскрипта ITGA7 Таким образом, было до-
121

казано, что мутации в гене ITGA7 ответственны за некото-
рые редкие формы мягких врожденных миопатии.
Получена трансгенная линия мышей с направленно раз-
рушенным геном а7 интегрина — Itga7 Мутантные живот-
ные имеют признаки врожденной миопатии, сходной с той,
которая наблюдается у пациентов с дефицитом а7 интегрина
p1D(Hayashi et al., 1998).
в) Нитчатая (немалиновая) миопатия, тип 1 (MIM:
161800); тип 2 (MIM: 256030)
1. Клиническая характеристика заболевания
Считается, что немалиновая миопатия наиболее часто
встречающаяся форма врожденных непрогрессирующих ми-
опатии. Нередко это заболевание диагностируется благода-
ря ряду дизэмбриогенетических внешних признаков. У боль-
ных часто отмечается удлиненный лицевой череп, низко рас-
положенные ушные раковины, готическое небо, гипоплазия
нижней челюсти, деформации грудной клетки по типу «кури-
ной» и позвоночника в виде кифосколиоза. Характерна так-
же амимия, обусловленная включением в процесс лицевой
мускулатуры. Больные плохо морщат лоб, не полностью смы-
кают веки, не могут свистеть, надувать щеки. Часто наблю-
дается носовой оттенок голоса. Мышечная гипотония и мы-
шечная слабость проявляются с первых месяцев жизни и как
при любой диффузной мышечной слабости имеет место симп-
том «запрокидывания» головы при попытке поднять лежа-
щего на спине ребенка за руки. Выражены симптомы «сво-
бодных» надплечий, «треножника» и др. Отстают темпы мо-
торного развития. В первые три года возможны повторные
пневмонии. Дети начинают ходить с полутора лет, не могут
бегать, прыгать. В дальнейшей жизни больные остаются ин-
валидами, однако способность к самостоятельному передви-
жению сохраняется, что дает возможность приспособиться к
самообслуживанию и даже приобрести специальность. Тече-
ние заболевания в целом относительно стационарное. Мы-
шечная сила более снижена в проксимальных отделах конеч-
122

ностей, и отчетливо преобладает слабость в руках. Глубокие
рефлексы снижены и в течение жизни могут угасать. Разви-
тия сухожильных ретракций, как правило, не отмечается.
Весьма характерны мышечные атрофии.
Немалиновая миопатия получила свое название в свя-
зи с особыми нитеобразными структурами, обнаруживаемы-
ми при гистологическом анализе в мышечных клетках боль-
ных. Патологический фибриллярный материал сходен с ве-
ществом, образующим Z- диски и, возможно, является тро-
помиозином В. Наряду с тропомиозином В, а-актинин явля-
ется главным белковым компонентом Z-дисков и немалино-
вого тела, образующегося, по-видимому, в результате лате-
ральной экспансии Z-дисков.
Чаще всего немалиновая миопатия наследуется по ау-
тосомно-рецессивному типу, хотя описаны и доминантные
формы заболевания. Оказалось, что не менее трех генов
изолированно участвуют в контроле немалиновой миопатии:
доминантные формы заболевания связаны с мутациями в
гене ос-тропомиозина — ТРМЗ и в гене мышечного а-акти-
на — АСТА1, тогда как типичная непрогрессирующая или
медленно прогрессирующая рецессивная форма обусловле-
на мутациями в гене небулина — NEB (Laing et al., 1995; Pelin
et al., 1999; Nowak et al., 1999).
2. Роль а-актинина и ос-тропомиозина в патогенезе
немалиновой миопатии
При различных формах немалиновой миопатии часто
обнаруживается снижение или отсутствие актин-связанного
белка а-актинина в мышечных клетках, тогда как в немышеч-
ных клетках пациентов никаких аномалий актина или а-акти-
нина не отмечается (Wallgren-Petersson et al., 1990). Было
высказано предположение, что гены мышечного а-актини-
на — ACTN2 и ACTN3, расположенные в хромосомах 1q42-
q43 и 11q13-q 14 соответственно, ответственны за некоторые
формы немалиновой миопатии. Однако в дальнейшем это
предположение не нашло экспериментального подтвержде-
ния. Так, с использованием техники микросателлитного кар-
123
тирования было исключено сцепление рецессивной формы
заболевания с геном ACTN2 (Tahvanainen et al., 1994). Мало-
вероятно также, что эта форма немалиновой миопатии обус-
ловлена дефектом гена ACTN3. Хотя а-актинин 3 отсутствует
при многих формах миопатии, этот дефект не является пер-
вичным. При проведении обширного иммуно-скрининга с ис-
пользованием образцов биоптатов мышц 55 контрольных ин-
дивидуумов и 118 пациентов с различными формами нейро-
мышечных заболеваний (среди них 74 пациента с миопатия-
ми и 20 — с нейрогенными болезнями) экспрессии гена
ACTN2 у больных не было обнаружено ни в одном случае,
тогда как а-актинин 3 отсутствовал в 19% исследованных
образцов (North et al., 1999). При этом никакой корреляции
между биохимическим дефектом и клиническим фенотипом
выявлено не было. Оказалось, что в 96 % случаев отсутст-
вие а-актинина 3 связано с наличием двух высокополиморф-
ных гомозиготных мутаций в гене ACTN3: миссенс-мутации
Q523R и нонсенс-мутации R577X. В разных популяциях час-
тота нонсенс-мутации R577X варьирует от 22% до 52%. Вы-
явлено сильное неравновесие по сцеплению между двумя
этими мутациями. В подавляющем большинстве случаев в
популяциях встречается сочетание либо двух мажорных, либо
двух минорных аллелей. Суммарная частота аллелей 523R/
577R и 523Q/577X составляет всего лишь около 4%.
При семейном генетическом анализе было обнаруже-
но сцепление гена NEM1(nemaline myopathy JJ, ответствен-
ного за доминантную форму заболевания, с геном АРОА2,
картированным в области 1q21-q23 (Laing et al., 1992). Неда-
леко от APOA2 в районе 1q23-q24 локализован ген а-субъе-
диницы немышечного тропомиозина — ТРМЗ. У человека
идентифицировано 4 гена тропомиозина. Для каждого из этих
генов показан альтернативный сплайсинг, сопровождающий-
ся образованием множественных изоформ соответствующих
белков. Ген ТРМЗ преимущественно экспрессируется в мы-
шечных волокнах первого типа. Этот ген также был исследо-
ван в качестве кандидатного для NEM1. В одной из семей с
124

доминантно наследуемой немалиновой миопатией у больных
была обнаружена миссенс-мутация в гене ТРМЗ, косегреги-
рующая с заболеванием (Laing et al., 1995). Эта мутация со-
провождается заменой аминокислоты в актин-связывающем
центре немышечного тропомиозина. Полученные данные
делают весьма вероятной гипотезу об идентичности генов
ТРМЗ и NEM1. Эта гипотеза была подтверждена в дальней-
шем при обнаружении в гене ТРМЗ гомозиготной нонсенс-
мутации у пациента с рецессивным типом наследования не-
малиновой миопатии (Tan et al., 1999). Таким образом, мута-
ции в гене а-тропомиозина могут явиться причиной разви-
тия как доминантных, так и рецессивных форм заболевания.
З.Молекулярные основы аутосомно-реиессивной медленно
прогрессирующей немалиновой миопатии
В ряде семей с аутосомно-рецессивным типом насле-
дования и типичным течением непрогрессирующей или мед-
ленно прогрессирующей немалиновой миопатии, дебютиру-
ющей в младенческом возрасте, было обнаружено сцепле-
ние мутантного гена NEM2 с маркерами длинного плеча хро-
мосомы 2. В области 2q21.2-q22 локализован ген небулина —
NEB (Zeviani et al., 1988). Кодирующая часть гена NEB разде-
лена на 187 экзонов, распределенных на площади около
400 кб. Размер кДНК гена NEB составляет 20.8 кб.
Огромный по своим размерам саркомерный белок не-
булин, составляющий около 3—4% всего микрофибрилляр-
ного белка, является наряду с актином и титином интеграль-
ным компонентом тонких филамент поперечно-полосатых
мышц
(Wang
et al., 1996). Молекулярная масса небулина ва-
рьирует от 600 до 800 кД, и полипептид, состоящий из 6690
аминокислот, содержит 185 копий 35-аминокислотных моду-
лей, кодируемых отдельными экзонами гена NEB.3TH повто-
ряющиеся модули классифицированы на 7 различных типов.
120-кД карбокси-терминальный район небулина высококон-
сервативен и гомологичен одному из филаментных белков
сердечной мышцы (nebulette). На С-конце небулина распола-
гаются два уникальных домена — серин-богатый, содержа-
125

щий многочисленные сайты фосфорилирования, и ЭНЗ-до-
мен. Модули М 163-М 176 являются компонентами 1-диска,
тогда как М177-М 185 входят в Z-мембрану. Прикрепление
небулина к Z-дискам саркомера осуществляется посредст-
вом его взаимодействия с ЭНЗ-гомологичной последователь-
ностью. Таким образом, С-терминальный район небулина,
локализованный в I-Z-I диске, участвует в регуляции образо-
вания и интеграции Z-мембраны в саркомере. Множество
изоформ небулина, образующихся за счет альтернативного
сплайсинга гена NEB, определяют молекулярное разнообра-
зие Z-дисков. Особенно интенсивный дифференциальный
сплайсинг наблюдается в районе повторяющихся модулей
М176 —М182.
Был проведен молекулярный анализ З'-района кДНК
гена NEB, включающего экзоны 163—172, в 22 семьях раз-
личного этнического происхождения с рецессивной формой
небулиновой миопатии (Pelin et al., 1999). Поиск мутаций осу-
ществляли с использованием методов однонитевого конфор-
мационного полиморфизма (SSCP) и обратной ПЦР (RT-PCR).
При этом анализе было идентифицировано 6 различных му-
таций у больных из 5 семей различного этнического проис-
хождения. Все мутации сопровождались сдвигом рамки счи-
тывания и образованием укороченных на 25-80 кД форм не-
булина. Иммунофлюоресцентный анализ с использованием
антител на С-терминальную часть белка показал, что укоро-
чение небулина ведет к потере разнообразия типов волокон
и это, по-видимому, является основной причиной развития
патологических процессов, ведущих к образованию немали-
новых тел.
4. Актиновая миопатия
Относительно недавно были описаны 3 пациента с тя-
желой формой врожденной миопатии, в мышечных биопта-
тах которых наблюдались большие накопления тонких фила-
мент, расположенные под сарколеммой мышечного волокна
(Goebrl et al., 1997). Двое из этих пациентов умерли в мла-
126
денческом возрасте, третий дожил до 7.5 года. Наблюдае-
мые у пациентов филаментные образования интенсивно ок-
рашивались антителами на актин, и потому заболевание по-
лучило название актиновой миопатии. Ген а-актина скелет-
ных мышц — АСТА1, локализованный в области 1q42, был
исследован в качестве кандидатного для новой формы мио-
патии (Nowak et al., 1999). У всех трех пациентов были найде-
ны гетерозиготные миссенс-мутации в кодирующей области
гена АСТА1. Поскольку у двух из обследованных пациентов
наряду с филаментными образованиями наблюдались нема-
линовые тела, было высказано предположение, что некото-
рые тяжелые формы немалиновой миопатии могут быть кли-
ническими вариантами актиновой миопатии. У детей с тяже-
лыми формами немалиновой миопатии уже при рождении от-
мечается выраженная гипотония и слабость мышц, недоста-
ток спонтанных движений, затруднения при кормлении и ды-
хательная недостаточность. Такие дети часто погибают в мла-
денческом или в раннем детском возрасте.
Для проверки выдвинутого предположения был прове-
ден поиск мутаций в гене АСТА1 у 59 больных с различными
формами немалиновой миопатии, включая тяжелую (Nowak
et al., 1999). В результате у больных из 14 неродственных
семей было идентифицировано 15 различных миссенс-мута-
ций, затрагивающих все 6 кодирующих экзонов гена АСТА1.
Во всех этих семьях, за исключением одной, мутации у боль-
ных присутствовали в гетерозиготном состоянии, что под-
тверждает доминантный характер наследования заболева-
ния. В 7 случаях удалось доказать возникновение мутации
de novo. В одной из семей с относительно мягким течением
заболевания было прослежено рецессивное наследование.У
большинства носителей мутаций немалиновая миопатия про-
являлась в очень тяжелой форме и приводила к гибели детей
в младенческом возрасте (8 семей) или в первом десятиле-
тии жизни (3 семьи). Таким образом, было доказано, что на-
следуемые по аутосомно-доминантному типу тяжелые фор-
мы немалиновой миопатии, а также некоторые рецессивные
127
формы заболевания могут быть обусловлены мутациями в
гене а-актина, то есть являются аллельными вариантами ак-
тиновой миопатии.
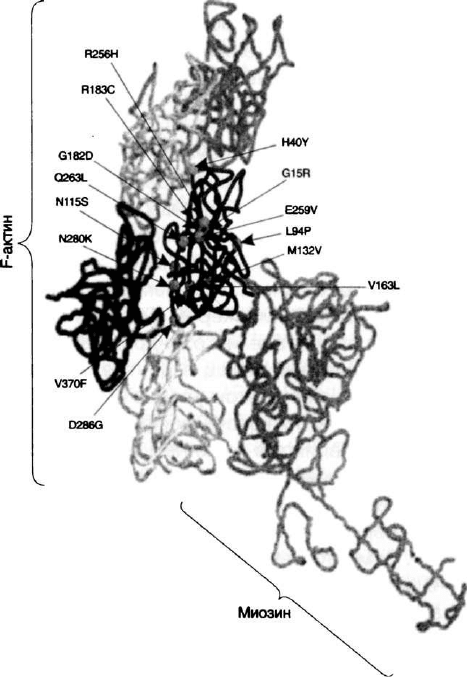
На рис. 15 схематически изображена модель F-актина,
взаимодействующего с миозином. Взаимодействие между F-
актином тонких филамент и миозином толстых филамент
лежит в основе сокращения и расслабления мышечных во-
локон. F-актин состоит из 6 отдельных субъединиц актина. В
центре комплекса расположен а-актин. Кружками указана
локализация аминокислотных замен, идентифицированных
у больных с актиновой и немалиновой миопатией. Иденти-
фицированные мутации могут быть разделены на два типа:
(1) замещения остатков, расположенных в гидрофобных кла-
стерах или в корах — L94P, M132V, V163L и V370F, и (2) — на
поверхности молекулы —G15R, H40Y, N115S,G182D, R183C,
R256H, E259V, Q263L, N280K и D286G. Некоторые из этих
мутаций, идентифицированные у пациентов с наиболее тя-
желыми формами заболевания, локализованы в функцио-
нально-значимых сайтах актиновой молекулы. Так, глицин в
15 положении а-актина (G15) принимает участие в образо-
вании водородных связей с (3-фосфатами АТФ и АДФ, амино-
кислотные остатки G182 и R183 локализованы в сайтах свя-
зывания с ДНКазой I, а Н40 и V370 — в сайтах связывания с
миозином. Аспарагиновая кислота в 286 положении прини-
мает непосредственное участие во взаимодействиях субъе-
диниц F-актина, и можно предположить, что ее замещение
приводит к дестабилизации всего комплекса. Аминокислоты
R183 и N280, расположенные на поверхности а-актина, спо-
собны формировать ионные взаимодействия с другими час-
тями актина. В этой связи интересно подчеркнуть, что в ана-
логичных взаимодействиях принимают участие две амино-
кислоты в актине сердечной мышцы — R312 и Е361 — и каж-
дая из них вовлечена в мутацию при одном из наследствен-
ных вариантов дилатационной кардиомиопатии (Olson et al.,
1998). Однако, несмотря на очевидную связь между харак-
тером мутационного повреждения в гене АСТА1 и тяжестью
128
течения актиновой миопатии, в ряде случаев не удается ис-
ключить зависимость фенотипического проявления мутаций
от каких-то других факторов как эндогенного, так и экзоген-
ного порядка.
Рис. 15. Модель F
:
-актина и миозина с указанием
локализации аминокислотных замен, идентифицированных
у больных с немалиновой миопатией
9 Заказ № 170
Подводя итоги, можно заключить, что молекулярной
основой развития патологических процессов и, в частности,
образования немалиновых тел при различных формах нема-
линовой миопатии являются дефекты в структуре небулина,
актина и, возможно, других белков тонких филамент, а так-
же взаимодействующих с ними белков, таких как тропомио-
зин и а-актинин. Подобные дефекты ведут к нарушению фи-
зиологического взаимодействия этих белков в Z-дисках, и эти
нарушения являются критическими для развития немалино-
вой миопатии.
г) Болезнь центрального стержня (MIM: 117000)
Заболевание выделено как самостоятельная нозологи-
ческая форма из группы врожденных непрогрессирующих
миопатии, благодаря своеобразным морфологическим изме-
нениям мышечных волокон, обнаруживаемым в биопатах при
специальной окраске с использованием электронной микро-
скопии. Гистологическим маркером болезни центрального
стержня является отсутствие митохондрий на свежезаморо-
женных срезах скелетных мышц в центре многих волокон
первого типа. На биохимическом уровне имеет место высво-
бождение фосфата из глюкозо-6-фосфата. Начальные при-
знаки болезни проявляются в раннем возрасте общей мы-
шечной гипотонией, мышечной слабостью, задержкой тем-
пов моторного развития. Интеллектуальное развитие не стра-
дает. Статус в первые месяцы укладывается в понятие «вя-
лый ребенок». Самостоятельная ходьба начинается с задерж-
кой на 4—6 месяцев и характеризуется неуверенностью и
частыми падениями. Мышечная слабость локализуется пре-
имущественно в проксимальных отделах верхних и нижних
конечностей. Слабость мышц спины и грудной клетки может
способствовать развитию костных деформаций в виде ско-
лиоза позвоночника, воронкообразной или «куриной» груд-
ной клетки. Атрофии мышц выражены умеренно, псевдоги-
пертрофий не бывает. Глубокие рефлексы сохраняются, хотя
могут быть в той или иной степени снижены. Сухожильные
130
