Фёршт Э. Структура и механизм действия ферментов
Подождите немного. Документ загружается.


ТРЕХМЕРНАЯ СТРУКТУРА ФЕРМЕНТОВ
31
Таблица
1.3
Гомологичность сериновых протеаз
млекопитающих
Фермент
Поджелудочная
железа
Трипсин
Химотрипсин
А
Химотрипсин
В
Эластаза
Плазма
Тромбин
Фактор
Ха
Гомологичность
%
100
53
49
48
38
50
а
) Аминокислотный состав ферментов сравнивается
с таковым
для
бычьего трипсина.
Все
ферменты выделены
из
клеток быка,
за
исключением эластазы, выделенной
из
клеток свиньи. [Hartley
В. S., Sym. Soc.
Gen. MIcrobloI.,
24,
152 (1974)].
Совершенно неожиданные особенности были обнаружены
в
кристаллической
структуре
химотрипсина. Исследования этого
фермента
в
растворе показывали,
что
имидазольное кольцо
His-57
повышает реакционную способность
Ser-195.
Однако
ни-
каких указаний
на то, что
этот гистидин связан водородной
связью
с
карбоксильной группой
Asp-102,
в
результате
чего
образуется каталитическая триада, известная
под
названием
«система
с
переносом
заряда»
[38], не
было. Теперь такая
система обнаружена
во
всех
сериновых протеазах.
А.
—с
ны"Л I (1.3)
\,
<ч?
но
По-видимому, сериновые протеазы млекопитающих являются
классическим
результатом
дивергентной
эволюции.
Все
они,
ве-
роятно,
происходят
от
некоего общего предка
—
сериновой
про-
теазы, образовавшейся
в
далеком прошлом.
2. Сериновые протеазы микроорганизмов:
конвергентная эволюция
Определение кристаллической
структуры
бактериальной
се-
риновой протеазы
—
субтилизина
из
Bacillus
amyloli-
quifaciens
—
показало,
что
данный фермент резко отли-

32
ГЛАВА
I
чается от сериновых протеаз млекопитающих [39]. Это не было
неожиданностью, поскольку субтилизин имеет иную аминокис-
лотную последовательность. Однако при более детальном ис-
следовании обнаружилось, что по способности связывать суб-
страт и по своим каталитическим свойствам эти ферменты фун-
кционально
идентичны. В субтилизине имеется система с
переносом заряда, такая же, как у аналогичных ферментов мле-
копитающих, система водородных связей для связывания кар-
бонильного кислорода и ацетамидной NH-группы субстрата и
тот же набор подцентров для связывания ацильного фрагмента
субстрата (рис. 1.12, см. также ниже). По-видимому, в данном
случае
мы имеем пример
конвергентной
эволюции.
Различные
организмы,
начиная с разных третичных структур, выработали
некий
общий механизм катализа.
Как
было показано позже, некоторые сериновые протеазы
неживотного происхождения на
20—50%
гомологичны анало-
гичным ферментам млекопитающих (табл. 1.4), что свидетель-
ствует
о значительном
сходстве
их третичных структур. Когда
Таблица
1.4
Различия
между
сериновыми протеазами
а
'
Фермент
Трипсин
Эластаза
Субтилизин
Источник
Бык
Акула
5.
griseus
Свинья
М.
sorangium
S.
griseus
В.
subtilis
В.
amyloliquifaciens
Гомологичность, %
100
69
43
48
26
~20
0
0
а
' Данные взяты из табл. 1.3 и работы Delbaere L. Т. J,, Hutcheon
W. L. В., James М. N. G., Thiessen W. E., Nature, Lond., 267, 758 (1975).
была установлена кристаллическая
структура
эластазоподобной
протеазы из 5.
griseus,
оказалось, что, хотя ее полипептидная
цепь
существенно короче (186 аминокислотных остатков вместо
246 в а-химотрипсине),
2
/
3
цепи имеет ту же конформацию, что и
у ферментов млекопитающих [40]. Возможно, бактериальные и
панкреатические ферменты происходят от общего предшествен-
ника,
хотя
следует
отметить, что эволюционные взаимосвязи
между
этими типами организмов совершенно неясны.

ТРЕХМЕРНАЯ
СТРУКТУРА
ФЕРМЕНТОВ 33
3. Карбоксипептидазы [41, 42]
Карбоксипептидаза А гидролизует белки с С-конца полипеп-
тидной цепи. Она специфична в отношении гидрофобных боко-
вых цепей фенилаланина, тирозина и триптофана. Карбоксипеп-
тидаза В специфична в отношении положительно заряженных
боковых цепей лизина и аргинина. Между этими ферментами
существует
такая же связь, как
между
химотрипсином и трип-
сином.
Их аминокислотные последовательности идентичны на
49%. Что касается различий в третичной структуре, то они
имеются лишь в участках молекул, расположенных на поверхно-
сти.
Основное отличие состоит в том, что остаток Пе-255, нахо-
дящийся
в кармане карбоксипептидазы А, в карбоксипептидазе
В заменен на
Asp-255,
необходимый для связывания положи-
тельно заряженных боковых цепей основных субстратов.
4. Дегидрогеназы и домены [43]
Вполне разумно предположить, что ЫАО
+
-зависимые дегид-
рогеназы — класс ферментов, связанных с одним и тем же ко-
фактором
и обладающих одной и той же функцией — составля-
ют группу структурно родственных ферментов. По-видимому,
так
оно и есть, однако структурное родство проявляется не столь
четко, как в
случае
сериновых протеаз. При наложении молекул
лактатдегидрогеназы акулы и растворимой малатдегидрогеназы
свиньи
(первых
двух
ферментов класса NAD+-3aBHCHMbix дегид-
рогеназ, которые удалось получить в кристаллическом виде)
наблюдается почти полное их совмещение; исключение состав-
ляют первые 20 остатков лактатдегидрогеназы. Вполне есте-
ственно было предположить, что эти ферменты произошли от
общей дегидрогеназы-предшественника. Установление
структу-
ры алкогольдегидрогеназы из печени лошади и глицеральде-
гид-3-фосфат—дегидрогеназы омара, которая оказалась суще-
ственно
иной,
усложнило картину, хотя и обнаружилось, что
каждый из четырех ферментов состоит из
двух
доменов и один
из
них одинаков у
всех
четырех белков. Это участок, на котором
происходит связывание NAD+ (рис.
1.13).
Обнаруженные структурные особенности привели к созданию
следующей гипотезы: дегидрогеназы появились в
ходе
эволюции
в
результате
слияния гена, который кодировал участок фермен-
та, связывающий динуклеотид, с рядом генов, каждый из кото-
рых кодировал отдельный «каталитический домен». Такой
меха-
низм
дает
весьма простой способ получения семейства фермен-
тов с разной специфичностью.
Складка в молекуле фермента, где происходит связывание
нуклеотида, имеет сложную
структуру,
изменяющуюся при
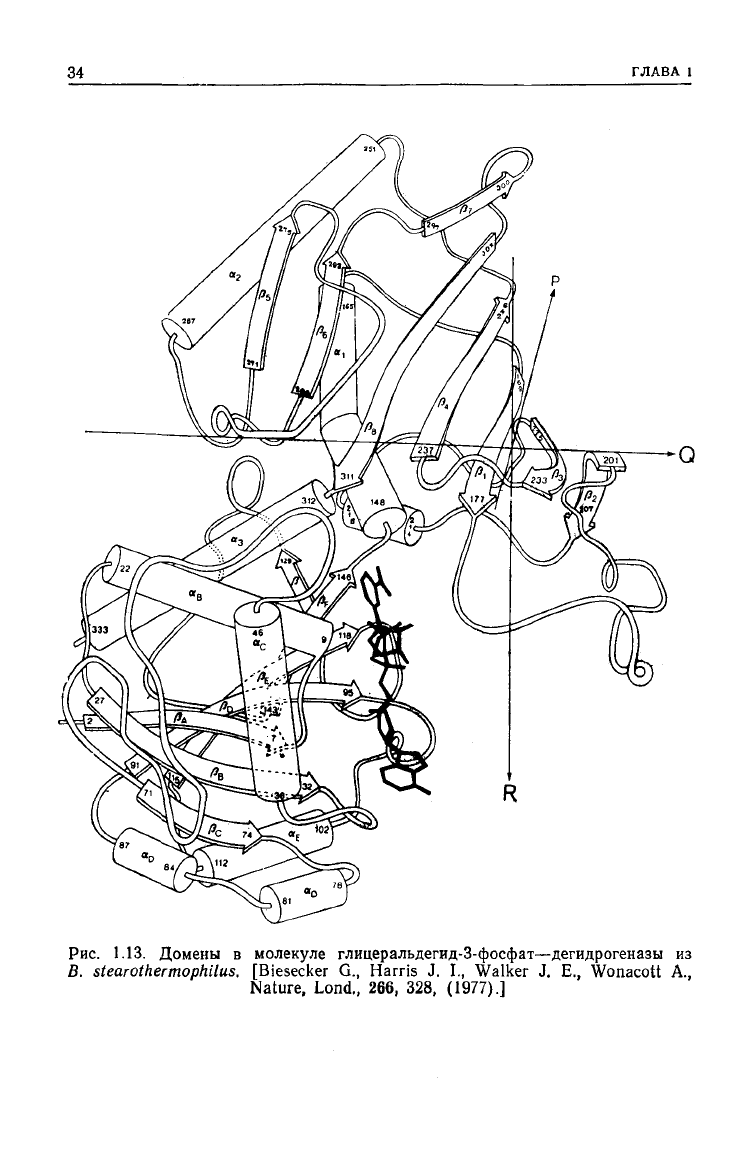
34
ГЛАВА
1
Рис.
1.13. Домены в молекуле глицеральдегид-З-фосфат—дегидрогеназы из
В.
stearothermophilus.
[Biesecker G., Harris J. I., Walker J. E., Wonacott A.,
Nature,
Lond., 266, 328, (1977).]

ТРЕХМЕРНАЯ
СТРУКТУРА
ФЕРМЕНТОВ 35
переходе от одной дегидрогеназы к другой. В первом приближении
можно считать, что она образована шестью параллельными
участками р-структуры и четырьмя параллельными спиральны-
ми
участками, направление которых противоположно направле-
нию
р-структуры. Подобная
структура
встречается у многих
связывающих нуклеотиды белков, например у фосфоглицерат-
киназы.
Однако она обнаружена и у таких белков, как флаво-
доксин,
которые не относятся к нуклеотид-связывающим. Явля-
ется ли это
сходство
указанием на наличие общего эволюцион-
ного белка-предшественника или оно связано только с ограни-
ченностью числа способов укладки полипептидной цепи — не
известно.
Г. Структура фермент-субстратных комплексов
Удивительная особенность ферментативного катализа состо-
ит в том, что фермент специфическим образом связывает суб-
страт и все реакции протекают внутри фермент-субстратного
комплекса.
Таким образом, чтобы понять, как работает фермент,
необходимо знать
структуру
не только нативного фермента, ной
комплексов
фермента с субстратами, а также промежуточных
соединений
и продуктов. Только в этом
случае
мы сможем по-
нять,
как происходит связывание субстрата, какие каталитиче-
ские
группы
участвуют
в этом процессе и какие структурные
изменения
происходят в
субстрате
и ферменте при образовании
фермент-субстратного комплекса. Основная трудность на этом
пути связана с тем, что реакции в фермент-субстратных комп-
лексах и образование продуктов протекают за доли секунды,
тогда
как для снятия рентгенограммы требуется, как правило,
несколько
часов. В связи с этим обычно определяют
структуру
комплексов
ферментов с продуктами реакции, ингибиторами
или
аналогами субстратов.
1. Методы исследования
фермент-субстратных комплексов
а.
Разностный
Фурье-метод
Обычно белковые кристаллы содержат около 50% раствори-
теля, иногда эта величина уменьшается до 30%, но никогда не
бывает меньше. Нередко в кристаллах имеются заполненные
растворителем каналы, которые
идут
от поверхности образца к
активному центру; по ним субстраты
могут
диффундировать
внутрь кристаллов и связываться с ферментом. Часто проводят
сокристаллизацию фермента с субстратами. Разностный Фурье-

36
ГЛАВА
1
метод позволяет установить
структуру
комплекса в том случае,
когда связывание лиганда не сопровождается сильными изме-
нениями
в
структуре
или упаковке молекул фермента в кристал-
ле.
Этот метод состоит в выявлении различий
между
рентгено-
граммами исходных кристаллов белка и этих же кристаллов,
пропитанных
раствором лиганда. Электронную плотность мо-
лекулы связанного лиганда и любые незначительные измене-
ния
в
структуре
фермента можно определить, не устанавливая
полную
структуру
комплекса.
б.
Получение
стабильных
комплексов
Отправным пунктом в первых опытах по определению
структуры фермент-субстратного комплекса, в котором
субстрат
связан
продуктивно, была
структура
стабильных комплексов
между
ферментом и ингибитором. Классическим примером та-
кого рода является установление структуры лизоцима (см. конец
данной
главы). Указанный
подход
можно реализовать несколь-
кими
способами. Например, можно связать определенную часть
молекулы субстрата с ферментом и установить
структуру
остальной части путем построения модели. Другой способ состо-
ит в использовании не способного к ферментативному превра-
щению
аналога субстрата, в котором модифицирована реакци-
онноспособная
связь. Показательным примером применения по-
добного подхода может служить связывание рибонуклеазой
фосфоната
вместо фосфата (гл. 12, разд. В).
Иногда
удается прямо исследовать реакционноспособный
фермент-субстратный комплекс в условиях, при которых фермен~
тативная реакция не протекает. Эти прием и основаны на ис-
пользовании
медленно реагирующих субстратов при рН, когда
фермент почти полностью инактивирован в
результате
перехода
остатка каталитического центра в
другое
ионное состояние
(см.
индолилакрилоилхимотрипсин), или при очень низких тем-
пературах (ацильное производное эластазы; см. ниже), либо на
использовании
химически модифицированного фермента. При-
мером химической модификации является восстановление кар-
боксильной
группы важного в каталитическом отношении остат-
ка
Asp-52
лизоцима до спиртовой группы (см. ниже и гл. 12,
разд. Д).
Иногда
удается прямо исследовать реакционноспособный
фермент-субстратный комплекс при быстром протекании реак-
ции.
Эта возможность реализуется в тех
случаях,
когда
между
субстратом и продуктом устанавливается равновесие, смещенное
в
сторону образования субстрата. Добавление к равновесной
смеси фермента не может изменить положение равновесия в
растворе, в
результате
чего удается получить стабильный фер-

ТРЕХМЕРНАЯ СТРУКТУРА ФЕРМЕНТОВ 37
мент-субстратный комплекс. Однако нет никакой уверенности в
том, что положение равновесия, имеющее место в растворе,
остается прежним для связанных с ферментом реагентов (гл. 3).
Примером
такого равновесия служит гидролиз дипептида,
предпочтительный синтез которого
можно
стимулировать введе-
нием
избытка амина [44, 45]:
RCONHR'
<-^ RCO
2
-+ Н
+
+ R'NH
2
. (1.4)
Этот
подход
был использован также в опытах с применением
ЯМР-спектроскопии
[46].
Другим примером является связывание диоксиацетонфосфа-
та триозофосфатизомеразой (гл. 12, разд. Ж.1). Этот фермент
катализирует изомеризацию одного реагента в другой; устанав-
ливающееся равновесие сдвинуто в сторону образования одной
из
форм. Напомним, что для обратной реакции комплекс фер-
мент—продукт является фермент-субстратным комплексом.
Примеры
применения
всех
этих подходов обсуждаются в
гл. 12. Ниже несколько более подробно рассмотрены сериновые
протеазы и лизоцим. Эти ферменты сыграли важную роль в
развитии обсуждаемых здесь идей и методов и часто упомина-
ются в данной книге.
2. Пример 1: сериновые протеазы
Пептиды
и синтетические сложные эфиры гидролизуются
сериновыми
протеазами с образованием в качестве промежу-
точного продукта ацилфермента [47]:
Е—ОН
+ RCONHR' ч=^= Е—OH.RCONHR'
О"
Е—О—С—R
ч=* Е—OCOR ц=£ Е—OH.RCO
2
H
NHR'
+
т1 О-
5
)
NHR
NH
2
R'
||
Е—ОН
+
RCO
2
H
Сначала
в
результате
атаки
субстрата
гидроксилом
Ser-195
образуется нековалентно связанное промежуточное
со-
единение,
превращающееся
в
тетраэдрическое
промежуточное
соединение.
Затем
это
соединение распадается
с
образованием
ацилфермента
с
высвобождением амина
или
спирта. Далее
про-
исходит гидролиз ацилфермента
и
образование комплекса
фер-
мент—продукт. Кристаллографические исследования позволи-
ли
установить
структуру
большинства
из
этих комплексов.

38
ГЛАВА
1
Структура остальных может быть получена путем построения
моделей. Двигаясь в обратном направлении, от «фермент-про-
дуктного»
комплекса к фермент-субстратному, Стейц и др. [48]
установили
структуру
комплекса химотрипсина с продуктом —
Рис.
1.14. Ленточная диаграмма полипептидной цепи соевого ингибитора
трипсина. Зачерненные участки — области контакта с ферментом.
[Blow
D. М.,
Janin J., Chotia С, Nature, Lond., 249, 54
(1974).]
Ы-формил-Ь-триптофаном.
Авторы
использовали диффузию
продукта внутрь кристаллического фермента с последующим
применением разностного Фурье-метода.
Структуру
неспеци-
фичного ацилфермента, индолилакрилоилхимотрипсина, опреде-
ляли при рН 4, когда деацилирование комплекса происходит
очень медленно [49]. Субстрат, активированное производное
кислоты — индолилакрилоилимидазол, диффундировал в кри-

ТРЕХМЕРНАЯ
СТРУКТУРА
ФЕРМЕНТОВ
39
сталл, где ацилировал Ser-195.
Структуру
карбобензоксиаланил-
эластазы определяли при температуре
—55°С
[50, 51].
Природа предоставила нам редкую возможность установить
структуру
фермент-субстратных комплексов трипсина и химо-
трипсина с полипептидами, создав множество ингибиторов-по-
липептидов, которые очень прочно связываются с трипсином и
химотрипсином, поскольку зафиксированы в той конформации,
которую
субстрат
принимает при связывании [52]. Эти поли-
пептиды не гидролизуются при физиологических условиях, так
как
подвижность аминогруппы, которая высвобождается при
расщеплении пептида, ограничена и она не может диффундиро-
вать из активного центра фермента. При устранении ограниче-
ний
в панкреатическом ингибиторе трипсина путем восстановле-
ния
дисульфидного мостика в полипептидной цепи пептидная
связь
между
Lys-15
и
Ala-16
легко расщепляется трипсином
[53]. Структура трипсина, его комплекса с основным панкреа-
тическим ингибитором трипсина и свободного ингибитора была
установлена при разрешении 1,4, 1,9 и 1,7 А соответственно [54].
Полученные данные относятся к числу наиболее точных — поло-
жение атомов известно с точностью
0,1—0,2
А. Эти и
другие
исследования дали
следующую
информацию относительно свя-
зывания
субстратов [55—65].
а. Центр
связывания
«Центр связывания» полипептидного
субстрата
состоит из
ряда подцентров, расположенных по поверхности фермента. Эти
подцентры обозначаются так, как показано на
схеме
(1.6). Ами-
нокислотные остатки полипептидного
субстрата
обозначаются
буквой Р, а подцентры — буквой S. Если не считать первичного
подцентра Si, связывающего боковые цепи ароматических суб-
стратов химотрипсина или основных аминокислотных субстратов
трипсина, в сериновых протеазах нет никаких явно выраженных
складок или желобков, которые предназначались бы для связы-
вания
субстрата.
S
4
S
3
S
2
Sj Si Si
О О О О О .О
—NHCHC—NHCH(5-NHCHCyNHCH(^-NHCHC—NHCHC—NH—
R: R't R'Z (1.6)
R
4
R
3
Р
4
P, P'i Pi
Расщепление

40
ГЛАВА
I
б. Первичный подцентр связывания (S,)
Карман,
связывающий ароматические боковые цепи специ-
фических субстратов химотрипсина, представляет собой четко
выраженную впадину глубиной 10—12 А, имеющую в попереч-
ном
сечении размеры
3,5—4
А на
5,5—6,5А
[48]. Эти параметры
точно соответствуют размерам ароматического кольца, ширина
которого составляет 6 А, а толщина — 3,5 А. Диаметр метилено-
вой
группы равен 4 А (гл. 9), так что боковые цепи лизина или
Рис.
1.15. Схематическое изображение участка связыва-
ния
уходящей группы в химотрипсине, полученное с по-
мощью подгонки модели ингибитора панкреатического
трипсина
к
структуре
фермента [65].
аргинина
прочно связываются аналогичной по форме впадиной в
молекуле трипсина. Как указывалось в разд. В.1, в трипсине на
дне такого кармана имеется карбоксильная группа, предназна-
ченная
для связывания положительного заряда на конце боко-
вой
цепи субстрата, а в эластазе
вход
в карман частично блоки-
рован.
Карман,
связывающий
субстрат
в химотрипсине, можно на-
звать «гидрофобным карманом», поскольку он образован непо-
лярными
боковыми цепями аминокислот. Эти цепи создают
подходящую
среду,
необходимую для связывания неполярных
или
гидрофобных боковых цепей субстратов. Физическая приро-
да и прочность гидрофобных сил обсуждаются в гл. 9.
Участок гидрофобного связывания в субтилизине представ-
ляет собой не столь четко выраженную впадину, как у панкреа-
тических ферментов; он больше похож на неглубокую выемку.
