Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


Трансферрины.
(сидерофилины)
333
2. ВЫДЕЛЕНИЕ И ОЧИСТКА
2.1. Сывороточный трансферрин
Первые препараты сывороточного трансферрина были получе-
ны по методу Кои [16], а также фракционированием с помощью'
сульфата аммония в сочетании с осаждением этанолом [1]. Bno--
следствии стали использовать ионообменную хроматографию,
которая проще и, вероятно, мягче, чем методы, в которых исполь-
зуется спирт [17]. Последнее замечание, по-видимому, имеет неко-
торое значение, так как Шэйд [18] указывал, что некоторые пре-
параты трансферрина могут быть физиологически неактивны, хотя
их способность связывать железо остается неизменной. Самой
главной проблемой при очистке трансферрина было отделение его
от связанного с гемом сывороточного белка, гемопексина. Кристал-
лизацию сывороточного трансферрина проводили следующим об-
разом: постепенно добавляли спирт к концентрированному раство-
ру белка [19] с одновременной диффузией спирта в раствор белка
во время его концентрирования в аппарате для ультрафильтрации
[20]; кристаллы были также выделены из концентрированных
растворов при низкой ионной силе и низких значениях рН [13].
2.2. Кональбумин
Кональбумин был получен из белка куриных яиц фракциониро-
ванием с сульфатом аммония [21] или этанолом [22], а также
с помощью ионообменной хроматографии с использованием суль-
фометилцеллюлозы (СМ-целлюлоза) или сульфометилсефадекса
(СМ-сефадекс) [23]. Упрощенный метод для получения относи-
тельно больших количеств кональбумина, в котором используется
осаждение сульфатом аммония и ионообменная хроматография,
был предложен Финн и Коматчу [9]. Оба соединения — и апоко-
нальбумин и железосодержащий кональбумин — были выделены
в виде кристаллов из водно-этанольных растворов [21].
Следует отметить, что поступающие в продажу препараты ко-
нальбумина и трансферрина обычно гетерогенны и могут содер-
жать переменные количества низкомолекулярных веществ, в част-
ности хелатирующих агентов, используемых для их получения
[24].
2.3. Лактоферрин
В 1959 г. Гровс [25] детально описал процесс выделения лакто-
феррина из осажденной кислотой казеиновой фракции коровьего
молока. Этот метод состоит в использовании фракционирования

334
i лава 2
с сульфатом аммония и хроматографии на диэтиламиноэтилцел-
люлозе и позволяет выделить приблизительно 1 г белка из 60 л
молока. Гораздо более простой метод выделения лактоферрина из
женского молока был предложен Юханссоном [26]. Этот метод
состоит в прямой адсорбции протеина на СМ-сефадексе, который
добавляют к молоку. Выходы составляют от 0,5 до 1 г белка
на 1 л молока; такое повышение выхода по сравнению с тем, ко-
торый был достигнут при использовании коровьего молока, воз-
можно, связано и с различием в методике, и с большей концентра-
цией лактоферрина в женском молоке. Кристаллический лакто-
феррин можно выделить из разбавленного фосфатного буфера без
использования спирта [26].
3. ХИМИЧЕСКИЙ СОСТАВ
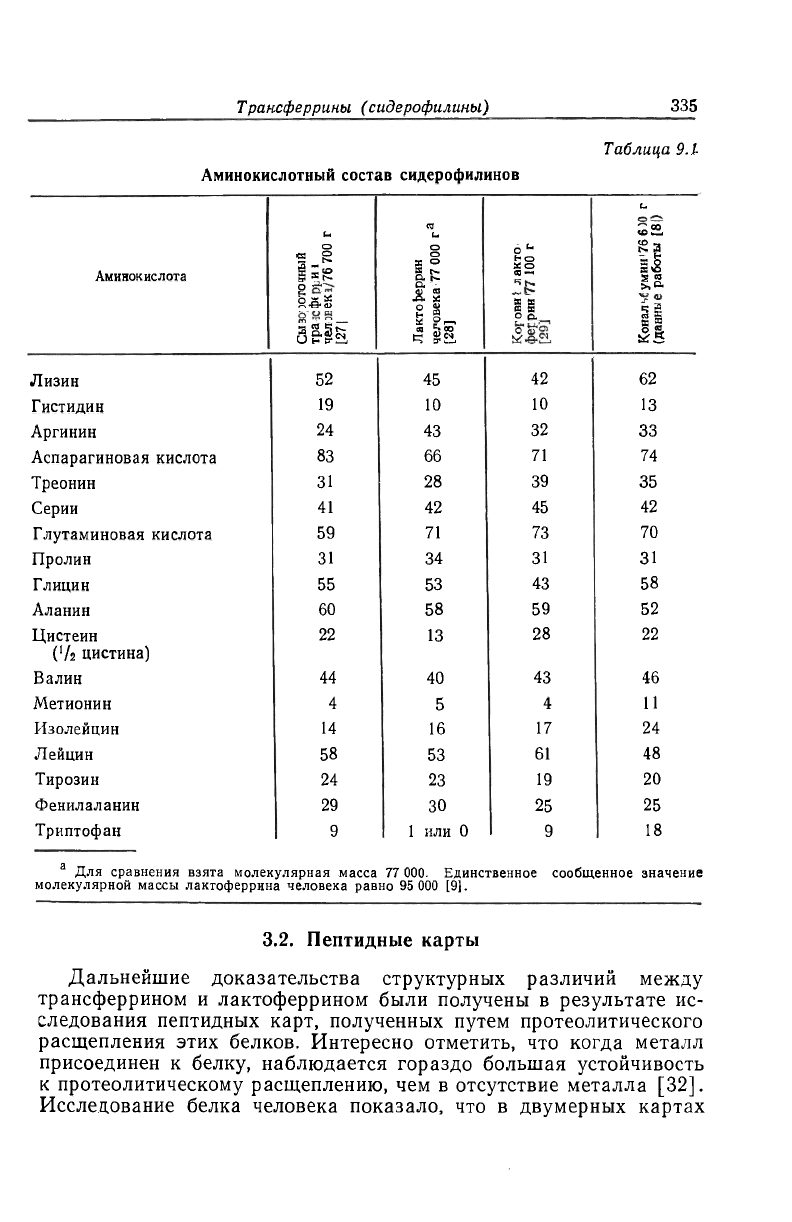
3.1. Аминокислотный состав
В основном данные об аминокислотном составе и определении
N-концевой аминокислоты в трансферрине и кональбумине, по
сведениям из ряда лабораторий, находятся между собой в хоро-
шем согласии (табл. 9.1) и не содержат ничего необычного. Так
как было сообщено, что кональбумин и птичий сывороточный
трансферрин имеют одинаковую белковую часть [8], можно пола-
гать, что различия в аминокислотном составе между сывороточным
трансферрином человека и кональбумином отражают видовое раз-
нообразие. Оба — и трансферрин и кональбумин, — по-видимому,
содержат только по одному концевому N-аминокислотному остат-
ку в молекуле. Иногда сообщают о присутствии небольшого коли-
чества остатков второй аминокислоты; возможно, это обусловлено
недостаточной чистотой анализируемого препарата белка или ча-
стичным гидролизом чувствительных к нему пептидных связей
[30].
По аминокислотному составу лактоферрин человека и коровии
лактоферрин заметно отличаются от соответствующих сывороточ-
ных белков. По-видимому, лактоферрин человека должен содер-
жать мало или совсем не содержать триптофана, который благо-
даря его свойствам можно обнаружить спектрофотометрическим
методом (см. ниже). Один N-концевой остаток аланина был обна-
ружен в коровьем лактоферрине [29]. Еще никак не объяснено от-
сутствие аминокислотного остатка со свободной аминогруппой
в лактоферрине человека [31]*.
* Массой (частное сообщение) недавно показал, что лактоферрин человек;
содержит 10 остатков триптофана на молекулу.
Трансферрины.
(сидерофилины)
335
Таблица 9.1
Аминокислотный состав сидерофилинов
и
U
Я
и
<о£
о
о
о
и
SSa
Аминокислота
1
s
I =S
S
IsS
о
IS
О. Г>-
о.
Ж
S
Т!
Но
ге о
я —<
S S
i!
аа
SllE
S S
Ё Orn
to
5-оо
Ч SEl
И
S
о CX
с; Д
Ii
£§
Лизин
52
45
42 62
Гистидин
19
10
10
13
Аргинин
24
43
32
33
Аспарагиновая кислота
83
66
71
74
Треонин
31
28
39
35
Серии
41 42
45
42
Глутаминовая кислота
59
71
73
70
Пролин 31
34 31
31
Глицин 55 53
43
58
Алании
60 58
59
52
Цистеин
22
13
28
22
('/г цистина)
Валин
44
40 43
46
Метионин
4
5
4 11
Изолейцин
14
16
17
24
Лейцин
58
53
61
48
Тирозин
24
23
19
20
Фенилаланин
29 30
25
25
Триптофан
9
1 или 0
9
18
а
Для сравнения взята молекулярная масса 77
ООО.
Единственное сообщенное значение
молекулярной массы лактоферрина человека равно 95 000 [9].
3.2. Пептидные карты
Дальнейшие доказательства структурных различий между
трансферрином и лактоферрином были получены в результате ис-
следования пептидных карт, полученных путем протеолитического
расщепления этих белков. Интересно отметить, что когда металл
присоединен к белку, наблюдается гораздо большая устойчивость
к протеолитическому расщеплению, чем в отсутствие металла [32].
Исследование белка человека показало, что в двумерных картах

336
i лава 2
триптического расщепления обнаруживается гораздо меньше пеп-
тидов, чем можно было бы ожидать на основании известного
числа имеющихся остатков лизина и аргинина [27]. Значение это-
го наблюдения будет обсуждаться в разделе, посвященном субъ-
единичной структуре трансферрина.
3.3. Углеводный состав и структура
Все известные сидерофилины правильно классифицировать как
гликопротеины. Трансферрин содержит около 5% углевода, кото-
рый расположен в двух разветвленных цепях, идентичных по со-
ставу и оканчивающихся остатком сиаловой (N-ацетилнейрамино-
вой) кислоты и, возможно, присоединенных к полипептидной цени
аспарагинильными связями [33]. Концевые остатки сиаловой кис-
лоты могут быть полностью удалены обработкой нейраминидазой
[34]. Сообщалось, что трансферрин, дефицитный по нейраминовон
кислоте и, возможно, другим углеводам, находится в крови пупо-
вины и цереброспинальной жидкости [35]. После удаления сиало-
вой кислоты из трансферрина с помощью нейраминидазы белок
может служить субстратом для галактозоксидазы, что указывает
на присоединение нейраминовой кислоты концом к галактозе с об-
разованием углеводных целей [36].
Хотя, по-видимому, кональбумин и сывороточный трансферрин
домашних птиц идентичны по своему аминокислотному составу,
иммунохимической реакционной способности и структуре пептидов,
в их углеводных компонентах замечены отчетливые различия.
В гликопептиде яичного белка не обнаружено ни сиаловой кисло-
ты, ни галактозы. В отличие от сывороточного белка человека
в белках птиц углевод, по-видимому, должен находиться в одной
цепи [37].
Было показано, что лактоферрин человека содержит околс
6,6% углевода, расположенного в трех цепях, каждая из которых
оканчивается остатком сиаловой кислоты и содержит один или двг
остатка фукозы, шесть остатков гексозы и четыре остатка N-ацет
глюкозамина [38]. Представлены также доказательства того, чтс
углеводные цепи связываются с белковой частью при помощи гли
козидной связи к гидроксильной группе треонина. Углеводный со
став коровьего лактоферрина, по-видимому, аналогичен со
ставу белка человека, за исключением того, что в нем обнаруже1
только один остаток сиаловой кислоты на молекулу [25].
Функциональная и структурная роль углеводных частей сидеро
филинов еще не выяснена. По-видимому, удаление сиаловой кисло
ты из трансферрина не влияет на ее металлсвязывающие свойств;
и на ее способность служить донором железа для ретикулоцито
[39].

Трансферрины (сидерофилины)
337
3.4. Иммунохимия
Все сидерофилины — антигены. Кональбумин и трансферрин,
полученные из яичного белка и сыворотки домашних птиц, имму-
нохимически идентичны, хотя они синтезируются в разных местах
[8]. В отличие от этого нет перекрестной иммунореактивности
между трансферрином из сыворотки человека и лактоферрином
человека [40]. Это почти определенно указывает на то, что белки
структурно не родственны один другому, за исключением их спо-
собности связывать металл, и что белки молока не являются про-
изводными белков крови.
4. ОСНОВНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА
4.1. Молекулярная масса
Более ранние определения молекулярной массы сывороточного
трансферрина с помощью ультрацентрифугирования дали значе-
ния, изменяющиеся от 68 ООО до 93 ООО. Недавно проведенные ис-
следования показали, что молекулярная масса изменяется от 75 ООО
до 80 000 дальтон [27]. В растворах нативного трансферрина не
наблюдается тенденции к образованию агрегатов или диссоциации
[27]. Молекулярная масса не зависит от того, насыщен ли транс-
феррин железом, наполовину насыщен или вовсе не содержит же-
леза [41].
Кональбумин и лактоферрин изучены в меньшей степени, чем
трансферрин. Наиболее точная оценка молекулярной массы ко-
нальбумина, определенная по его способности связывать железо,
дала значение около 76 000 дальтон [42]. Методом седиментацион-
ного равновесия для коровьего лактоферрина получена молекуляр-
ная масса 77 100 [29], для лактоферрина человека исследованием
связывания железа получено значение 80 000 [43], а методом оп-
ределения скорости седиментации при ультрацентрифугировании
[11]—значения 95 000 [11] и 82 000 [14].
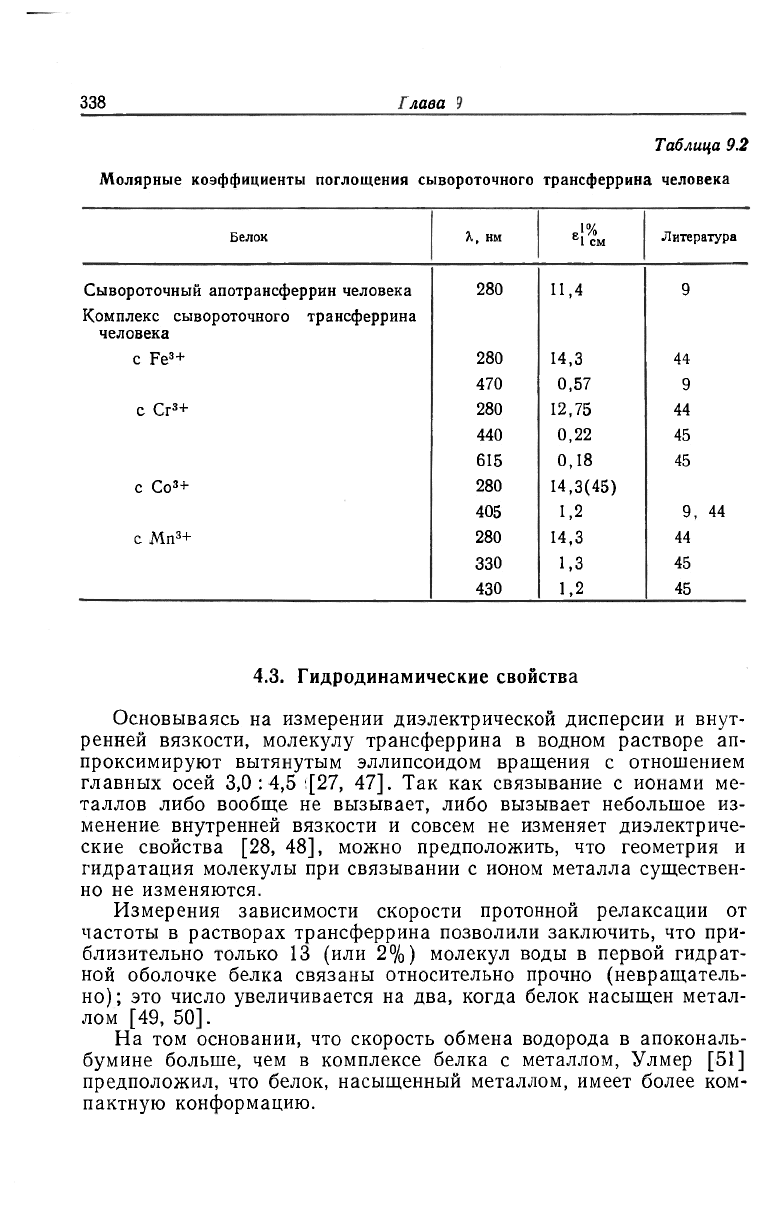
4.2. Оптические свойства
В табл. 9.2 приведены молярные коэффициенты поглощения
комплексов трансферрина в ультрафиолетовой и видимой обла-
стях. Особенно интересным является увеличение поглощения в уль-
трафиолетовой области при связывании ионов металла ,[44];
причина этого увеличения будет рассмотрена ниже.
При связывании с ионами металла наблюдается гашение флуо-
ресценции триптофана в трансферрине [46].
22—2451
338
i лава 2
Таблица 9.2
Молярные коэффициенты поглощения сывороточного трансферрина человека
Белок
1
K,
нм
J%
e
I
CM
Литература
Сывороточный апотрансферрин человека
280
11,4 9
Комплекс сывороточного трансферрина
человека
с Fe
3
+
280
14,3
44
470 0,57
9
с Cr
3
+
280
12,75
44
440
0,22
45
615
0,18
45
с Со
3
+
280
14,3(45)
405
1,2
9, 44
с Mn
3
+
280
14,3
44
330
1,3
45
430
1,2
45
4.3. Гидродинамические свойства
Основываясь на измерении диэлектрической дисперсии и внут-
ренней вязкости, молекулу трансферрина в водном растворе ап-
проксимируют вытянутым эллипсоидом вращения с отношением
главных осей 3,0: 4,5 [27, 47]. Так как связывание с ионами ме-
таллов либо вообще не вызывает, либо вызывает небольшое из-
менение внутренней вязкости и совсем не изменяет диэлектриче-
ские свойства [28, 48], можно предположить, что геометрия и
гидратация молекулы при связывании с ионом металла существен-
но не изменяются.
Измерения зависимости скорости протонной релаксации от
частоты в растворах трансферрина позволили заключить, что при-
близительно только 13 (или 2%) молекул воды в первой гидрат-
ной оболочке белка связаны относительно прочно (невращатель-
но); это число увеличивается на два, когда белок насыщен метал-
лом [49, 50].
На том основании, что скорость обмена водорода в апокональ-
бумине больше, чем в комплексе белка с металлом, Улмер [51]
предположил, что белок, насыщенный металлом, имеет более ком-
пактную конформацию.

Трансферрины (сидерофилины)
339
4.4. Субъединичная структура
Можно ожидать, что белок с двумя специфическими центрами
и двумя идентичными углеводными цепями построен из двух субъ-
единиц. Для выяснения этого было поставлено множество экспе-
риментов в ряде лабораторий. Джеппсон [52] сообщил, что вос-
становленный алкилированный трансферрин после высушивания
и повторного растворения диссоциирует на субъединицы с молеку-
лярной массой 39 000—42 000, как было определено методом рав-
новесного центрифугирования. Исследование восстановленного
алкилированного трансферрина независимо в лабораториях
Безкоровайного [53] и Финн [54] не подтвердили диссоциацию на
субъединицы. Впоследствии Безкоровайный [55] при изучении
восстановленного алкилированного и сульфитолизированного
трансферрина и кональбумина вновь не получил данных, свиде-
тельствующих о субъединичной структуре этих соединений. Дейст-
вительно, измерения вязкости обработанного трансферрина
в присутствии 8 M раствора мочевины показали только тенденцию
к образованию агрегатов [55]. Недавно проведенное тщательное
исследование вопроса о субъединичной структуре трансферрина
с использованием методов седиментационного равновесного цент-
рифугирования, измерения внутренней вязкости и гель-фильтрации
в 6 M гидрохлориде гуанидина подтвердило одноцепочечную при-
роду сывороточного трансферрина человека [27]. Если бы субъ-
единицы действительно существовали, они должны были бы соеди-
няться необычными и еще неизвестными связями. В свете имею-
щихся данных заманчивым выглядит предположение о том, что
структурный ген для трансферрина в ходе эволюции подвергся
дубликации и последующему делению [27, 54].
5. МЕТАЛЛСВЯЗЫВАЮЩИЕ ЦЕНТРЫ
5.1. Существует ли взаимодействие
между связывающими центрами?
После выделения относительно чистого трансферрина и кональ-
бумина удалось установить, что каждый белок способен специфи-
чески и прочно связывать два атома железа [1]. Было также по-
казано, что для развития характерной красной окраски требуется
двуокись углерода или одна из ее ионизированных форм [5]. Шэйд
и сотр. [5] смогли показать, что для полного развития окраски на
каждый связанный атом железа требуется один бикарбонатный
ион. При этом два или три протона выделяются в раствор.
Количественное изучение механизма комплексообразования
железа с кональбумином было предпринято Вернером и Вебером
22*

340
i лава 2
[42], которые установили, что связывание каждого атома железа
при рН от 7,5 до 9,5 сопровождается освобождением в раствор
трех протонов, а связывание с медью вызывает выделение двух
протонов. Хотя трудно определить, не освобождаются ли эти про-
тоны в результате гидролиза иона металла, претерпевающего свя-
зывание, представляется довольно вероятным, что они действитель-
но вытесняются из белка в процессе связывания, в частности
изучение равновесия связывания при несколько различающихся
значениях рН согласуется с этой точкой зрения [56]. Так как при
связывании двухвалентного катиона освобождаются два протона,
а при связывании трехвалентного иона — три, общий заряд белка
не изменялся бы, если бы никакие другие заряженные частицы не
участвовали в связывании. Однако измерение свободной электро-
форетической подвижности обнаружило повышение анионной
подвижности, соответствующее увеличению общего отрицательного
заряда белка на единицу на каждый связанный атом железа [42].
На основании этого факта, а также опытов Шэйда с сотрудника-
ми, пришли к заключению, что бикарбонатный ион является той
формой, в которой двуокись углерода принимает участие в металл-
связывающей функции трансферрина и кональбумина. Впослед-
ствии Массой и Хереманс [43] показали, что аналогичные явления
происходят при связывании железа и меди лактоферрином.
Таким образом, связывание первого и второго атомов железа
сидерофилинами можно представить следующими уравнениями:
Fe
3
+ + H
e
Tfn + HCO
3
<—^ [Fe
3+
H
3
Tfn
-HCO
3
]"
+ ЗН+ (1)
Fe
3
+ + [Fe
3+
H
3
Tfn-HCO
3
]" + HCOjT "<—* [(Fe
3+
)
2
Tfh-(HCO
3
)
2
]=-
-f
ЗН
+
(2)
Такая формулировка послужила поводом к одному из наиболее
интересных и горячих споров в химии и физиологии сидерофили-
нов. Используя цитрат в качестве агента, конкурирующего за же-
лезо с сидерофилинами, и измеряя окраску растворов кональбуми-
на, в которых термодинамическая активность железа изменялась
при изменении концентрации цитрата, Вернер и Вебер [42] при-
шли к заключению, что связывание железа кональбумином осу-
ществляется в две стадии, причем вторая константа устойчивости
гораздо больше, чем первая. Шэйд [57], исходя из нетермодина-
мических наблюдений за скоростью поглощения железа из белка
клетками печени, предложил такой же способ освобождения желе-
за из трансферрина. И, наконец, Вудворт [58] на основе измере-
ния кинетики связывания железа получил новые аргументы в поль-
зу двухступенчатого механизма связывания железа кональбуми-
ном. Следовательно, до последнего времени преобладало мнение,
что все время два атома железа входят и выходят из молекулы
сидерофилина, так что стабильные частицы в растворе должны

Трансферрины.
(сидерофилины)
341
либо вовсе не содержать, либо содержать 2 атома железа на мо-
лекулу сидерофилина.
В 1963 г. Мальмстрём с сотр. [56] опубликовал серию работ,
в которых изложил результаты тщательно выполненных экспери-
ментов с использовании классического термодинамического метода
равновесного диализа, дополненного методом электронного пара-
магнитного резонанса. Уделяя особое внимание тому, чтобы пока-
зать, что равновесие действительно достигается, и обрабатывая
свои данные новым методом графического анализа, эти исследова-
тели заключили, что связывание железа трансферрином можно
описать, предположив участие в связывании двух эквивалентных
невзаимодействующих центров. Если это так, то напрашивается
вывод, что трансферрин в растворах не полностью насыщен желе-
зом и должны сосуществовать три типа белковых частиц: частицы
с двумя связанными атомами железа, частицы только с одним свя-
занным атомом и частицы, не содержащие металла [59]. Вернер
и Вебер [21] на основании электрофоретических диаграмм, скорее
интуитивно, различили три типа молекул в неполностью насыщен-
ных железом растворах кональбумина. Однако они не сопоставили
это наблюдение со своими заключениями, сделанными на основа-
нии исследования равновесия. Позднее это предположение было
детально подтверждено для трансферрина с помощью фронтально-
го электрофореза методом движущейся границы [59], а оконча-
тельно для кональбумина методом изоэлектрического фокусирова-
ния [60]. Было высказано предположение, что частицы, обладаю-
щие промежуточной подвижностью при электрофорезе и в опытах
по изоэлектрическому фокусированию, могут представлять собой
димер апопротеина и белка, насыщенного железом [61]. Однако
позднее было доказано, что это предположение несостоятельно
[41].
Вся сумма имеющихся в настоящее время данных подтвержда-
ет мнение о том, что термодинамические константы, описывающие
связывание железа с трансферрином, внутренне идентичны. По-
вторное изучение методом равновесного диализа связывания желе-
за кональбумином также показало большое сходство в связыва-
нии металла этим белком и трансферрином [62]. По-видимому,
более ранние данные Вернера и Вебера были получены до дости-
жения равновесия, так как в этих опытах проходило только 18 ч
между добавлением железа к раствору апокональбумина и време-
нем наблюдения; проведенное позднее исследование зависимости
от времени показало, что для достижения истинного равновесия
требуется по крайней мере несколько дней [56]. Физиологическое
исследование Шэйда не содержало термодинамических измерений
и поэтому не противоречит предшествующим результатам. Коли-
чественных данных о связывании железа с лактоферрином в на-
стоящее время не имеется.

342
i лава 2
5.2. Значение констант связывания
Существуют некоторые разногласия по поводу значения чисел,
полученных при измерении связывания металла с сидерофилинами
методом равновесного диализа. Константы связывания Ki и K
2
характеризуют химические реакции, представленные выше уравне-
ниями (1) и (2), и записываются в следующем виде [55]:
[Fe
3+
H
3
Tfn - НСОз
]
[H
+
]
3
Ai - [Fe
3
+] [H
6
Tfn] [НСОз]
1
'
„ [(Fe^)
2
Tfn(HCO
3
)I-] [Н+р
Л2 _
[Fe
3
+]
[Fe
3+
H
3
Tfn•
НСО3]
[НСОз]
Так как на каждый атом связанного железа освобождаются три
протона, а связывается один бикарбонатный ион, каждая из истин-
ных термодинамических констант прямо пропорциональна третьей
степени концентрации ионов водорода и обратно пропорциональна
концентрации бикарбонат-иона в растворах, в которых выполняют-
ся измерения. Статистическое рассмотрение показывает, что, если
два специфических связывающих центра эквивалентны и независи-
мы, отношение Ki к K
2
должно быть равно четырем.
При фиксированных значениях рН и активности бикарбонат-
иона вклады этих составляющих в уравнения связывания можно
учесть в выражении для кажущихся констант равновесия следую-
щим образом [56]:
K
1
[НСО3] ^iPCO
2
ZCco
2
Ki (const. рН, рС0
2
) = •—jj^+p— = jjpji (5)
где Kco
2
— соответствующая константа гидратации CO
2
или иони-
зации карбоновой кислоты. Так как активность бикарбонат-иона
находится в обратной зависимости от рН, в этом выражении
должна быть отражена зависимость кажущейся константы от чет-
вертой степени концентрации ионов водорода, при которой иссле-
довалось равновесие, и прямая зависимость от парциального
давления двуокиси углерода в атмосфере, в равновесии с которой
они находятся. При относительно фиксированных значениях рН и
рС0
2
, которые преобладают в кровеносной системе человека, ка-
жущееся значение Ki составляет примерно IO
24
M
-1
. Учитывая все
изложенное, можно показать, что атому железа потребуется при-
близительно 10 000 лет, чтобы самопроизвольно отделиться от мо-
лекулы трансферрина в крови [63]. Из величин, которые исполь-
зуются для количественного описания связывания металлов
с трансферрином, по-видимому, наиболее важны с точки зрения
физиологии кажущиеся константы устойчивости.
