Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


Трансферрины. (сидерофилины)
343
Если принять во внимание значения рК протонодонорных групп
в белке, внутреннюю константу связывания металла с образова-
нием хелата можно записать в следующем виде:
Kl (хелат) = K
1
-10
PKl
(6)
При значениях рН, равных или больших 9,5, выделяются три
протона, так что значения рК протонодонорных групп должны
превышать эту величину. В соответствии с этим внутренняя кон-
станта связывания железа трансферрином в хелат должна превы-
шать IO
32
; возможно, она составляет IO
36
[56].
После того как была обнаружена идентичность констант свя-
зывания металла с двумя центрами белка, тотчас же возник во-
прос, идентичны ли сами связывающие центры. Эту проблему осо-
бенно трудно решить для белков, построенных из одной полипеп-
тидной цепи. И физиологические, и физические исследования про-
лили свет на эту еще не до конца решенную проблему, к которой
мы ниже вернемся.
5.3. Типы и состояния ионов металлов,
специфически связанных с трансферрином
Кроме железа и меди, комплексы с которыми хорошо изучены,
белок способен связывать и многие другие многовалентные катио-
ны. Цинк, хром, кобальт, марганец, кадмий, никель и галлий об-
разуют комплексы такого же стехиометрического состава, как
железо [9, 44, 64, 65]. Связывание хрома, марганца, кобальта и
меди также сопровождается связыванием бикарбонат-иона [45].
Еще не исследовалось, участвует ли бикарбонат-ион в связывании
других ионов металлов. Индий также способен связываться
с трансферрином, однако еще не было показано, те ли же самые
специфические центры принимают участие в связывании металла
[66].
По-видимому, из-за гидролиза первоначальные исследования
связывания железа сидерофилинами были выполнены с использо-
ванием ионов Fe(II). На вопрос о валентном состоянии связанно-
го железа нельзя было ответить до тех пор, пока Эренберг и Лау-
релл [67] не измерили при комнатной температуре статические
магнитные восприимчивости и не показали, что специфически свя-
занный металл находится в высокоспиновом состоянии (d
5
)
Fe(III). Парамагнитная восприимчивость иногда даже больше, чем
было предсказано для невзаимодействующих ионов Fe(III), так
что было выдвинуто предположение, что имеет место слабое взаи-
модействие между ионами металлов, связанными с одной и той же
молекулой. Однако последующий анализ спектров электронного
парамагнитного резонанса [57] и исследование статической вос-
приимчивости при низкой температуре [45] не подтвердили нали-

344
i лава 2
чие такого взаимодействия. Эти данные находятся в хорошем со-
гласии с законом Кюри, наблюдаемом при температурах между
1.5 и 77 К.
Все комплексы металлов с трансферрином имеют отчетливую
окраску и полосы поглощения в видимой области. Инман [9] на-
блюдал усиление характеристической окраски при образовании
комплексов с марганцем и кобальтом при добавлении перекиси во-
дорода и предположил, что, по-видимому, эти ионы металлов окис-
ляются при связывании до трехвалентного состояния. Такое пред-
положение подтверждается измерениями статической восприимчи-
вости при низких температурах, которые также показали, что
кобальт связан в низкоспиновой диамагнитной форме [45].
С точки зрения физиологии интересно знать, могут ли связы-
вающие центры трансферрина присоединять и ионы Fe(II) и ионы
Fe(III) или ионы Fe(II) должны быть окислены в Fe(III) до того,
как произойдет связывание. Неопубликованное исследование Габе-
ра, проведенное с применением дифференциальной спектрофото-
метрии и изотопного обмена, показало, что Fe
2
+ если и связывает-
ся, то очень слабо {68].
5.4. Роль бикарбоната
Характеристическая красная и желтая окраски комплексов же-
леза и меди с сидерофилинами не развиваются в отсутствие бикар-
боната. Отсюда следует, что этот ион играет главную роль
в комплексообразовании металлов с белками [5]. Прямое измере-
ние количества двуокиси углерода, выделяющейся при кислотной
денатурации комплексов с железом [42], медью [69], хромом,
марганцем и кобальтом [45], подтвердило сделанное ранее пред-
положение Шэйда [5] о том, что на каждый связанный ион метал-
ла связывается один бикарбонатный ион. Связывание бикарбоната
не является обязательным, и это было продемонстрировано серией
исследований связывания металла с трансферрином методом спек-
троскопии электронного парамагнитного резонанса, которые пока-
зали, что специфическое связывание, по крайней мере железа и
меди, может происходить и в отсутствие бикарбоната [70]. Обра-
зующиеся при этом комплексы были бесцветны и поэтому недетек-
тируемы до появления метода ЭПР. Очевидно, в отсутствие бикар-
боната связь железо — белок гораздо слабее, чем в его
присутствии, так как при стоянии не содержащего бикарбоната
комплекса железа с трансферрином при нейтральных или более
высоких значениях рН наблюдается гидролиз железа с образова-
нием нерастворимого гидроксида железа(III). Возможная физио-
логическая роль этого эффекта будет обсуждена в разделе, посвя-
щенном биологическим функциям сидерофилинов.

Трансферрины. (сидерофилины)
345
Центр, связывающий бикарбонат-ион, может также связывать
и многие другие анионы, в том числе этилендиаминтетраацетат,
нитрилтриацетат и оксалат [70, 71]. Общим свойством этих анио-
нов является наличие двух или более карбоксильных групп; еще
не известно, существенно ли это для того, чтобы анионный центр
связывания могли занять ионы, отличные от бикарбоната. О соот-
ношении и взаимном расположении связывающих центров бикар-
боната и металла также ничего не известно, хотя они должны
быть очень близки, так как место присоединения аннона может
быть занято только тогда, когда есть центр, связывающий металл.
Кроме того, было показано, что связыванию бикарбонат-иона соот-
ветствующей группой препятствует доступ воды как растворителя
к специфически координированному иону металла [72]. Когда свя-
зывание произошло, бикарбонат нельзя ни удалить длительным
откачиванием раствора белка, ни заменить на другой анион,
способный занять его место. Из изложенного следует, что, по-ви-
димому, бикарбонат связывается не только с ионом металла, но
еще каким-то образом присоединяется к одной или большему числу
групп в белке.
5.5. Кинетика связывания железа
Изучение кинетики комплексообразования металла с трансфер-
рином осложняется двумя факторами: скорость связывания может
быть такой большой, что превышает разрешающие способности
q6bi4Hbix приборов; необходимо принять во внимание наличие по-
бочных реакций, включая реакции гидролиза и реакции замещения
лигандов в тех случаях, когда металл взаимодействует с белком
в виде хелатного соединения. Для исследования этой проблемы
Залтман и сотр. [24] для случая взаимодействия ионов Fe(III)
с белком в виде нитрилтриацетатного комплекса разделили про-
цесс связывания на две фазы: на более раннюю первую фазу,
которую они не смогли измерить, и вторую, более медленную фазу,
которая имеет кинетический первый порядок по концентрации
комплекса железа. Последнее наблюдение согласуется с термоди-
намическим изучением, показавшим независимость связывания
ионов Fe(III) [55]. Эти исследования расходятся с результатами,
сообщенными Вудвортом [58], который обнаружил простую зави-
симость второго порядка для скорости комплексообразования от
концентрации железа, которое и в этом случае присутствовало
в виде нитрилтриацетатного комплекса железа (III). Временные
пределы используемых физических методов и временная шкала
спектрометра таковы, что можно надеяться разрешить это противо-
речие, только используя специальные методы для изучения быст-
рых реакций, в частности спектрофотометрию с остановкой струи.

346
i лава 2
5.6. Спектроскопические исследования
5.6.1. Оптические исследования
Большинство комплексов металлов с сидерофилинами имеют
интенсивные полосы поглощения в видимой области, которые обус-
ловлены их характерной окраской (табл. 9.2). Детальный кванто-
вомеханический анализ хромофорных центров не проводился, так
что еще нет объяснения природы полос поглощения в видимой
области. Простой перенос заряда, вероятно, исключается [73].
По-видимому, разумно предположить, что эти полосы обусловлены
переходами между главным образом Зс?-орбиталями центрального
иона металла, разрешенными вследствие гибридизации с Ap- и
45-орбиталями, возникающей из-за напряженной геометрии коор-
динирующихся лигандных групп белка. Было показано, что это
действительно имеет место в случае координации меди с церуло-
плазмином [74]. Имеет смысл упомянуть здесь и о других заслу-
живающих внимания особенностях полос поглощения в видимой
области комплексов металлов с сидерофилином: в присутствии
бикарбоната комплекс меди имеет необычную глубокую желтую
окраску, обусловленную поглощением с максимумом при 430 нм,
в то время как в спектре комплекса хром—трансферрин—бикар-
бонат в видимой области обнаруживаются две отдельные полосы.
Методом дифференциальной спектрофотометрии в ультрафио-
летовой области были обнаружены изменения в спектрах при свя-
зывании ионов металлов с сидерофилинами [45, 64, 70]. В спектрах
растворов комплексов металлов по сравнению со спектрами рас-
творов апофермента максимумы поглощения наблюдаются вблизи
245 и 295 нм [64]. В литературе имеются некоторые разногласия
относительно формы и интенсивности дифференциальной полосы
при 295 нм [46]; возможно, они связаны с различиями в концент-
рации исследуемых растворов, которые приводят к разным вкла-
дам в приборную ошибку, связанную со светорассеянием или
с общими трудностями в измерении небольших различий между
большими величинами поглощения. По-видимому, дифференциаль-
ная полоса поглощения при 295 нм обусловлена воздействием свя-
занного иона металла на тирозильные остатки [76]. Остатки трип-
тофана также могут давать вклады в дифференциальные спектры
[63]. Если это так, то спектры лактоферина человека должны от-
личаться от спектров сывороточного трансферрина, так как послед-
ний либо вовсе не содержит, либо содержит мало триптофана.
Спектрофотометрическое титрование комплексов железа и меди
с сидерофилином также показало значение тирозильных остатков
в металлсвязывающей функции белка [75, 76]. В дифференциаль-
ных спектрах поглощения белка в ультрафиолетовой области
в присутствии щелочи по сравнению со спектрами при нейтраль-

Трансферрины.
(сидерофилины) 347
ных значениях рН обнаружены полосы поглощения при 295 нм,
которые очень похожи на полосы в спектре л-ацетил-ь-тирозина
при рН 10,8 по сравнению с его спектром при рН 7, т. е. на полосы
ионизированной фенольной ОН-группы в сравнении с неионизиро-
ванной [64]. Таким образом, различия в спектрах белков объяс-
няются ионизацией тирозина. Молярный коэффициент поглощения
дифференциальной полосы можно получить из спектра поглощения
полностью денатурированного щелочью белка по сравнению со
спектром нативного белка, приняв во внимание число тирозильных
остатков в молекуле или из измерений, выполненных на модель-
ных соединениях. Существуют некоторые расхождения между зна-
чениями, полученными дифференциальным методом, и значениями,
сообщенными для различных белков, и эти расхождения трудно
объяснить [64, 76]. Кроме того, значение молярного коэффициента
поглощения, сообщенное для случая щелочной денатурации, воз-
можно, нельзя прямо применять к измерениям на нативном белке
[76]. По-видимому, изменения, наблюдаемые при связывании ме-
талла с сидерофилинами, действительно, связаны с изменениями
в тирозильных остатках, несмотря на то, что не существует зави-
симости от числа этих остатков в молекуле белка. Тан и Вудворт
[64] объяснили свои данные, предположив, что в связывании
с железом участвуют два остатка тирозина, а в связывании
с медью — один; Aaca и Айзен [76] сообщили, что при связывании
с медью оказываются затронутыми 1,3 остатка тирозина, а Виш-
ниа, Вебер и Вернер [75] установили, что в связывании с железом
участвуют три таких остатка. Следует указать, что различие
в числе спектрофотометрически титруемых остатков тирозина
в присутствии металла и без него не обязательно должно рассмат-
риваться как свидетельство их прямой координации к металлу.
Возможно также, что наблюдаемые различия вытекают из раз-
личий в значениях рК, изменяющихся в результате конформацион-
ных изменений или электростатических эффектов, вызываемых свя-
зыванием металла.
5.6.2. Исследование дисперсии оптического вращения
и кругового дихроизма
Как для трансферрина, так и для кональбумина в видимой об-
части наблюдается эффект Коттона, который зависит от присутст-
вия специфически связанного иона металла [77]. Полоса поглоще-
гия комплекса железа при 470 нм характеризуется отрицательным
эффектом Коттона, в то время как полоса комплекса марганца —•
юложительным эффектом Коттона. В отличие от этого комплексы
сональбумина и трансферрина с медью, имеющие максимальное
юглощение при 430 нм, не проявляют аномальной дисперсии
штического вращения в этой области. Тем не менее природа опти-

348
i лава 2
ческой активности, ассоциируемой с этой полосой, была установле-
на исследованием кругового дихроизма [78].
Необычная способность металлсвязывающего центра трансфер-
рина связывать и ионы меди, и ионы железа заслуживает обсуж-
дения. При связывании меди окружение иона металла приобретает
симметрию, очень близкую к аксиальной [76]. Небольшое откло-
нение от аксиальности явственно вытекающее из спектров ЭПР,
снятых при 35 °'С, согласуется с оптической активностью, наблю-
даемой Наги и Лерером [78]. В отличие от этого спектры ЭПР
[55] и оптическая активность комплекса железа свидетельствуют
о гораздо более низкой симметрии металлсвязывающего центра.
По-видимому, лиганды, предоставляемые белком, обладают очень
большой гибкостью, и этим объясняется легкая приспособляемость
этого центра* к иону металла.
6.СПЕКТРОСКОПИЯ МАГНИТНОГО РЕЗОНАНСА
По-видимому, наиболее ценные сведения о природе металлсвя-
зывающих центров сидерофилинов были получены методами маг-
нитного резонанса, особенно методом электронного парамагнитного
резонанса (ЭПР). Спектр ЭПР нативного комплекса Fe-трансфер-
рин — HCO
3
является характеристичным для иона Fe
3
+ в высоко-
спиновом состоянии в ромбически искаженном октаэдрическом
окружении [56, 79]. Отчетливый сигнал с g = 4,14 почти несомнен-
но возникает от ионов Fe
3
+ одного и того же типа, при этом не на-
блюдается никаких различий в форме линии как функции степени
насыщения белка железом [56]. Aaca [80] недавно произвел де-
тальную теоретическую обработку этого спектра, проанализировас
результаты в виде спин-гамильтониана следующего типа:
H=-D [3S| -S (S + 1)] + E (S
2
x
-SD + g$B-S.
Главные линии с g, приблизительно равным 4, возникают о
1
среднего из трех крамеровских дублетов со спином
5
/г- Экспери
ментально полученные спектры замороженных растворов интерпре
тируются как спектры порошка и представляют собой суперпози
цию спектров беспорядочно ориентированных кристаллитов. Ране
в несколько различной форме Блюмберг [81] и Доусинг и Гибсо
[82] показали, что экспериментально наблюдаемые линии возн!-
кают из переходов в главных плоскостях, а также вдоль главны
осей тензора кристаллического поля. Значения параметров епш
гамильтониана, выведенных Ааса, приведены в табл. 9.3; в не
также даны параметры комплексов меди и хрома.
* В данном случае автор, по-видимому, подразумевает под binding site «св
зывающие полости» в
белке.
— Прим. ред.

Трансферрины. (сидерофилины)
349
Таблица 9.3
Параметры спин-гамильтониана для комплексов трансферрина
Комплекс
см—1
\E/D\
S
А
И.
Гс
HN
1
сверх-
тонкое
расщеп-
ление
Число
N-ли-
гандов
Fe
3
+ — бикарбонат
0,27 0,31—0,32
Cr
3
+ — бикарбонат
тип 1
0,55 0,32—0,33
тип 2
0,55
0,27
Cu
2
+ — бикарбонат 2,312
g
x
=2,042
^=2,059
156
12
1
Cu
2
+ (без бикар-
боната)
2,205 2,05
210
9,5
4
При отсутствии связанного бикарбоната спектр ЭПР комплекса
Fe—трансферрин значительно изменяется, но все еще характери-
зует специфически связанный металл [70]. При переходе от ней-
тральных к кислым значениям рН в спектре наблюдаются изме-
нения, сопровождающиеся появлением новой компоненты, свиде-
тельствующей о различии между связывающими центрами в таких
условиях [76]. При отсутствии бикарбоната в спектрах обнаружи-
ваются различные сигналы от тройного комплекса железа, транс-
феррина и многих других хелатных соединений металлов [70].
Спектр ЭПР комплекса железо—кональбумин—бикарбонат по
своим главным особенностям идентичен спектру комплекса с транс-
феррином; однако он содержит еще дополнительную компоненту
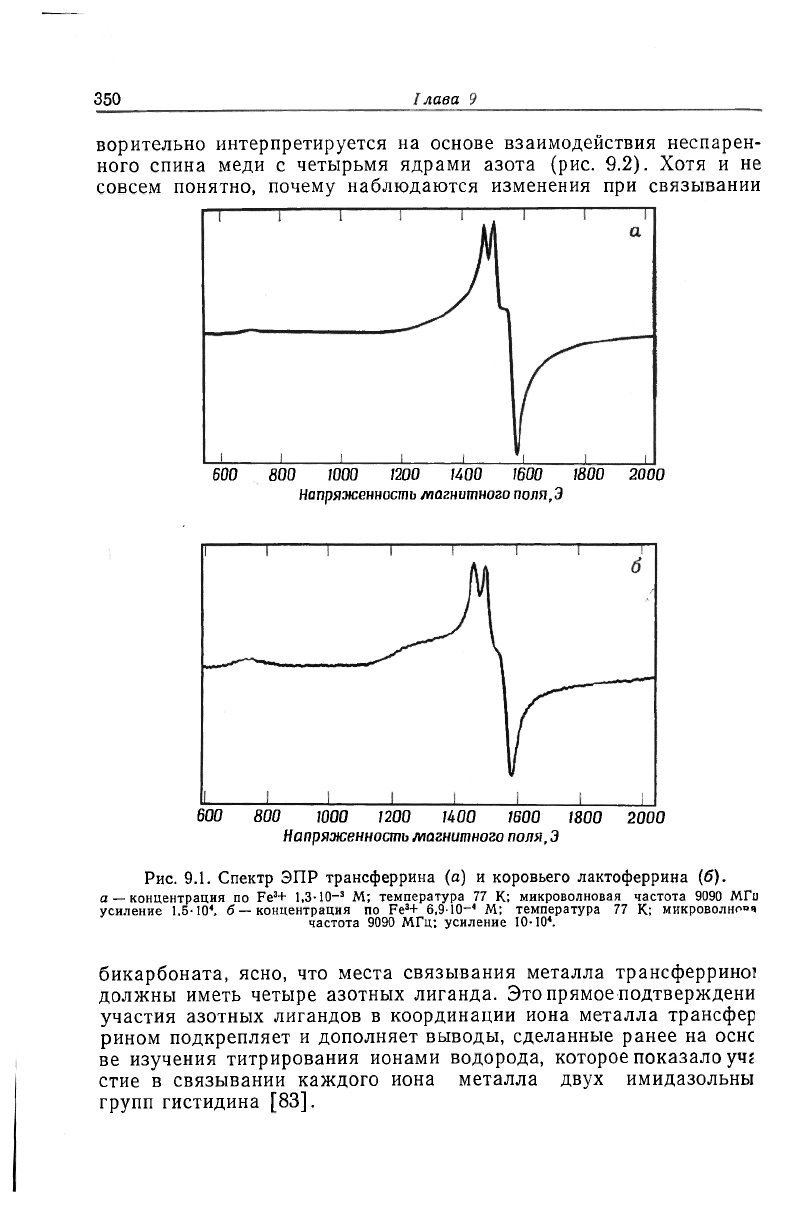
в области низкого поля с g'=4,3 [56]. Такую же компоненту на-
блюдали и другие авторы в спектрах комплекса с лактоферрином
(рис. 9.1). Детально эта дополнительная полоса еще не исследова-
на, но, по-видимому, она может быть обусловлена ионом Fe
3
+,
связанным иначе, чем в комплексе с трансферрином. Таким обра-
зом, вполне вероятно, что связывающие центры этих белков могут
несколько отличаться.
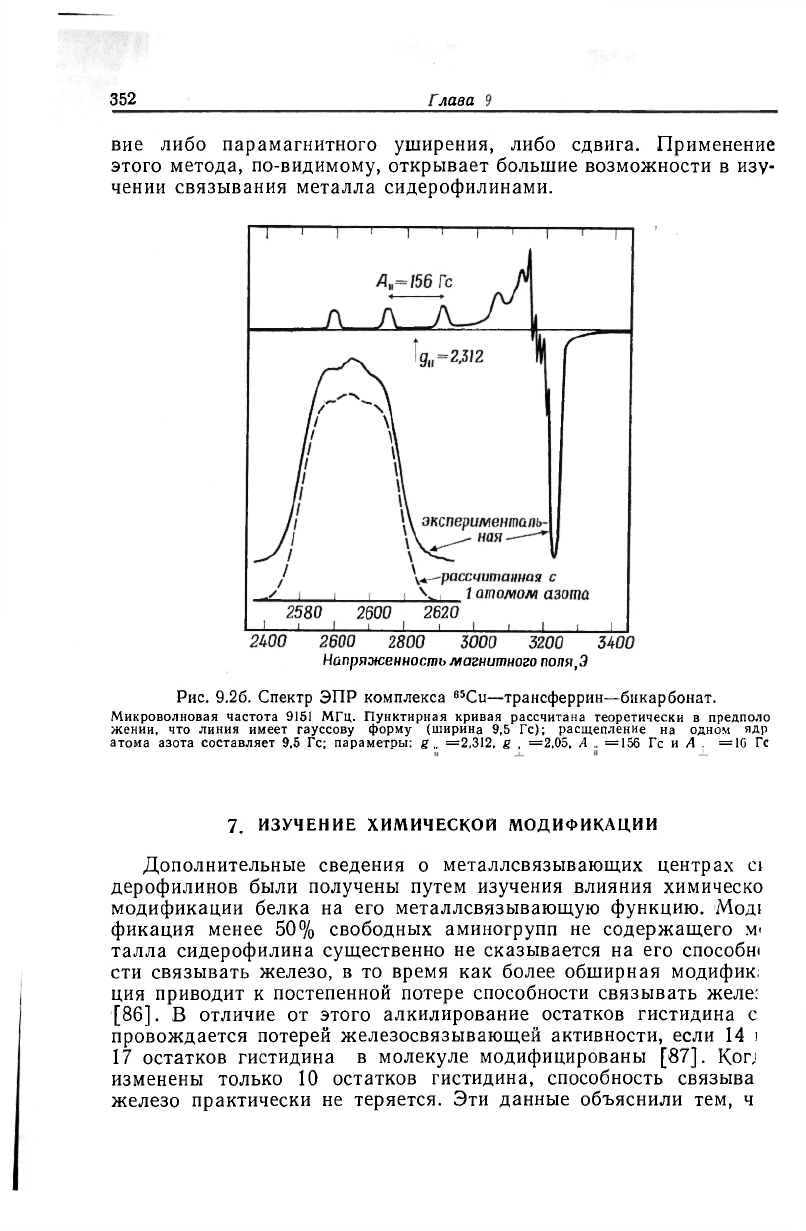
Спектр ЭПР комплекса трансферрина с медью также зависит
DT связывания бикарбоната [75]. В обоих случаях спектры явля-
ются характеристичными для атома меди, находящегося в аксиаль-
ном окружении. Наблюдаемая сверхтонкая структура находящейся
з слабом поле линии желтого комплекса медь—трансферрин—би-
<арбонат обусловлена взаимодействием с одним ядром атома азо-
га. В отсутствие бикарбоната сверхтонкая структура в спектре
зесцветного бинарного комплекса меди с трансферрином удовлет-
350
i лава 2
ворительно интерпретируется на основе взаимодействия неспарен-
ного спина меди с четырьмя ядрами азота (рис. 9.2). Хотя и не
совсем понятно, почему наблюдаются изменения при связывании
BOO 800 1000 1200 1400 1В00 1800 2000
Напряженность магнитного поля,Э
600 800 1ООО 1200 1400 1600 1800 2000
Напряженность магнитного поля, Э
Рис. 9.1. Спектр ЭПР трансферрина (о) и коровьего лактоферрина (б).
а — концентрация по Fe
3
+ 1,3-10
-
* М; температура 77 К; микроволновая частота 9090 МГц
усиление 1,5-10
1
, б — концентрация по Fe
3
+ 6,9-10-' М; температура 77 К; микроволной
частота 9090 МГц; усиление 10-10*.
бикарбоната, ясно, что места связывания металла трансферринот
должны иметь четыре азотных лиганда. Это прямое подтверждени
участия азотных лигандов в координации иона металла трансфер
рином подкрепляет и дополняет выводы, сделанные ранее на оснс
ве изучения титрирования ионами водорода, которое показало учг
стие в связывании каждого иона металла двух имидазольны
групп гистидина [83].
Tрансферрины (сидеррофилины)
351
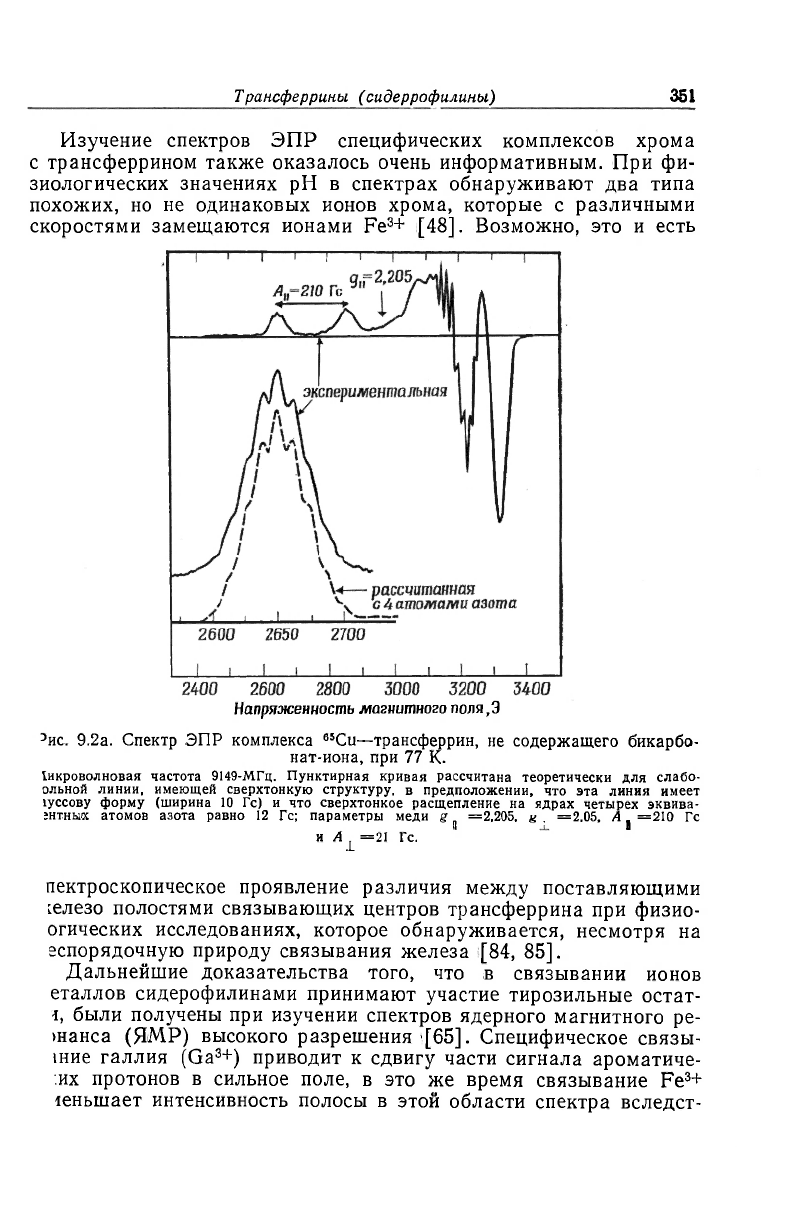
Изучение спектров ЭПР специфических комплексов хрома
с трансферрином также оказалось очень информативным. При фи-
зиологических значениях рН в спектрах обнаруживают два типа
похожих, но не одинаковых ионов хрома, которые с различными
скоростями замещаются ионами Fe
3
+ [48]. Возможно, это и есть
Напряженность магнитного поля,Э
э
ис. 9.2а. Спектр ЭПР комплекса
65
Cu-трансферрин, не содержащего бикарбо-
нат-иона, при 77 К.
!икроволновая частота 9149-МГц. Пунктирная кривая рассчитана теоретически для слабо-
ольной линии, имеющей сверхтонкую структуру, в предположении, что эта линия имеет
1уссову форму (ширина 10 Гс) и что сверхтонкое расщепление на ядрах четырех эквива-
:нтньих атомов азота равно 12 Гс; параметры меди g
^
=2,205, =2.05, A ^ =210 Гс
и A^ =21 Гс.
пектроскопическое проявление различия между поставляющими
селезо полостями связывающих центров трансферрина при физио-
огических исследованиях, которое обнаруживается, несмотря на
еспорядочную природу связывания железа [84, 85].
Дальнейшие доказательства того, что в связывании ионов
еталлов сидерофилинами принимают участие тирозильные остат-
1, были получены при изучении спектров ядерного магнитного ре-
шанса (ЯМР) высокого разрешения '[65]. Специфическое связы-
шие галлия (Ga
3
+) приводит к сдвигу части сигнала ароматиче-
:их протонов в сильное поле, в это же время связывание Fe
3
+
!еньшает интенсивность полосы в этой области спектра вследст-
352
i лава 2
вие либо парамагнитного уширения, либо сдвига. Применение
этого метода, по-видимому, открывает большие возможности в изу-
чении связывания металла сидерофилинами.
Напряженность магнитного поля,.9
Рис. 9.26. Спектр ЭПР комплекса
65
Cu-трансферрин—бикарбонат.
Микроволновая частота 9151 МГц. Пунктирная кривая рассчитана теоретически в предполо
жении, что линия имеет гауссову форму (ширина 9,5 Гс); расщепление на одном ядр
атома азота составляет 9,5 Гс; параметры: g =2,312, g =2,05, А =156 Гс и А =16 Гс
7. ИЗУЧЕНИЕ ХИМИЧЕСКОЙ МОДИФИКАЦИИ
Дополнительные сведения о металлсвязывающих центрах Ct
дерофилинов были получены путем изучения влияния химическо
модификации белка на его металлсвязывающую функцию. Мод!
фикация менее 50% свободных аминогрупп не содержащего м*
талла сидерофилина существенно не сказывается на его способа
сти связывать железо, в то время как более обширная модифик
ция приводит к постепенной потере способности связывать желе:
[86]. В отличие от этого алкилирование остатков гистидина с
провождается потерей железосвязывающей активности, если 14 :
17 остатков гистидина в молекуле модифицированы [87]. Korj
изменены только 10 остатков гистидина, способность связыва
железо практически не теряется. Эти данные объяснили тем, ч
