Буканова Е.Ф. Коллоидная химия ПАВ. Часть 1. Мицеллообразование в растворах ПАВ
Подождите немного. Документ загружается.


действием электролитов. На ККМ влияет концентрация и валентность вводимых
противоионов.
Влияние органических веществ на ККМ.
Характер влияния зависит от размера углеводородного радикала
органического вещества. Так длинноцепочечные спирты понижают ККМ, причем
степень снижения увеличивается при увеличении молекулярной массы спирта.
Увеличенный размер мицелл и вязкость растворов ПАВ эти факты объясняются
образованием смешанных мицелл ПАВ + спирт.
Низкомолекулярные добавки (метанол, ацетон, диоксан) повышают ККМ и
понижают мицеллярную массу коллоидных ПАВ.
Влияние температуры на ККМ.
Влияние температуры на ККМ определяется взаимодействием различных
факторов и характер его различен для ионогенных и неионогенных ПАВ. Вообще,
повышение температуры должно затруднять образование мицелл вследствие
возрастания дезагрегирующего влияния теплового движения молекул. Вместе с тем
с увеличением интенсивности теплового движения уменьшается гидратация
полярных групп молекул (ионов) ПАВ. Важную роль играют структурные
изменения воды при нагревании. Повышение температуры вызывает
разупорядочение воды, увеличивается энтропия воды, понижается ККМ.
Рис. 2.4. Зависимость ККМ от температуры для ионогенных и неионогенньгх ПАВ:
1 — С
10
Н
21
О(СНСН
2
О)
12
СН
3
; 2 — C
12
H
25
O(CH
2
CH
2
O)
7
H; 3 — додецилсульфат
натрия; 4 — додециламмонийхлорид.
ККМ ионогенных ПАВ слабо зависит от температуры. ККМ неионогенных
ПАВ уменьшается с ростом температуры. Гидрофильные свойства НПАВ
обуславливаются наличием в полиоксиэтилированной цепи гетероатомов кислорода
(и концевых полярных групп ОН). Дегидратация полиоксиэтилированных цепочек
при повышении температуры резко понижает истинную растворимость НПАВ в
31

воде и понижает ККМ. Гидрофобное взаимодействие усиливается, уменьшается
структурирование воды.
В случае ионогенных ПАВ эффекты дегидратации сохраняют свое значение,
однако появляется дополнительный фактор – влияние заряженных полярных
молекул ПАВ, которые оказывают разрушающее действие на структуру воды.
Переход маломерных ионов из объема водной фазы в мицеллы создает возможность
дополнительно структурировать воду, что сопровождается выделением тепла.
Повышение температуры препятствует этому процессу и затрудняет
мицеллообразование. В совокупности эти факторы в значительной мере
компенсируют друг друга и температура незначительно влияет на ККМ ионогенных
ПАВ.
2.4. Две модели мицеллообразования.
В настоящее время известно два подхода к описанию мицеллообразования.
2.4.1. Двухфазная (псевдофазная) модель мицеллообразования.
Согласно этому подходу мицеллообразование рассматривается как явление
разделения фаз, а ККМ – как концентрация, соответствующая предельной
растворимости ПАВ в молекулярной форме.
Подтверждением фазовой природы мицеллообразования служит наличие
резких изломов на кривой зависимости физико-химических свойств от
концентрации ПАВ в области ККМ. Вместе с тем образование мицелл не может
считаться истинным фазовым разделением. Размер мицелл слишком мал по
сравнению с обычными макроскопическими фазами (числа агрегаций лежат обычно
в пределах 20 – 2000). К столь малым частицам не может быть в полной мере
приложимо термодинамическое понятие фазы, которое предполагает совокупность
достаточно больших по объему гомогенных частей системы. Поэтому мицеллы
рассматривают лишь как зародыши новой фазы («псевдофазы»), а
мицеллообразование – как начало фазового разделения, остановившегося на стадии
образования зародышей.
2.4.2. Мицеллообразование как химическое равновесие.
Согласно этой точке зрения процесс мицеллообразования рассматривается как
обратимая химическая реакция, подчиняющаяся закону действующих масс, а
мицеллярные растворы – как гомогенные системы.
Процесс мицеллообразования в соответствии с законом действия масс можно
выразить для неионогенных и ионогенных ПАВ с помощью уравнений
m(ПАВ) (ПАВ)m (2.4)
и
32

nK+ + mR- M(m – n) (2.5)
K
+
- противоион; R
-
- поверхностно-активный анион; М – мицелла; m – число
R в мицелле; n – число противоионов, связанных с поверхностью мицеллы (m n);
разность (m – n) – заряд мицеллы.
Процесс мицеллообразования – быстрая обратимая реакция с периодом t =10-
7 с.
Константы равновесия этих реакций будут равны соответственно:
m
M
m
М
m
М
неион
с
c
К
(2.6)
m
R
n
K
M
m
R
n
K
M
m
R
n
К
М
ион
cc
c
К
(2.7)
где , К
+
и R
-
- активности молекулярно растворенного ПАВ, противоионов
К
+
и полиионов R
-
соответственно; и М – коэффициенты активности
неионогенного ПАВ соответственно в молекулярном и мицеллярном состоянии; К
+
, R
-
и М – коэффициенты активности соответственно противоионов, полиионов
и мицелл ионогенного ПАВ.
Стандартная энергия Гиббса мицеллообразования, приходящаяся на 1 моль
мономера, составит
K
m
RT
G
M
ln
0
(2.8)
Подставляя вместо константы равновесия мицеллообразования ее значение из
(2.6), принимая коэффициенты активности, равными единице (т. к. раствор
разбавленный), а также учитывая равенство С = ККМ, получим, например для
неионогенных ПАВ:
m
M
M
KKM
m
RT
G
ln
0
(2.9)
Рассмотрение мицеллообразования с использованием закона действия масс
позволяет определить термодинамические функции этого процесса по значению
ККМ и активности мицелл в этой области концентрации.
Активность мицелл часто принимают равной единице, однако это допущение
не совсем правомерно. Активность мицелл можно определить методом
распределения ПАВ между двумя жидкими фазами.
2.5. Гидрофобные взаимодействия. Термодинамика
мицеллообразования в водной среде.
Гидрофобные взаимодействия возникают только в водных растворах в
результате взаимодействия полярных молекул воды с неполярными гидрофобными
33
частицами (углеводородами) или неполярными радикалами молекул, в частности,
неполярными радикалами ПАВ. Основная причина возникновения гидрофобных
взаимодействий, приводящих к образованию мицеллярных растворов ПАВ, связана
со структурными изменениями, происходящими в воде при растворении в ней
углеводородов. Эти структурные изменения воды обуславливают низкую
растворимость в ней углеводородов, которая связана не с увеличением энергии, а с
уменьшением энтропии при растворении.
В настоящее время не существует единой физической картины, позволяющей
описать всю совокупность свойств воды и водных растворов. Тем не менее
расхождения между различными моделями не слишком принципиальны. В целом
вода представляется высокоструктурированной жидкостью с частичным
сохранением тетраэдрической льдоподобной ажурной структуры и наличием
несвязанных молекул воды.
Основное отличие структуры жидкой воды ото льда заключается в разрыве
части связей под действием усиленных тепловых колебаний решетки. При
комнатной температуре в воде часть водородных связей разорвана. Однако
равномерное распределение разорванных связей по всему объему воды невыгодно
из-за кооперативного характера образования водородных связей. Образуются
микрообласти, содержащие ассоциаты с максимальным числом водородных связей
на молекулу, а следовательно, со структурой, близкой к структуре льда,
обеспечивающей максимальное число связей, находящихся в равновесии со
свободными молекулами воды. "Локальные флуктуации энергии приводят к распаду
кластеров и образованию новых упорядоченных ассоциатов — кластеров, время
жизни которых порядка 10
-
10 с.
Установлено экспериментально по ИК спектрам, что при 20° С средний
кластер содержит около 57 молекул воды, около 70% всех молекул воды находится
в кластерах, причем 30% молекул в кластерах имеют координационное число,
равное четырем. Было также показано, что с повышением температуры заметно
уменьшается средняя величина кластеров (от 90 молекул при 0° до 25 при 70° С).
Специфическая структура воды является причиной гидрофобных
взаимодействий между неполярными молекулами или радикалами в водной среде
(растворе). Термин «гидрофобные взаимодействия» был введен Кауцманном для
описания взаимного притяжения неполярных групп в водной среде.
Рассмотрим, какие изменения могут происходить в воде при внесении в нее
молекул с углеводородными радикалами. Для такого рассмотрения лучше всего
подходят углеводороды, так как в них отсутствуют полярные группы, сильно
взаимодействующие как со свободными, так и со структурированными молекулами
воды. Водные растворы неполярных веществ, особенно углеводородов,
обнаруживают аномалии термодинамического поведения. Растворимость
углеводорода определяется изменением свободной энергии Гиббса ∆G, которое
складывается из энтальпийного и энтропийного членов
∆G=∆H-T∆S (2.10)
Знак при ∆G будет определяться соотношением этих членов.
34
Расчет изменения термодинамических параметров при переносе
углеводородов из неполярной среды в воду показал, что растворение алифатических
углеводородов обоих классов сопровождается возрастанием свободной энергии из-
за резких отрицательных изменений ∆S.
Например при растворении бутана в воде ∆G составляет 4,3 ккал/моль, ∆H –
1,0 ккал/моль, а ∆S - -23 ккал/моль; соответствующие параметры для бензола равны:
∆G - 4,3 ккал/моль, ∆H – 0,6 ккал/моль, ∆S - -14 ккал/моль.
Растворение углеводородов в воде приводит к уменьшению энтропии системы
в результате увеличения доли упорядоченных элементов в структуре воды.
Многочисленные экспериментальные данные: изменение диэлектрических свойств
растворов, расширение линии ЯМР, снижение коэффициента самодиффузии
показывают, что неполярные молекулы стабилизуют структуру воды, т. е.
упорядочивают ее, вследствие чего энтропия системы понижается. Плохая
растворимость углеводородов в воде связана не с увеличением энергии за счет
замены более выгодных контактов вода— вода контактами углеводород — вода, как
считали раньше, а с уменьшением энтропии. Поэтому удаление молекул
углеводорода из воды (переход их в неполярное окружение) сопровождается
увеличением энтропии и переходом системы в более выгодное энергетическое
состояние. Таким образом, гидрофобные взаимодействия определяются как ван-дер-
ваальсовыми притяжениями самих неполярных групп, так и взаимодействиями этих
групп с водой, которые, как было показано выше, связаны со структурой воды.
Главное в теории гидрофобных взаимодействий, согласно Шераге, это
представление о том, что число водородных связей, рассчитанное на моль воды,
выше вблизи углеводородной молекулы. Гидрофобные взаимодействия приводят к
большому отрицательному изменению свободной энергии (∆G) в результате
положительного изменения энтропии и малых изменений энтальпии.
Изложенные представления распространяются и на процесс
мицеллообразования ПАВ в водной среде, который протекает самопроизвольно и
сопровождается понижением свободной энергии Гиббса.
Экспериментально установлено, что энтальпия мицеллообразования
ионногенных ПАВ невелика (3-4 кДж/моль) и может принимать как положительные
значения, так и в некоторых случаях (например для алканоатов калия (с С
10
– С
14
))
практически равна нулю. В случае неионногенных ПАВ ∆H больше и всегда
положительно, т. е. мицеллообразование происходит с поглощением тепла.
Следовательно, решающую роль в протекании самопроизвольной ассоциации
ПАВ в мицеллы играет энтропийный вклад в изменение энергии Гиббса, т. е.
процесс имеет энтропийную природу. Движущая сила процесса
мицеллообразования – положительная энтропия процесса.
Положительная энтропия процесса мицеллообразования ПАВ обусловлена
тем, что как было рассмотрено выше, при растворении углеводородов и
углеводородных радикалов ПАВ в воде вокруг них возникают структурированные
участки льдоподобной («айсберговой») воды, что сильно снижает малую истинную
растворимость в воде углеводородов и мицеллообразующих ПАВ.
35
Обратный же процесс, т. е. перенос гидрофобных молекул (или
углеводородных радикалов ПАВ) из воды в неполярную среду, связан с
разрушением (плавлением структурированных оболочек вокруг углеводородных
цепей) и сопровождается повышением энтальпии (поглощением тепла) и ростом
энтропии. Поэтому по достижении предельной растворимости ПАВ в молекулярной
форме становится термодинамически выгодным мицеллообразование, приводящее к
значительному росту энтропии.
Таблица 2.2
Термодинамические функции мицеллообразования.
№
п/п
ПАВ
Т,
К
∆G,
кДж/моль
∆H,
кДж/моль
∆S,
кДж/моль
1 Додецилсульфат натрия 298 -21,7 2,2 80,2
2 Олеат натрия 298 -26,9 14,5 41,6
3
Додецилтриметиламмоний
бромид
298 -20,5 -1,3 64,8
4
Оксиэтилированный
моноалкилфенол
298 -21,4 7,6 103
303 -23,6 7,6 103
Гидрофобные взаимодействия обуславливают не только процесс
мицеллообразования. К числу подобных процессов относится солюбилизация
(самопроизвольный переход молекул углеводородов из воды в мицеллы ПАВ),
процессы глобулизации белковых молекул вследствие взаимодействия их
гидрофобных углеводородных фрагментов, агломерирование частиц в водных
суспензиях неполярных веществ, и также адсорбция дифильных молекул из водной
среды на границе раздела с неполярными средами, образование монослоев
нерастворимых ПАВ на поверхности воды.
2.6. Зависимость растворимости ионогенных ПАВ в воде от
температуры
Изучение растворимости ионогенных ПАВ с ростом температуры позволило
установить существование температуры (точнее, узкого интервала температуры),
при которой наблюдается резкое увеличение растворимости. По имени немецкого
ученого, впервые обратившего внимание на это явление, температура начала
коллоидной растворимости ПАВ была названа точкой Крафта (Т
Кр
). Впоследствии
выяснилось, что этот практически неограниченный рост растворимости обусловлен
мицеллобразованием ПАВ, тогда как межмицеллярная концентрация
«мономерного» ПАВ меняется незначительно. Рис.2.5 иллюстрирует фазовую
диаграмму раствора ПАВ в районе точки Крафта. Здесь кривая (а) это кривая
36
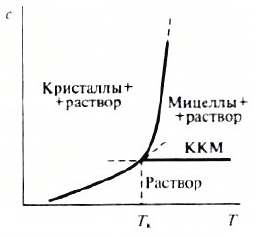
растворимости ПАВ, которая разграничивает область существования
кристаллогидратов ПАВ (а) с мицеллярной областью (в) и областью истинного
раствора (с), где ПАВ находится в молекулярно-дисперсном, ионизированном
состоянии. Точка Крафта интерпретируется как тройная точка на диаграмме
состояния ПАВ, в которой сосуществуют в равновесии мицеллы, ионы и кристаллы
ПАВ. Имеет право на существование и другое упрощенное ее определение как
нижнего температурного предела существования мицеллярной области, или как
температуры, при которой растворимость ионного ПАВ становится равной его ККМ
и достаточной для образования мицелл.
Рис. 2.5. Диаграмма состояния системы мицеллообразующее ПАВ – вода.
Другая точка зрения на точку Крафта предложена К.Шинодой и находит
развитие в более современных работах. Она базируется на рассмотрении модели
мицеллообразования как процесса выделения из пересыщенного раствора новой
высокодисперсной фазы. При таком толковании переход из области (а) в область (в)
на рис. 2.5 можно интерпретировать как процесс фазового перехода из
гидратированных кристаллов в жидкую фазу. Тогда точку Крафта следует
рассматривать как точку плавления кристаллогидратов, находящихся в равновесии с
раствором. Существенным уточнением физического смысла точки Крафта явилось
исследование В.Н. Вережникова, согласно которому в области Т
Кр
имеет место
молекулярно-структурное превращение ПАВ, зафиксированное методом
аннигиляции позитронов. Это превращение происходит в твердой фазе и в
молекулярно-дисперсном растворе и заключается в «размораживании»
определенной степени свободы внутримолекулярной подвижности, что делает
возможным «плавление» кристаллогидрата и переход ПАВ в мицеллы, сердцевина
которых обычно имеет жидкообразную структуру.
Точка Крафта характеризуется двумя параметрами: концентрационным и
температурным. Поэтому имея в виду температуру, было бы точнее говорить не
«точка Крафта», а температурный параметр точки Крафта. Но из соображений
краткости последнее название, по-видимому, не прижилось. Температурный
параметр точки Крафта связан с ее концентрационным параметром (ККМк)
следующей логарифмической зависимостью:
37

Т
Кр
=
lgККМк (2.11)
где
и
- постоянные, определяемые экспериментальным путем.
Для ПАВ типа 1:1 коэффициент
=11-19 и повышается с введением
дополнительных полярных групп до 22-53.
Величина точки Крафта зависит от молекулярного строения ПАВ, природы и
концентрации добавок. Изменения структуры ПАВ, приводящие к усилению
межмолекулярного притяжения в углеводородных областях, вызывают ее
повышение. Так, величина Т
Кр
повышается в гомологических рядах ПАВ по мере
роста длины углеводородного радикала (табл. 2.3).
Таблица 2.3
Влияние длины углеводородного радикала в гомологических рядах ионных ПАВ
на Т
Кр
и степень оксиэтилирования в неионных ПАВ на Тп.
n
Т
Кр
, С растворов ионных ПАВ
m
Т
Кр
, С растворов нонилфенола
Алкилсульфаты
Na
Сульфосукцинаты
Na
В
дистиллированной
воде
В растворе
NaCl
10 - 7.5 9 55 45
12 37 19 10 72 61
14 45 39 15 98 84.5
16 58 50 20 100 95
18 70 - - - -
Соединения с разветвленной цепью имеют меньшую Т
Кр
по сравнению с
аналогичными ПАВ нормального строения (при одинаковом количестве атомов
углерода в радикале), т.к. разветвленные цепи менее плотно упакованы и силы
когезии между цепями меньше. Заметно снижается Т
Кр
при введении в цепь двойной
связи, что обусловлено некоторой ее гидрофильностью. Это видно из сравнения
стеарата натрия (Т
Кр
=51
0
С) и соответствующего ненасыщенного соединения олеата
натрия (Т
Кр
=0
0
С). Введение полярных групп в радикалы также обычно снижает Т
Кр
.
Существенно влияет на Т
Кр
природа противоиона. У додецилсульфатов
щелочных металлов и аммония Т
Кр
лежат ниже 20
0
С. В ряду додецилсульфатов
щелочноземельных металлов уже значительно выше: для Mg(DDS)2 – 25, для
Са(DDS)2 – 50, для Sr(DDS)2 – 64 и для Ва(DDS)2 – 105
0
С. Жесткость воды, как
известно, в основном обусловлена присутствием солей кальция и магния, поэтому
низкую растворимость их солей с анионными ПАВ в обычных условиях нельзя не
учитывать при разработке рецептур моющих средств.
38
2.7. Влияние температуры на растворимость неионогенных ПАВ.
Растворы неионогенных ПАВ обладают специфической способностью
существенно изменять свои физико-химические свойства при нагревании. Это
связано с изменением их растворимости. Растворимость НПАВ уменьшается с
повышением температуры, для них характерна точка помутнения. Растворимость
оксиэтилированных ПАВ в воде обусловлена образованием гидратов вследствие
возникновения водородных связей между молекулами воды и эфирными
кислородными атомами полиэтиленгликолевого остатка. При нагревании это связи
ослабевают, происходит их дегидратация, то есть уменьшение растворимости
молекул ПАВ, что приводит к появлению опалесценции, а затем и к помутнению
раствора. При дальнейшем нагревании этого раствора происходит укрупнение
частиц вплоть до выделения капелек ПАВ в виде отдельной фазы, то есть их
“высаливание”. Температура помутнения раствора (Тп) и высаливание (Тв) ПАВ
часто используется в качестве характеристики степени полиоксиэтилирования
промышленных продуктов и влияния различных добавок на их растворимость.
Температура помутнения зависит от строения НПАВ, уменьшаясь при
увеличении степени гидрофобности (табл.2.3) На температуру помутнения влияют
электролиты. Она зависит как от природы электролита, так и от его концентрации.
2.8. Физико-химические свойства смесей ПАВ.
Композиции смесей как гомологических, так и разнотипных ПАВ широко
применяют при создании эффективных моющих средств, при эмульсионной
полимеризации, для стабилизации эмульсий различного назначения.
Использование сочетаний двух или нескольких ПАВ предоставляет
возможность изменить или расширить качественные показатели или свойства
композиции. Неаддитивное изменение того или иного показателя часто относят за
счет синергизма или, наоборот, антагонизма между молекулами ПАВ, т. е. усиления
или ослабления различных физико-химических свойств их растворов по сравнению
со свойствами растворов индивидуальных компонентов. Обычно понятие
синергизма относят к вполне конкретному показателю. Так, добавку неионогенного
ПАВ к анионному считают синергетической, если она снижает ККМ сильнее, чем
следовало бы ожидать исходя из ККМ отдельных компонентов. В тоже время эта
добавка может повышать поверхностное натяжение раствора и ухудшать моющее
действие – тогда говорят об антагонизме.
Понятие синергизма и антагонизма подразумевает наличие между
компонентами избыточного притяжения или отталкивания. Количественное
описание взаимодействий в растворах ПАВ возможно в рамках термодинамических
представлений, развитых Д.Н. Рубином и базирующихся на теории регулярных
растворов.
39

Химический потенциал неассоциированного поверхностно-активного
компонента в мицеллярном растворе (полагая, что коэффициент активности равен
1) выглядит так:
(2.12)
где μ
1
0
- стандартный химический потенциал, а С
1
- концентрация
неассоциированного ПАВ. Химический потенциал этого компонента в смешанной
мицелле можно представить через коэффициент активности f
1
:
(2.13)
При мицеллообразовании первого ПАВ (ККМ
1
= С1m):
(2.14)
α - мольная доля 1-го ПАВ в растворе, С - суммарная концентрация ПАВ
Для второго компонента аналогично можно записать:
(2.15)
По условию непрерывности следует, что ККМ смешанного
мицеллообразования (С*) равно:
(2.16)
Затем делается обычное для теории регулярных растворов допущение
относительно коэффициентов активностей:
где х - мольная доля первого ПАВ в растворе.
Параметр молекулярного взаимодействия в смешанной мицелле β связан с
энергиями парных взаимодействий молекул ПАВ;
(2.17)
Когда энергии взаимодействия между разнородными молекулами W12 велика,
то параметр β отрицателен.
В результате этих рассуждений получено уравнение, связывающее ККМ
смеси ПАВ с ККМ индивидуальных компонентов:
1
)1(/)1(ln)1(
)/ln(
2
*2
1
2
xCCx
CCx
x
(2.18)
Это уравнение используется для дальнейшего анализа смешанного
мицеллообразования. Задавая разное мольное соотношение ПАВ и располагая
40
