Березов Т.Т., Коровкин Б.Ф. Биологическая химия
Подождите немного. Документ загружается.

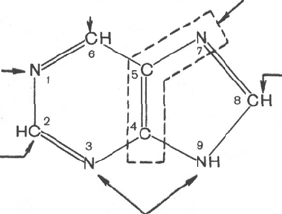
Из схемы видно, что 4-й и 5-й атомы углерода и 7-й атом азота в ядре
имеют своим источником глицин. Два атома азота (N-3 и N-9) происходят
из амидной группы глутамина, один атом азота (N-1) – из азота аспара-
гиновой кислоты; углеродный атом (С-2) происходит из углерода N
10
-фор-
мил-ТГФК, атом углерода в 8-м положении – из N
5
,N
10
-метенил-ТГФК и,
наконец, углерод С-6 имеет своим источником СО
2
.
В настоящее время благодаря исследованиям Дж. Бьюкенена, Дж. Грин-
берга, А. Корнберга и сотр. полностью расшифрована последовательность
включения перечисленных веществ в пуриновое кольцо, установлена при-
рода всех промежуточных соединений и ферментных систем, катализи-
рующих химические реакции синтеза. Интересным оказался факт почти
полного совпадения путей синтеза пуриновых оснований в печени животных
и у микроорганизмов, в частности у Е. coli и Neurospora crassa. Следует,
однако, отметить, что конечным результатом синтеза оказалось не сво-
бодное пуриновое основание, а рибонуклеотид – инозиновая кислота
(ИМФ), из которой далее синтезируются АМФ и ГМФ. На схеме пред-
ставлена последовательность всех 11 химических реакций этого синтеза
с указанием ферментных систем, коферментов, источников энергии и других
известных к настоящему времени кофакторов (см. с. 472).
Как видно из приведенной схемы, синтез инозиновой кислоты на-
чинается с D-рибозо-5-фосфата, который, как известно, является продуктом
пентозофосфатного цикла и на который переносится в необычной реакции
пирофосфатная группа АТФ. Образовавшийся 5-фосфорибозил-1-пирофос-
фат (ФРПФ) взаимодействует с глутамином, являющимся донором
NH
2
-группы, в результате чего образуется β-5-фосфорибозил-амин, причем
в процессе реакции наряду с освобождением пирофосфата и свободной
глутаминовой кислоты происходит изменение его конфигурации (из α- в β-).
Таким образом, данная стадия становится ключевой реакцией в синтезе
пуринов. На следующей стадии присоединяется вся молекула глицина
к свободной NH
2
-группе β-5-фосфорибозил-амина (реакция нуждается в
доставке энергии АТФ) с образованием глицинамидрибонуклеотида. Затем,
на следующей стадии, цепь удлиняется за счет присоединения формильной
группы из N
5
,N
10
-метенил-ТГФК с образованием формилглицинамид-
рибонуклеотида. На формильную группу последнего переносится далее
амидная группа глутамина и синтезируется формилглицинамидинрибо-
нуклеотид (реакция также идет с потреблением энергии АТФ). На сле-
дующей стадии замыкается пятичленное имидазольное кольцо и образуется
5-аминоимидазолрибонуклеотид, который способен акцептировать СО
2
с образованием рибонуклеотида 5-аминоимидазол-4-карбоновой кислоты.
471
Аспартат
N
10
–СНО–ТГФК
СО
2
Глицин
N
5
, N
10
=СН–ТГФК
Амидный азот
глутамина
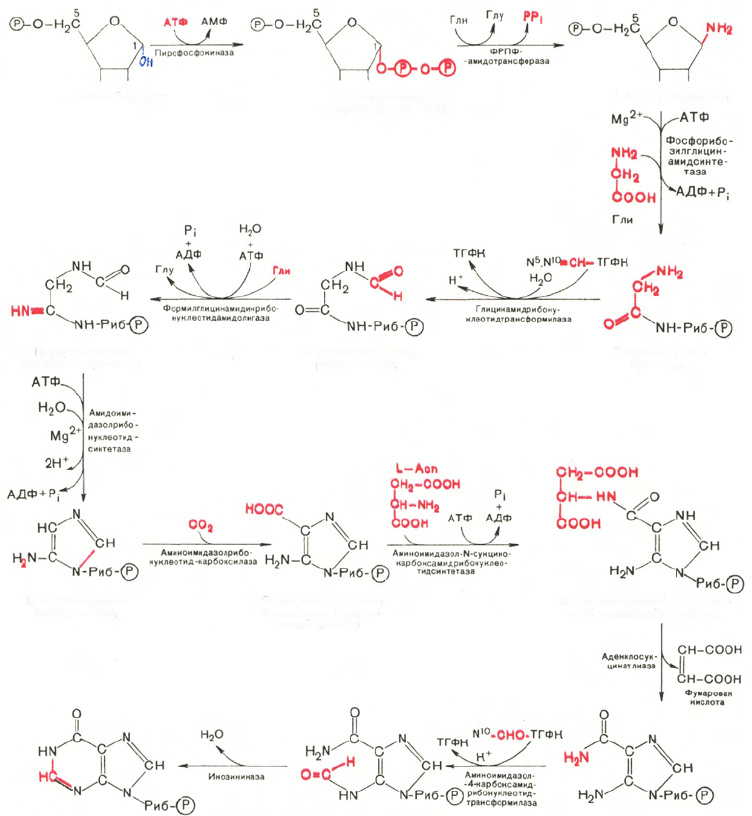
В последующем двухступенчатом процессе, в котором участвуют аспа-
рагиновая кислота и АТФ, образуется 5-аминоимидазол-4-карбоксамид-
рибонуклеотид и освобождается фумаровая кислота. В этих реакциях азот
аспарагиновой кислоты включается в 1-е положение будущего пуринового
ядра. Последний углеродный атом пиримидинового остатка кольца пурина
вводится в виде формильного остатка (источник N
10
-формил-ТГФК), ко-
торый присоединяется к 5-NH
2
-группе. После этого отщепляется молекула
воды и второе кольцо замыкается. В результате образуется первый пу-
риновый нуклеотид – инозиновая кислота (ИМФ), которая является пред-
шественником пуриновых нуклеотидов в составе нуклеиновых кислот.
АМФ и ГМФ образуются из ИМФ, причем в синтезе обоих моно-
нуклеотидов участвуют по два фермента, различных по своему механизму
472
Рибозо-5-фосфат
5-Фосфорибозил-
-1-пирофосфат (ФРПФ)
5-Фосфорибозиламин
Глицинамидрибо-
нуклеотид
N-формилглицинамид-
рибонуклеотид
N-формилглицин-
амидинрибонуклеотид
5-Аминоимидазол-
рибонуклеотид
Рибонуклеотид-5-ами-
ноимидазол-4-карбо-
новой кислоты
5-Аминоимидазол-4-N-сукцино-
карбоксамидрибонуклеотид
5-Аминоимидазол-4-кар-
боксамидрибонуклеотид
5-Формамидоимидазол-
-4-карбоксамидрибонуклеотид
Инозиновая
кислота (ИМФ)
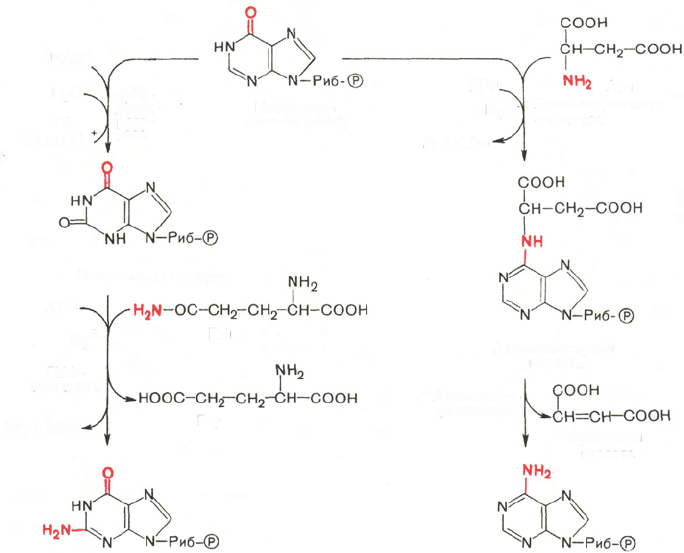
действия. Образование ГМФ из ИМФ катализируют ИМФ-дегидрогеназа
и ГМФ-синтетаза, а образование АМФ из того же предшественника
катализируется последовательным действием аденилосукцинатсинтетазы
и аденилосукцинат-лиазы. Механизм двухэтапного синтеза АМФ и ГМФ
можно представить в виде химических реакций.
В ферментативном синтезе АМФ из ИМФ специфическое участие при-
нимает аспарагиновая кислота, являющаяся донором NH
2
-группы, и ГТФ
в качестве источника энергии; промежуточным продуктом реакции является
аденилоянтарная кислота. Биосинтез ГМФ, напротив, начинается с де-
гидрогеназной реакции ИМФ с образованием ксантозиловой кислоты;
в аминировании последней используется только амидный азот глутамина.
Превращение АМФ и ГМФ в соответствующие нуклеозидди- и нуклео-
зидтрифосфаты также протекает в 2 стадии при участии специфических
нуклеозидмонофосфат- и нуклеозиддифосфаткиназ *:
ГМФ + АТФ
<=>
ГДФ +
АДФ;
ГДФ + АТФ <=> ГТФ +
АДФ.
* Следует напомнить, что основным механизмом синтеза самого АТФ из АДФ и не-
органического фосфата в живых организмах является окислительное фосфорилирование (см.
главу 9).
473
НАД
+
Н
2
О-
НАДН + Н
+
ИМФ-
дегид-
роге-
наза
Инозиновая
нислота (ИМФ)
Ксантиловая кислота
АТФ
Мg
2+
ГМФ-
синтетаза
PP
i
+ АМФ
Глн
Глу
ГМФ
ГТФ
Мg
2+
Р
i
+ ГДФ
Асп
Аденилосунцинат-
синтетаза
Аденилоянтарная
кислота
Аденилосук-
цинатлиаза
Фумаровая
кислота
АМФ
Следует указать на существование в клетках весьма тонкого механизма
регуляции синтеза пуриновых нуклеотидов. Синтез их тормозится ко-
нечными продуктами по принципу обратной связи, т.е. ингибированием
первой стадии переноса аминогруппы глутамина на ФРПФ. Фермент,
катализирующий эту стадию, оказался аллостерическим регуляторным
ферментом. Вторая особенность механизма регуляции заключается в том,
что избыток ГМФ в клетках оказывает аллостерическое торможение только
на свой собственный синтез, не влияя на синтез АМФ, и, наоборот,
накопление АМФ подавляет свой синтез, не ингибируя синтеза ГМФ.
Биосинтез пиримидиновых нуклеотидов
Механизм синтеза пиримидиновых нуклеотидов почти полностью рас-
шифрован благодаря исследованиям П. Рейхарда. Показано, что в клетках
животных и в микроорганизмах конечными продуктами синтеза также не
являются свободные пиримидиновые основания и остаток рибозы при-
соединяется к уже сформировавшемуся пиримидиновому кольцу. Синтез
начинается с элементарных уровней (СО
2
, NH
3
, аспартат), и специфическую
ключевую роль выполняет оротовая кислота.
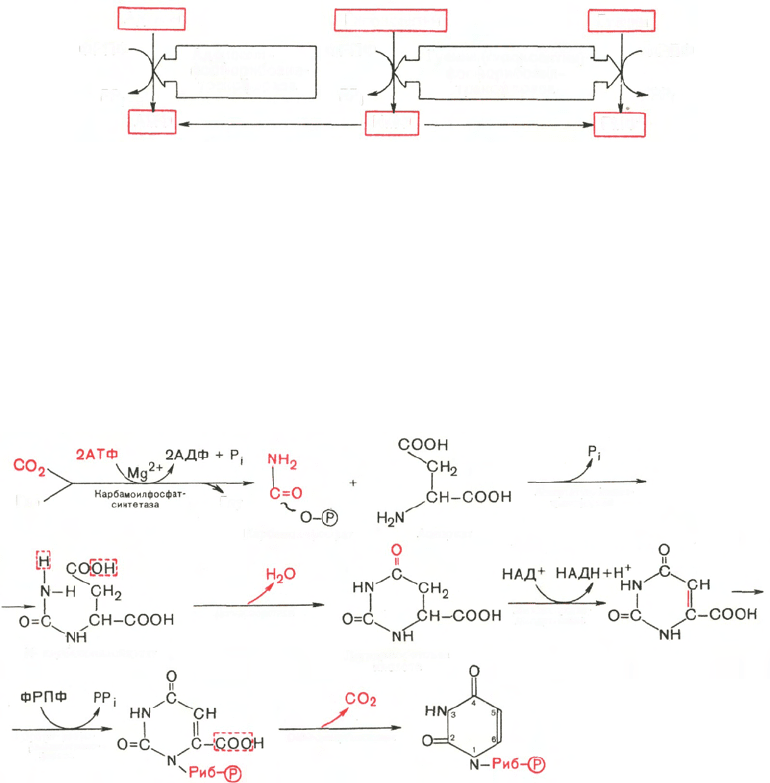
Последовательность химических реакций синтеза пиримидиновых нук-
леотидов, в частности УМФ, можно представить в следующем виде:
Как видно, I стадия синтеза УМФ включает катализируемое цито-
плазматической карбамоилфосфатсинтетазой образование карбамоилфос-
фата из глутамина (см. главу 12).
474
ФРПФ
PP
i
Аденин
АМФ
Аденозин-
фосфорибозил-
трансфераза
Гипоксантин
ФРПФ
РР
i
ИМФ
Гуанин (гипоксантин)-
фосфорибозил-
трансфераза
Гуанин
ГМФ
ФРПФ
РР
i
Глн
Глу
Карбамоилфосфат
Аспартат
Аспартаткарбамоил-
трансфераза
N- карбамоиласпартат
Дигидрооротаза
Дигидрооротовая
кислота
Дигидрооротат-
дегидрогеназа
Оротовая кислота
Оротат-фосфо-
рибозилтранс-
фераза
Оротидин-5'-фосфат (ОМФ)
ОМФ-декарбоксилаза
Уридин-5'-фосфат (УМФ)
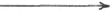
На II стадии карбамоилфосфат реагирует с аспартатом, в результате
чего образуется N-карбамоиласпарагиновая кислота. Последняя подвер-
гается циклизации (под действием дигидрооротазы) с отщеплением мо-
лекулы воды, при этом образуется дигидрооротовая кислота, которая,
подвергаясь дегидрированию, превращается в оротовую кислоту. В этой
реакции участвует специфический НАД-содержащий фермент дигидро-
оротатдегидрогеназа. Оротовая кислота обратимо реагирует с ФРПФ,
являющимся донатором рибозо-фосфата, с образованием оротидин-5'-фос-
фата (ОМФ). Декарбоксилирование последнего приводит к образованию
первого пиримидинового нуклеотида – уридин-5-фосфата (УМФ).
Превращение УМФ в УДФ и УТФ осуществляется, как и пуриновых
нуклеотидов, путем фосфотрансферазных реакций:
УМФ + АТФ <=> УДФ +
АДФ;
УДФ + АТФ <=> УТФ + АДФ .
Биосинтез цитидиловых нуклеотидов. Предшественником цитидиловых
нуклеотидов является УТФ, который превращается в ЦТФ:
У прокариот в этой реакции используется преимущественно свободный
аммиак, в то время как в клетках животных ЦТФ-синтетаза катализирует
включение амидной группы глутамина в 4-е положение пиримидинового
кольца УТФ. Следует отметить, что образующийся ЦТФ служит от-
рицательным эффектором регуляторного аллостерического фермента ас-
партаткарбамоилтрансферазы, ингибируя по типу обратной связи началь-
ную стадию биосинтеза пиридиновых нуклеотидов. АТФ предотвращает
это ингибирование.
Биосинтез тимидиловых нуклеотидов. Тимидиловые нуклеотиды входят
в состав ДНК, содержащей дезоксирибозу. Поэтому сначала рассмотрим
механизмы синтеза дезоксирибонуклеотидов. При помощи метода меченых
атомов было показано, что этот синтез начинается не со свободной
дезоксирибозы, а путем прямого восстановления рибонуклеотидов у 2'-го
атома углерода. При инкубации меченых предшественников (рибонуклео-
тидов) в бесклеточной системе бактерий метку обнаружили в составе
дезоксирибонуклеотидов. По данным П. Рейхарда, у Е. coli все 4 рибо-
нуклеозиддифосфата восстанавливаются в соответствующие дезоксиана-
логи: dАДФ, dГДФ, dЦДФ, dУДФ – при участии сложной ферментной
системы, состоящей по меньшей мере из четырех разных ферментов.
Химический смысл превращения рибонуклеотидов в дезоксирибо-
нуклеотиды сводится к элементарному акту – восстановлению рибозы в
2-дезоксирибозу, требующему наличия двух атомов водорода. Непосред-
ственным источником последних оказался восстановленный термостабиль-
ный белок тиоредоксин, содержащий две свободные SH-группы на 108
аминокислотных остатков. Тиоредоксин легко окисляется, превращаясь
в дисульфидную S-S-форму. Для его восстановления в системе имеется
специфический ФАД-содержащий фермент тиоредоксинредуктаза (мол.
масса 68000), требующая наличия восстановленного НАДФН. Обозначив
475
УТФ + Глн + АТФ
Мg
2+
ЦТФ-синтетаза
ЦТФ + Глу + АДФ + Р
i
.
условно рибонуклеозиддифосфат РДФ, образование дезоксирибонуклео-
тидов можно представить следующим образом:
Тиоредоксин-(SН)
2
+ РДФ –> Тиоредоксин-S
2
+ dРДФ
Рибонуклеозиддифосфатредуктаза
Тиоредоксин-S
2
+ НАДФН + Н
+
–> Тиоредоксин-(SН)
2
+ НАДФ
+
Тиоредоксинредуктаза
Обе стадии могут быть представлены в виде схемы:
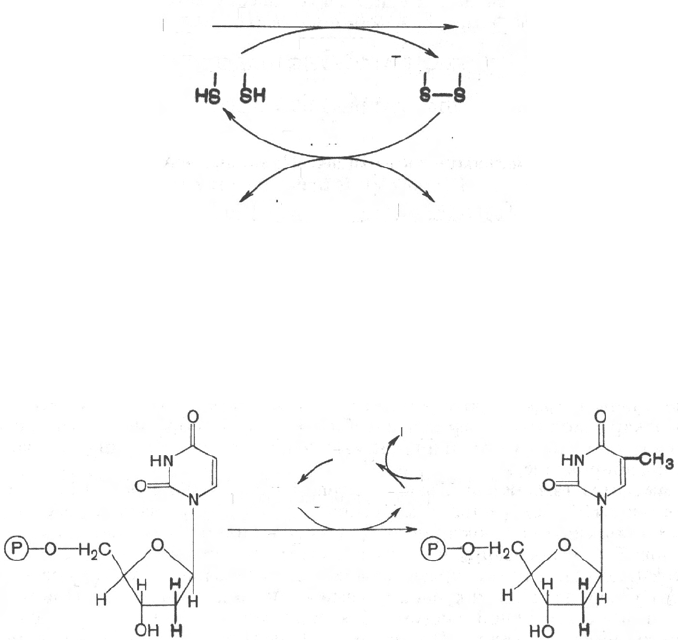
Для синтеза тимидиловых нуклеотидов, помимо дезоксирибозы, тре-
буется также метилированное производное урацила – тимин. Оказалось, что
в клетках имеется особый фермент тимидилатсинтаза, катализирующая
метилирование не свободного урацила, а dУМФ; реакция протекает по
уравнению:
Донором метильной группы в тимидилатсинтазной реакции является
N
5
,N
10
-метилен-ТГФК, которая одновременно отдает и водородный про-
тон, поэтому одним из конечных продуктов реакции является не тетра-
гидро-, а дигидрофолиевая кислота (ДГФК). Последняя вновь восста-
навливается до ТГФК под действием НАДФН-зависимой дигидрофолат-
редуктазы. Из образовавшегося ТМФ путем фосфотрансферазных реакций
образуются dТДФ и dTТФ.
Регенерация N
5
,N
10
–СН
2
–ТГФК, собственно ее биосинтез, пред-
ставляет определенный интерес. Оказалось, что этот синтез требует участия
476
Рибонуклеозиддифосфат-
редуктаза
Тиоредоксин
РДФ
dPДФ
Тиоредоксин-
редуктаза
НАДФ
+
НАДФН+ Н
+
Тиоредоксин
ТГФК
НАДФ
+
НАДФН + Н
+
N
5
,N
10
—CН
2
—ТГФК
ДГФК
Тимидилатсинтаза
dУМФ
dТМФ

аминокислоты серина (донатор метильной группы) и пиридоксальфосфат-
содержащего фермента сериноксиметилтрансферазы в соответствии с урав-
нением:
Синтез всех остальных дезоксирибонуклеозид-5'-трифосфатов, непо-
средственно участвующих в синтезе ДНК, также осуществляется путем
фосфорилирования дезоксирибонуклеозид-5'-дифосфатов в присутствии
АТФ:
АТФ + dАДФ –> АДФ + dATФ; АТФ + dЦДФ –> АДФ + dЦТФ;
АТФ + dГДФ –> АДФ + dГТФ; АТФ + dТДФ –> АДФ + dТТФ.
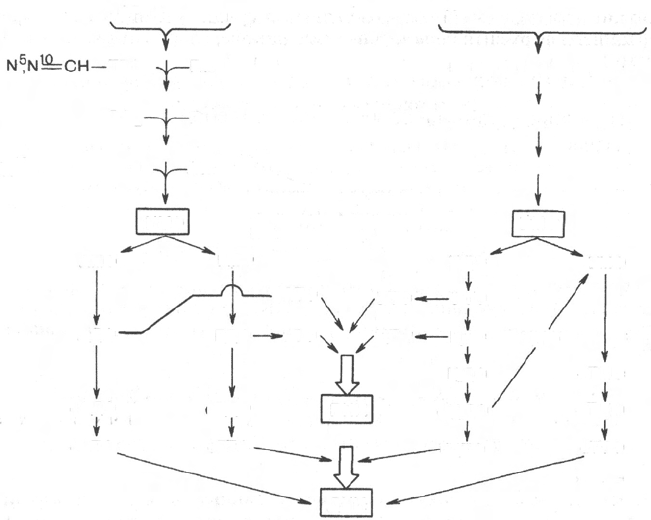
Далее на двух схемах суммированы данные о взаимопревращениях
пуриновых и пиримидиновых нуклеотидов, а также о связи их с синтезом
нуклеиновых кислот. Как видно из схем, в образовании пуриновых и
пиримидиновых нуклеотидов специфическое участие принимает ФРПФ,
являющийся донором фосфорибозильного остатка в биосинтезе как оро-
тидин-5'-фосфата, так и ИМФ; последние считаются ключевыми субстра-
тами в синтезе нуклеиновых кислот в клетках.
477
Серин
Глицин
ТГФК
Сериноксиметилтрансфераза
Аденилоянтарная
кислота
Фумарат
5-Фосфорибозил-
-1-пирофосфат
Ксантиловая
кислота
Оротовая
кислота
Оротидин-5-фосфат
CH
2
(OH)—CH(NH
2
)—COOH
CH
2
(NH
2
)—COOH
N
5
,N
10
—CH
2
—TГФK
Acп
ИМФ
НАД
+
НАДН+Н
+
Глн
Глу
РР
i
ТТФ
ТДФ
ТМФ
dУМФ
АМФ
dAMФ
АДФ
АТФ
dАДФ
dАТФ
ГМФ
dГМФ
ГДФ
dГДФ
ГТФ
dГТФ
dУТФ
dУДФ
УТФ
УДФ
УМФ
ЦТФ
ЦДФ
ЦМФ
dЦТФ
dЦДФ
dЦМФ
Биосинтез нуклеиновых кислот
Проблема биосинтеза нуклеиновых кислот является предметом присталь-
ного внимания многих исследователей и целых научных коллективов.
Следует прежде всего отметить исключительную трудность решения этой
важнейшей проблемы, связанную с неполными представлениями о природе
белковых факторов и механизмах регуляции синтеза нуклеиновых кислот.
До сих пор не раскрыты в деталях молекулярные механизмы передачи
генетической информации, закодированной в нуклеотидной последователь-
ности ДНК. Различают три основных этапа реализации генетической
информации. На первом этапе – этапе репликации происходит обра-
зование дочерних молекул ДНК, первичная структура которых идентична
родительской ДНК (копирование ДНК). Репликация ДНК является клю-
чевой функцией делящейся клетки и частью таких биологических процессов,
как рекомбинация, транспозиция и репарация. На втором этапе, названном
транскрипцией, генетическая информация, записанная в первичной
структуре ДНК, переписывается в нуклеотидную последовательность РНК
(синтез молекулы РНК на матрице ДНК). На третьем этапе – этапе
трансляции генетическая информация, содержащаяся уже в нуклеотидной
последовательности молекулы РНК, переводится в аминокислотную по-
следовательность белка. Далее представлены основные итоги исследований
и наши представления о биосинтезе полимерных молекул ДНК, РНК
и белка, полученные к середине 1996 г.
Биосинтез ДНК
Прежде чем изложить современные представления о механизме биосинтеза
ДНК, следует представить сведения о синтезе этого соединения в бес-
478
ФРПФ + Глн
ТГФК
Гли
СО
2
Глн
N
10
-CHO—ТГФК
Асп
ИМФ
АМФ
АДФ
dАДФ
dАТФ
ГМФ
ГДФ
dГДФ
dГТФ
АТФ
ГТФ
Карбамоилфосфат + Асп
N-карбамоиласпартат
Оротовая кислота
УМФ
УДФ
УМФ
УТФ
УТФ
ЦТФ
ЦТФ
РНК
ДНК
ЦДФ
dЦДФ
dЦТФ
ЦМФ
dТМФ
dTДФ
dТТФ
клеточной системе, которыми располагает биохимия. Известно, что для
любого синтеза полимерной органической молекулы, осуществляемого in
vitro или in vivo, требуется энергия. Источником энергии в реакциях
полимеризации мононуклеотидов является энергия, освобождаемая всеми
четырьмя типами дезоксирибонуклеозидтрифосфатов, участвующих в син-
тезе ДНК. Образующийся пирофосфат под действием пирофосфатазы
также расщепляется на две молекулы ортофосфата, давая дополнительную
энергию для биосинтеза ДНК.
Помимо энергии, биогенез ДНК требует наличия специфических фер-
ментов, катализирующих отдельные этапы синтеза, и множества белковых
факторов, абсолютно необходимых для регулирования процесса репли-
кации и проявления каталитической активности ферментов.
Ферментные системы синтеза ДНК у про- и эукариот до конца не
выяснены. По имеющимся данным, в репликации ДНК, включающей
узнавание точки начала процесса, расплетение родительских цепей ДНК
в репликационной вилке, инициацию биосинтеза дочерних цепей и даль-
нейшую их элонгацию и, наконец, окончание (терминация) процесса,
участвует более 40 ферментов и белковых факторов, объединенных в
единую ДНК-репликазную систему, называемую реплисомой.
После открытия в 1958 г. А. Корнбергом у Е. coli фермента, катали-
зирующего биосинтез ДНК и названного ДНК-полимеразой I, в течение
почти 10 лет считалось, что этот фермент является единственной по-
лимеразой, принимающей участие в репликации ДНК in vitro *. Однако
позже был открыт мутант Е. coli, лишенный ДНК-полимеразы I, но спо-
собный синтезировать ДНК с нормальной скоростью. Оказалось, что для
репликации ДНК Е. coli необходимо участие нескольких ферментов.
ДНК-полимераза I не наделена способностью инициировать синтез цепей
ДНК de novo. Одним из хорошо изученных ферментов, участвующих
в стадии инициации репликации ДНК, является специфическая клеточная
РНК-полимераза, названная праймазой, которая катализирует синтез
короткого олигорибонуклеотида (от 10 до 60 нуклеотидов), т.е. праймера,
с которого затем начинается синтез ДНК. Праймазы различаются как по
структуре, так и по специфичности действия. Получены новые данные
о существенной роли праймасомы в каталитическом действии фермента.
Праймасома представлена ансамблем из 7 различных субъединиц, вклю-
чающих около 20 полипептидов общей мол. массой 70000. При помощи
белка n' праймасома подвергается быстрому перемещению к отстающей
цепи ДНК за счет энергии, генерируемой АТФазной активностью белка n'.
В состав праймасомы входит также комплекс белков dna В и dna С,
который вблизи репликационной вилки периодически участвует в фор-
мировании специфической вторичной структуры ДНК, подходящей для
узнавания праймазой.
Основным ферментом, катализирующим биосинтез новообразованной
ДНК (точнее, стадию элонгации репликации ДНК), является ДНК-поли-
мераза III, представляющая собой мультимерный комплекс собственно
ДНК-полимеразы (мол. масса около 900000) и ряда других белков.
ДНК-полимераза III из Е. coli состоит минимум из 10 субъединиц. Одна из
них – β-субъединица получена в кристаллическом виде, и выяснена ее тре-
тичная структура. Имеются доказательства, что в димерной форме
* За выдающийся вклад в решение проблем биосинтеза ДНК и РНК А. Корнберг
и С. Очоа были удостоены Нобелевской премии в 1959 г.
479
ДНК-полимераза III катализирует сопряженный синтез ведущей (лиди-
рующей) и отстающей цепей ДНК при репликации (см. далее). Более точно
выяснена также роль ДНК-полимеразы I: она катализирует отщепление
затравочного олигорибонуклеотидного праймера и заполнение образу-
ющихся после этого пробелов (ниш) дезоксирибонуклеотидами. Известно,
что ДНК-полимеразы II из Е. coli (мол. масса 88000) выполняет «ре-
монтные» функции, исправляя повреждения цепей ДНК. Укажем также, что
ДНК-полимераза I в качестве матрицы использует одноцепочечные участ-
ки, в то время как ДНК-полимераза III – двухцепочечные ДНК, в которых
имеются короткие одноцепочечные последовательности.
Важную функцию соединения двух цепей ДНК или замыкания двух
концов одной цепи ДНК в процессе репликации либо репарации ДНК
выполняет особый фермент – ДНК-лигаза, катализирующая за счет энер-
гии АТФ образование фосфодиэфирной связи между 3'-ОН-группой де-
зоксирибозы одной цепи и 5'-фосфатной группой другой цепи ДНК.
Функцию раскручивания (расплетения) двойной спирали ДНК в репли-
кационной вилке, происходящего за счет энергии гидролиза АТФ, вы-
полняет специфический rep-белок, названный хеликазой (мол. масса
300000). Образовавшиеся на определенное время одноцепочечные участки
ДНК служат в качестве матрицы при репликации и стабилизируются при
помощи особых белков, связывающихся с одноцепочечной ДНК (ДНК-
связывающие белки) и препятствующих обратному комплементарному
взаимодействию цепей ДНК (мол. масса 75600). В связи с этим их иногда
называют дестабилизирующими двойную спираль белками. Имеются, кро-
ме того, особые ферменты топоизомеразы (у прокариот одна из них
названа ДНК-гиразой), которые играют особую роль в сверхспирализации,
обеспечивая как репликацию, так и транскрипцию ДНК. Эти ферменты
наделены способностью не только создавать супервитки, но и уничтожать
суперспирализацию путем сшивания образующихся разрывов или раз-
резания ДНК. Наконец, открыты специальные ферменты, «редактиру-
ющие» ДНК, т.е. осуществляющие вырезание и удаление ошибочно вклю-
ченных нуклеотидов или репарирующие повреждения ДНК, вызванные
физическими или химическими факторами (рентгеновское излучение, УФ-
лучи, химический мутагенез и др.).
Из клеток животных выделено несколько ДНК-полимераз, и в разных
лабораториях они получили различные наименования.
К настоящему времени у эукариот, как и у бактерий (см. ранее),
открыто несколько ДНК-полимераз. В репликации ДНК эукариот
участвуют два главных типа полимераз – α и δ. Показано, что ДНК-
полимераза α состоит из 4 субъединиц и является идентичной по
структуре и свойствам во всех клетках млекопитающих, причем одна из
субъединиц оказалась наделенной праймазной активностью. Самая крупная
субъединица ДНК-полимеразы а (мол. масса 180000) катализирует реак-
цию полимеризации, преимущественно синтез отстающей цепи ДНК, яв-
ляясь составной частью праймасомы. ДНК-полимераза δ состоит из
2 субъединиц и преимущественно катализирует синтез ведущей цепи ДНК
(см. далее). Открыта также ДНК-полимераза ε, которая в ряде случаев
заменяет δ-фермент, в частности при репарации ДНК (исправление на-
рушений ДНК, вызванных ошибками репликации или повреждающими
агентами). Следует отметить, что в эукариотических клетках открыты два
белковых фактора репликации, обозначаемых RFA и RFC. Фактор репли-
кации А выполняет функцию белка – связывание одноцепочечной ДНК
(наподобие белковых факторов связывания разъединенных цепей ДНК при
480
