Березов Т.Т., Коровкин Б.Ф. Биологическая химия
Подождите немного. Документ загружается.

с мочой в качестве главного конечного продукта белкового обмена в
организме человека и животных. Подсчитано, что в состоянии азотистого
равновесия организм взрослого здорового человека потребляет и соот-
ветственно выделяет примерно 15 г азота в сутки; из экскретируемого
с мочой количества азота на долю мочевины приходится около 85%,
креатинина – около 5%, аммонийных солей – 3%, мочевой кислоты – 1% и на
другие формы – около 6%.
В процессе эволюции живые организмы выработали различные типы
азотистого обмена. Это аммониотелический тип, при котором главным
конечным продуктом азотистого обмена является аммиак; он свойствен
преимущественно рыбам. При уреотелическом типе обмена основным ко-
нечным продуктом обмена белков является мочевина; такой тип характерен
для человека и животных. Урикотелический тип характерен для птиц
и рептилий; главным конечным продуктом данного типа обмена является
мочевая кислота.
Специфические пути обмена некоторых аминокислот
Помимо общих путей обмена, характерных для большинства аминокислот,
в настоящее время в животных тканях довольно подробно выяснены
индивидуальные пути превращения почти всех аминокислот, входящих
в состав белковых молекул. Некоторые из этих превращений в коли-
чественном отношении имеют второстепенное значение, но образующиеся
из них продукты реакции могут играть важную, а иногда и решающую роль
в процессах обмена веществ. Далее рассматривается выборочно обмен тех
аминокислот, специфические (так называемые частные) пути превращения
которых в организме человека и животных определяют во многих от-
ношениях его физиологическое состояние.
Обмен глицина и серина
Глицин является единственной из всех входящих в состав белков амино-
кислот, в молекуле которой отсутствует асимметричный атом углерода.
Тем не менее метаболически он связан с химическими компонентами
организма в большей степени, чем любая другая аминокислота.
На схеме видно, что глицин в некоторых синтезах играет незаменимую
роль, в частности в образовании белков, пуриновых нуклеотидов, гема
гемоглобина, парных желчных кислот, креатина, глутатиона и др. Боль-
шинство этих реакций представлено в соответствующих разделах учебника.
Здесь укажем на реакции, при помощи которых осуществляются взаимо-
превращения глицина, серина и треонина, а также на реакции катаболизма
451
Глутатион
Муравьиная кислота
Гиппуровая кислота
Креатин
H
2
O + СО
2
+ NН
3
Серин
ГЛИЦИН
Треонин
Тканевые белки
Глюкоза (гликоген)
Липиды
Гем (гемоглобин)
Пурины (ДНК, РНК)
Желчные кислоты
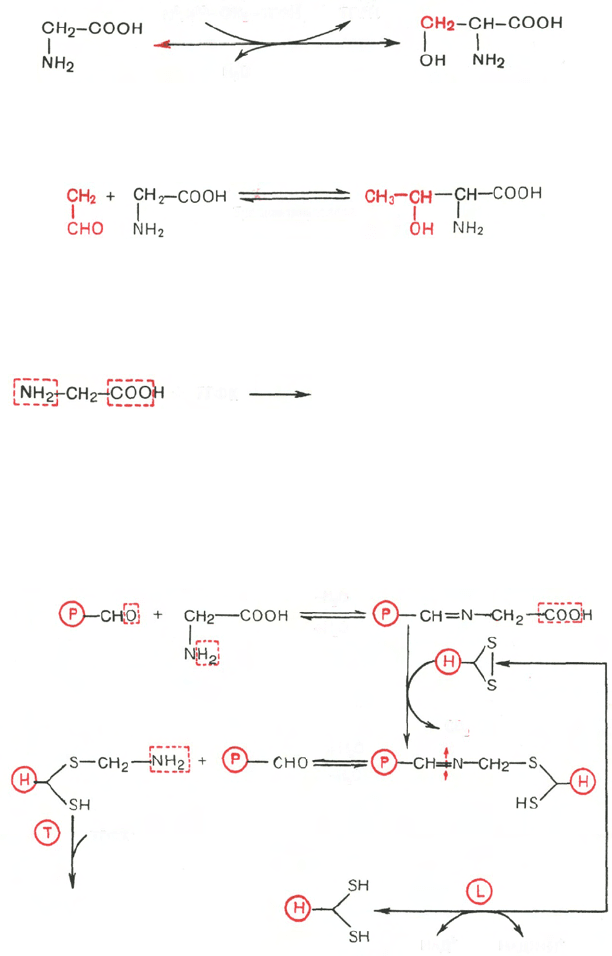
глицина. Показано, что в реакции взаимопревращения глицина и серина
участвует тетрагидрофолиевая кислота; эту реакцию катализирует пири-
доксалевый фермент серин-оксиметилтрансфераза:
Имеются также доказательства взаимопревращения треонина и глицина
в треонинальдолазной реакции:
Основным путем катаболизма глицина в животных тканях, однако,
считается распад его на СО
2
, NH
3
и N
5
,N
10
-метилентетрагидрофолиевую
кислоту по уравнению:
Механизм этой реакции, недавно раскрытый К. Тада, включает участие
митохондриальной глицинрасщепляющей ферментной системы,
отличной от глицинсинтазы и состоящей из 4 белков: Р-белка, содержащего
пиридоксальфосфат (глициндекарбоксилаза); Н-белка, содержащего липое-
вую кислоту; Т-белка, требующего присутствия ТГФК, и L-белка, назван-
ного липамиддегидрогеназой:
Биологический смысл данного пути катаболизма глицина состоит,
вероятнее всего, в образовании активного одноуглеродного фрагмента (N
5
,
N
10
—СН
2
—ТГФК), используемого в уникальных реакциях синтеза ме-
тионина, пуриновых нуклеотидов, тимидиловой кислоты и др. Получены
452
Глицин
Серин
Треонинальдолаза
Глицин
Треонин
НАД
+
НАДН + Н
+
N
5
, N
10
-CH
2
-ТГФK
ТГФK
Н
2
О
+ ТГФК
СO
2
+ NH
3
+ N
5
, N
10
–СН
2
-ТГФК
–H
2
O
+H
2
O
СO
2
+ Н
2
O
–Н
2
О
ТГФК
N
5
, N
10
–СН
2
-ТГФК + NH
3
+

доказательства, что наследственная некетогенная глицинемия (повышение
уровня глицина в крови) обусловлена недостаточностью Р- или Т-белка
глицинрасщепляющей ферментной системы печени или мозга и что каждый
из этих белков контролируется отдельным геном.
Серин легко превращается в пируват под действием сериндегидратазы.
В связи с этим в тканях имеются условия для превращения глицина (через
серин) в пируват. Этим путем осуществляется участие глицина в обмене
углеводов. Важную роль играет серин в биосинтезе сложных белков –
фосфопротеинов, а также фосфоглицеридов. Помимо фосфатидилсерина,
углеродный скелет и азот серина используются в биосинтезе фосфатидил-
этаноламина и фосфатидилхолина (см. главу 11).
Ряд других эссенциальных функций глицина, в частности участие в
образовании δ-аминолевулиновой кислоты при синтезе порфиринов (гема)
и пуриновых нуклеотидов, рассматривается далее (см. главу 13).
Обмен серосодержащих аминокислот
В молекулах белка обнаружены три серосодержащие аминокислоты (ме-
тионин, цистеин и цистин), метаболически тесно связанные друг с другом.
Благодаря наличию в составе цистеина высокореактивной SH-группы в
тканях легко осуществляется ферментативная окислительно-восстанови-
тельная реакция между цистеином и цистином *.
Дисульфидная связь часто образуется между двумя остатками цистеина
внутри одной полипептидной цепи или между двумя полипептидными
цепями, способствуя тем самым стабилизации молекулы белка. Цистеин
является составной частью трипептида глутатиона, сокращенно обозна-
чаемого Г—SH, что подчеркивает функциональную значимость его тио-
группы и возможность образования дисульфидной связи окисленного глу-
татиона (Г—S—S—Г).
Известно, что многие ферменты содержат в активном центре SH-груп-
пы, абсолютно необходимые для каталитической реакции. При их окисле-
нии ферменты теряют свою активность. Предполагают, что одной из
главных функций глутатиона является сохранение этих ферментов в ак-
тивной восстановленной форме. Окисленный глутатион может восстанав-
ливаться под действием глутатионредуктазы, используя НАДФН. Кроме
того, глутатион может оказывать ингибирующее действие на некоторые
белки. В частности, известная реакция инактивации инсулина под действием
глутатионинсулинтрансгидрогеназы, в которой SH-глутатион является до-
нором водородных атомов, разрывающих дисульфидные связи между
двумя полипептидными цепями молекулы инсулина. Установлена также
коферментная функция глутатиона, в частности для глиоксилазы I. Ранее
обсуждалось участие глутатиона в транспорте аминокислот через кле-
точную мембрану.
* Окисление цистеина в цистин возможно и неферментативным путем.
453
Цистеинредунтаза
НАД
+
НАДН + Н
+
Цистеин
Цистеин
Цистин
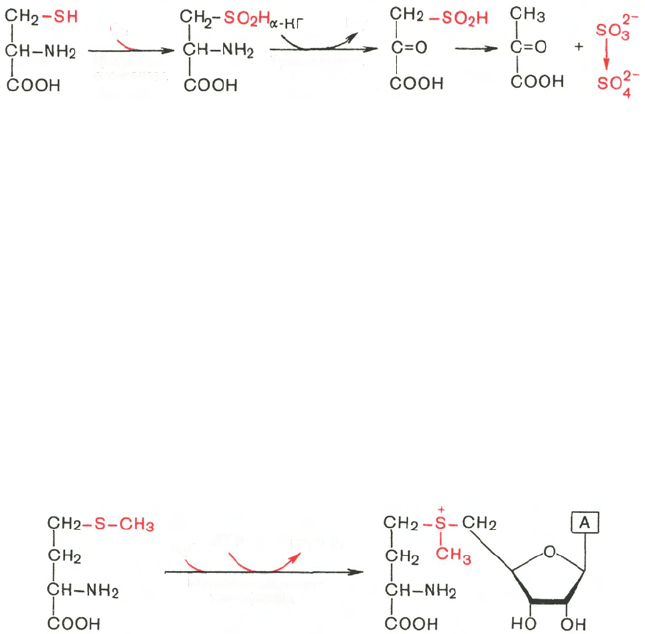
В процессе катаболизма сера метионина в тканях в основном переходит
в серу цистеина, а взаимопревращение цистина в цистеин осуществляется
легко. Поэтому проблема окисления серы всех аминокислот практически
сводится к окислению цистеина. Главным путем оказался окислительный,
включающий окисление цистеина в цистеинсульфиновую кислоту, транс-
аминирование последней с α-кетоглутаратом и образование пирувата и
сульфита по схеме:
Сульфит затем быстро окисляется в тканях и выводится с мочой в виде
нетоксичных сульфатов и эфиросерных кислот. Использование цистеина
и продуктов его окисления – цистеинсульфиновой и цистеиновой кислот – в
образовании таурина рассмотрено ранее.
Метаболические пути превращения метионина в тканях значительно
разнообразнее, чем пути превращения других серосодержащих аминокис-
лот; тем не менее катаболизм метионина осуществляется через цистеин. Это
превращение метионина в цистеин оказалось необратимым процессом.
Выяснилось также, что углеродный скелет цистеина происходит из другой
аминокислоты, а именно серина. Фактическим донором метильных групп
в реакциях трансметилирования является не свободный метионин, а так
называемый активный метионин – S-аденозилметионин, который образу-
ется в процессе АТФ-зависимой реакции, катализируемой метионин-
аденозилтрансферазой.
Своеобразие данной реакции заключается в том, что СН
3
-группа ме-
тионина активируется под действием положительного заряда соседнего
атома серы. S-аденозилметионин участвует во всех реакциях, где метильная
группа используется в биосинтетических реакциях: например, в синтезе
адреналина, креатинина, тимина, фосфатидилхолина, бетаина и др. Об-
разовавшийся после отщепления метильной группы S-аденозилгомоцистеин
подвергается гидролизу на аденозин и гомоцистеин; последний исполь-
зуется в синтезе серина (это основной путь превращения) или служит
акцептором метильной группы от N
5
—СН
3
—ТГФК в синтезе метионина
(эту реакцию катализирует гомоцистеинметилтрансфераза), завершая, та-
ким образом, своеобразный цикл активирования метильной группы.
454
Цистеинди-
оксигеназа
Трансаминаза
Цистеин
Цистеин-
сульфинат
β-Сульфи-
нилпируват
Пируват
Метионин-аденозил-
трансфераза
Метионин
S-Аденозилметионин
О
2
Глу
Н
2
О
АТФ
PP
i
+ P
i
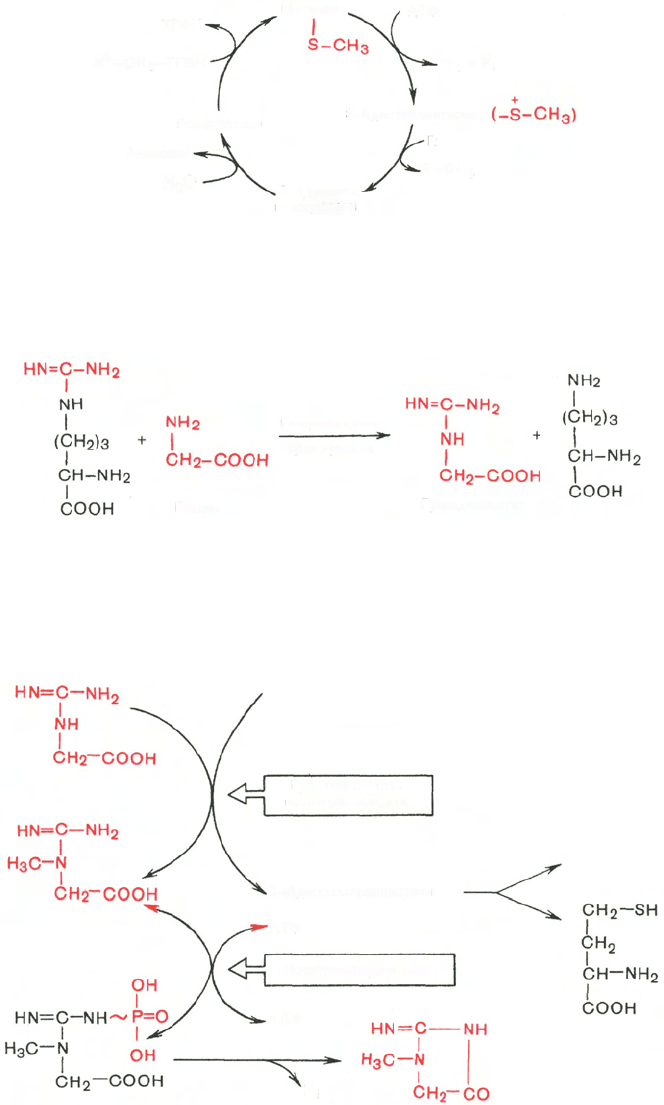
В качестве примера приводим схему биосинтеза креатина, в котором
принимают участие три аминокислоты: аргинин, глицин и метионин.
Реакция синтеза протекает в две стадии. Первая стадия – биосинтез гуани-
динацетата – осуществляется в почках при участии глицин-амидинотранс-
феразы (КФ 2.1.4.1):
Вторая стадия синтеза креатина протекает в печени при участии
гуанидинацетатметилтрансферазы (КФ 2.1.1.2):
455
Метионин
АТФ
PP
i
+ Р
i
S-Аденозилметионин
R
R-CH
3
S-Аденозил-
гомоцистеин
Н
2
О
Аденозин
Гомоцистеин
ТГФК
N
5
–СН
3
-ТГФК
Глицин
Аргинин
Глицинамидино-
трансфераза
Гуанидинацетат
Орнитин
S-Аденозилметионин
Гуанидинацетат
Гуанидинацетат-
метилтрансфераза
Креатин
Креатинфосфат
S- Аденозилгомоцистеин
Аденозин
АТФ
АДФ
P
i
Креатинин
Гомоцистеин
Креатинфосфокиназа
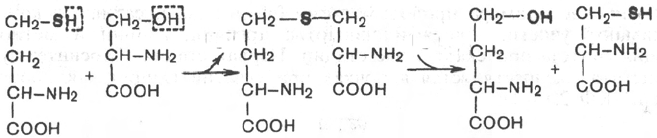
Креатин подвергается фосфорилированию с образованием креатин-
фосфата, который после дефосфорилирования (необратимая реакция)
превращается в креатинин, выделяющийся с мочой.
Гомоцистеин может вновь превращаться в метионин путем мети-
лирования. Однако основной путь дальнейшего превращения гомоцис-
теина связан с его использованием в синтезе цистеина, который мо-
жет быть представлен в виде двух последовательных ферментативных
реакций.
Ферменты, катализирующие синтез и распад цистатионина (циста-
тионин-β-синтаза и цистатионаза), содержат ПФ. Цистеин далее подвер-
гается окислению по описанному ранее пути, а гомосерин после транс-
аминирования с α-кетоглутаратом превращается в α-кетомасляную кис-
лоту; последняя может также образоваться из цистатионина непосредствен-
но, минуя стадию гомосерина.
Обмен фенилаланина и тирозина
Фенилаланин относится к незаменимым аминокислотам, поскольку ткани
животных не обладают способностью синтезировать его бензольное коль-
цо. В то же время тирозин полностью заменим при достаточном по-
ступлении фенилаланина с пищей. Объясняется это тем, что основной путь
превращения фенилаланина начинается с его окисления (точнее, гидрокси-
лирования) в тирозин (рис. 12.6). Реакция гидроксилирования катали-
зируется специфической фенилаланин-4-монооксигеназой, которая в ка-
честве кофермента содержит, как все другие гидроксилазы, тетрагидро-
биоптерин. Блокирование этой реакции, наблюдаемое при нарушении
синтеза фенилаланин-4-монооксигеназы в печени, приводит к развитию
тяжелой наследственной болезни – фенилкетонурии (фенилпировиноградная
олигофрения). В процессе трансаминирования тирозин превращается в
n-оксифенилпировиноградную кислоту, которая под действием специфи-
ческой оксидазы подвергается окислению, декарбоксилированию, гидро-
ксилированию и внутримолекулярному перемещению боковой цепи с об-
разованием гомогентизиновой кислоты; эта реакция требует присутствия
аскорбиновой кислоты, роль которой пока не выяснена. Дальнейшее
превращение гомогентизиновой кислоты в малеилацетоуксусную кислоту
катализируется оксидазой гомогентизиновой кислоты. Малеилацетоуксус-
ная кислота под действием специфической изомеразы в присутствии глу-
татиона превращается в фумарилацетоуксусную кислоту, подвергающуюся
гидролизу с образованием фумаровой и ацетоуксусной кислот, дальнейшие
превращения которых уже известны.
456
Гомоцистеин
Серин
Цистатионин
Гомосерин
Цистеин
H
2
O
H
2
O
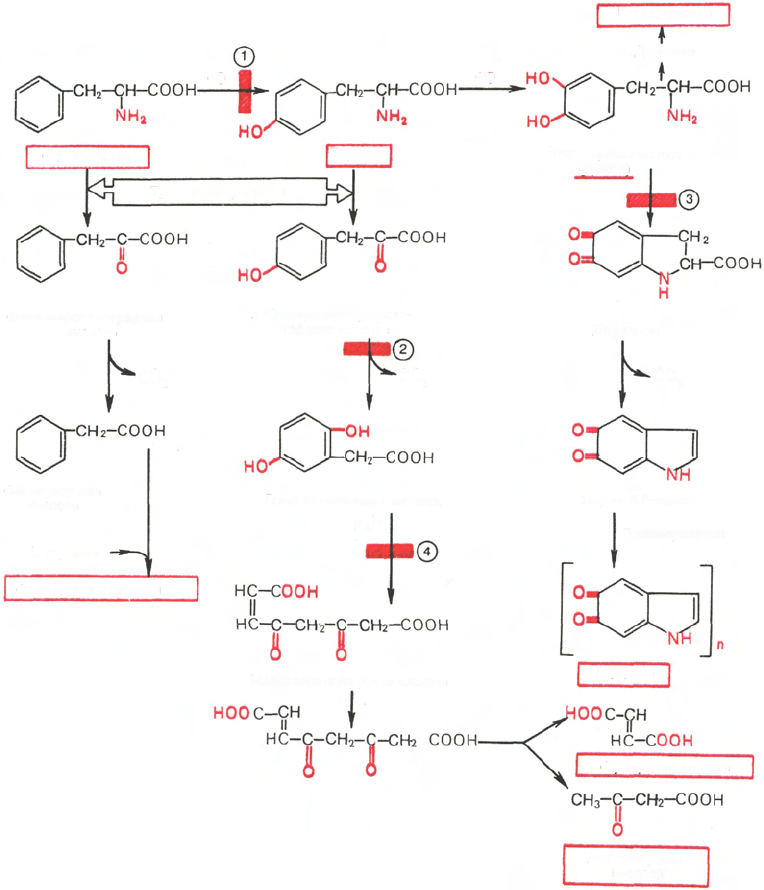
Рис. 12.6. Основные метаболические превращения фенилаланина и тирозина.
Цифры в кружках - участки блокирования реакций при фенилкетонурии (1), тирозинозе (2),
альбинизме (3) и алкаптонурии (4).
Участие молекулы тирозина в биосинтезе гормонов щитовидной железы
и катехоламинов подробно представлено в главе 8. Фенилаланин и тирозин
являются также предшественниками меланинов. В этом важном биоло-
гическом процессе, обеспечивающем пигментацию кожи, глаз, волос, ак-
тивное участие принимает фермент тирозиназа.
457
Катехоламины
Дофамин
Фенилаланин
Тирозин
Диоксифенилаланин
(ДОФА)
Трансаминирование
Фенилпировиноградная
кислота
n-Оксифенилпировино-
градная кислота
Дофахром
Фенилуксусная
кислота
Гомогентизиновая кислота
Индол-5,6-хинон
L-глутамин
Полимеризация
Фенилацетилглутамин
Малеилацетоуксусная кислота
Меланин
Фумарилацетоуксусная кислота
Фумаровая кислота
Ацетоуксусная
кислота
+O
+O
СO
2
CO
2
CO
2
Fe
2+
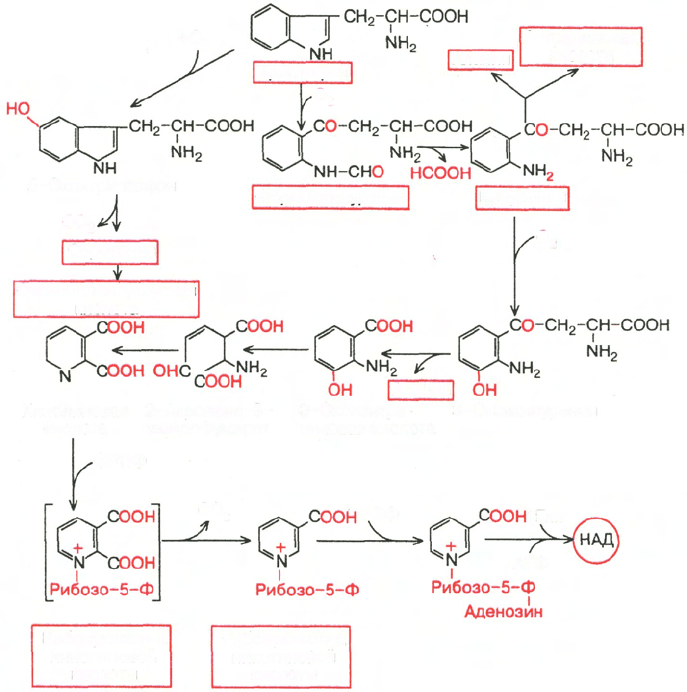
Обмен триптофана
Триптофан относится к незаменимым для человека и животных амино-
кислотам, поскольку является предшественником ряда важных биологи-
чески активных веществ, в частности серотонина и рибонуклеотида ни-
котиновой кислоты. Кроме того, один из его метаболитов, в частности
индолилуксусная кислота, обладает ростстимулирующей актив-
ностью в отношении растений (ростовой фактор). В физиологических
условиях более 95% триптофана окисляется по кинурениновому пути и не
более 1% – по серотониновому (рис. 12.7). Серотонин в организме под-
вергается окислительному дезаминированию с образованием индолилук-
сусной кислоты, которая выделяется с мочой. Содержание этой кислоты
в моче повышено при поражениях кишечника злокачественными карци-
ноидами, когда около 60% триптофана окисляется по серотониновому
пути. Основной путь обмена триптофана приводит к синтезу НАД, умень-
шая потребность организма в витамине PP. Триптофан под действием
гемсодержащего фермента триптофан-2,3-диоксигеназы в присутствии
Рис. 12.7. Метаболические превращения триптофана.
458
5-Окситриптофан
Триптофан
Аланин
Антраниловая
кислота
Формилкинуренин
Кинуренин
Серотонин
Оксииндолилуксусная
кислота
Хинолиновая
кислота
2-Акролеил-3-
амидофумарат
3-Оксиантра-
ниловая кислота
Аланин
3-Оксикинуренин
Рибонуклеотид
хинолиновой
кислоты
Рибонуклеотид
никотиновой
кислоты
Дезамидо-НАД
+O
2
O
2
СO
2
O
2
ФРПФ
СО
2
АТФ
Глн
АТФ
молекулярного кислорода превращается в формилкинуренин, который рас-
падается при участии формамидазы (формилкинурениназы) на муравьиную
кислоту и кинуренин; последний окисляется в 3-оксикинуренин. Дальнейшие
превращения 3-оксикинуренина связаны с пиридоксалевым ферментом
кинурениназой, гидролизующей его на аланин и 3-оксиантраниловую
кислоту, которая через ряд промежуточных продуктов (механизм обра-
зования их до конца не раскрыт) превращается в хинолиновую кислоту, т.е.
в непосредственный предшественник рибонуклеотида никотиновой кис-
лоты.
Обмен аминокислот с разветвленной цепью
Катаболизм аминокислот с разветвленной цепью: лейцина, изолейцина
и валина – преимущественно осуществляется не в печени (место распада
большинства остальных аминокислот), а в мышечной и жировой тканях,
в почках и ткани мозга. Сначала все три аминокислоты подвергаются
трансаминированию с α-кетоглутаратом под действием одного общего
и специфического фермента – аминотрансферазы аминокислот с разветв-
ленной цепью (КФ 2.6.1.42) (не содержится в печени) с образованием
соответствующих α-кетокислот. Последующее окислительное декарбокси-
лирование α-кетокислот приводит к образованию ацил-КоА-производных.
Следует отметить, что фермент, катализирующий окислительное де-
карбоксилирование указанных α-кетокислот, высокоспецифичен (по ана-
логии с пируватдегидрогеназным и α-кетоглутаратдегидрогеназным комп-
лексами) и также нуждается в присутствии всех пяти кофакторов (см. главу
10). Известно наследственное заболевание «болезнь кленового сиропа», при
которой нарушено декарбоксилирование указанных α-кетокислот (вслед-
ствие синтеза дефектного дегидрогеназного комплекса), что приводит не
только к накоплению в крови аминокислот и α-кетокислот, но и к их
экскреции с мочой, издающей запах кленового сиропа. Болезнь встречается
редко, проявляется обычно в раннем детском возрасте и приводит к
нарушению функции мозга и летальному исходу, если не ограничить или
полностью не исключить поступление с пищей лейцина, изолейцина и
валина.
Обмен дикарбоновых аминокислот
Классическими работами советских ученых А.Е. Браунштейна и С.Р. Мар-
дашева и американского биохимика А. Майстера доказана роль дикарбо-
новых аминокислот (глутаминовой и аспарагиновой кислот и их амидов –
459
Лейцин
Изолейцин
Валин
α-КГ
Глу
Аминотрансфераза
АМК с разветвлен-
ной цепью
α-Кетоизокапроат
α-Кето-β-метилва-
лериат
α-Кетоизовалериат
СO
2
Дегидрогеназ-
ный комплекс
α-кетокислот
с разветвлен-
ной цепью
Ацил-КоА-
производ-
ные
жирных
кислот
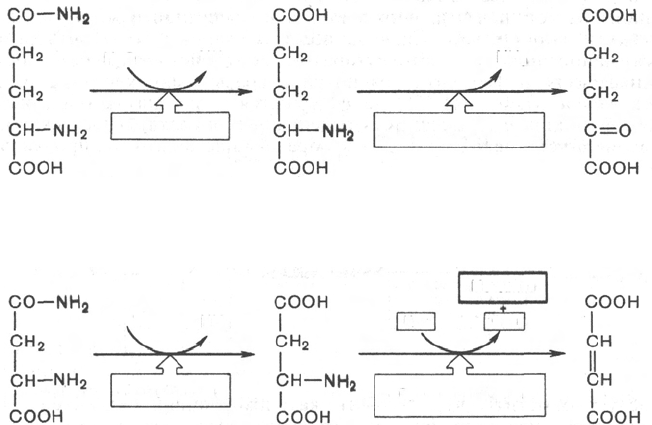
глутамина и аспарагина) в интеграции азотистого обмена в организме.
Система дикарбоновых аминокислот, к которой относят также соответст-
вующие α-кетокислоты, теснейшим образом связана не только с азотистым
метаболизмом в целом, но и с обменом липидов и углеводов. Ранее
отмечалась особая роль дикарбоновых аминокислот и ферментов, ка-
тализирующих их превращения, в перераспределении азота в организме,
дезаминировании и синтезе природных аминокислот (реакции трансде-
заминирования и трансреаминирования), в образовании конечных про-
дуктов белкового обмена – синтезе мочевины.
Основные катаболические пути превращения дикарбоновых амино-
кислот и их амидов могут быть представлены в виде следующих
реакций:
Аспарагиновая кислота принимает непосредственное участие в орни-
тиновом цикле мочевинообразования, в реакциях трансаминирования и
биосинтезе углеводов (гликогенная аминокислота), карнозина и ансерина,
пуриновых и пиримидиновых нуклеотидов (см. главу 14), а также в синтезе
N-ацетиласпарагиновой кислоты в ткани мозга. Роль последней, содер-
жащейся в довольно высоких концентрациях в ткани мозга млекопи-
тающих, пока не выяснена.
Глутаминовая кислота, являющаяся гликогенной и заменимой амино-
кислотой для человека и животных, также включается в синтез ряда
специфических метаболитов, в частности глутатиона и глутамина. Помимо
участия в транспорте аммиака и регуляции кислотно-щелочного равно-
весия, глутамин – это незаменимый источник азота в ряде синтезов, в
частности в биосинтезе пуриновых и пиримидиновых нуклеотидов, амино-
сахаров, в обезвреживании фенилуксусной кислоты (синтез фенилацетил-
глутамина) у человека и человекообразных обезьян, а также в синтезе
460
Глутаминаза
Глу-дегидрогеназа
Глутамин
Глутамат
α-Кетоглутарат
Аспарагиназа
Орнитиновый цикл
Н
2
O
NH
3
NH
3
H
2
O
NH
3
Мочевина
Цит
Орн
Аспарагин
Аспартат
Фумарат
