Березов Т.Т., Коровкин Б.Ф. Биологическая химия
Подождите немного. Документ загружается.

Этот тип неконкурентного ингибирования чаще всего наблюдается
у ферментов, катализирующих превращения более одного субстрата, когда
связывание ингибитора не блокирует связывание субстрата с активным
центром. Ингибитор при этом соединяется как со свободным ферментом,
так и с ES-комплексом.
Известно, кроме того, так называемое бесконкурентное ингиби-
рование, когда ингибитор связывается с ферментом также в некатали-
тическом центре, однако не со свободным ферментом, а только с ES-комп-
лексом в виде тройного комплекса.
Для выяснения вопроса о типе ингибирования пользуются уравнениями
Михаэлиса-Ментен, Лайнуивера-Бэрка или другими, например уравне-
нием Эди-Хофсти:
v = –K
m
(v/[S]) + V
max
и соответствующими графиками в прямолинейных координатах.
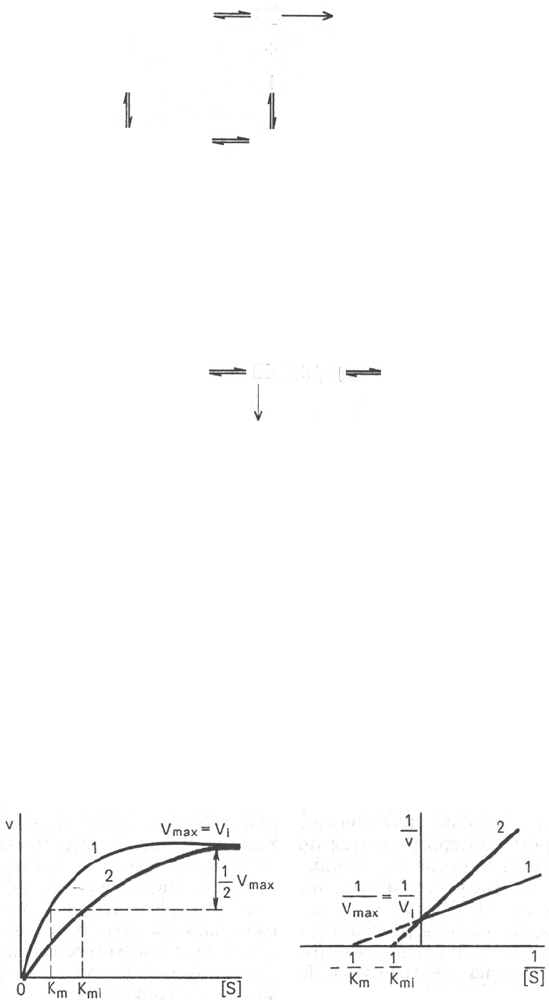
При конкурентном типе ингибирования ингибитор увеличивает значение
К
m
, не оказывая влияния на максимальную скорость V
max
(рис. 4.21). Это
означает, что при достаточно высокой концентрации субстрата [S] ин-
гибитор вытесняется молекулами субстрата из комплекса EI. При некон-
курентном ингибировании (рис. 4.22) ингибитор снижает величину макси-
мальной скорости. Если при этом величина К
m
не уменьшается, то говорят
о полностью неконкурентном ингибировании. Подобный тип ингибиро-
вания имеет место при образовании неактивных, труднодиссоциирующих
Рнс. 4.21. Графики зависимости скорости ферментативной реакции от концентра-
ции субстрата в присутствии конкурентного ингибитора.
а - в координатах v от [S]; б - в координатах 1/v от 1/[S]; V
max
и V
i
- максимальные скорости
реакции; К
m
и K
mi
- константа Михаэлиса соответственно в отсутствие (1) и в присутствии (2)
ингибитора.
151
Е
+
S
ES
+
Е
+
Р
+
I
ЕI
+
S
I
ESI
Е
+
S
ES
+
l
ESI
Е
+
Р
а
б
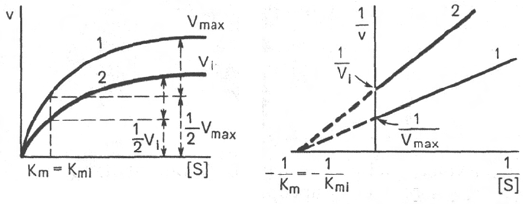
Рис. 4.22. Графики зависимости скорости ферментативной реакции от концентра-
ции субстрата в присутствии неконкурентного ингибитора.
Обозначения те же, что на рис. 4.21.
комплексов EI и(или) EIS. Часто, однако, наблюдается смешанный тип
ингибирования, иногда называемый частично неконкурентным, или обра-
тимым неконкурентным ингибированием (см. ранее), при котором сни-
жение V
max
сочетается с одновременным увеличением значений К
m
. Это
означает, что комплекс EI сохраняет частичную активность, т.е. способ-
ность к образованию промежуточного тройного комплекса EIS, в котором
субстрат подвергается замедленному каталитическому превращению. В
редких случаях степень торможения активности фермента может увели-
чиваться с повышением концентрации субстрата. Для этого типа тормо-
жения был предложен, как отмечено ранее, довольно неточный термин
«бесконкурентное ингибирование». Один из механизмов такого торможения
обусловлен возможностью соединения ингибитора с комплексом ES с об-
разованием неактивного или медленно реагирующего тройного ком-
плекса EIS.
Таким образом, при графическом анализе скоростей ферментативных
реакций как функции концентраций субстрата может быть получена ценная
информация не только о кинетике ферментативных реакций, но и о мо-
лекулярных механизмах ферментативного катализа.
РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ
Одним из уникальных свойств живых организмов является удивительная их
способность к сохранению сбалансированности катаболических (биодегра-
дативных) и анаболических (биосинтетических) процессов. При этом в клет-
ках одновременно совершаются процессы синтеза, распада и взаимопрев-
ращения сотен и тысяч разнообразных веществ, которые в свою очередь
регулируются множеством механизмов, обеспечивающих постоянство внут-
ренней среды организма. Некоторые из этих регуляторных механизмов,
среди которых важная роль принадлежит механизмам регуляции синтеза
и каталитической активности ферментов, будут рассмотрены далее.
Влияние закона действия масс. В катализируемой ферментом обратимой
химической реакции, например А + В <=> С + D, концентрация компонентов
реакции и соответственно направление реакции будут регулироваться влия-
нием закона действия масс. Оно, в частности, может быть показано
в обратимой реакции трансаминирования, катализируемой ферментом
аланинаминотрансферазой:
Аланин + α-Кетоглутарат <=> Пируват + Глутамат.
152
а
б
Этот тип регуляции играет, очевидно, лишь ограниченную роль, по-
скольку в реальных условиях реакция обычно протекает в одном направле-
нии, так как образовавшиеся продукты могут оказаться субстратами для
действия других ферментов и выводиться из сферы реакции. В этих случаях
устанавливается скорее устойчивое (стационарное) состояние, чем истинное
равновесие.
Изменение количества фермента. На бактериях хорошо изучен феномен
индуцированного (индуцирующего) синтеза ферментов при выращи-
вании их на среде, где единственным источником углерода и энергии служит
тот или иной углевод, например глюкоза. Замена в среде глюкозы на
лактозу (индуктор) приводит к индуцированному или адаптивному (после
небольшого периода лаг-фазы) синтезу фермента галактозидазы (програм-
мированному лактозным геном, см. главу 13), расщепляющей лактозу на
глюкозу и галактозу.
В клетках прокариот и эукариот имеются ферменты, концентрация
которых не требует добавления индуктора; это так называемые консти-
тутивные ферменты. Количество фермента в клетке зависит от наличия
продукта реакции, катализируемой данным ферментом, причем продукт
реакции вызывает торможение синтеза фермента в результате репрессии
(см. далее).
В животных тканях быстрый синтез ферментов наблюдается реже.
Механизм его (индуцирующий синтез) изучен только для небольшого
числа ферментов: тирозинтрансаминазы, серин- и треониндегидратазы,
триптофанпирролазы и др. – в ответ на введение гормонов или прием
белковой пищи. Однако при поступлении в организм некоторых ядов,
канцерогенных веществ, алкалоидов, инсектицидов через несколько дней
наблюдается резкое повышение активности (соответственно количества)
ферментов-гидроксилаз (монооксигеназ) эндоплазматической сети
клеток печени, окисляющих чужеродные вещества в нетоксичные для
организма продукты. Вполне допустимо предположить, что в этих случаях
имеет место синтез ферментов путем индукции (т.е. de novo). Описаны
случаи, когда под действием подобных гидроксилаз чужеродные вещества
превращаются в организме в более токсичные соединения. Это явление,
обратное детоксикации, получило название летального синтеза.
Проферменты. Протеолитические ферменты пищеварительного тракта,
а также поджелудочной железы синтезируются в неактивной форме – в виде
проферментов (зимогенов). Регуляция в этих случаях сводится к пре-
вращению проферментов в активные ферменты под влиянием специфи-
ческих агентов или других ферментов – протеиназ. Так, трипсин в под-
желудочной железе синтезируется в форме неактивного трипсиногена.
Поступив в кишечник, он превращается в активный трипсин в результате
аутокатализа или под действием других протеиназ (механизм активации
подробно рассматривается в главе 12). Превращение неактивного пепси-
ногена в активный пепсин происходит аутокаталитически в результате
специфического ограниченного протеолиза в присутствии соляной кислоты
и также связано с отщеплением от профермента специфического ингибитора
пептидной природы. Эти превращения зимогенов в активные ферменты
связаны с конформационными изменениями молекулы фермента и форми-
рованием активного центра или его раскрытием (демаскирование). Синтез
протеиназ в неактивной форме и ряда других неактивных белков-пред-
шественников имеет, очевидно, определенный биологический смысл, пре-
дотвращая разрушение клеток органов, в которых образуются профер-
менты. Примерами подобного активирования белков является активиро-
153

Рис. 4.23. Ковалентная модификация фермента путем фосфорилирования-дефосфо-
рилирования остатков серина.
Рис. 4.24. Нековалентная модификация фермента путем аденилирования-деадени-
лирования.
вание некоторых гормонов (проинсулин —> инсулин), белка соединительной
ткани (растворимый проколлаген превращается в нерастворимый колла-
ген), белков свертывающей системы крови.
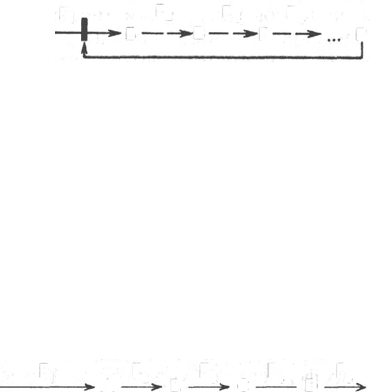
Химическая модификация фермента. Некоторые белки при формиро-
вании третичной структуры подвергаются постсинтетической химической
модификации (см. главу 1). Оказалось, что активность ряда ключевых
ферментов обмена углеводов, в частности фосфорилазы, гликогенсинтазы
и др., также контролируется путем фосфорилирования и дефосфорили-
рования, осуществляемого специфическими ферментами – протеинкиназой
и протеинфосфатазой, активность которых в свою очередь регулируется
гормонами (см. главу 10). Уровень активности ключевых ферментов обмена
углеводов и соответственно интенсивность и направленность самих про-
цессов обмена определяются соотношением фосфорилированных и де-
фосфорилированных форм этих ферментов.
Обычно различают обратимую ковалентную и нековалентную хими-
ческие модификации ферментов, осуществляемые через ОН-группы серина,
реже – тирозина или за счет нековалентных взаимодействий с молекулой
фермента. В первом случае активным ферментом оказывается или фосфо-
рилированная, или дефосфорилированная форма, как в случае с моле-
кулами мышечной фосфорилазы и гликогенсинтазы соответственно (см.
главу 10). В качестве примеров можно в виде схемы представить оба типа
модификации, в которой символом Р обозначается остаток фосфата,
P
i
– неорганический фосфат (Н
3
РО
4
), РР
i
– неорганический пирофосфат
(Н
4
Р
2
О
7
), АМФ – остаток адениловой кислоты (рис. 4.23; 4.24).
Химическая постсинтетическая модификация ферментов включает,
кроме того, процессы ограниченного протеолиза (см. ранее), метилиро-
вания (см. главу 13), гликозилирования, уридилирования, аденилирования,
АДФ-рибозилирования * и др., обеспечивая тем самым микроскопический
* Интересно, что дифтерийный и холерный токсины наделены энзиматической актив-
ностью, вызывая АДФ-рибозилирование (соответственно инактивацию) ключевых клеточных
ферментов или белков. Дифтерийный токсин выключает синтез белкового фактора 2 стадии
элонгации синтеза белка, а холерный – специфического G-белка и как следствие вызывает
массивную потерю воды.
154
2АТФ
2АДФ
Киназа
Фосфатаза
2P
i
2Н
2
O
Е
Е
Е
Е
Е
Е
2АТФ
2РР
i
2АМФ
2Н
2
O
АМФ
АМФ
Е
Е
тип регуляции активности ферментов и соответственно физиологическую
скорость процессов обмена веществ.
Аллостерическая регуляция. Во многих строго биосинтетических реак-
циях основным типом регуляции скорости многоступенчатого фермента-
тивного процесса является ингибирование по принципу обратной
связи. Это означает, что конечный продукт биосинтетической цепи подав-
ляет активность фермента, катализирующего первую стадию синтеза,
которая является ключевой для данной цепи реакции. Поскольку конечный
продукт структурно отличается от субстрата, он связывается с аллостери-
ческим (некаталитическим) центром молекулы фермента, вызывая ингиби-
рование всей цепи синтетической реакции.
Предположим, что в клетках осуществляется многоступенчатый био-
синтетический процесс, каждая стадия которого катализируется собст-
венным ферментом:
Скорость подобной суммарной последовательности реакций в значи-
тельной степени определяется концентрацией конечного продукта Р,
накопление которого выше допустимого уровня оказывает мощное инги-
бирующее действие на первую стадию процесса и соответственно на
фермент E
1
.
Впервые существование подобного механизма контроля активности
ферментов метаболитами было обнаружено у Е.coli при исследовании
синтеза изолейцина и ЦТФ. Оказалось, что изолейцин, являющийся
конечным продуктом синтеза, избирательно подавляет активность треонин-
дегидратазы, катализирующей первую стадию последовательного процесса
превращения треонина в изолейцин, насчитывающего пять ферментативных
реакций:
Аналогично ЦТФ как конечный продукт биосинтетического пути оказы-
вает ингибирующий эффект на первый фермент (аспартаткарбамоилтран-
сферазу), регулируя тем самым свой собственный синтез (см. главу 13).
Этот тип ингибирования получил название ингибирования по принципу
обратной связи, или ретроингибирования. Существование его доказано
во всех живых организмах. В настоящее время он рассматривается как один
из ведущих типов регуляции активности ферментов и клеточного мета-
болизма в целом *.
С другой стороны, в амфиболических процессах, выполняющих одно-
временно биосинтетические и биодеградативные функции **, доказано су-
* Скорость реакции (как и активность ферментов) в чисто биодеградативных (ката-
болических) процессах регулируется промежуточными продуктами, являющимися индикато-
рами энергетического состояния клетки (пуриновые нуклеотиды, пирофосфат, неорганический
фосфат и др.).
** К амфиболическим процессам относят такие центральные пути обмена, как гликолиз,
гликогенолиз, цикл трикарбоновых кислот, гексозомонофосфатный путь, трансаминирование
аминокислот.
155
L-треонин
Треонинде-
гидратаза
L-изолейцин.
А
E
1
Е
2
Е
3
Е
4
Р
Б
В
Г
E
1
А
Е
2
В
Е
3
С
Е
4
D
Е
5
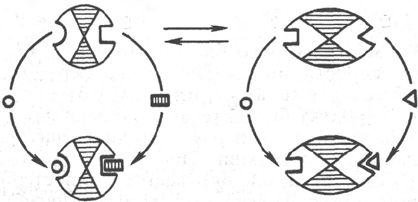
Рис. 4.25. Взаимодействие алло-
стерического фермента с субст-
ратом и эффекторами (схема).
а - активный комплекс; б - неактив-
ный комплекс; 1 - активный центр;
2 - аллостерический центр; 3 - субст-
рат; 4 - положительный эффектор;
5 - отрицательный эффектор.
ществование регуляции как по типу ретроингибирования, так и макроэрги-
ческими соединениями – индикаторами энергетического состояния клетки.
Для амфиболических процессов уникальным типом регуляции, свойствен-
ным только им, является, кроме того, активация предшественником,
когда первый метаболит в многоступенчатом пути активирует фермент,
катализирующий последнюю стадию. Так, доказано активирующее влияние
глюкозо-6-фосфата, являющегося предшественником гликогена, на фермент
гликогенсинтазу.
Подобные типы ингибирования конечным продуктом и активирования
первым продуктом свойственны аллостерическим (регуляторным) фермен-
там, когда эффектор, модулятор, структурно отличаясь от субстрата,
связывается в особом (аллостерическом) центре молекулы фермента, прост-
ранственно удаленном от активного центра. Следует, однако, иметь в виду,
что модуляторами аллостерических ферментов могут быть как активаторы,
так и ингибиторы. Часто оказывается, что сам субстрат оказывает активи-
рующий эффект. Ферменты, для которых и субстрат, и модулятор пред-
ставлены идентичными структурами, носят название гомотропных в от-
личие от гетеротропных ферментов, для которых модулятор имеет
отличную от субстрата структуру. Взаимопревращение активного и неак-
тивного аллостерических ферментов в упрощенной форме, а также конфор-
мационные изменения, наблюдаемые при присоединении субстрата и эф-
фекторов, представлены на рис. 4.25. Присоединение отрицательного эф-
фектора к аллостерическому центру вызывает значительные изменения
конфигурации активного центра молекулы фермента, в результате чего
фермент теряет сродство к своему субстрату (образование неактивного
комплекса).
Аллостерические взаимодействия проявляются в характере кривых за-
висимости начальной скорости реакции от концентрации субстрата или
эффектора, в частности в S-образности этих кривых (отклонение от гипер-
болической кривой Михаэлиса-Ментен). S-образный характер зависимости
v от [S] в присутствии модулятора обусловлен эффектом кооперативности.
Это означает, что связывание одной молекулы субстрата облегчает связы-
вание второй молекулы в активном центре, способствуя тем самым увели-
чению скорости реакции. Кроме того, для аллостерических регуляторных
ферментов характерна нелинейная зависимость скорости реакции от кон-
центрации субстрата.
Другие типы регуляции активности ферментов. Абсолютное количество
присутствующего в клетке фермента регулируется временем его синтеза
и распада. К регуляторным механизмам могут быть отнесены также
конкуренция ферментов за общий субстрат, выключение активности одного
из изоферментов (у множественных форм ферментов), влияние концентра-
156
1
2
3
4
а
б
1
2
5
3
ций кофакторов и явление компартментализации. Механизм компарт-
ментализации метаболических процессов играет, по-видимому, важную
биологическую роль, пространственно разъединяя с помощью биомембран
ферменты со своими субстратами (например, лизосомальные ферменты:
протеиназы, фосфатазы, рибонуклеазы и другие гидролитические фермен-
ты – с цитоплазматическими веществами, на которые они действуют). Кро-
ме того, облегчая независимую регуляцию, этот механизм позволяет
разделить несовместимые в одном и том же месте (и, возможно, в одно и то
же время) метаболические процессы. Примером последних могут быть пути
синтеза высших жирных кислот, протекающие в основном в растворимой
фракции цитоплазмы, и пути распада (окисления) жирных кислот, сосре-
доточенные в митохондриях. Необходимо указать, однако, что при ком-
партментализации возникает проблема транспорта как метаболитов, так
и восстановительных эквивалентов через биомембраны субклеточных ор-
ганелл. Эту задачу решает так называемый челночный механизм, позво-
ляющий перевод метаболитов в формы, способные переходить через
мембраны, и обеспечивающий внутриклеточный гомеостаз (см. главу 13).
ОПРЕДЕЛЕНИЕ АКТИВНОСТИ ФЕРМЕНТОВ
Определение количественного содержания ферментов в биологических
объектах представляет известные трудности, поскольку, за редким ис-
ключением, ферменты в тканях присутствуют в ничтожно малых концент-
рациях. Поэтому о количестве ферментов судят по скорости катализи-
руемой реакции в определенных, согласованных условиях измерения. При
оптимальных условиях температуры, рН среды и полном насыщении
фермента субстратом скорость катализируемой реакции пропорциональна
концентрации фермента. О скорости ферментативной реакции судят или по
скорости убыли субстрата, или по скорости образования продукта реакции.
Для выражения концентрации фермента и количественной оценки его
активности в условных единицах Комиссией по ферментам Междуна-
родного биохимического союза была рекомендована стандартная между-
народная единица (Е или U): за единицу активности любого фер-
мента принимается то количество его, которое в оптимальных условиях
катализирует превращение 1 микромоля субстрата или образование 1 мик-
ромоля продукта в минуту (мкмоль/мин) *.
В связи с введением Международной системы единиц (СИ) предложено
новое выражение активности фермента в каталах (кат, kat): 1 кат
есть каталитическая активность, способная осуществлять реакцию со ско-
ростью, равной 1 молю в 1 с (1 моль/с). Отношение международной
единицы (U) к каталу можно выразить следующим образом: 1 кат =
1 моль•с
–1
= 60 моль•мин
–1
= 60•10
6
мкмоль•мин
–1
= 6•10
7
U, или:
1 U = 1 мкмоль•мин
–1
= (1/60) мкмоль•с
–1
= (1/60) мккат = 16,67 нкат.
Таким образом, 1 U фермента соответствует 16,67 нкат.
Рекомендовано, кроме того, измерять активность фермента при темпе-
ратуре 25°С, оптимуме рН и концентрации субстрата, превышающей
концентрацию насыщения. В этих случаях скорость соответствует нулевому
порядку реакции в отношении субстрата и будет зависеть только от
концентрации фермента.
* Мкмоль, 10
–6
моль; единицы активности фермента выражают также в наномолях (10
–9
моль) и пикомолях (10
–12
моль).
157
Для выражения активности в практической работе с ферментами часто
пользуются произвольными понятиями удельной и молярной активности.
Удельную активность фермента принято выражать числом единиц
ферментативной активности на 1 мг белка (или числом каталов на 1 кг
активного белка). Количество молекул субстрата, подвергающихся пре-
вращению одной молекулой фермента в продукт в процессе реакции
в единицу времени при полном насыщении фермента субстратом, принято
называть числом оборотов фермента, или молярной активностью
(молярная каталитическая активность выражается в каталах на 1 г-моль
фермента). Одна молекула каталазы эритроцитов способна, например,
расщепить в 1 с 44000 молекул перекиси водорода *.
ВНУТРИКЛЕТОЧНАЯ ЛОКАЛИЗАЦИЯ ФЕРМЕНТОВ
Вопрос о локализации ферментов в структурных образованиях клетки
(ядро, митохондрии, лизосомы и др.) является чрезвычайно важным,
особенно в препаративной энзимологии, когда перед исследователем
поставлена задача изолировать и выделить фермент в чистом виде.
Сравнительно легко обнаружить локализацию фермента методами цито-
и гистохимии. Для этого тонкие срезы органа инкубируют с соответст-
вующими субстратами и после инкубации локализацию продукта реакции
устанавливают добавлением подходящих реактивов до появления специ-
фической окраски.
В препаративной энзимологии чаще пользуются методом дифферен-
циального центрифугирования гомогенатов тканей (рис. 4.26). Для этого
сначала разрушают клеточную структуру с помощью подходящего де-
зинтегратора и полученную квазиоднородную (гомогенизированную) массу
подвергают дифференциальному центрифугированию при температуре
0–4°С. Обычно распределение ферментов изучают в последовательных
индивидуальных фракциях, изолированных при дробном центрифугирова-
нии гомогенатов, в частности во фракции ядер, которую получают при
низкой скорости центрифугирования, во фракции митохондрий, которая
осаждается при средней скорости центрифугирования, во фракции микро-
сом (или рибосом), для изолирования которой требуется высокая скорость
центрифугирования, и, наконец, в оставшейся прозрачной надосадочной
жидкости (супернатант), представляющей собой растворимую фракцию
цитоплазмы. Следует отметить, что фракция митохондрий не является
гомогенной, поскольку из нее удается изолировать частицы, известные как
лизосомы, размер которых занимает промежуточное место между разме-
рами митохондрий и микросом. В свою очередь микросомальная фракция
также является гетерогенной, поскольку состоит в основном из элементов
эндоплазматической сети неоднородного строения.
При помощи метода фракционирования гомогенатов органов и тканей
в центрифугах было показано, что ядерная фракция печени и почек
содержит незначительное число ферментов, хотя известно, что в ядрах
осуществляется синтез некоторых белков. Основное место синтеза белка,
как теперь установлено,– фракция рибосом цитоплазмы. Показано, кроме
* Чтобы 1 атом неорганического железа, также катализирующий распад Н
2
О
2
, расщепил
такое число молекул Н
2
О
2
, которое расщепляет каталаза в 1 с, потребовалось бы несколько
лет. Этот пример является наглядным доказательством одного из главных свойств фермен-
тов – их высокой каталитической активности.
158

Рис. 4.26. Дифференциаль-
ное центрифугирование го-
могенатов ткани печени
(схема),
g - ускорение силы тяжести.
того, что ферменты гликолиза сосредоточены преимущественно в раство-
римой фракции цитоплазмы, в то время как цитохромоксидаза и ферменты
цикла Кребса локализованы во фракции митохондрий. С митохондриями
связаны также ферменты, катализирующие окислительное фосфорилиро-
вание и распад жирных кислот. Ферменты, катализирующие биосинтез
жирных кислот, наоборот, содержатся в растворимой фракции цитоплазмы.
Для изолирования и выделения ферментов из биологических объектов
в чистом (гомогенном) состоянии используют весь арсенал методов выде-
ления белков в индивидуальном виде (см. главу 1).
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ
Современные классификация и номенклатура ферментов были разработаны
Комиссией по ферментам Международного биохимического союза и ут-
верждены на V Международном биохимическом конгрессе в 1961 г.
в Москве *.
* В работе Комиссии принимали участие крупнейшие энзимологи мира, от нашей
страны – акад. А.Е. Браунштейн.
159
Гомогенизация
в
0,25
М
растворе
сахарозы
Измельчение Ткань
Гомогенат
600 g
10 мин
Ядра;
неразрушенные
клетки
Супернатант
10000 g
20 мин
Митохондрии
Супернатант
105000 g
60 мин
Микросомы
Растворимая
фракция
белков
Необходимость систематики номенклатуры диктовалась прежде всего
стремительным ростом числа вновь открываемых ферментов, которым
разные исследователи присваивали названия по своему усмотрению. Более
того, одному и тому же ферменту часто давали два или несколько названий,
что вносило путаницу в номенклатуру. Некоторые названия ферментов
вообще не отражали тип катализируемой реакции, а при наименовании
фермента исходили из названия субстрата, на который действует фермент,
с добавлением окончания -аза: в частности, амилазы (ферменты, гидро-
лизирующие углеводы), липазы (действующие на липиды), протеиназы
(гидролизирующие белки) и т.д.
До 1961 г. не было и единой классификации ферментов. Трудности
заключались в том, что разные исследователи за основу классификации
ферментов брали различные принципы. Комиссией были рассмотрены
3 принципа, которые могли служить основой для классификации ферментов
и их обозначения. Первый принцип – химическая природа фермента, т.е.
принадлежность к флавопротеинам, пиридоксальфосфатпротеинам, гемо-
протеинам, металлопротеинам и т. д. Однако этот принцип не мог служить
общей основой для классификации, так как только для небольшого числа
ферментов известны простетические группы, доступные идентификации
и прямому определению. Второй принцип – химическая природа субстрата,
на который действует фермент. По этому принципу трудно классифи-
цировать фермент, так как в качестве субстрата могут служить разнообраз-
ные соединения внутри определенного класса веществ (белки, углеводы,
липиды, нуклеиновые кислоты) и бесчисленное множество промежуточных
продуктов обмена. В основу принятой классификации положен третий
принцип – тип катализируемой реакции, который является специфич-
ным для действия любого фермента. Этот принцип логично использовать
в качестве основы для классификации и номенклатуры ферментов.
Таким образом, тип катализируемой химической реакции в сочетании
с названием субстрата (субстратов) служит основой для систематического
наименования ферментов. Согласно Международной классификации, фер-
менты делят на шесть главных классов, в каждом из которых несколько
подклассов: 1) оксидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы;
5) изомеразы; 6) лигазы (синтетазы) (табл. 4.5).
Оксидоредуктазы. К классу оксидоредуктаз относят ферменты, ката-
лизирующие с участием двух субстратов окислительно-восстановительные
реакции, лежащие в основе биологического окисления. Систематические
названия их составляют по форме «донор: акцептор оксидоредуктаза».
Например, лактат: НАД
+
оксидоредуктаза для лактатдегидрогеназы
(ЛДГ).
Различают следующие основные оксидоредуктазы: аэробные дегидро-
геназы или оксидазы, катализирующие перенос протонов (электронов)
непосредственно на кислород; анаэробные дегидрогеназы, ускоряющие
перенос протонов (электронов) на промежуточный субстрат, но не на
кислород; цитохромы, катализирующие перенос только электронов. К это-
му классу относят также гемсодержащие ферменты каталазу и пероксидазу,
катализирующие реакции с участием перекиси водорода.
Трансферазы. К классу трансфераз относят ферменты, катализирующие
реакции межмолекулярного переноса различных атомов, групп атомов
и радикалов. Наименование их составляется по форме «донор: транспор-
тируемая группа – трансфераза».
Различают трансферазы, катализирующие перенос одноуглеродных ос-
татков, ацильных, гликозильных, альдегидных или кетонных, нуклеотидных
160
