Березов Т.Т., Коровкин Б.Ф. Биологическая химия
Подождите немного. Документ загружается.

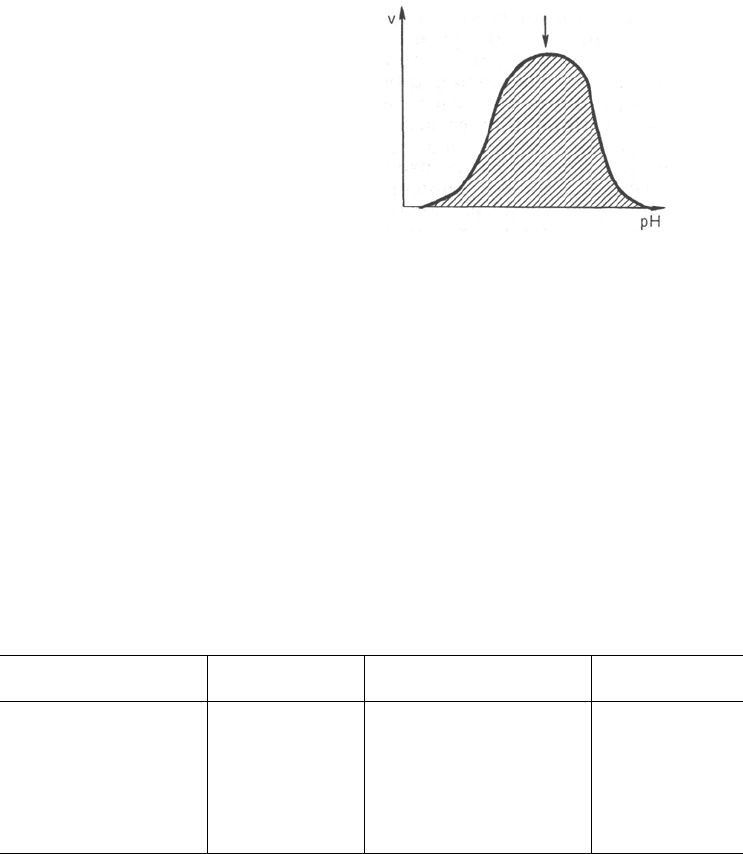
Рис. 4.17. Зависимость скоро-
сти катализируемой ферментом
реакции от рН (стрелка указы-
вает оптимум рН).
между скоростью инактивации фермента и степенью денатурации белка.
Следует отметить, что на термолабильность ферментов определенное
влияние оказывает концентрация субстрата, рН среды и другие факторы.
Зависимость активности ферментов от рН среды. Ферменты обычно
наиболее активны в пределах узкой зоны концентрации водородных ионов,
соответствующей для животных тканей в основном выработанным в про-
цессе эволюции физиологическим значениям рН среды 6,0–8,0. При гра-
фическом изображении на кривой колоколообразной формы имеется опре-
деленная точка, в которой фермент проявляет максимальную активность;
эту точку называют оптимумом рН среды для действия данного фермента
(рис. 4.17). При определении зависимости активности фермента от концент-
рации водородных ионов реакцию проводят при разных значениях рН
среды, обычно при оптимальной температуре и наличии достаточно высо-
ких (насыщающих) концентраций субстрата. В табл. 4.3 приводятся опти-
мальные значения рН среды для ряда ферментов.
Таблица 4.3. Оптимальные значения рН для некоторых ферментов
Фермент
Пепсин
Катепсин В
Амилаза из солода
Сахараза кишечная
Амилаза слюны
рН
1,5–2,5
4,5–5,0
4,9–5,2
5,8–6,2
6,8–7,0
Фермент
Каталаза
Уреаза
Липаза
панкреатическая
Трипсин
Аргиназа
рН
6,8–7,0
7,0–7,2
7,0–8,5
7,5–8,5
9,5–10,0
Из данных табл. 4.3 видно, что рН-оптимум действия ферментов лежит
в пределах физиологических значений. Исключение составляют пепсин,
рН-оптимум которого 2,0 (при рН 6,0 он не активен и не стабилен).
Объясняется это, во-первых, структурной организацией молекулы фермента
и, во-вторых, тем, что пепсин является компонентом желудочного сока,
содержащего свободную соляную кислоту, которая создает оптимальную
кислую среду для действия этого фермента. С другой стороны, рН-оптимум
аргиназы лежит в сильнощелочной зоне (около 10,0); такой среды нет
в клетках печени, следовательно, in vivo аргиназа функционирует, по-ви-
димому, не в своей оптимальной зоне рН среды.
Согласно современным представлениям, влияние изменений рН среды
на молекулу фермента заключается в воздействии на состояние и степень
141
ионизации кислотных и основных групп (в частности, СООН-группы дикар-
боновых аминокислот, SH-группы цистеина, имидазольного азота гисти-
дина, NH
2
-группы лизина и др.). При резких сдвигах от оптимума рН среды
ферменты могут подвергаться конформационным изменениям, приводя-
щим к потере активности вследствие денатурации или изменения заряда
молекулы фермента. При разных значениях рН среды активный центр
может находиться в частично ионизированной или неионизированной
форме, что сказывается на третичной структуре белка и соответственно на
формировании активного фермент-субстратного комплекса. Имеет зна-
чение, кроме того, состояние ионизации субстратов и кофакторов.
Специфичность ферментов. Ферменты обладают высокой специфич-
ностью действия. Это свойство часто существенно отличает их от неорга-
нических катализаторов. Так, мелкоизмельченные платина и палладий
могут катализировать восстановление (с участием молекулярного водо-
рода) десятков тысяч химических соединений различной структуры. Высо-
кая специфичность ферментов обусловлена, как было отмечено, конфор-
мационной и электростатической комплементарностью между молекулами
субстрата и фермента и уникальной структурной организацией активного
центра, обеспечивающими «узнавание», высокое сродство и избиратель-
ность протекания одной какой-либо реакции из тысячи других химических
реакций, осуществляющихся одновременно в живых клетках.
В зависимости от механизма действия различают ферменты с отно-
сительной (или групповой) и абсолютной специфичностью. Так,
для действия некоторых гидролитических ферментов наибольшее значение
имеет тип химической связи в молекуле субстрата. Например, пепсин
в одинаковой степени расщепляет белки животного и растительного проис-
хождения, несмотря на то что эти белки существенно отличаются друг от
друга как по химическому строению и аминокислотному составу, так и по
физико-химическим свойствам. Однако пепсин не расщепляет ни углеводы,
ни жиры. Объясняется это тем, что точкой приложения, местом действия
пепсина является пептидная —СО—NH-связь. Для действия липазы, ка-
тализирующей гидролиз жиров на глицерин и жирные кислоты, подобным
местом является сложноэфирная связь. Аналогичной групповой специфич-
ностью обладают трипсин, химотрипсин, пептидазы, ферменты, гидроли-
зующие α-гликозидные связи (но не β-гликозидные связи, имеющиеся
в целлюлозе) в полисахаридах, и др. Обычно эти ферменты участву-
ют в процессе пищеварения, и их групповая специфичность, вероятнее
всего, имеет определенный биологический смысл. Относительной специ-
фичностью наделены также некоторые внутриклеточные ферменты, на-
пример гексокиназа, катализирующая в присутствии АТФ фосфорилиро-
вание почти всех гексоз, хотя одновременно в клетках имеются и спе-
цифические для каждой гексозы ферменты, выполняющие такое же фос-
форилирование (см. главу 10).
Абсолютной специфичностью действия называют способность фермента
катализировать превращение только единственного субстрата. Любые из-
менения (модификации) в структуре субстрата делают его недоступным для
действия фермента. Примерами таких ферментов могут служить аргиназа,
расщепляющая в естественных условиях (в организме) аргинин, уреаза,
катализирующая распад мочевины, и др.
Имеются экспериментальные доказательства существования так назы-
ваемой стереохимической специфичности, обусловленной сущест-
вованием оптически изомерных L- и D-форм или геометрических (цис-
и транс-) изомеров химических веществ. Так, известны оксидазы L-
142
и D-аминокислот, хотя в природных белках обнаружены только L-ами-
нокислоты. Каждый из видов оксидаз действует только на свой спе-
цифический стереоизомер *.
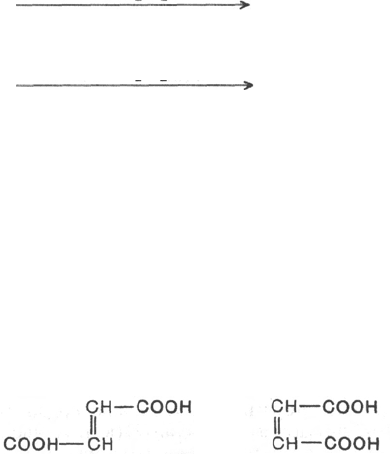
Наглядным примером стереохимической специфичности является бак-
териальная аспартатдекарбоксилаза, катализирующая отщепление СО
2
только от L-аспарагиновой кислоты с превращением ее в L-аланин. Сте-
реоспецифичность проявляют ферменты, катализирующие и синтетические
реакции. Так, из аммиака и α-кетоглутарата во всех живых организмах
синтезируется L-изомер глутаминовой кислоты, входящей в состав при-
родных белков. Если какое-либо соединение существует в форме цис-
и транс-изомеров с различным расположением групп атомов вокруг двой-
ной связи, то, как правило, только один из этих геометрических изомеров
может служить в качестве субстрата для действия фермента. Например,
фумараза катализирует превращение только фумаровой кислоты (транс-
изомер), но не действует на малеиновую кислоту (цис-изомер):
Таким образом, благодаря высокой специфичности действия ферменты
обеспечивают протекание с большой скоростью лишь определенных хи-
мических реакций из огромного разнообразия возможных превращений
в микропространстве клеток и целостном организме, регулируя тем самым
интенсивность обмена веществ.
ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ АКТИВНОСТЬ ФЕРМЕНТОВ
В этом разделе кратко рассмотрены общие факторы, в частности зави-
симость скорости ферментативной реакции от времени, влияние концент-
раций субстрата и фермента на скорость реакций, катализируемых фер-
ментами, и более подробно – вопросы об активировании и ингибировании
ферментов. Ранее была отмечена существенность для активности фермен-
тов таких факторов, как температура, рН, т.е. факторов, которые опре-
деляют в оптимальных условиях сохранность пространственной конфор-
мации молекулы фермента, когда она приобретает максимальную ак-
тивность.
Как известно, скорость любой химической реакции уменьшается со
* Имеется, однако, небольшая группа ферментов – рацемазы, катализирующие изменение
стерической конфигурации субстрата. Так, бактериальная аланин-рацемаза обратимо превра-
щает как L-, так и D-аланин в оптически неактивную смесь обоих изомеров – DL-аланин
(рацемат).
143
Фумаровая кислота
Малеиновая кислота
L-аминокислота
+
1
/
2
О
2
Оксидаза L-аминокислот
α-Кетокислота + NH
3
+ Н
2
О;
D-аминокислота
+
1
/
2
О
2
Оксидаза D-аминокислот
α-Кетокислота + NH
3
+ H
2
О.
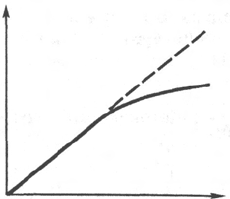
Рис. 4.18. Зависимость скорости
ферментативной реакции от вре-
мени.
временем, однако кривая зависимости скорости ферментативных реакций
от времени не имеет обычно той общей формы, которая характерна для
гомогенных химических реакций (рис. 4.18). Такое снижение скорости
ферментативных реакций со временем может быть обусловлено тормо-
зящим действием продуктов реакции, уменьшением степени насыщения
фермента субстратом (поскольку по мере протекания реакции концентрация
субстрата снижается) или частичной инактивацией фермента при заданных
значениях температуры и рН среды. Следует учитывать, кроме того,
влияние скорости обратной реакции, которая может оказаться сущест-
венной по мере увеличения концентрации продуктов ферментативной реак-
ции. Учитывая эти обстоятельства, при исследовании скорости фермента-
тивных реакций в тканях и биологических жидкостях обычно определяют
начальную скорость реакции в условиях, когда скорость фермента-
тивной реакции приближается к линейной (в том числе при достаточно
высокой для насыщения фермента концентрации субстрата).
Влияние концентраций субстрата и фермента
на скорость ферментативной реакции
Из приведенного ранее материала вытекает важное заключение: одним из
наиболее существенных факторов, определяющих скорость ферментатив-
ной реакции, является концентрация субстрата (или субстратов) и продукта
(продуктов). При постоянной концентрации фермента скорость реакции
постепенно увеличивается, достигая определенного максимума (см. рис.
4.12, 4.13), когда дальнейшее увеличение количества субстрата практически
не оказывает влияния на скорость ферментативной реакции. В таких
случаях принято считать, что субстрат находится в избытке, а фермент
полностью насыщен, т.е. все молекулы фермента связаны с субстратом.
Ограничивающим скорость реакции фактором в последнем случае ста-
новится концентрация фермента. Именно при этих условиях определяют
величину максимальной скорости (V
max
) и значения константы Михаэлиса
(K
m
) (см. рис. 4.13; 4.14).
Скорость любой ферментативной реакции непосредственно зависит от
концентрации фермента (рис. 4.19). Существующая линейная зависимость
между этими величинами, когда скорость реакции прямо пропорциональна
количеству присутствующего фермента, справедлива только в определен-
ных условиях, например в начальный период ферментативной реакции, так
как в этот период практически не происходит обратной реакции, а концент-
рация продукта оказывается недостаточной для обратимости реакции.
Именно в этом случае скорость реакции (точнее, начальная скорость
реакции v) будет пропорциональна концентрации фермента. Как было
144
Количество
продукта
Время
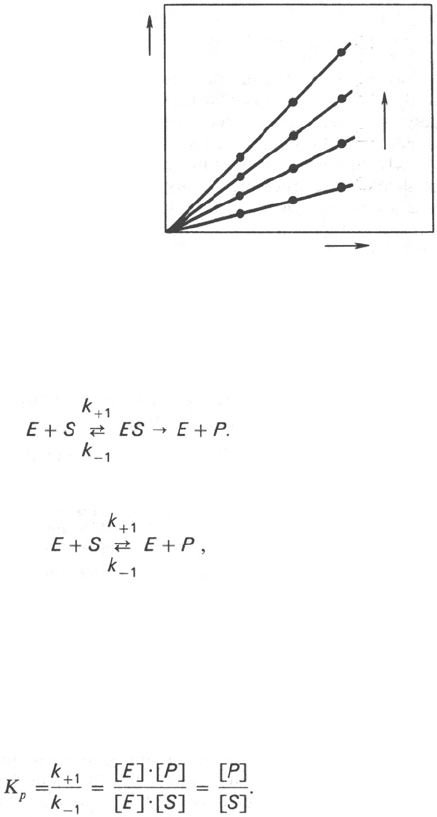
Рис. 4.19. Зависимость скорости
реакции от концентрации фермен-
та в присутствии насыщающих
концентраций субстрата.
отмечено, фермент является одной из реагирующих молекул в химической
реакции и при взаимодействии с субстратом образует промежуточный
фермент-субстратный комплекс, который далее подвергается распаду на
продукт и свободный фермент:
Если упростить это уравнение, исключив промежуточный ES-комплекс:
то в уравнениях для скоростей прямой и обратной реакций обязательным
компонентом является концентрация фермента:
v
+1
= k
+1
[E]•[S]; v
+2
= k
–1
[E]•[Р].
Однако в уравнениях для константы равновесия (K
eq
или К
р
) концент-
рация фермента уже не имеет значения:
Как видно, константа равновесия (K
р
) ферментативной реакции не
зависит от концентрации фермента. Определяя скорость и направление
химической реакции, фермент тем не менее не оказывает влияния на
конечные (равновесные) концентрации реагирующих молекул и продуктов,
определяющих величину константы равновесия.
Активирование и ингибирование ферментов
Скорость ферментативной реакции, как и активность фермента, в значи-
тельной степени определяется также присутствием в среде активаторов
и ингибиторов: первые повышают скорость реакции, а вторые тормозят эту
реакцию. Активирующее влияние на скорость ферментативной реакции
оказывают разнообразные вещества органической и неорганической приро-
ды. Так, соляная кислота активирует действие пепсина желудочного сока;
145
Количество
продукта
Время
Повышение
концентрации
фермента
4х
3х
2х
1х
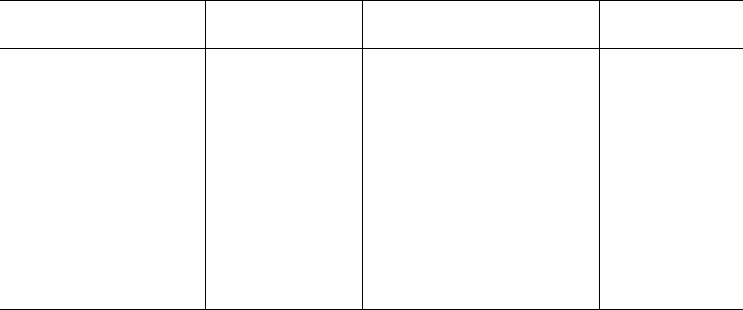
желчные кислоты повышают активность панкреатической липазы; неко-
торые тканевые ферменты (оксидоредуктазы, катепсины, аргиназа), расти-
тельная протеиназа и др. в значительной степени активируются соеди-
нениями, содержащими свободные SH-группы (глутатион, цистеин), а ряд
ферментов – также витамином С. Особенно часто активаторами выступают
ионы двухвалентных и, реже, одновалентных металлов. Получены дока-
зательства, что около четверти всех известных ферментов для проявления
полной каталитической активности нуждаются в присутствии металлов.
Многие ферменты вообще не активны в отсутствие металлов. Так, при
удалении цинка угольная ангидраза (карбоангидраза), катализирующая
биосинтез и распад Н
2
СО
3
, практически теряет свою ферментативную
активность; более того, цинк при этом не может быть заменен никаким
другим металлом. Известны ферменты *, действие которых активируется
ионами нескольких металлов; в частности, енолаза активируется Mg
2+
,
Mn
2+
, К
+
(табл. 4.4).
Таблица 4.4. Ферменты, активируемые металлами
Фермент
Цитохромы
Каталаза
Пероксидаза
Триптофаноксидаза
Гомогентизиказа
Аскорбатоксидаза
Тирозиназа
Фенолоксидаза
Ксантиноксидаза
Нитратредуктаза
Альдегидоксидаза
Некоторые пептидазы
Металл
Fe
Fe
Fe
Fe
Fe
Cu
Cu
Cu
Mo
Mo
Mo
Co
Фермент
Амилаза
Липаза
Карбоангидраза
Лактатдегидрогеназа
Уриказа
Карбоксипептидаза
Пируваткарбоксилаза
Фосфатазы
Фосфоглюкокиназа
Аргиназа
Фосфоглюкомутаза
Холинэстераза
Металл
Са
Са
Zn
Zn
Zn
Zn
Mg
Mg
Mg
Mn
Mn
Mn
Молекулярный механизм действия металлов в энзиматическом катализе,
или роль металлов в активировании ферментами. В ряде случаев ионы
металлов (Со
2+
, Mg
2+
, Zn
2+
, Fe
2+
) выполняют функции простетических
групп ферментов, или служат акцепторами и донаторами электронов, или
выступают в качестве электрофилов либо нуклеофилов, сохраняя реактив-
ные группы в необходимой ориентации. В других случаях они способствуют
присоединению субстрата к активному центру и образованию фермент-
субстратного комплекса. Например, ионы Mg
2+
через отрицательно заря-
женную фосфатную группу обеспечивают присоединение монофосфатных
эфиров органических веществ к активному центру фосфатаз, катализирую-
щих гидролиз этих соединений. Иногда металл соединяется с субстратом,
образуя истинный субстрат, на который действует фермент. В частности,
ионы Mg
2+
активируют креатинфосфокиназу благодаря образованию ис-
тинного субстрата – магниевой соли АТФ. Наконец, имеются эксперимен-
тальные доказательства прямого участия металлов (например, ионов Са
2+
* Обычно трудно провести границу между металлоферментами (когда металл связан
прочно с белком и незаменим) и ферментами, активируемыми металлами (последние лишь
ускоряют реакцию и легко диссоциируют).
146
в молекуле амилазы слюны) в формировании и стабилизации активного
центра и всей трехмерной структуры молекулы фермента. Следует отме-
тить также, что металлы нередко выступают в роли аллостерических
модуляторов (эффекторов; см. рис. 4.22). Взаимодействуя с аллостеричес-
ким центром, подобный металл (эффектор) способствует образованию
наиболее выгодной пространственной конфигурации фермента и активного
фермент-субстратного комплекса.
Анионы в физиологических концентрациях обычно неэффективны или
оказывают небольшое активирующее влияние на ферменты. Исключение
составляют пепсин, некоторые оксидоредуктазы, активируемые анионами,
а также амилаза слюны, катализирующая гидролиз крахмала, активность
которой повышается при действии ионов хлора, и аденилатциклаза, кото-
рая активируется анионами галогенов.
Ингибиторы ферментов обычно принято делить на два больших
класса: обратимые и необратимые. Это вещества, вызывающие частичное
(обратимое) или полное торможение реакций, катализируемых фермента-
ми. Недавно открыты антиферменты (антиэнзимы, или антизимы),
представляющие собой белки (или полипептиды), действующие как инги-
биторы ферментов. К подобным веществам относятся, например, инги-
битор трипсина, обнаруженный в соевых бобах, и сывороточный анти-
трипсин. Недавно открыт в печени животных антифермент орнитинде-
карбоксилазы (см. главу 12). Антизимы, вероятнее всего, образуют трудно-
диссоциируемые комплексы с соответствующими ферментами, выключая
их из химических реакций. Иногда ингибитор является составным компо-
нентом предшественника фермента, например пепсина (см. главу 12), или
входит в состав сложных комплексов ферментов, например в состав
протеинкиназы и протеинфосфатазы, катализирующих процессы фосфо-
рилирования-дефосфорилирования в живых организмах. Однако до сих
пор не выяснено, являются ли подобные антиферменты истинными инги-
биторами или регуляторными субъединицами, в частности, какова разница
в назначении регуляторной (R) субъединицы в составе протеинкиназы
и ингибиторной (I) субъединицы в составе протеинфосфатазы.
Ферменты являются белками, поэтому любые агенты, вызывающие
денатурацию белка (кислоты, щелочи, соли тяжелых металлов, нагревание),
приводят к необратимой инактивации фермента. Однако подобное инак-
тивирование относительно неспецифично, оно не связано с механизмом
действия ферментов. Гораздо большую группу составляют так называемые
специфические ингибиторы, которые оказывают свое действие на какой-
либо один фермент или группу родственных ферментов, вызывая обрати-
мое или необратимое ингибирование. Исследование этих ингибиторов
имеет важное значение. Во-первых, ингибиторы могут дать ценную инфор-
мацию о химической природе активного центра фермента, а также о составе
его функциональных групп и природе химических связей, обеспечивающих
образование фермент-субстратного комплекса. Известны вещества, вклю-
чая лекарственные препараты, специфически связывающие ту или иную
функциональную группу в молекуле фермента, выключая ее из химической
реакции. Так, йодацетат IСН
2
—СООН, его амид и этиловый эфир, пара-
хлормеркурибензоат ClHg—С
6
Н
4
—СООН и другие реагенты сравнитель-
но легко вступают в химическую связь с некоторыми SH-группами фер-
ментов. Если такие группы имеют существенное значение для акта ката-
лиза, то добавление подобных ингибиторов приводит к полной потере
активности фермента:
R-SH + IСН
2
—СООН —> НI + R—S—CH
2
—COOH
147
Действие ряда других ферментов (холинэстераза, трипсин и химотрип-
син) сильно тормозится некоторыми фосфорорганическими соединениями,
например ДФФ, вследствие блокирования ключевой гидроксильной группы
серина в активном центре (см. ранее).
Во-вторых, ингибиторы нашли широкое применение в энзимологии при
исследовании природы множественных форм ферментов и изоферментов,
различающихся не столько электрофоретической подвижностью, сколько
различной чувствительностью к одному и тому же ингибитору.
При помощи ингибиторов, выключающих отдельные стадии многосту-
пенчатого метаболического процесса, могут быть точно установлены не
только последовательность химических реакций, но и природа участвую-
щих в этих превращениях ферментов. Этим путем, применяя йодацетат,
фториды и другие специфические ингибиторы, был расшифрован глико-
литический путь окислительно-восстановительных превращений глюкозы
до стадии образования молочной кислоты в мышечной ткани, насчиты-
вающий 11 стадий с участием 11 ферментов и 10 промежуточных ме-
таболитов.
С ингибированием ферментов связан механизм действия многих токси-
нов и ядов на организм. Известно, что при отравлениях солями сенильной
кислоты смерть наступает вследствие полного торможения и выключения
дыхательных ферментов (цитохромная система) тканей, особенно клеток
мозга. Токсическое влияние на организм человека и животных некоторых
инсектицидов обусловлено торможением активности холинэстеразы – фер-
мента, играющего ключевую роль в деятельности нервной системы.
Современная, так называемая рациональная, химиотерапия (направлен-
ное применение лекарственных препаратов в медицине) должна основы-
ваться на точном знании механизма действия лекарственных средств на
биосинтез ферментов, на активность уже синтезированных ферментов или
на регуляцию их активности в организме. Иногда для лечения некоторых
болезней используют избирательно действующие ингибиторы. Так, инги-
битор ряда протеиназ (трипсина, химотрипсина и калликреина) трасилол
широко применяется для лечения острого панкреатита – болезни, при ко-
торой уровень трипсина и химотрипсина в крови резко возрастает. Знание
избирательного ингибиторного действия некоторых природных и синте-
тических соединений (так называемых антиметаболитов) на ферменты
может служить методологической основой для разработки эффективных
методов синтеза химиотерапевтических препаратов. Этот путь открывает
широкие возможности для направленного воздействия на синтез ферментов
в организме и регуляции интенсивности метаболизма при патологии.
Типы ингибирования. Различают обратимое и необратимое ингибиро-
вание. Если ингибитор вызывает стойкие изменения пространственной
третичной структуры молекулы фермента или модификацию функциональ-
ных групп фермента, то такой тип ингибирования называется необрати-
мым. Чаще, однако, имеет место обратимое ингибирование, под-
дающееся количественному изучению на основе уравнения Михаэлиса-
Ментен. Обратимое ингибирование в свою очередь разделяют на кон-
курентное и неконкурентное в зависимости от того, удается или не удается
преодолеть торможение ферментативной реакции путем увеличения кон-
центрации субстрата.
Конкурентное ингибирование может быть вызвано веществами,
имеющими структуру, похожую на структуру субстрата, но несколько
отличающуюся от структуры истинного субстрата. Такое ингибирование
основано на связывании ингибитора с субстратсвязывающим (активным)
148
центром. Классическим примером подобного типа ингибирования является
торможение сукцинатдегидрогеназы (СДГ) малоновой кислотой. Этот фер-
мент катализирует окисление путем дегидрирования янтарной кислоты
(сукцината) в фумаровую:
Если в среду добавить малонат (ингибитор), то в результате структур-
ного сходства его с истинным субстратом сукцинатом (наличие двух таких
же ионизированных карбоксильных групп) он будет взаимодействовать
с активным центром с образованием фермент-ингибиторного комплекса,
однако при этом полностью исключается перенос атома водорода от
малоната. Структуры субстрата (сукцинат) и ингибитора (малонат) все же
несколько различаются. Поэтому они конкурируют за связывание с актив-
ным центром, и степень торможения будет определяться соотношением
концентраций малоната и сукцината, а не абсолютной концентрацией
ингибитора. Таким образом, ингибитор может обратимо связываться
с ферментом, образуя фермент-ингибиторный комплекс. Этот тип ингиби-
рования иногда называют ингибированием по типу метаболического анта-
гонизма (рис. 4.20).
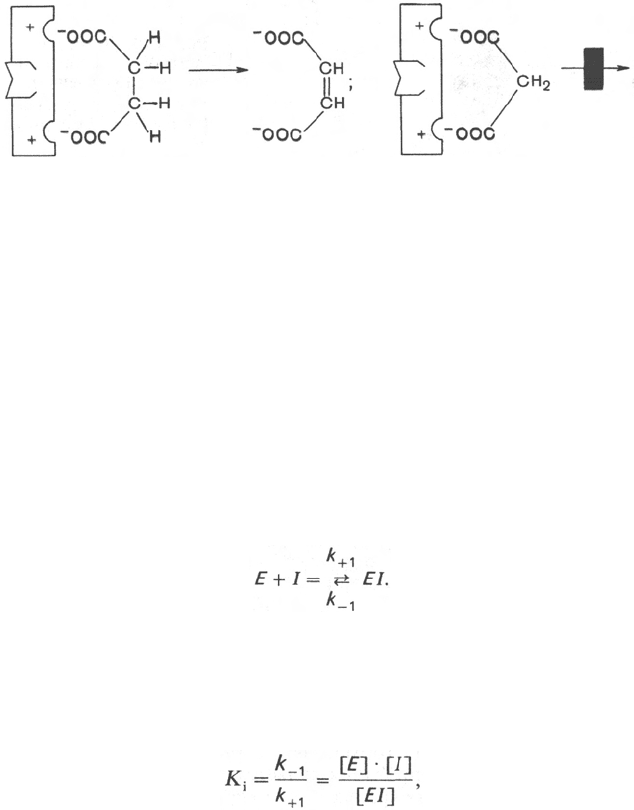
В общей форме реакция взаимодействия ингибитора с ферментом может
быть представлена следующим уравнением:
Образовавшийся комплекс, называемый фермент-ингибиторным комп-
лексом ЕI, в отличие от фермент-субстратного комплекса ES не распадается
с образованием продуктов реакции. Константу диссоциации комплекса EI,
или ингибиторную константу К
i
, можно, следуя теории Михаэлиса–Мен-
тен, определить как отношение констант обратной и прямой реакций:
т.е. ингибиторная константа прямо пропорциональна произведению кон-
центрации фермента и ингибитора и обратно пропорциональна концент-
рации комплекса EI.
Метод конкурентного торможения нашел широкое применение в ме-
дицинской практике. Известно, например, что для лечения некоторых
инфекционных заболеваний, вызываемых бактериями, применяют сульфа-
ниламидные препараты. Оказалось, что эти препараты имеют структурное
сходство с парааминобензойной кислотой, которую бактериальная клетка
использует для синтеза фолиевой кислоты, являющейся составной частью
149
Сукцинат
Фумарат
Малонат
Блокирование
реакции
–2Н
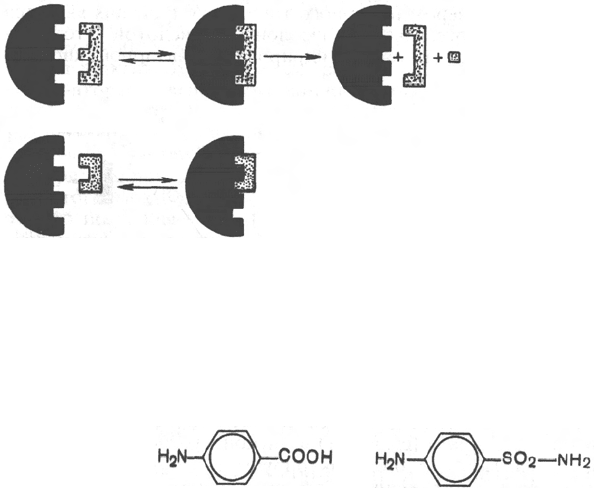
Рис. 4.20. Действие конку-
рентного ингибитора (схема
по В.Л. Кретовичу).
Е - фермент; S - субстрат; Р
1
и
Р
2
- продукты реакции; I - инги-
битор.
ферментов бактерий. Благодаря этому структурному сходству сульфани-
ламид блокирует действие фермента путем вытеснения парааминобензой-
ной кислоты из комплекса с ферментом, синтезирующим фолиевую кисло-
ту, что ведет к торможению роста бактерий.
Некоторые аналоги витамина В
6
и фолиевой кислоты, в частности
дезоксипиридоксин и аминоптерин (см. главу 7), действуют как конкурент-
ные, так называемые коферментные, ингибиторы (или антивитамины),
тормозящие многие интенсивно протекающие при патологии биологи-
ческие процессы в организме. Применение подобных аналогов в меди-
цинской практике (в частности, в дерматологии и онкологии) основано на
конкурентном вытеснении коферментов из субстратсвязывающих центров
ключевых ферментов обмена.
Неконкурентное ингибирование вызывается веществами, не
имеющими структурного сходства с субстратами и часто связывающимися
не с активным центром, а в другом месте молекулы фермента. Степень
торможения во многих случаях определяется продолжительностью дейст-
вия ингибитора на фермент. При данном типе ингибирования благодаря
образованию стабильной ковалентной связи фермент часто подвергается
полной инактивации, и тогда торможение становится необратимым. При-
мером необратимого ингибирования является действие йодацетата, ДФФ,
а также диэтил-n-нитрофенилфосфата и солей синильной кислоты. Это
действие заключается в связывании и выключении функциональных групп
или ионов металлов и молекуле фермента.
Следует указать, что неконкурентное ингибирование также может быть
обратимым и необратимым, поскольку отсутствует конкуренция между
субстратом и ингибитором за активный центр. Примеры необратимого
ингибирования приведены ранее. При обратимом неконкурентном
ингибировании субстрат S и ингибитор I связываются с разными
центрами, поэтому появляется возможность образования как комплекса EI,
так и тройного комплекса EIS; последний может распадаться с осво-
бождением продукта, но с меньшей скоростью, чем комплекс ES.
150
E + S
ES
E
P
1
P
2
E + l
Комплекс El
(неактивный)
п-Аминобензой-
ная кислота
Сульфаниламид
