Жариков В.А. Основы физической геохимии
Подождите немного. Документ загружается.


топологические элементы диаграммы плавкости, а уже затем строятся трехфазовые
равновесия субсолидуса. Затем наносится фигуративная точка исходного состава,
определяется трехфазовое равновесие субсолидуса и находится нонвариантная точка,
отвечающая началу плавления или концу кристаллизации данного фазового равновесия:
три твердые фазы + расплав. После этого отыскивается путь плавления или
кристаллизации - линия изменения состава расплава и последовательность изменения
фазовых равновесий на пути исходный состав → нонвариантная точка (или наоборот).
Покажем схематически анализ кристаллизации и плавления на примере диаграммы
плавкости тройной системы MgO-Al
2
O
3
-SiO
2
, изучавшeйся многими исследователями
(Ранкин, Мервин, Боуэн, Грейг, Шеер, Форстер, 1918-1952 годы). Для наглядности
диаграмма упрощена: исключен из рассмотрения сапфирин (Mg
4
Al
10
Si
2
O
19
) с его очень
маленьким полем инконгруэнтного плавления, опущена область несмесимости вблизи
вершины SiO
2
, муллит и шпинель обозначены как фазы постоянного состава (хотя в
действительности они образуют твердые растворы с корундовой молекулой).
Соответственно уточнена топология диаграммы. На рис. 3.66 показана принципиальная
схема диаграммы плавкости с участием однокомпонентных фаз: кристобалита - Crb
(SiO
2
), тридимита - Tr (SiO
2
), периклаза - Per (MgO), корунда - Cor (Al
2
O
3
), двойных
соединений (содержание компонентов показаны в весовых процентах): энстатита - En
(MgSiO
3
, MgO-40%, SiO
2
-60%), форстерита - Fo (Mg
2
SiO
4
, MgO-57%, SiO
2
-43%), шпинели
- Spl (MgAl
2
O
4
, MgO-29%, Al
2
O
3
- 71%), муллита - Mul (Al
6
Si
2
O
13
, Al
2
O
3
-72%, SiO
2
-28%) и
тройного соединения кордиерита - Cord (Mg
2
Al
4
Si
5
O
18
, MgO-14%, Al
2
O
3
-35%, SiO
2
-51%).
Все фазы имеют постоянный состав и образуют в субсолидусе следующие трехфазовые
равновесные ассоциации (обозначенные на треугольнике составов римскими цифрами): I
Per Fo Spl, II Fo Spl Cord, III Fo En Cord, IV En Cord Crb (Tr), V Cord Mul Crb (Tr), VI Cord
Mul Spl и VII Mul Spl Cor.
Определим характер нонвариантных точек и моновариантных линий. Поля ликвидусов
фаз Per, Fo и Spl сходятся в точке E, которая лежит внутри фазового треугольника I - Per
Fo Spl и поэтому является эвтектической, а линии e
1
E
1
, e
2
E
1
, и e
6
E
1
- котектическими, что
очевидно, исходя из рассмотренных выше правил фазового треугольника и касательной.
Для парагенетического треугольника II - Fo Spl Cord нонвариантная точка P
2
, где сходятся
поля ликвидусов Fo, Spl и Cord, является перитектической (реакция L
P2
+ Spl = Fo + Cord),
а линии e
6
P
2
и P
2
P
3
- котектическими (реакции L
n
= Fo + Spl + L
n + 1
и L
m
= Cord + Spl + L
m
+ 1
). В парагенетическом треугольнике III располагается эвтектическая точка E
2
, а
принадлежащие ей моновариантные линии P
2
E
2
и e
7
E
2
являются котектическими, тогда
как линия P
1
E
2
остается перитектической на всем протяжении (реакция L
n
+ Fo = En + L
n +
1
), и касательная проектируется вне конноды FoEn. Парагенетический треугольник IV
содержит эвтектическую точку E
3
, в которой сходятся котектические линии e
7
E
3
, e
3
E
3
и
P
4
E
3
. Заметим, что в поле L + SiO
2
проходит также линия полиморфного перехода Crb=Tr.
Остальные нонвариантные точки диаграммы P
3
, P
4
, P
5
- перитектические. Точка P
3
расположена в поле Fo Spl Cord, тогда как нонвариантный парагенезис ее L
P2
+ Mul = Cord
+ Spl, принадлежащие этой точке моновариантные линии P
2
P
3
и P
3
P
5
- котектические, а
линия P
3
P
4
- перитектическая. В точке P
4
сходятся поля ликвидусов тридимита, муллита и
кордиерита, тогда как она расположена в парагенетическом треугольнике IV En Cord Tr.
Собственно перитектическая реакция в P
4
: L
P4
+ Mul = Cord + Tr. Линии (e
5
)P
4
и P
4
E
3
-
котектические, P
3
P
4
, - перитектическая. Наконец, точка P
5
расположена в инородном поле
VI Cord Mul Spl и характеризуется перитектической реакцией L
P5
+ Cord = Mul + Spl.
Линия P
5
P
6
- перитектическая (L
n
+ Cord = Mil + L
n + 1
), а линия e
4
P
5
- котектическая (L
m
=
Cord + Spl + L
m + 1
). Напомним, что при определении характера процесса - конгруэнтный
или инконгруэнтный -каждый раз использовались подробно рассмотренные выше правила
фазового треугольника и касательной. Для облегчении диаграммы рис. 3.66 на нее не
нанесены изотермы. Но температурные координаты всех нонвариантных точек и
температуры плавления фаз приведены в подписи к диаграмме. Там же указаны составы
фаз в весовых процессах.
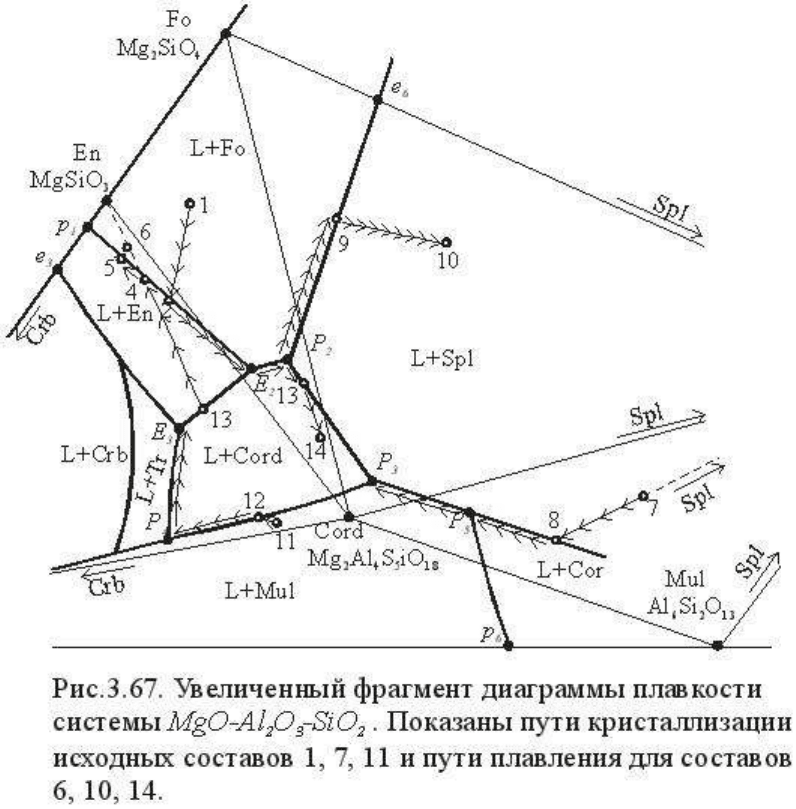
Рассмотрим теперь кратко примеры кристаллизации и плавления некоторых исходных
составов, интересных фазовыми превращениями. Для этой цели на рис. 3.67 представлена
в увеличенном масштабе часть диаграммы системы MgO-Al
2
O
3
-SiO
2
в области составов,
прилегающих к полю ликвидуса кордиерита.
Исходный состав, заданный точкой 1 (0,18Cord
.
0,33Fo
.
0,49En), проектируется в поле
ликвидуса Fo, и в субсолидусе будет сложен фазовым равновесием Cord Fo En.
Следовательно, кристаллизация этого состава начнется с Fo и закончится в точке E
2
, где
сходятся ликвидусы кордиерита, форстерита и энстатита. Общая схема кристаллизации и
факторы состояния (согласно правилу фаз n=k + 1-r или f
in
+ f
ex
= k + 1 при r=f
ex
) будут
следующие (где y
En
+ y
Cord
+ y
Fo
= 1, - весовые количества или доли соответствующих фаз):

Обратим внимание, что на линии 2 → E
2
происходит перитектическая реакция (появление
En за счет Fo и L) вплоть до точки E
2
, где форстерит снова начнет кристаллизоваться из
эвтектического расплава (соотношение фаз, кристаллизующихся в эвтектике,
Fo
8
En
35
Cord
57
). Примечательно в этом случае поведение форстерита: кристаллизация из
расплава (первая генерация), затем растворение части его в ходе инконгруэнтной
кристаллизации энстатита и, наконец, снова кристаллизация Fo (вторая генерация) в
эвтектическом расплаве.
Расплавим исходный состав, заданный точкой 6. В субсолидусе он будет сложен
энстатитом (81%), кордиеритом (15%) и тридимитом (4%). Следовательно, плавление его
начнется в точке E
3
, где будет выплавляться эвтектический состав (0.19Tr + 0,34En +
0,47Cord → L
E
). Как только весь тридимит будет выплавлен, система становится
моновариантной, и при повышении температуры будет происходить котектическое
плавление En + Cord → L (соотношение 0,61Cord
.
0,39En) вплоть до полного
расплавления кордиерита в точке 3. Положение точки 3 легко определить, проведя линию
En6 до ее пересечения с котектикой. Составы L
3
-6-En лежат на одной прямой и,
следовательно, исходный состав 6 полностью сложен фазами En + L
3
. При исчезновении
Cord система становится дивариантной, и путь плавления (путь изменения состава
расплава при плавлении) лежит на прямой 3-4, что обусловлено плавлением только
энстатита (продолжив линию 3-4 через точку 6 до состава En нетрудно убедиться в
линейной зависимости L
m
-En → L
m + 1
). Точка 4 лежит на перитектической линии и в
диапазоне 4 → 5 будет происходить инконгруэнтное плавление энстатита: L
4
+ En → Fo +
L
4 + n
вплоть до точки 5, в которой весь энстатит будет расплавлен (фигуративный состав 6
полностью слагается из фаз L
5
+ Fo). От точки 5 до точки 6 происходит плавление
форстерита. При температуре T
6
и выше в системе существует один расплав.
Общая схема плавления и параметры состояния следующие:
Обратим внимание на то, что при высоких температурах (от T
4
до T
6
) вследствие
перитектической реакции в системе появляется дополнительная фаза - форстерит, которая
отсутствовала в субликвидусной парагенетической ассоциации. Появление
дополнительных ликвидусных фаз имеет важное значение для понимания генезиса
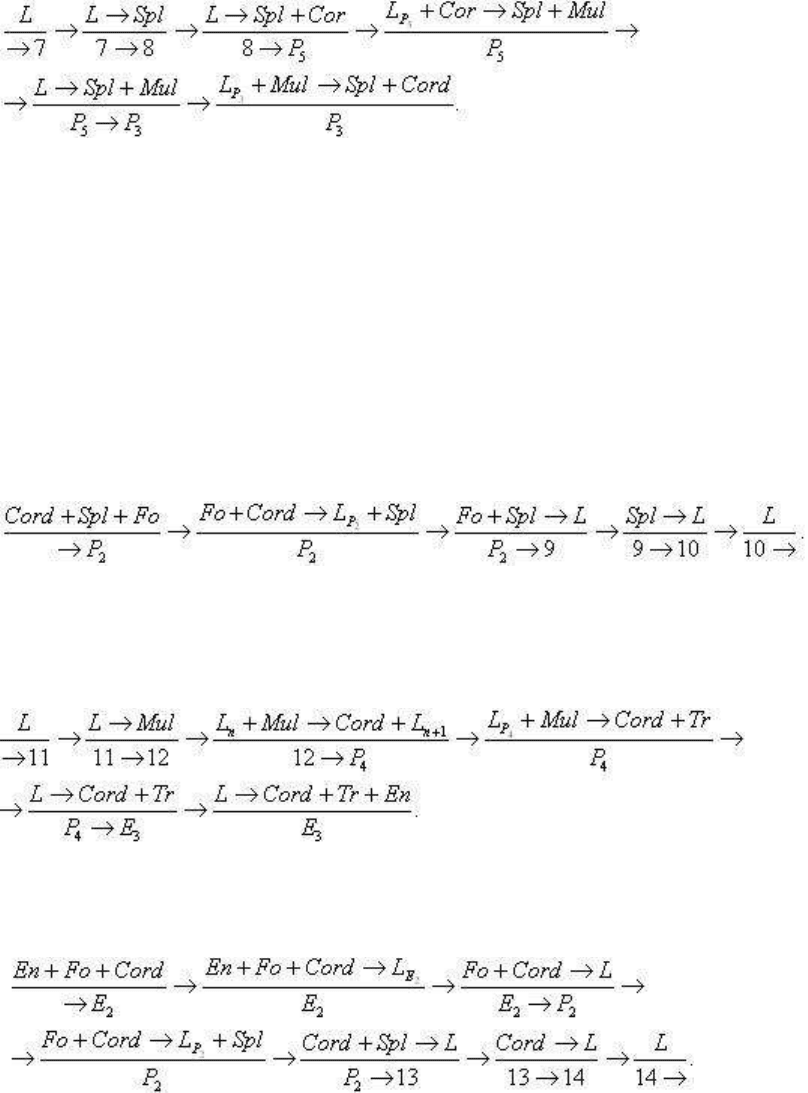
магматических горных пород, многие минералы которых характеризуются
инконгруэнтным плавлением.
Раскристаллизуем в качестве очередного примера исходный состав, заданный точкой 7
(0,24Mul
.
0,31Spl
.
0,45Cord). Кристаллизация начнется в поле ликвидуса Spl и закончится
в точке P
3
, где сходятся поля ликвидуса Spl, Mul и Cord. Ограничим рассмотрение общей
схемой кристаллизации, опустив обозначение факторов состояния, определение которых
достаточно ясно из приведенных выше примеров:
Особенности кристаллизации исходного состава 7 состоят в том, что в диапазоне
температур от T
8
до T
P5
в системе появляется дополнительная фаза - корунд (Al
2
O
3
),
который сначала кристаллизуется на котектике 8P
5
(L → Cor + Spl), а затем растворяется в
результате перитектической реакции (L
P5
+ Cor → Spl + Mul). Кристаллизация
заканчивается в перитектике P
3
, однако путь P
5
P
3
- котектический.
Анализ кристаллизации или плавления для исходных составов, расположенных в других
фазовых треугольниках не вызывает особых затруднений, поскольку при этом
повторяются уже рассмотренные соотношения. Поэтому ограничимся краткими схемами.
Плавление состава 10 (Cord
26
Spl
27
Fo
47
) происходит по схеме
Кристаллизация состава 11 (Cord
84
Tr
12
En
4
) начнется с дополнительной ликвидусной фазы
- муллита (Al
6
Si
2
O
13
) и закончится в эвтектике E
3
, состав которой (Cord
51
En
35
Tr
14
)
существенно отличается от исходного состава системы. Схема кристаллизации:
Плавление состава 14, расположенного в треугольнике En Fo Cord будет происходить по
схеме
В этом случае так же, как и при анализе фазовых соотношений при кристаллизации
состава 7, в некотором диапазоне температур появится и исчезнет дополнительная фаза. В

данном случае при T
P2
в результате инконгруэнтного плавления возникнет, а на пути P
2
→
13 конгруэнтно растворится шпинель.
Рассмотренными в этом разделе примерами исчерпываются типовые соотношения,
которые обычно встречаются при анализе трехкомпонентных систем с соединениями
постоянного состава, которые плавятся инконгруэнтно. Отметим более сложные фазовые
соотношения в этих системах по сравнению с эвтектическими системами. Главная
особенность состоит в том, что в процессе плавления и кристаллизации возникают и затем
исчезают дополнительные фазы, отсутствующие в субсолидусном состоянии системы.
Это, в свою очередь, выражается в сложных структурных соотношениях
кристаллизующихся фаз.
Диаграммы систем с ликвацией
Среди петрологически важных встречаются системы с неполной, ограниченной, взаимной
растворимостью или смесимостью в жидком состоянии. Физико-химические причины
ограниченной смесимости могут быть различными, но с термодинамических позиций
причина ограниченной смесимости единообразна и вызывается тем, что в каком-то
интервале составов термодинамический потенциал раствора оказывается выше, чем
термодинамический потенциал смеси фаз, вызывая расслоение жидкого расплава в этой
области составов на несмешивающиеся жидкости. Такое расслоение носит название
ликвации, и соответствующие системы (и диаграммы их состояния) можно кратко
обозначить как системы (и диаграммы) с ликвацией.

Рассмотрим сначала двухкомпонентные системы. На рис. 3.68 представлен вывод Т-х
диаграммы бинарной системы с ликвацией обычным путем, при помощи изотермических
G-x диаграмм. Пусть при температуре T
1
во всем диапазоне составов существует
гомогенный расплав. G-потенциал расплава будет представлен вогнутой кривой,
обладающей минимумом в любой точке состава от a до b. Его значение, как было
показано выше, равно . При понижении температуры, в
точке 2 (при T
2
) на кривой G
L
возникнет возмущение, приводящее к увеличению G-
потенциала расплава, которое при дальнейшем понижении температуры будет
распространяться на прилежащие к точке 2 составы. Так, при T
3
установятся
соотношения, при которых G-потенциал расплава (G
L
mst
) между значениями G
3
L
1
и G
3
L
2
окажется выше, чем сумма G-потенциалов расплавов, ограничивающих эту область (G
L
mst
> x
L
1
G
3
L
1
+ x
L
2
G
3
L
2
). Вследствие этого полученный расплав в этой области будет
термодинамически неустойчивым и распадется на два несмешивающихся расплава L
1
3
и
L
2
3
. Проведя на G-x диаграмме касательную к кривой G
L
в точках L
1
3
и L
2
3
на пересечении
с осями координат получим, как обычно, значения химических потенциалов компонентов
a и b в сосуществующих расплавах.
Перенесем изотермические G-T-x сечения (T
1
, T
2
и T
3
) на T-x диаграмму, расположенную
в основании фигуры. При T
1
во всем диапазоне составов существует гомогенный расплав.
При T
2
на T-x диаграмме появляется единственная точка 2, отвечающая началу ликвации в
системе и фиксирующая вершину кривой расслаивания. При T
3
на T-x диаграмму
проектируются две точки l
1
3
и l
2
3
, обозначающие сосуществующие составы двух
жидкостей L
1
и L
2
. Соединив l
1
3
и l
2
3
с точкой 2, получим верхнюю часть области
расслаивания (или купола расслаивания, если рассматривать систему в пространстве G-T-
x). Кривая, ограничивающая область расслаивания называется бинодальной кривой, а ее
вершина - критической точкой бинодали.
При понижении температуры область расслаивания будет увеличиваться, в то же время в
других частях системы возможны и иные фазовые изменения. Так, при T
4
значения G
4
L
1
и
G
4
L
2
будут ограничивать область расслаивания расплава. На T-x диаграмме
соответствующие сосуществующие составы обозначены как l
1
4
и l
2
4
. В области составов,
обогащенных компонентом b, термодинамический потенциал фазы B (G
B
) имеет меньшее
значение, чем G
b
L
. Тогда, построив касательную из точки G
B
к кривой G
L
, получим
значение G-потенциала расплава L (G
4
L''
2
), находящегося в равновесии с твердой фазой B.
Обозначив состав этого расплава через получим точку на кривой ликвидуса фазы B (при
T
4
), а, проведя линию l
2''
4
T
B
m
, обозначим верхнюю часть ликвидуса фазы B.
Последняя ситуация, имеющая принципиальное значение для бинарной системы с
ликвацией, отвечает температуре T
5
. При этой температуре прямая, проведенная на
диаграмме G-x из точки G
B
, касается одновременно кривой G
L
2
(точка G
5
L
2
) и кривой G
L
1
(точка G
5
L
1
). Это означает, что в этой части системы в равновесии будут находиться три
фазы B + L
2
+ L
1
и система окажется в нонвариантном состоянии: n = k + 1 - r = 2 + 1 - 3 =
0. В нонвариантном состоянии будет происходить кристаллизация расплава L
2
с
выделением твердой фазы B и расплава L
1
. Это хорошо видно на T-x диаграмме, где на
изотерме T
5
состав расплава L
2
(точка L
2
5
) разлагается на фазу B (x
b
=1) и расплав L
1
(точка L
1'
5
): L25 → B + L1'5 1. Эта реакция будет продолжаться до исчезновения расплава
l
2
5
, после чего в системе происходит обычная кристаллизация, завершающаяся в
эвтектической точке: L → B → L → A + B. Нетрудно вообразить, что этот тип диаграммы
"получается", когда область расслаивается, "садится" на кривую ликвидуса фазы B.

В области составов от x
a
=1 до L
1'
5
система кристаллизуется по схеме бинарной
диаграммы с одной эвтектикой, которая детально рассмотрена выше.
Как отмечалось, физико-химические причины ликвации расплавов могут быть
различными. Однако с термодинамических позиций они выражаются единообразно -
отклонением свойств расплавов от идеальности. Действительно, как мы видели, кривая
G
L
-потенциала описывается уравнением , которое
показывает, что в каждой точке составов G
L
= min и кривая имеет вогнутый вид,
изменяясь от G
L
= G
L
a
при x
a
= 1 до G
L
= G
L
b
при x
b
= 1. Член всегда
отрицательный, поскольку x
a
< 1. Положительное возмущение G
L
возможно только если
последний член в каком-то диапазоне составов (например, от x
a
=0,44 до x
a
=0,24 для точек
G
3
L
1
и G
3
L
2
) примет вид , где γ
a
> 1. В этом случае
расплав в этом диапазоне составов является неидеальным (с положительным отклонением
от идеальности, γ
a
> 1) и в системе происходит ликвация. Отметим тенденцию, общую для
расплавов, жидких и твердых растворов - повышение температуры приводит к идеальной
смесимости, понижение, напротив, способствует отклонению от идеальности. Поэтому
рассмотренн
ая диаграмма
с
расширение
м купола
расслаивани
я по мере
понижения
температуры
типична для
силикатных
систем.

Рассмотрим теперь в качестве примера диаграмму бинарной системы Mg
2
SiO
4
-SiO
2
(рис.
3.69), где ликвация осуществляется в области кристаллизации кристобалита. Это приводит
к существованию (при температуре, отвечающей точке 3 ~= 1690
o
C) нонвариантного
состояния, в котором из жидкости L
2
(состава 3
l
2
) кристаллизуется кристобалит с
одновременным обособлением оставшейся несмешивающейся жидкости L
1
(состава 3
l
1
):
3
l
2
→ Crb + 3
l
1
. Общая схема смены фазовых равновесий по мере понижения температуры
для состава расплава, заданного фигуративной точкой 1 будет записана следующим
образом:
Приведенная схема достаточно проста, и после рассмотренных выше особенностей
диаграммы не требует дополнительных пояснений.
В трехкомпонентных системах равновесие двух несмешивающихся жидкостей
дивариантно: n
p
= k + 1 - r = 3 + 1 - 2 = 2 , и состав сосуществующих жидкостей при
данной температуре может быть различным. Если представить, что в трехмерной T-x
диаграмме область расслоения представляет какую-то объемную фигуру, ограниченную
криволинейной замкнутой поверхностью -"купол расслоения"-, то изотерма будет
представлять сечение этой фигуры в виде кривой расслоения. Для определения системы в
этом случае кроме общего состава необходимо знать состав какой-либо жидкости при
каждой температуре. В трехкомпонентной системе возможно и моновариантное
равновесие трех несмешивающихся жидкостей.
Равновесие двух жидкостей и кристаллической фазы возникает в трехкомпонентной
системе при совмещении купола расслоения с поверхностью ликвидуса одной из фаз. Это
равновесие моновариантно (n
p
= k + 1 - r = 1 ), и составы сосуществующих расплавов
изобразятся сопряженными точками на кривых, отвечающих равновесию с твердой фазой
соответственно каждого расплава. Равновесие двух несмешивающихся жидкостей и двух
твердых фаз нонвариантно, и это состояние сохраняется при постоянной температуре до
исчезновения одной из фаз (раскристаллизации жидкости или плавления одной из фаз).
Такое состояние осуществляется в трехкомпонентной системе, когда купол расслаивания
"садится" на котектическую линию, захватывая поверхности ликвидуса сосуществующих
в котектике фаз. Наконец, теоретически возможно, но маловероятно, нонвариантное
равновесие трех несмешивающихся жидкостей и твердой фазы.

Наибольший интерес и затруднения при анализе диаграмм трехкомпонентных систем с
ликвацией вызывают моновариантные состояния L
1
+ L
2
+ S, когда в системе
моновариантно протекает монотектическая реакция (где S - любая твердая фаза
постоянного состава). Рассмотрим немного подробнее два главных варианта диаграмм
состояния.
Первый вариант, когда кривая расслаивания (бинодаль) лежит на поверхности
кристаллизации одной фазы. На рис. 3.70 представлена схема такой диаграммы. Кривая
расслаивания n
1
n
2
расположена в поле кристаллизации фазы A, причем точка n
1
отвечает
максимальной температуре бинодали, n
2
- минимуму температуры, что легко представить
себе, вспомнив, что поверхность ликвидуса фазы имеет наклон в направлении e
1
Ee
2
(где E
- эвтектический минимум температуры). Очевидно также, что фигуративные точки в
треугольниках составов Aa'e
1
и Aa''
2
(где a' и a''- касательные к области расслоения)
кристаллизуются по обычной эвтектической схеме. Фигуративные составы,
расположенные внутри поля Aa'n
2
a''при кристаллизации или плавлении претерпевают
фазовые изменения с появлением ликвации.
Так, для состава, заданного точкой Y на ликвидусе будет выделяться из расплава фаза A и
состав расплава будет перемещаться от фазы A по прямой, обозначенной стрелками. При
достижении бинодали в точке l
2
1
произойдет расслоение расплава на два: L
1
и L
2
, составы
