Жариков В.А. Основы физической геохимии
Подождите немного. Документ загружается.

Эвтектика - нонвариантное состояние системы и соответственно точка на диаграмме (в
координатах Т-р-х), в которой при наименьшей температуре из расплава одновременно
кристаллизуется максимальное число фаз системы. Соответственно обозначают
эвтектический состав системы, эвтектическую температуру и т. д.
Котектика - моновариантное состояние системы, в котором одновременно
кристаллизуется несколько фаз системы. Соответственно обозначают котектические
линии (на Т-р-х диаграммах), котектические составы и т.д.
Среди диаграмм плавкости в соответствии с особенностями фазового состава систем
можно различать следующие главные типы.
1. Диаграммы плавкости систем с неограниченной растворимостью в жидком состоянии и
твердыми фазами постоянного состава:
а) с одной эвтектикой (без соединений);
б) с соединениями, плавящимися конгруэнтно;
в) с соединениями, плавящимися инконгруэнтно.
2. Диаграммы плавкости систем с ликвацией и твердыми фазами постоянного состава
(подобно первой группе возможны подгруппы а, б, в).
3. Диаграммы плавкости систем с неограниченной растворимостью в жидком состоянии и
твердыми фазами переменного состава (твердыми растворами):
а) с неограниченными твердыми растворами;
б) с ограниченными твердыми растворами;
в) с соединениями (постоянного и (или) переменного состава).
4. Диаграммы состояния систем с ограниченной растворимостью в жидком состоянии и
твердыми фазами переменного состава (подобно третей группе возможны подгруппы а, б
и в).
Перечисленные типы диаграмм практически исчерпывают топологические разновидности
диаграмм, характеризующих условия плавления неорганических веществ. Нетрудно
видеть, что четвертый тип диаграмм представляет, по существу, комбинацию второго и
третьего типов и имеет к тому же ограниченную применимость. Поэтому для наших целей
можно ограничиться рассмотрением первых трех типов диаграмм плавкости. Диаграммы
плавкости, т.е. Т-х диаграммы конденсированных систем, охватывающие условия
плавления фаз, представляют, как мы отмечали, только одну разновидность диаграмм в
координатах интенсивных и экстенсивных параметров. Кроме них могут быть построены
р-х диаграммы, охватывающие как область субсолидуса, так и явления плавления фаз. Для
определенных целей необходимы Т-х диаграммы для области субсолидуса, μ
j
-х
диаграммы, характеризующие и области солидуса, и области ликвидуса, и т.д. Однако
топологически, т.е. по своей графической структуре и обобщенным физико-химическим
свойствам, все эти диаграммы полностью аналогичны диаграммам плавкости, а поскольку
диаграммы плавкости наиболее широко используются в физико-химической петрологии,
целесообразно рассмотреть этот класс диаграмм на их примере.
Диаграммы плавкости систем с неограниченной растворимостью в жидком
состоянии и с твердыми фазами постоянного состава
Диаграммы систем без соединений (с одной эвтектикой)
Это простейший тип диаграмм плавкости. Полное название диаграмм такого типа:
изобарические Т-х диаграммы состояния систем в конденсированном состоянии с
неограниченной растворимостью в жидкой фазе и твердыми фазами постоянного состава,
не образующими между собой соединений. Для краткости будем обозначать их как
диаграммы плавкости с одной эвтектикой.
Рассмотрим сначала диаграмму плавкости бинарной системы. Состав системы:
компоненты а и b, которые образуют соответственно твердые фазы A и B, третья фаза -
расплав L, состав которого может изменяться от a до b. Термодинамический потенциал
такой системы в изобарических условиях зависит от температуры и состава системы: G =
ƒ(T, x
a
, x
b
), изменение его выразится уравнением
dG = -SdT + μ
a
dx
a
+ μ
b
dx
b
(3.12)
Термодинамический потенциал рассматриваемой системы может быть представлен в
трехмерной G-Т-х диаграмме, где по оси абсцисс в барицентрических координатах
отложен состав системы, а по другим осям - температура и термодинамический
потенциал. Воспользуемся графическим образом термодинамического потенциала
системы для построения (вывода) интересующей нас Т-х диаграммы.
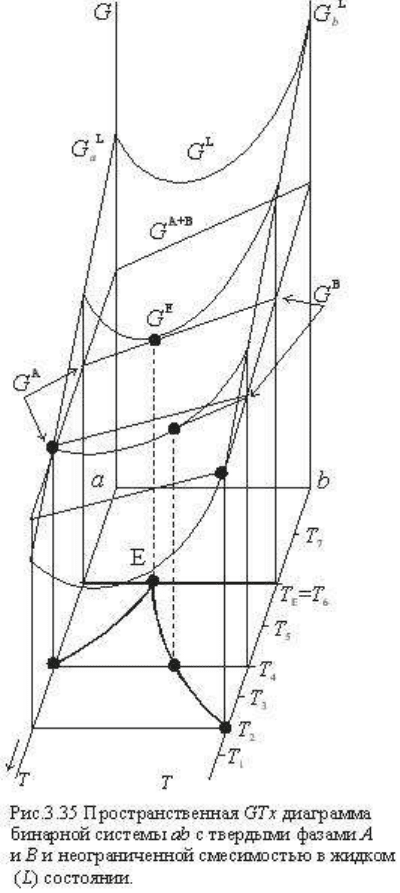
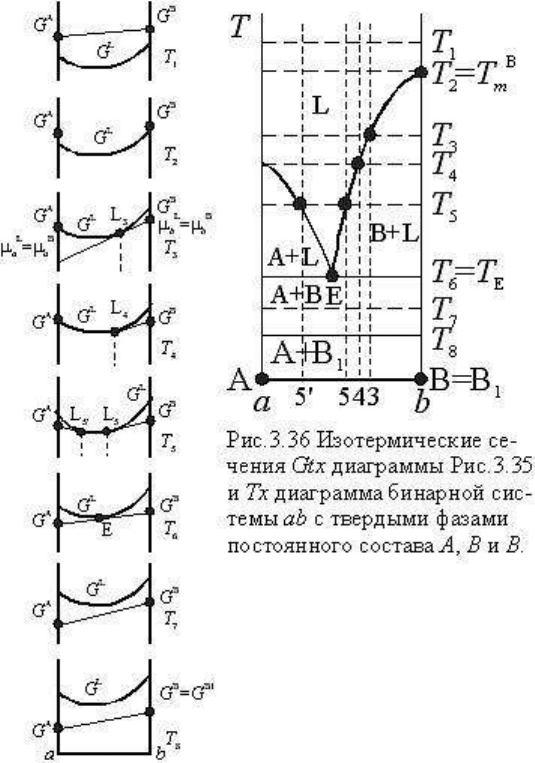
Для этой цели на рис. 3.35
представлена пространственная G-Т-
х диаграмма системы, на которой: а)
показаны термодинамические
потенциалы фаз системы в
зависимости от температуры; б) на Т-
х плоскости построена диаграмма
состояния системы, основанная на
минимальных значениях G в
зависимости от Т и х, и в)
обозначены изотермические сечения
и соответствующие им значения G
фаз для характерных состояний
системы. На рис. 3.36 представлены
G-х диаграммы для обозначенных
изотермических сечений
пространственной диаграммы
(причем
T
1
>T
2
>T
3
>T
4
>T
5
>T
6
=T
E
>T
7
>T
8
) и
выведенная при их помощи Т-х
диаграмма системы. Оба рисунка
находятся в полном соответствии.
Отметим, что обычно при выводе
диаграмм плавкости не строится
полная диаграмма (рис. 3.35), а
используются изотермические
сечения G-Т-х диаграмм (рис. 3.36):
для бинарных систем - они более
наглядны, а для тройных систем
полную G-Т-х диаграмму построить невозможно (она четырехмерна). Разберем эти
диаграммы.
При высокой температуре во всем диапазоне составов от а до b термодинамический
потенциал жидкой фазы (расплава) меньше, чем термодинамический потенциал суммы
твердых фаз G
A
+ G
B
, и в системе устойчив только расплав. Такие соотношения
представлены на сечении Т
1
, где кривая G
L
расположена ниже линии, соединяющей G
A
с
G
B
и отвечающей, как мы показано выше, потенциалу смеси фаз А + В.
По мере понижения температуры в соответствии с уравнением (3.12) термодинамические
потенциалы фаз будут увеличиваться, причем термодинамический потенциал расплава
будет возрастать больше, чем термодинамические потенциалы твердых фаз, поскольку
энтропия жидкой фазы всегда больше энтропии твердой фазы того же состава. В
результате при температуре T
2
(сечение T
2
, диаграмм рис. 3.35 и 3.36) термодинамический
потенциал расплава, по составу отвечающего чистому компоненту b, станет равным
термодинамическому потенциалу твердой фазы В и из расплава начнется кристаллизация
фазы В (если, естественно, тепло отводится от системы).
Термодинамические соотношения в этом состоянии можно записать следующим образом
(обратим внимание читателя, что в данном случае индекс m обозначает, как принято в
термодинамике, плавление (melting).):

G
b
L
= G
B
, ΔG
m
= G
b
L
- G
B
= 0
ΔG
m
= ΔH
m
- T
m
B
ΔS
m
= 0 и
ΔH
m
= T
m
B
ΔS
m
(3.13)
где T
m
B
- температура кристаллизации, равная температуре плавления фазы B, ΔH
m
= H
b
L
-
H
B
= -Q - изменение энтальпии при плавлении (или кристаллизации) фазы В, равное (с
обратным знаком) теплоте плавления фазы В, ΔS
m
= S
b
L
- S
B
- изменение энтропии при
плавлении фазы В.
При дальнейшем понижении температуры происходит моновариантная (n
p
= k + 1- r = 3 -
2 = 1) кристаллизация фазы В из расплава. По мере кристаллизации фазы В состав
расплава непрерывно обедняется компонентом b таким образом, что каждой температуре
отвечает определенный состав расплава. Например, для какой-то температуры T
3
(сечение
T
3
диаграмм рис. 3.35 и 3.36) состав расплава можно определить, проведя касательную из
точки G
B
к кривой G
L
и спроектировав точку касания L
3
на ось составов (пунктир на
диаграммах), получим фигуративную точку состава расплава, отвечающего данной
температуре. Совокупность точек, каждая из которых отвечает составу расплава,
равновесного с твердой фазой при данной температуре, составит линию ликвидуса на
диаграмме Т-х. На рис. 3.36 линии ликвидуса L-В и L-А показаны на Т-х диаграмме
соответственно кривыми T
m
B
-L
3
-L
4
-L
5
-E и T
m
A
-L
5
-E .
Определение состава расплава сосуществующего с твердой фазой путем проведения
касательной из точек G
B
и G
A
к кривой G
L
, зависит от условий равновесия
сосуществующих фаз.
Действительно, продолжив касательную G
B
-L
3
(сечение T
3
) до пересечения ее с осями
ординат, мы получим (как показано выше) значения химических потенциалов
компонентов a и b в сосуществующих фазах B и L, которые равны между собой: μ
a
L
= μ
a
B
и μ
b
L
= μ
b
B
в состоянии равновесия. Для сохранения равновесия обязательно также dμ
a
L
=
dμ
a
B
и dμ
b
L
= dμ
b
B
, что отвечает перемещению точки касания по кривой G
L
.
Эти соотношения лежат в основе вывода уравнения ликвидуса. Раскроем выражение dμ
b
L
= dμ
b
B
, подставляя их значения (см. уравнение (2.137), глава 2). Поскольку
рассматривается изобарическое сечение, из dμ
b
L
= dμ
b
B
следует:
-S
b
L
dT + RT dln a
b
L
= -S
b
B
dT
(фаза В имеет постоянный состав a
b
B
= 1).
Преобразуя, получим уравнение:
которое и представляет искомое уравнение ликвидуса на Т-х диаграмме. Для идеальных
растворов, где a
b
L
= x
b
L
, получим уравнение:

Заменяя ΔS
m
B
= S
b
L
- S
b
B
на (H
b
L
- H
b
B
) / T = ΔH
m
B
, можно записать уравнение ликвидуса в
форме:
где ΔH
m
B
= Q
m
B
- энтальпия (с обратным знаком) при температуре плавления фазы В,
сложенной чистым компонентом b. Уравнение (3.16) можно интегрировать, учтя
зависимость теплоты плавления от температуры (см. гл. 4) или пренебрегая этой
зависимостью, считая в первом приближении ΔH
m
B
величиной постоянной. В последнем
случае, интегрируя в пределах от x
b
L
= 1 до x
b
L
, где x
b
L
- любая точка на линии ликвидуса
В и соответственно от T = T
m
L
до Т, отвечающей x
b
L
, получим уравнение, известное как
уравнение Шредера:
Уравнение (3.17) можно представить в виде:
Уравнения (3.14-3.18) очевидно показывают, что уменьшение мольной доли компонента в
расплаве уменьшает температуру плавления фазы, сложенной этим компонентом, и
связывают эту зависимость с другими термодинамическими характеристиками
компонента (ΔH
m
B
и T
m
B
).
Продолжим рассмотрение диаграмм рис. 3.35 и 3.36. Дальнейшее понижение температуры
приведет к тому, что при Т=Т
4
термодинамический потенциал, расплава для составов,
отвечающих чистому компоненту а, станет равным термодинамическому потенциалу
фазы А (сложенной чистым компонентом а), и при отводе тепла из системы станет
возможной кристаллизация фазы А. Состав расплава, равновесного с кристаллизующейся
фазой В, определится точкой касания l
4
(касательная из точки G
B
к кривой G
L
).
При температуре T=T
5
в рассматриваемой бинарной системе: а) происходит
кристаллизация фазы A из расплавов, имеющих состав от а до L
5'
, причем состав расплава,
равновесного с фазой А, при этой температуре отвечает точке L
5'
, которую мы
определяем, проведя касательную из точки G
A
к кривой G
L
; б) происходит кристаллизация
фазы В из расплавов, состав которых меняется от b до L
5
, соответственно состав
равновесного расплава отвечает точке L
5
, в) в области составов от L
5
до L
5'
существует
расплав, поскольку G
L
в этой области меньше другой возможной кривой G-потенциала .
Продолжение касательных до пересечения с осями ординат дадут нам значения μ
a
A
= μ
a
L
,
μ
a
L
= μ
a
B
и μ
b
L
= μ
b
B
, дифференцируя которые получим, как показано выше, уравнения
ликвидуса фаз А и В.
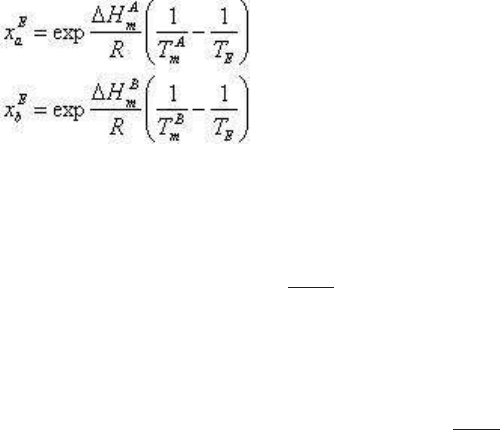
При дальнейшем понижении температуры точки касания L
5
и L
5'
будут перемещаться по
кривой навстречу друг другу вплоть до того, когда они образуют единую точку касания Е,
как это показано на сечении Т
6
диаграмм рис. 3.35 и 3.36. В соответствии с диаграммой G-
х в точке Е в равновесии находятся три фазы: расплав, А и В. Трехфазовая бинарная
система в изобарических условиях нонвариантна: n
p
= k + 1-r=3-3=0, т.е. при одной,
конкретной температуре в равновесии находятся две твердые фазы постоянного состава и
расплав, также имеющий определенный постоянный состав, который легко получить,
спроектировав точку Е на ось составов. Из сопоставления G-х диаграмм при различных
температурах нетрудно видеть, что точка Е - единственная точка диаграммы, в которой
совместно сосуществуют три фазы, и она характеризует наименьшую температуру, при
которой существует жидкая фаза. Это особенно хорошо видно на Т-х диаграмме: в точке
Е пересекаются линии ликвидусов фаз А и В. Точка Е как особенная точка диаграммы
получила название эвтектической. Соответственно эвтектикой, как отмечалось,
называется состояние системы, в котором при наименьшей температуре кристаллизуется
максимальное число фаз системы (r
max
=k + 1) при nр=0. Состав и температура эвтектики
обозначаются как эвтектические, хотя нередко для краткости под эвтектикой понимают и
состояние системы, и соответствующий состав ее, и точку на диаграмме с ее
координатами Т и х.
Положение эвтектической точки может быть определено совместным решением
уравнений вида (3.18) для компонентов a и b:
и уравнения x
a
+ x
b
= 1. Вместо (3.18) можно использовать для этого и интегральные
решения уравнения (3.15), однако во всех случаях решение оказывается сравнительно
громоздким (см. подробнее гл. 4).
Обратим внимание, что для нонвариантного эвтектического состояния системы
независимыми параметрами (факторами равновесия) будут уже не температура и массы
компонентов, а энтропия и массы компонентов. Напомним, что число фаз в системе всегда
равно числу экстенсивных параметров (см. гл. 2) и, следовательно, для бинарной системы
r=3=f
ex
. Экстенсивными параметрами в таком случае являются массы компонентов (фаз) и
энтропия, приведенное теплосодержание системы, которая определяет количество
расплава в системе. По мере уменьшения теплосодержания в системе происходит
кристаллизация А и В и количество расплава уменьшается вплоть до полной его
раскристаллизации.
По исчерпанию расплава система снова становится моновариантной: две твердые фазы А
и В, n
p
=k + 1-r=1 и возможно дальнейшее понижение температуры без изменения
фазового состояния системы. На рис. 3.35 и 3.36 изотерма T
7
отвечает одному из таких
состояний системы. Термодинамический потенциал смеси двух фаз А и В меньше G
L
во
всем диапазоне составов, что и обусловливает устойчивость А + В при температурах ниже
эвтектической, т.е. в области субсолидуса.
Моновариантное изменение системы будет продолжаться до тех пор, пока в области
субсолидуса не станет возможной какая-либо реакция в твердом состоянии, например
полиморфный переход B→B
1
или образование соединения А + В→АВ и т.д. Нетрудно
убедиться, что эти реакции в изобарических условиях также нонвариантны и будут
осуществляться при постоянной температуре вплоть до исчезновения одной из фаз. В
нонвариантном состоянии, как отмечалось, система описывается только экстенсивными
параметрами, массами компонентов и энтропией, изменение которой является причиной
фазового перехода. На диаграмме рис. 3.36 твердофазовой реакции полиморфного
перехода В→B1 отвечает изотерма T
8
. Нетрудно видеть, что в этом случае G
B
=G
B1
, ΔG
t
=
G
B
- G
B1
= 0, ΔG
t
= ΔH
t
- TΔS
t
= 0 и ΔH
t
= TΔS
t
, где ΔG
t
, ΔH
t
, ΔS
t
- изменение свободной
энергии, энтальпии и энтропии реакции фазового перехода. После того как фаза В
полностью переходит в более низкотемпературную модификацию В
1
, система снова
может находиться в моновариантном изменении до следующей реакции в твердом
состоянии.
Рассмотрим теперь
Т-х диаграмму
состояния системы
(см. рис.3.36).
Спроектировав с
диаграммы G-х все
точки касания к
кривой G
L
из G
B
и G
A
в интервале от T
2
до
T
E
, получим на
диаграмме Т-х линии
ликвидуса фаз А и В,
соответственно и ,
которые сходятся
(пересекаются) в
эвтектической точке.
Линии ликвидуса
отделяют
дивариантное поле
расплава L от полей
диаграммы, где
устойчивы по две
фазы: B + L и A + L-
твердые фазы
постоянного состава
и расплав, состав
которого
моновариантно
изменяется в зависимости от температуры. Отрезок любой изотермы от линии ликвидуса
до ординаты представит конноду равновесия твердая фаза + расплав. При эвтектической
температуре эти конноды, сливаясь на продолжении, образуют линию, отделяющую
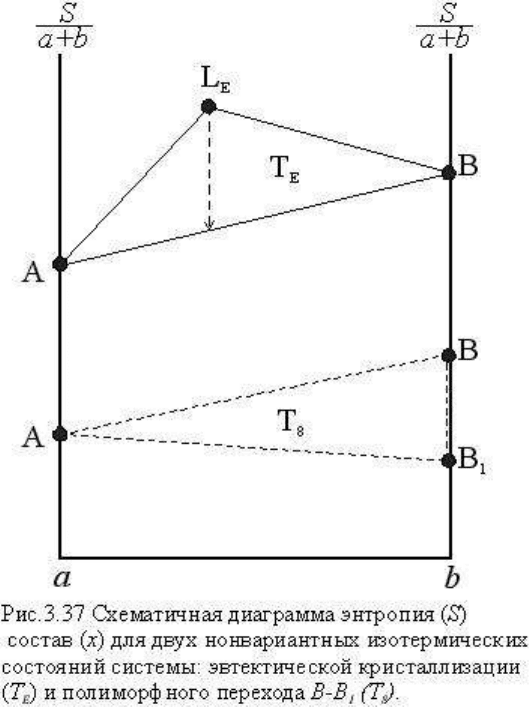
ликвидус от солидуса. Заметим, что на диаграмме Т-х трехфазовое нонвариантное
состояние изобразилось линией, составленной двумя коннодами, но если построить
необходимую диаграмму в координатах трех экстенсивных параметров - компоненты a, b
и энтропия, то эвтектическое нонвариантное состояние будет представлено
треугольником с коннодами АВ, AL и BL. В субсолидусе расположены поля равновесия А
+ В и A + B
1
, которые разделены нонвариантным состоянием А + В + B
1
- оно на
диаграмме изображено изотермой T
8
, составленной совпадающими коннодами АВ, АВ1 и
ВВ1. Точно так же на диаграмме S-х этому состоянию отвечает треугольник с коннодами
АВ, AВ
1
и BB
1
. На рис. 3.37 показаны схематически рассмотренные нонвариантные
состояния T
E
и T
8
в координатах S-a-b. Пунктир на изотерме T
E
характеризует
уменьшение расплава и энтропии системы при эвтектической кристаллизации из расплава
(L
E
) твердых фаз A + B.
T-х диаграмма плавкости описывает фазовые соотношения в системе при остывании и
кристаллизации расплавов или, наоборот, при плавлении пород. Рассмотрим их на
примере конкретной диаграммы состояния, имеющей непосредственное отношение к
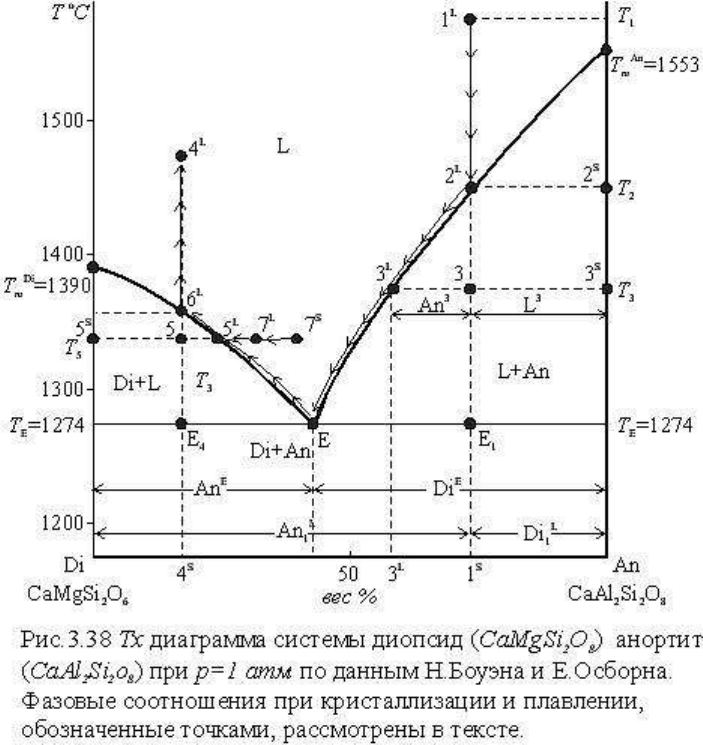
петрологическим проблемам. На диаграмме рис. 3.38 показана изобарическая (р=1 атм) Т-
х диаграмма системы диопсид (Di) - анортит (An). В этой системе компонентами
выступают сложные минеральные молекулы CaMgSi
2
O
6
(Di) и CaAl2Si2O8 (An), каждый
из которых представляет конгруэнтно плавящиеся фазы, не образующие между собой
соединений. Сплошными линиями на диаграмме разделены поля стабильности
возможных фаз системы: L (расплав), L + Di, L + An, Di + An. Фазовые границы - линии
T
m
Di
E и T
m
An
E - кривые плавления, соответственно Di и An, описываемые уравнением
Шредера. Легко видеть, например, что чистый Di плавится или кристаллизуется при T
m
Di
= 1390
o
C. По мере увеличения в системе содержания An температура плавления Di
понижается вплоть до эвтектики (Е), в которой одновременно кристаллизуются Di и An.
Рассмотрим в качестве примера кристаллизацию расплава, обозначенного фигуративной
точкой 1
L
. Составы расплава и закристаллизовавшейся из него смеси фаз определяются по
правилу барицентрических координат: опустив из точки 1 перпендикуляр (линия 1
L
1
S
),
отсечем на оси абсцисс отрезки пропорционально содержанию An и Di: отрезок Di 1
S
показывает содержание An в расплаве (An
L
1), отрезок Аn1
S
- содержание Di(Di
L
1). При
температуре, отвечающей точке 1
L
(T
1
), система, состав которой задан этой точкой,
существует в виде одной гомогенной фазы - расплава. Согласно правилу фаз (n
p
=k + 1-r=2
+ 1-1=2) система дивариантна, т.е. не нарушая фазового состава, можно изменять
температуру и мольные соотношения компонентов. Следовательно, однофазовое
состояние системы 1
L
в виде расплава будет сохраняться при понижении температуры
вплоть до точки 2
L
, расположенной на кривой плавления An. При достижении
температуры Т
2
An
, отвечающей температуре плавления An в системе заданного состава, из
расплава начнет кристаллизоваться An в данной системе как фаза постоянного состава.
При кристаллизации анортита расплав будет обедняться этим компонентом. В
соответствии с правилом фаз (n
p
= k + 1-r=2 + 1-2=1) система моновариантна, т.е.
изменение состава расплава должно сопровождаться изменением температуры и
наоборот. Следовательно, при кристаллизации An состав расплава будет изменяться вдоль
кривой плавления 2
L
-Е (показано стрелками). В любой момент моновариантной
кристаллизации, т.е. при любой температуре между T
2
и Т
E
, пользуясь свойствами
барицентрических координат, можно определить состав и количество фаз. Например, для
Т
3
: проекция точки 3
1
на ось абсцисс показывает состав расплава; отношение отрезков 3 3
5
/ 3
L
3
5
отвечает количеству расплава, а 3 3
L
/ 3
L
3
5
количеству An. Моновариантная
кристаллизация L + An будет продолжаться до достижения эвтектики. В эвтектике из
расплава кроме анортита будет кристаллизоваться также диопсид, система нонвариантна
(n
p
=k + 1-r=2 + 1-3=0), температура и состав расплава будут оставаться неизменными до
полной раскристаллизации расплава. Состав эвтектического расплава легко определяется
проектированием точки Е на ось составов (на рис. 3.38 отрезки An
E
Di
E
), относительные
количества кристаллизующихся фаз отвечают их соотношениям в расплаве.
Относительные количества расплава и твердых фаз в каждый момент эвтектической
кристаллизации по диаграмме вычислить нельзя, так как количество расплава, как
отмечалось, определяется теплосодержанием (или энтропией) системы, которое
графически не отражено на диаграмме (сравни выше рис. 3.37).
Рассмотренный процесс кристаллизации удобно записать в виде кратких схем. При этом
можно выбрать две формы записи. Одна из них (I) отражает смену фазовых равновесий по
мере отвода тепла и изменения температуры системы от точки 1 до точки Е. При этом для
полной характеристики можно обозначить интенсивные и экстенсивные параметры в
каждом состоянии системы. Другая форма записи (II) отражает процесс происходящий в
каждом состоянии системы. Приведем эти записи:
