Страйер Л. Биохимия. Том 3
Подождите немного. Документ загружается.


кажущийся (при низкой разрешающей спо-
собности метода) рост одной из дочерних
цепей в направлении 3'—>5'?
Проблема была решена Рейдзи Оказаки
(Reiji Okazaki), который обнаружил, что зна-
чительная часть новосинтезированной
ДНК существует в виде коротких фрагмен-
тов. Такие фрагменты длиной около 1000
нуклеотидов (они называются фрагментами
Оказаки) существуют в течение непродол-
жительного времени в непосредственной
близости от репликационной вилки. По ме-
ре прохождения репликации эти фрагменты
соединяются друг с другом ковалентно под
действием ДНК-лигазы и образуют одну из
дочерних цепей (рис. 24.40). Другая новая
цепь синтезируется непрерывно или почти
непрерывно. Та цепь, которая образуется из
фрагментов Оказаки, называется отстаю-
щей цепью, а та, что синтезируется без раз-
рывов или почти без разрывов,- ведущей
цепью. И фрагменты Оказаки, и ведущая
цепь синтезируются в направлении 5'—>3'.
Прерывистая сборка отстающей цепи позво-
ляет путем полимеризации в направлении
5'—>3' на атомном уровне получать общий
рост цепи в направлении 3'—>5'.
24.20. Затравкой синтеза ДНК служит
РНК
Как начинается синтез ДНК? Напомним,
что всем ДНК-полимеразам для иницииро-
вания синтеза ДНК необходима затравка со
свободной 3'-ОН-группой. Что служит за-
травкой при синтезе ведущей цепи и фраг-
ментов Оказаки? Важным толчком к реше-
нию этого вопроса послужило наблюдение,
что для инициации синтеза ДНК необходим
синтез РНК. На основе этого открытия бы-
ло высказано предположение, что РНК, оче-
видно, служит затравкой в синтезе ДНК, так
как уже было известно, что РНК-полиме-
разы способны начинать синтез цепей de
novo. Затем было показано, что новообра-
зующаяся ДНК ковалентно связана с ко-
ротким фрагментом РНК, который и слу-
жит затравкой. Итак, РНК-затравка
в синтезе ДНК.
По всей вероятности, репликация ДНК
в клетке E.coli происходит, как показано на
рис. 24.41.
1. Особая РНК-полимераза (ее называют
праймаза) синтезирует короткую цепь РНК
(примерно 10 нуклеотидов), комплементар-
ную одной из цепей ДНК-матрицы. В отли-
чие от ДНК-полимеразы праймаза не ну-
Рис. 24.40. Схематическое изображение
репликационной вилки. Обе це-
пи ДНК синтезируются в на-
правлении 5'—>3'. Ведущая
цепь синтезируется непрерыв-
но, а отстающая - в виде корот-
ких фрагментов (фрагменты
Оказаки).
Рис. 24.41. Инициация синтеза ДНК.
А - праймаза синтезирует ко-
роткую комплементарную
цепь РНК; Б - эта РНК служит
затравкой для синтеза новой
ДНК; В - РНК, входящая в со-
став новообразованной цепи,
гидролизуется, при этом обра-
зуется брешь, которая впослед-
ствии заполняется.
24. ДНК: генетическая роль,
структура и репликация
31
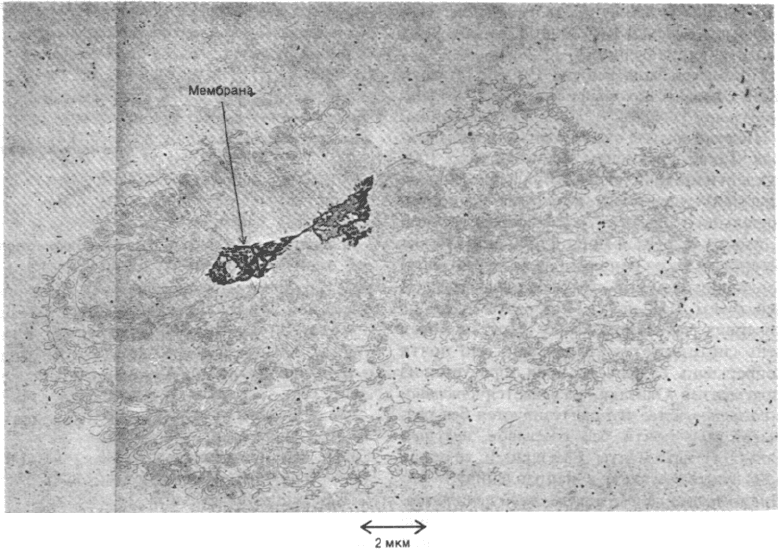
Рис. 24.42. Электронная микрофотогра-
фия хромосомы Е. coli, прикре-
пленной к двум фрагментам
клеточной мембраны. На ри-
сунке изображена одна интакт-
ная суперспирализованная мо-
лекула ДНК. [Delius H.,
Worcel A., J. Mol. Biol., 82, 108
(1974).]
ждается в затравке для синтеза полинуклео-
тида.
2. 3'-гидроксильная группа концевого ри-
бонуклеотида этой цепи РНК служит за-
травкой для синтеза ДНК под действием го-
лофермента ДНК-полимеразы III. Большая
часть новообразованной ДНК синтезирует-
ся этим мультисубъединичным комплексом.
3. РНК-компонент этого РНК-ДНК-ги-
брида гидролизуется под действием ДНК-
полимеразы I.
4. После удаления РНК из новообразо-
ванных цепей между фрагментами ДНК
остаются довольно обширные бреши. ДНК-
полимераза I, которая хорошо приспособле-
32
Часть IV.
Информация
на для синтеза ДНК на одноцепочечной ма-
трице, заполняет эти бреши.
Последние исследования показали, что
действию праймазы предшествует образо-
вание предзатравочного промежуточного
комплекса, состоящего как минимум из пяти
белков. Один из них - белок dnaB - может
передвигаться вдоль ДНК, используя энер-
гию гидролиза АТР. Белок dnaB может слу-
жить сигналом для активации праймазы.
Специфичность инициации очередного ци-
кла репликации может обеспечиваться бел-
ками, доставляющими белок dnaB точно
в область гена ilv, где находится точка нача-
ла репликации хромосомы E.coli. Время на-
чала репликации ДНК имеет критическое
значение, поскольку оно должно быть
скоординировано с делением клетки. И дей-
ствительно, бактериальная хромосома ассо-
циирована с впячиванием клеточной мем-
браны (рис. 24.42).
24.21. Энергия гидролиза АТР используется
для расплетания родительской ДНК
в области репликационной вилки
под действием белка rep
В 1953 г. Уотсон и Крик отмечали, что «рас-
крутить спираль - задача труднопреодоли-
мая». Исследования, проведенные в послед-
нее время, показали, что в клетке E.coli

Рис. 24.43. Каталитические активности
ДНК-гиразы.
в области репликационной вилки происхо-
дит активное расплетание родительской
двойной спирали под действием фермента —
белка rep. Поскольку энергия для расплета-
ния родительской ДНК высвобождается
при гидролизе АТР, белок гер называют хе-
ликазой. На разделение каждой пары осно-
ваний затрачиваются примерно две моле-
кулы АТР. Затем каждая из разделенных
цепей родительской ДНК взаимодействует
с несколькими молекулами белка, связываю-
щегося с одноцепочечной ДНК (ОЦ-связы-
вающий белок). Роль ОЦ-связывающего
белка - стабилизировать одноцепочечные
участки ДНК, образовавшиеся под дей-
ствием хеликазы, чтобы расплетенная
область могла функционировать в качестве
матрицы. ОЦ-связывающие белки назы-
вают также белками, дестабилизирующими
спираль (белки ДС), или плавящими белка-
ми.
24.22. ДНК-гираза вводит отрицательные
супервитки в родительскую ДНК, чтобы
облегчить ее расплетание
При расплетании ковалентно замкнутой
кольцевой молекулы ДНК возникают топо-
логические проблемы, так как расплетание
двойной спирали вызывает образование по-
ложительных супервитков в замкнутой мо-
лекуле. В области репликационной вилки
родительская ДНК вращается со скоростью
100 об/с - более чем в 100 раз быстрее, чем
обычная долгоиграющая пластинка. Чтобы
процесс расплетания продолжался, необхо-
димо снять эти положительные супервитки,
образовавшиеся в результате вращения.
Другими словами, необходимо наличие ка-
кого-то молекулярного шарнира. Недавно
Мартин Геллерт (Martin Gellert) установил,
что эту функцию выполняет ДНК-гираза.
Эта топоизомераза удаляет положи-
тельные супервитки, внося одноцепочечные
разрывы и затем заделывая фосфодиэфирные
связи в остове ДНК. АТР не требуется для
такой термодинамически выгодной релакса-
ции третичной структуры ДНК. Более того,
ДНК-гираза может активно вводить отри-
цательные супервитки в ковалентно замкну-
тую кольцевую ДНК за счет энергии гидро-
лиза АТР (рис. 24.43). Эти отрицательные
супервитки способствуют расхождению це-
пей родительской ДНК в области реплика-
ционной вилки
1
.
24.23. Сложность аппарата репликации,
по-видимому, необходима для обеспечения
очень высокой надежности
Существующие представления о молекуляр-
ном механизме репликации ДНК у E.coli
1
В этой главе автор называет ДНК-гиразой
два совершенно различных фермента. Один из
них - ДНК-гираза, способная вводить в ДНК
термодинамически невыгодные отрицательные
супервитки за счет энергии гидролиза АТР; дру-
гой - независимая от АТР ДНК-топоизомераза,
приводящая кольцевую молекулу ДНК в тер-
модинамически равновесное (релаксированное)
состояние. Это два совершенно различных бел-
ка: у них различные ингибиторы, потребности
в ионных условиях среды, механизм действия.
В репликации в качестве молекулярного шарни-
ра участвует ДНК-гираза.- Прим. перев.
24. ДНК: генетическая роль,
структура к репликация
33
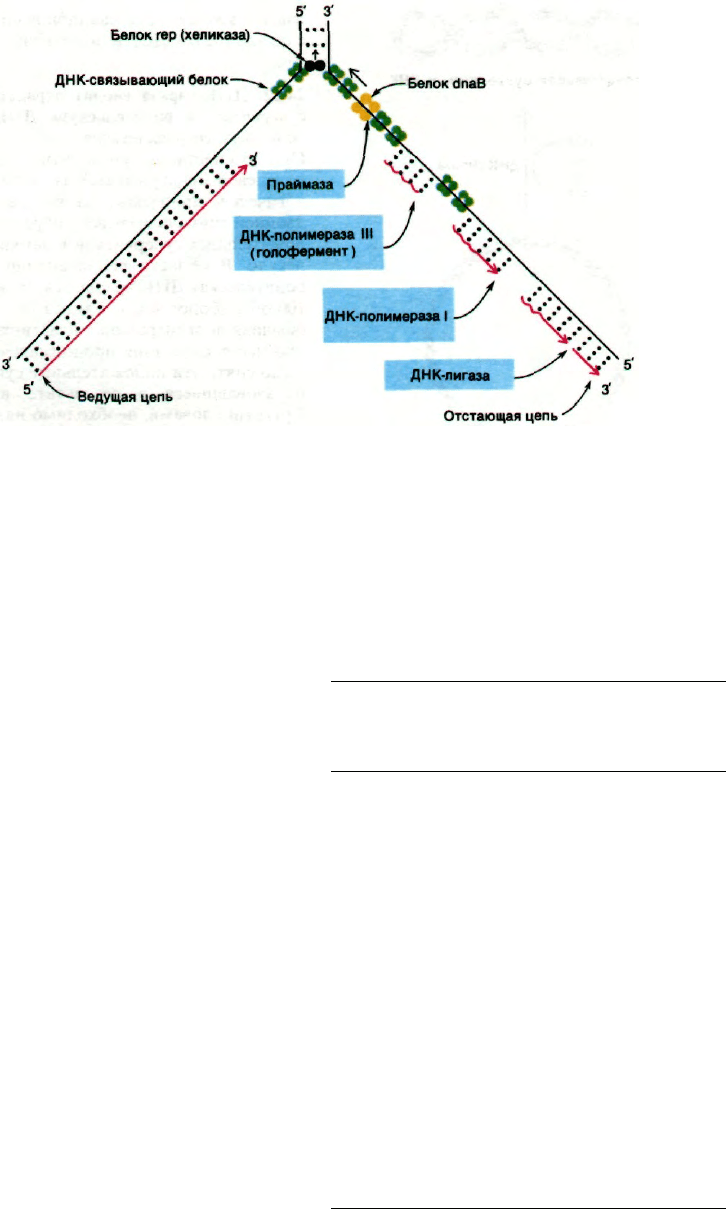
Рис. 24.44. Схематическое изображение
ферментативных процессов
в области репликационной вил-
ки Е. coli. Фрагменты, отме-
ченные синим цветом, катали-
зируют инициацию, элонгацию
и сшивание (с помощью ДНК-
лигазы) цепей ДНК. (Коrn-
berg A., DNA replication,
W.H. Freeman and Co., 1980.)
представлены на рис. 24.44 и в табл. 24.2.
Поражает сложность взаимодействий мно-
жества белков, участвующих в этом процес-
се. Генетический анализ показывает, что
в репликации ДНК непосредственно уча-
ствует не менее 15 белков. Почему механизм
репликации ДНК столь сложен? В частно-
сти, почему синтез ДНК начинается с РНК-
затравки, которая затем удаляется? Если бы
ДНК-полимеразы могли начинать синтез
цепей de novo, в РНК-затравке не было бы
надобности. Однако такая способность бы-
ла бы несовместима с чрезвычайно высокой
точностью ДНК-полимераз. Напомним, что
ДНК-полимеразы, прежде чем образовать
новую фосфодиэфирную связь, проверяют
правильность предшествующей пары осно-
ваний. Эта функция редактирования суще-
ственно снижает частоту ошибок. РНК-по-
лимеразы, напротив, могут начинать синтез
цепей de novo, так как они не проверяют
34
Часть IV.
Информация
предыдущую пару оснований. Частота оши-
бок для них на несколько порядков вели-
чины выше, чем для ДНК-полимераз. Было
найдено остроумное решение этой про-
блемы: начинать синтез ДНК с полинуклео-
тида, синтезируемого с низкой надеж-
ностью, но отмечать его «временный»
характер, включив в его состав рибонуклео-
Таблица 24.2. Белки репликации Е. coli
Белок
dna В
Праймаза
rер
ДНК-связы-
вающий
ДНК-гираза
Голофермент
ДНК-полиме-
разы III
ДНК-полиме-
раза I
ДНК-лигаза
Функция
Дает возможность
праймазе иницииро-
вать синтез РНК
Синтезирует РНК-за-
травки
Расплетает двойную
спираль
Стабилизирует одно-
цепочечные участки
Вводит суперспираль-
ные витки
Синтезирует ДНК
Удаляет затравку и
заполняет бреши
Соединяет концы
ДНК
Масса,
кДа
~250
60
65
74
400
>300
109
74
Число
моле-
кул в
клетке
20
100
50
300
20
300
300

тиды. Затем ДНК-полимераза I вырезает
эти короткие последовательности РНК-за-
травок и замещает их последовательностью
ДНК, синтезированной с высокой надеж-
ностью. Создается впечатление, что многие
детали, усложняющие механизм реплика-
ции ДНК, предназначены для обеспечения
чрезвычайно высокой точности. Генетиче-
ский анализ показывает, что частота оши-
бок
составляет
одну
на
10
9
-10
10
считанных
пар оснований.
24.24. Повреждения ДНК постоянно
репарируются
Поскольку множество химических и физиче-
ских агентов вызывает в ДНК повреждения,
во всех клетках имеются специальные меха-
низмы для исправления этих повреждений.
Основания в ДНК могут изменяться и те-
ряться, фосфодиэфирные связи остова мо-
гут разрываться, а две цепи могут попереч-
но сшиваться друг с другом. Эти поврежде-
ния образуются под действием ионизирую-
щей радиации, ультрафиолетового облуче-
ния и различных химических веществ.
Многие повреждения в ДНК поддаются ис-
правлению, так как генетическая информа-
ция записана в обеих цепях двойной спира-
ли. Благодаря этому информацию, утрачен-
ную одной из цепей, можно извлечь из
другой цепи.
Один из наиболее хорошо изученных ме-
ханизмов репарации - вырезание пиримиди-
нового димера (рис. 24.45), который обра-
зуется при действии на ДНК ультрафиоле-
тового света. Соседние пиримидиновые
остатки в одной цепи ДНК могут в этих ус-
ловиях образовать ковалентную сшивку.
Такой пиримидиновый димер не уклады-
вается в двойную спираль, так что реплика-
ция и экспрессия генов оказываются блоки-
рованными до тех пор, пока повреждение не
будет удалено.
В осуществлении этого процесса важную
роль играют четыре ферментативные актив-
ности (рис. 24.46). Первая из них - УФ-специ-
фичная эндонуклеаза - находит место повре-
Рис. 24.45. Модель димера урацила, обра-
зованного под действием уль-
трафиолетового облучения.
Тиминовый димер имеет при-
мерно такую же структуру.
ждения и вносит одноцепочечный разрыв
вблизи от димера, обычно с 5'-стороны.
Участок, содержащий димер, выпячивается
из двойной спирали, что позволяет ДНК-по-
лимеразе I (или другой подобной полимера-
зе) провести репарационный синтез в напра-
влении 5'—>3'. Затравкой при этом служит
3'-конец разорванной цепи, а матрицей - ин-
тактная комплементарная цепь. Затем
область, где расположен пиримидиновый
димер, вырезается под действием 5'—>
—>3'-нуклеазной активности ДНК-полиме-
разы. Наконец, новосинтезированная цепь
и остаток той же цепи ДНК соединяются
ДНК-лигазой. Другой путь репарации-фо-
тохимическое расщепление пиримидиново-
го димера. Почти все клетки содержат фо-
тореактивирующий фермент, который уз-
нает димер и расщепляет его на исходные
основания, используя энергию поглощенно-
го синего света.
24.25. Рак кожи при золотистой ксеродерме
обусловлен нарушением нормальной
репарации ДНК
Золотистая ксеродерма (Xeroderma
pigmentosum) - редкое заболевание кожи
у людей. Оно наследуется как аутосомный
рецессивный признак. У гомозиготных
больных кожа крайне чувствительна к сол-
нечному и ультрафиолетовому свету. Серь-
езные поражения кожи наблюдаются уже
в детстве, а с возрастом они принимают все
более тяжелый характер. Кожа становится
сухой, и дерма в значительной степени атро-
24. ДНК: генетическая роль,
структура и репликация
35

Ксеродерма -
от греч. слов, означающих «сухая кожа». Этот термин был впервые использован
F. Hebra и М. Kaposi в 1874 г. для описания «пергаментной кожи» и аномаль-
ной пигментации, наблюдавшихся у одного из больных.
фируется. Появляются кератозы, веки по-
крываются рубцами, поражается роговица.
Обычно во многих местах возникает рак ко-
жи. Многие больные погибают, не достиг-
нув 30 лет, от метастазов этих злокаче-
ственных опухолей кожи.
В ДНК человека, как и у E.coli, под дей-
ствием ультрафиолетового света образуют-
ся пиримидиновые димеры. Более того, ме-
ханизмы репарации у человека и у E.coli,
по-видимому, сходны. Изучение фибробла-
стов кожи больных золотистой ксеродер-
мой показало, что одна из форм этой болез-
ни сопровождается биохимическим наруше-
нием. В нормальных фибробластах поло-
вина пиримидиновых димеров, образовав-
шихся под действием ультрафиолетового
облучения, вырезается менее чем за сутки.
В фибробластах же, полученных от больных
золотистой ксеродермой, за тот же проме-
жуток времени вырезания димеров почти не
наблюдается. Какой этап репарации нару-
шен? Ответ был получен путем определения
молекулярной массы цепей ДНК из фибро-
бластов, облученных ультрафиолетовым
светом. В нормальных клетках в течение не-
скольких часов после облучения происходит
заметное снижение молекулярной массы
одноцепочечной ДНК. Это снижение моле-
кулярной массы обусловлено первой реак-
цией процесса репарации, а именно расще-
плением цепи ДНК рядом с пиримиди-
новым димером. После УФ-облучения кле-
ток золотистой ксеродермы, наоборот, сни-
жения молекулярной массы не происходит.
Следовательно, это кожное заболевание,
возможно, вызвано инактивацией эндону-
клеазы, которая гидролизует остов ДНК ря-
дом с пиримидиновым димером. Тяжелые
клинические последствия этого фермента-
тивного нарушения свидетельствуют об ис-
ключительной важности процессов репара-
ции
ДНК.
24.26. ДНК содержит тимин вместо урацила,
что делает возможной репарацию
дезаминированного цитозина
Цитозин в ДНК спонтанно дезаминируется
с измеримой скоростью, образуя урацил.
36
Часть IV.
Информация
Дезаминирование цитозина является потен-
циально мутагенным, так как образующий-
ся урацил спаривается с аденином, и, следо-
вательно, одна из дочерних цепей будет
содержать AU-пару оснований вместо ис-
ходной GC-пары:
Эта мутация исправляется под действием
репарационной системы, узнающей чуже-
родный урацил в молекуле ДНК
(рис. 24.47). Прежде всего урацил-
ДНК—гликозидаза гидролизует гликозид-
ную связь остатка урацила с дезоксирибо-
зой. На этом этапе остов ДНК остается
интактным, но одно основание отсутствует.
Затем специфическая эндонуклеаза узнает
этот дефект и расщепляет остов рядом с от-
сутствующим основанием. ДНК-полимера-
за I вырезает оставшийся дезоксирибозо-
фосфат и вставляет цитозин, комплемен-
тарный гуанину в неповрежденной цепи.
Наконец, репарированная цепь заделывает-
ся ДНК-лигазой.
В течение многих лет оставалось загад-
кой, почему в ДНК присутствует тимин, а не
урацил, ведь оба основания спариваются
с аденином. Единственное различие между
ними - метильная группа тимина на месте
атома водорода при С-5 в урациле. Почему
это метилированное основание использует-
ся в ДНК, но не в РНК? Напомним, что на
метилирование дезоксиуридилата с образо-
ванием дезокситимидилата расходуется
много энергии (разд. 22.16). Открытие срав-
нительно недавно активной системы, репа-
рируюшей дезаминирование цитозина, слу-
жит убедительным ответом на эту загадку.
Урацил-ДНК—гликозидаза не удаляет
тимина из ДНК. Таким образом, метильная
группа тимина служит меткой, позволяю-
щей отличать его от дезаминированного ци-
тозина. Если бы этой метки не было, ура-
цил, стоящий на правильном месте, было бы
невозможно отличить от урацила, образо-
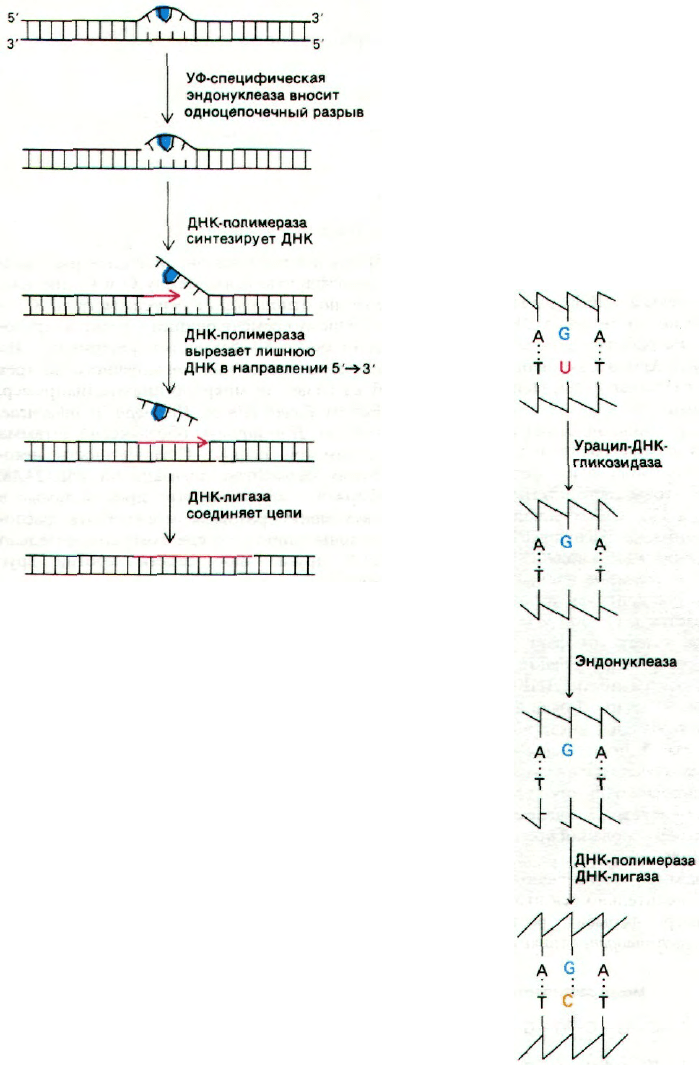
Рис. 24.46. Репарация участка ДНК, со-
держащего тиминовый димер,
в результате последовательно-
го действия специфической эн-
донуклеазы, ДНК-полимеразы
и ДНК-лигазы. Тиминовый ди-
мер показан синим цветом,
а новосинтезированный уча-
сток ДНК - красным. [На-
nawalt P.C, Endeavor, 31, 83
(1972).]
вавшегося в результате дезаминирования.
Дефект остался бы незамеченным, и в одной
из дочерних молекул ДНК неизбежно про-
изошло бы мутационное замещение одной
GC-пары на AU-пapy. Система репарации,
которая выискивает урацилы и оставляет
тимины, подавляет такие мутации. По всей
вероятности, тимин используется в ДНК
вместо урацила для увеличения надежности
генетической информации. В противопо-
ложность этому РНК не репарируется, и
в ней используется урацил, так как он пред-
ставляет собой менее дорогой строи-
тельный блок.
24.27. Рестриктирующие эндонуклеазы
совершили переворот в анализе ДНК
Ферменты рестрикции - эндонуклеазы, спо-
собные узнавать определенные последова-
тельности оснований в двухспиральной
ДНК и расщеплять обе цепи. Эти исключи-
тельно тонкие скальпели - великолепный
подарок природы биохимикам. Существо-
вание ферментов рестрикции позволило
проводить эксперименты, о которых нельзя
было даже и мечтать всего лишь несколько
лет назад. Они представляют собой незаме-
нимые инструменты для исследования
Рис. 24.47. Остатки уранила в ДНК выре-
заются и замещаются цитози-
ном - исходным основанием.
24. ДНК: генетическая роль,
структура и репликация
37
Палиндром (перевертыш) -
слово, предложение или стих, которые читаются одинаково слева направо
и справа налево.
Примеры:
Радар
То не ясли ломал, а молился енот.
А роза упала на лапу Азора.
Нажал кабан на баклажан.
Roma tibi subito motibus ibit amor.
Происходит от греческого слова palindromos - бегу назад.
структуры хромосомы, определения после-
довательности нуклеотидов в очень
длинных молекулах ДНК, выделения генов
и получения новых молекул ДНК для кло-
нирования. Разработку всех этих методов
начали Вернер Арбер, Гамилтон Смит и Дэ-
ниел Натанс (Werner Arber, Hamilton Smith,
Daniel Nathans).
Рестриктирующие эндонуклеазы обнару-
живаются у самых различных прокариот.
Биологическая роль этих ферментов со-
стоит в том, чтобы расщеплять чужеродные
молекулы ДНК. Собственная клеточная
ДНК при этом не расщепляется, так как
участки, узнаваемые своими ферментами
рестрикции, у нее метилированы. Взаимос-
вязь между ресткрикцией и модификацией
рассматривается в гл. 30 (разд. 30.9). Важ-
ное значение имеет тот факт, что многие
ферменты рестрикции узнают специфиче-
ские последовательности ДНК длиной от
четырех до шести пар оснований и гидроли-
зуют фосфодиэфирные связи в обеих цепях
в этой области. Удивительная особенность
таких участков расщепления - их симметрия
относительно оси вращения второго поряд-
ка. Другими словами, узнаваемая последо-
вательность пар оснований представляет со-
бой палиндром.
Расщепляемые участки расположены сим-
метрично относительно оси второго поряд-
ка. Например, фермент рестрикции из
Streptomyces achromogenes узнает последова-
тельность
38
Часть IV.
Информация
В каждой цепи эта эндонуклеаза рвет фос-
фодиэфирную связь между G и С, дисталь-
ную по отношению к оси симметрии. К на-
стоящему времени очищено и охарактеризо-
вано более 80 ферментов рестрикции. Их
названия состоят из сокращенного до трех
букв названия микроорганизма (например,
Есо от E.coli, Hin от Haemophilus influenzae,
Нае от H.aeguptins), обозначения штамма
и римской цифры. Специфичность неко-
торых ферментов показана на рис. 24.48.
Обратите внимание, что производимые в
двух цепях разрывы могут быть распо-
ложены либо со сдвигом относительно
друг друга, либо строго против друг
друга.
Ферменты рестрикции используются для
расщепления молекул ДНК на опреде-
ленные фрагменты, которые более удобны
для анализа и манипулирования, чем ис-
ходная молекула. Например, EcoRI расще-
пляет кольцевую двухцепочечную ДНК ви-
руса SV-40 длиной 5,1 kb только в одном
месте, Нра - в четырех местах и Hind - в 11
местах. Кусок ДНК, образованный одним
ферментом рестрикции, можно специфиче-
ски расщепить на более мелкие фрагменты
с помощью другого фермента. Используя
несколько ферментов рестрикции, можно
картировать хромосомы (разд. 31.8). Более
того, набор фрагментов, полученных с по-
мощью ферментов рестрикции, может слу-
жить своего рода «отпечатком пальца»
для соответствующей молекулы ДНК. Не-
большие различия между сходными моле-
кулами ДНК можно легко выявить с по-
мощью электрофоретического разделения
их рестрикционных фрагментов. Для каж-
дого данного геля электрофоретическая
подвижность фрагмента ДНК обратно
пропорциональна логарифму числа пар ос-
нований (до определенного предела длины
фрагментов). Для разделения фрагментов
ДНК длиной до 1000 пар оснований ис-
пользуют полиакриламидный гель, а для

Рис. 24.48. Специфичность некоторых эн-
донуклеаз рестрикции. После-
довательности пар оснований,
узнаваемые этими фермента-
ми, имеют ось симметрии вто-
рого порядка. Две цепи ДНК
в этой области симметричны
относительно оси, обозначен-
ной зеленым овалом. (Одна
цепь сдвинута относительно
другой на 180°.) Места расще-
пления показаны красными
стрелками. Сокращенные на-
звания каждого фермента ре-
стрикции приведены справа от
последовательности, которую
он узнает.
разделения более длинных молекул более
пористый агарозный гель. Если ДНК со-
держит радиоактивную метку, полосы
можно выявить методом радиоавтографии.
В другом случае гель можно покрасить
бромистым этидием, который при связыва-
нии с двухспиральной ДНК флуоресцирует
ярким оранжевым светом. При использо-
вании этого способа можно легко увидеть
полосу, содержащую 50 нг ДНК
(рис. 24.49). Помимо чувствительности,
важное достоинство таких гелей - их высо-
кая разрешающая способность.
24.28. Последовательность нуклеотидов
в ДНК можно быстро определить
с помощью специфического химического
расщепления
Появление надежных методов определения
последовательности нуклеотидов в моле-
кулы ДНК облегчило также изучение
структуры ДНК и ее связи с экспрессией
гена. Метод химического расщепления, раз-
работанный Алланом Максамом и Уолте-
ром Гилбертом (Allan Maxam, Walter
Gilbert), основан на использовании ДНК,
меченной
32
Р по одному из концов одной
из цепей. Для введения
32
Р в 5'-гидро-
ксильный конец обычно используют поли-
нуклеотидкиназу. Меченую ДНК расщеп-
ляют предпочтительно по одному из четы-
рех нуклеотидов. Условия реакции подби-
рают таким образом, чтобы на каждую
цепь приходился в среднем один разрыв.
Рис. 24.49. Электрофоретическое разделе-
ние фрагментов, образующих-
ся при расщеплении ДНК
SV-40 тремя различными фер-
ментами рестрикции. Эти
фрагменты флуоресцируют
благодаря тому, что гель окра-
шен бромистым этидием. (Пе-
чатается с любезного разреше-
ния д-ра Jeffrey Sklar.)
24. ДНК: генетическая роль,
структура и репликация
39
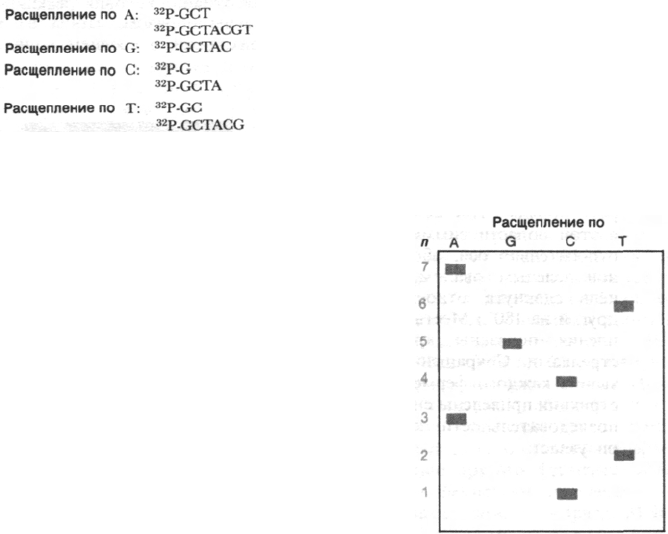
Частичное расщепление по каждому осно-
ванию дает набор радиоактивных фраг-
ментов, начинающихся
32
Р-меткой и кон-
чающихся одним из положений этого
основания. Например, если исследуемая
ДНК имеет последовательность
5'-
32
P-GCTACGTA-3'
то в результате специфического расщепле-
ния с 5'-стороны каждого из четырех осно-
ваний получатся следующие радиоак-
тивные фрагменты:
Затем эти фрагменты разделяют методом
электрофореза в полиакриламидном геле,
который дает возможность разделять мо-
лекулы ДНК, различающиеся по длине
всего лишь на один нуклеотид. Следую-
щий этап - радиоавтография этого геля.
Как показано на рис. 24.50, самая нижняя
полоса расположена на дорожке, соответ-
ствующей расщеплению по С, следую-
щая - на дорожке Т, затем еще одна - на
дорожке А. Следовательно, последователь-
ность первых трех нуклеотидов имеет вид
5'-СТА-3'. Если прочитать все семь полос
снизу вверх, получится последовательность
5'-CTACGTA-3'. Итак, радиоавтограф геля,
полученного после четырех различных реак-
ций химического расщепления, дает набор
полос, по которым можно непосредственно
прочитать нужную последовательность.
Как достигается специфическое расще-
пление ДНК? Для этого используют со-
единения, которые способны модифициро-
вать основание и затем отщеплять его от
остатка сахара (рис. 24.51). Пурины моди-
фицируют диметилсульфатом, метилирую-
щим гуанин по N-7 и аденин по N-3. Рас-
щепление гликозидной связи метилирован-
ного пурина легко достигается нагрева-
нием при нейтральном значении рН.
40
Часть IV.
Информация
В результате основание отделяется от со-
ответствующего остатка сахара. Затем
смесь нагревают в щелочи, что вызывает
расщепление сахарофосфатного остова
ДНК и удаление остатка сахара. В резуль-
тате образуются фрагменты, несущие на
конце метку. Эти фрагменты разделяют
в полиакриламидном геле и на радиоавто-
графе получают картину полосы различ-
ной интенсивности. Темные полосы со-
ответствуют фрагментам, образовавшимся
при расщеплении по гуанину, так как гуа-
нин метилируется гораздо быстрее, чем
аденин. В то же время гликозидная связь
в метилированном аденозине менее ста-
бильна, чем в метилированном гуанозине.
Поэтому при обработке разбавленной кис-
лотой после метилирования происходит
предпочтительное выщепление аденина
(получается дорожка А + G). Сравнение до-
рожки А + G с параллельной дорожкой
G на том же геле показывает, происходит
ли расщепление по А или по G (рис. 24.52).
Расщепление по цитозину и тимину прово-
дят гидразином. Остов затем расщепляют
Рис. 24.50. Схематическое изображение
геля, на котором показаны ра-
диоактивные фрагменты, обра-
зовавшиеся при специфиче-
ском расщеплении последова-
тельности 5'-
32
P-GCTACGTA-
3' по каждому из четырех осно-
ваний (дорожки A, G, С и Т).
Слева указано число нуклеоти-
дов (n) в каждом фрагменте.
Последовательность основа-
ний читается непосредственно
с геля снизу вверх.
