Страйер Л. Биохимия. Том 3
Подождите немного. Документ загружается.


ная», «суперспиральная», «суперскручен-
ная» и «сверхспиральная» - синонимы.
Кольцевую ДНК, совершенно лишенную
суперспиральных витков, называют релак-
сированной. Для того чтобы превратить ре-
лаксированную ДНК в суперспирализован-
ную, необходимо затратить определенную
энергию. Например, энергия, затрачивае-
мая на образование 15 суперспиральных
витков в одной молекуле ДНК вируса
SV-40 (ее контурная длина 1,7 мкм), соста-
вляет около 100 ккал/моль. Энергия напря-
жения суперспирализованной ДНК (энер-
гия суперспирализации) примерно пропор-
циональна квадрату числа суперспи-
ральных витков.
Суперспирализация, по-видимому, вы-
полняет две биологические функции. Во-
первых, суперспирализованная ДНК имеет
более компактную форму, чем релаксиро-
ванная ДНК такой же длины (рис. 24.23).
Суперспирализация может играть опреде-
ленную роль в упаковке ДНК. Во-вторых,
Суперспирализация может влиять на сте-
пень расплетания двойной спирали и, сле-
довательно, на ее взаимодействия с други-
ми молекулами. Точнее, отрицательная
суперспирализация может приводить к рас-
кручиванию двойной спирали. Интересно от-
метить, что почти все кольцевые молекулы
ДНК, встречающиеся в природе, отрица-
тельно суперспирализованы.
Важная характеристика замкнутой коль-
цевой ДНК - ее порядок зацепления L (от
англ. linking). Число L указывает, сколько
раз одна цепь пересекает другую цепь, если
их спроецировать на плоскость. Число
L должно быть целым. Кручение Т (от
англ. twisting) и величина суперспирализа-
ции W (от англ. writhe) связаны между со-
бой уравнением
L = W + Т,
т.е. находятся в обратной зависимости.
Порядок зацепления - топологическая ха-
рактеристика; она может изменяться, лишь
когда в одну или в обе цепи кольцевой
ДНК вносятся разрывы. Действительно,
были выделены ферменты, которые ката-
литически изменяют величину L. Катали-
тическую активность таких топоизомераз
легко выявить с помощью гель-электрофо-
реза, так как суперспирализованная ДНК
более компактна и поэтому имеет боль-
шую подвижность, чем релаксированная
ДНК (рис. 24.24).
Рис. 24.23. Электронные микрофотогра-
фии митохондриальной ДНК:
А - релаксированная кольцевая
форма; Б - суперспирализован-
ная кольцевая форма. (Печа-
тается с любезного разрешения
д-ра David Clayton.)
24.12. Открытие ДНК-полимеразы
Перейдем теперь к молекулярному меха-
низму репликации ДНК. Артур Корнберг
(Arthur Kornberg) и его коллеги в 1955 г.
начали поиск фермента, синтезирующего
ДНК. Вскоре этот поиск увенчался успе-
хом, главным образом потому, что при
планировании экспериментов были при-
няты три правильных решения, т.е. был
сделан правильный выбор между несколь-
кими возможностями.
1. Что представляют собой активиро-
ванные предшественники ДНК? Корнберг
и его коллеги сделали правильное предпо-
ложение, что активированные промежу-
точные продукты синтеза ДНК - дезоксири-
бонуклеозид-5'-трифосфаты. В основе это-
24. ДНК: генетическая роль,
структура и репликация
21

Рис. 24.24. Фотографии гелей, на которых
видна релаксация суперспира-
лизованной ДНК вируса SV-40.
Дорожка А - суперспирализо-
ванная ДНК с большим чис-
лом отрицательных витков.
При инкубации ДНК с топои-
зомеразой в течение 5 мин (Б)
и 30 мин (В) образуется ряд по-
лос с более низкой степенью су-
перспирализации. [Keller W.,
Proc. Nat. Acad. Sci., 72, 2553
(1975).]
го предположения лежали два соображе-
ния. Во-первых, пути биосинтеза пуринов
и пиримидинов приводят к образованию
нуклеозид-5'-фосфатов (а не нуклеозид-3'-
фосфатов). Во-вторых, активированным
промежуточным продуктом синтеза пиро-
фосфатной связи в таких коферментах, как
NAD
+
, FAD и СоА, является АТР.
2. Что может служить критерием синте-
за ДНК? Предполагалось, что абсолютное
количество ДНК, синтезированной в пер-
воначальных экспериментах, должно быть
весьма невелико, главным образом из-за
обилия нуклеаз. Поэтому нужен был ка-
кой-то чувствительный тест. Был разрабо-
тан такой тест с использованием радиоак-
тивных нуклеотидов-предшественников.
Включение этих предшественников в ДНК
обнаруживали путем измерения радиоак-
22
Часть IV.
Информация
тивности в осадке, полученном после обра-
ботки инкубационной смеси кислотой. В ос-
нове этого метода лежит тот факт, что
ДНК осаждается кислотами, например
трихлоруксусной кислотой, а нуклеотиды-
предшественники остаются в растворе.
3. Какие клетки следует выбрать для ис-
следования? После того как первона-
чальные эксперименты с экстрактами жи-
вотных клеток дали отрицательные резуль-
таты, выбор пал на бактерии Е. coli,
поскольку деление этих клеток происходит
всего лишь за 20 мин (время генерации), и,
следовательно, их можно выращивать
в больших количествах. Как и предполага-
лось, эта бактерия исключительно богата
ферментами, участвующими в синтезе
ДНК.
Экстракт Е. coli инкубировали с радиоак-
тивным дезокситимидин-5'-трифосфатом.
Радиоактивность этого
14
С-меченного
предшественника составляла 1•10
6
имп./
мин. Радиоактивность осадка, полученного
добавлением к инкубационной смеси кис-
лоты, составляла всего 50 имп./мин. Было
синтезировано лишь несколько пикомолей
ДНК, но этим было положено начало.
Корнберг писал: «Хотя количество нуклео-
тида, включившегося в состав нуклеиновой
кислоты, было ничтожным, оно было су-
щественно выше уровня фона. Мы попро-
бовали забить клин в эту узенькую щелку.
Рис. 24.25. Электронная микрофотогра-
фия молекул ДНК-полиме-
разы (сферические структуры),
связанных с молекулой ДНК
(тонкая нить). (Печатается
с любезного разрешения д-ра
Jack Griffith.)
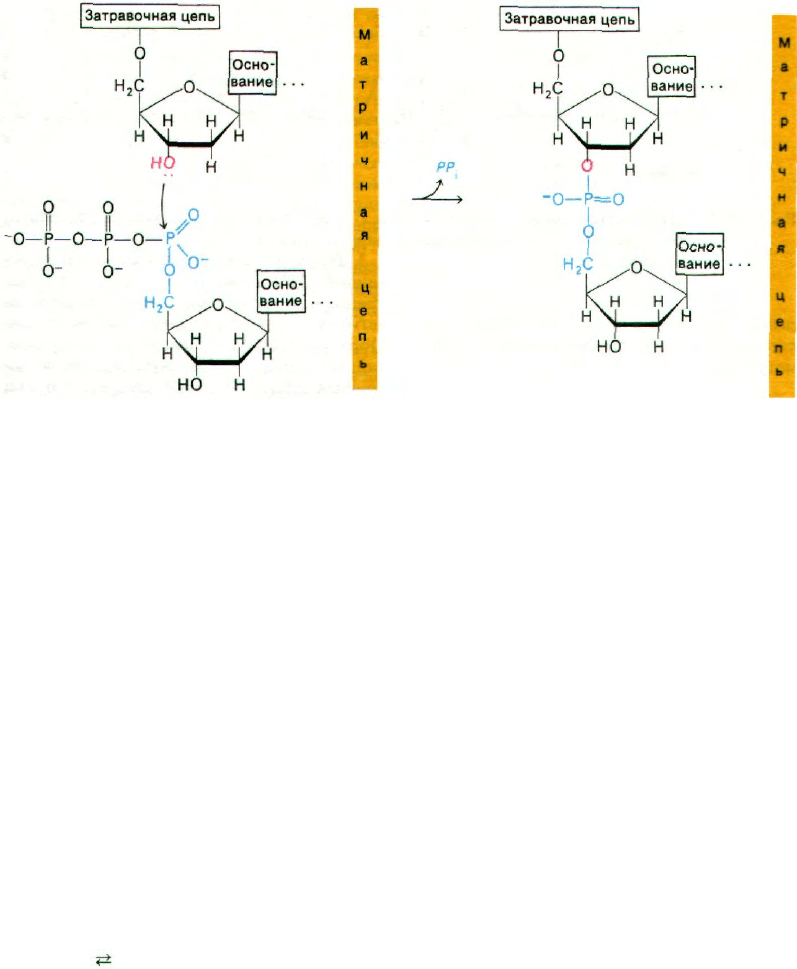
Рис. 24.26. Реакция элонгации цепи, ката-
лизируемая ДНК-полимера-
зой.
Молотком нам служила очистка фермен-
та - метод, отработанный при изучении
спиртового брожения».
Этот новый фермент был назван ДНК-
полимеразой (рис. 24.25). Теперь его назы-
вают ДНК-полимеразои I, так как с тех
пор были выделены другие ДНК-полиме-
разы. После десяти лет напряженной ра-
боты в лаборатории Корнберга ДНК-по-
лимераза I была очищена до гомогенного
состояния и детально охарактеризована.
Насколько велики были масштабы проде-
ланной работы, говорит тот факт, что для
получения 500 мг чистого фермента необ-
ходимо было взять 100 кг клеток E.coli.
ДНК-полимераза I - это единая полипеп-
тидная цепь с массой 109 кДа. Она катали-
зирует последовательное присоединение де-
зоксирибонуклеиновых звеньев к цепи ДНК:
(ДНК)
n
остатков
+
+ dNTP (ДНК)
n+1
+ РР
i
Для синтеза цепи ДНК ДНК-полимеразе
I необходимы следующие компоненты:
1. В среде должны присутствовать все
четыре дезоксирибонуклеозид-5'-трифосфа-
та: dATP, dGTP, dTTP и dCTP. В дальней-
шем мы будем обозначать эти дезоксири-
бонуклеозидтрифосфаты общим символом
dNTP. Кроме того, необходимы ионы
Мg
2+
.
2. ДНК-полимераза I присоединяет де-
зоксирибонуклеотиды к 3'-гидроксильному
концу предсуществующей цепи ДНК (или
РНК). Другими словами, необходима за-
травочная цепь, или затравка, со свобод-
ной 3'-гидроксильной группой.
3. Необходима матричная ДНК. Матри-
цей может служить как одно- так и двухце-
почечная ДНК. Двухцепочечная ДНК слу-
жит эффективной матрицей лишь в том
случае, если ее сахарофосфатный остов
разорван в одном или нескольких местах.
Реакция элонгации (удлинения) цепи, ка-
тализируемая ДНК-полимеразой, происхо-
дит путем нуклеофильной атаки 3'-ОН-кон-
цом матрицы ближайшего к рибозе атома
фосфора очередного дезоксирибонуклеозид-
трифосфата. В результате образуется фос-
фодиэфирный мостик и одновременно выс-
вобождается пирофосфат (рис. 24.26). По-
следующий гидролиз пирофосфата обеспе-
чивает дальнейшую полимеризацию. Такое
смещение общего состояния равновесия
было бы невозможно, если бы активиро-
ванными промежуточными продуктами
служили нуклеозиддифосфаты. Именно
в этом мы усматриваем убедительную
причину преобладания нуклеозидтрифос-
фатов по сравнению с дифосфатами в каче-
стве активированных предшественников
в биосинтетических реакциях. Элонгация
цепи ДНК происходит в направлении 5'—>
—>3' (рис. 24.27). За секунду одна молекула
ДНК-полимеразы I присоединяет пример-
но 10 нуклеотидов. Полимеризация процес-
24. ДНК: генетическая роль,
структура и репликация
23
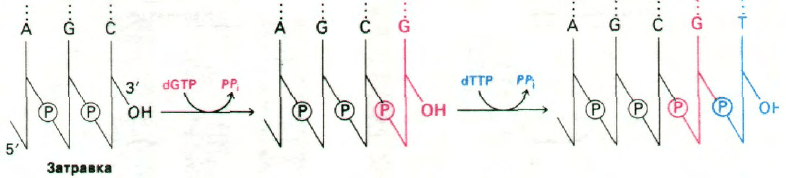
Рис. 24.27. ДНК-полимеразы катализи-
руют рост цепей ДНК в напра-
влении 5'—>3'.
сивна, т. е. фермент присоединяет много ну-
клеотидов, оставаясь связанным с одной
матрицей.
24.13. ДНК-полимераза получает
инструкции от матрицы
ДНК-лолимераза катализирует образова-
ние фосфодиэфирной связи только в том
случае, если основание очередного нуклео-
тида комплементарно соответствующему
основанию матричной цепи. Если же осно-
вание очередного нуклеотида не образует
уотсон-криковской пары с соответствую-
щим основанием матричной цепи, вероят-
ность образования ковалентной связи
очень низка. Следовательно, ДНК-полиме-
раза - фермент, направляемый матрицей.
Она была открыта первой из ферментов
такого типа.
Ряд экспериментов доказывает, что ДНК-
полимераза получает инструкции от ма-
трицы.
1. Первым доводом в пользу этого утвер-
ждения послужил тот факт, что значи-
тельный синтез ДНК идет только в при-
сутствии всех четырех дезоксирибонуклео-
зидтрифосфатов и матричной ДНК,
2. ДНК-полимераза может включать
в ДНК некоторые аналоги оснований. На-
пример, урацил или 5-бромурацил может
замещать тимин. Гипоксантин может заме-
щать гуанин. Способность аналогов заме-
щать основания высоко специфична. Со-
гласно правилу замещения, тот или иной
аналог может включаться лишь при усло-
вии, что он способен образовать уотсон-
криковскую пару с основанием, комплемен-
тарным замещаемому основанию. Так, ги-
поксантин может замещать G (но не А, Т
24
Часть IV.
Информация
и С), поскольку он образует подходящую
пару оснований с цитозином.
3. Нуклеотидный состав новосинтезиро-
ванной ДНК зависит от характера ма-
трицы, а не от относительного количества
четырех нуклеотидов-предшественников.
Образующаяся ДНК имеет тот же нуклео-
тидный состав, что и двухспиральная ма-
тричная ДНК. Из этого следует, что под
действием ДНК-полимеразы реплицируют-
ся обе цепи матричной ДНК.
4. Наиболее убедительным доводом слу-
жат данные о том, что ДНК фага φХ174,
реплицированная in vitro ДНК-полимера-
зой I, полностью инфекционна. Следова-
тельно, частота, с которой этот фермент
делает ошибки, очень низка.
24.14. ДНК-полимераза I исправляет
ошибки в ДНК
ДНК-полимераза обладает еще одним ви-
дом ферментативной активности: в опреде-
ленных условиях она способна расщеплять
цепи ДНК. ДНК-полимераза постепенно
гидролизует цепь ДНК с 3'-гидроксильно-
го конца. При этом отщепляются монону-
клеотиды. Таким образом, ДНК-полимера-
за I является также 3'—>5'-экзонуклеазой
(рис. 24.28). Удаляемый нуклеотид должен
иметь свободный 3'-ОН-конец и не должен
находиться в составе двойной спирали.
Является ли такая экзонуклеазная актив-
ность фермента нежелательным побочным
эффектом, или она каким-то образом уча-
ствует в биологическом действии ДНК-по-
лимеразы? Эксперименты с использова-
нием химически синтезированных полину-
клеотидов с некомплементарным остатком
на конце затравки показали, что 3'—>
—>5'-экзонуклеазная активность выпол-
няет в процессе полимеризации функцию ре-
дактирования. Рассмотрим полимер, пока-
занный на рис. 24.28, в котором последова-
тельность остатков dT образует двойную
спираль с более длинным полимером dA.
На 3'-конце этой poly(dT)-последователь-
ности имеется один остаток dC, который

не образует водородных связей, так как он
не комплементарен dA. При добавлении
ДНК-полимеразы и dTTP этот некомпле-
ментарный остаток dC отщепляется рань-
ше, чем начинается присоединение остат-
ков dT. Эксперименты с использованием
множества различных синтетических поли-
меров показали, что ДНК-полимераза
I всегда удаляет некомплементарные
остатки на конце затравки, прежде чем
продолжать полимеризацию. Если на конце
находится комплементарное основание и
в среде присутствуют активированные
предшественники, гидролиза практически
не происходит. Полимеризация предотвра-
щает гидролиз с 3'-конца.
По всей вероятности, репликация ДНК
идет с высокой точностью, так как спарива-
ние оснований проверяется дважды. В тех
случаях, когда пара оснований не вмещает-
ся в двойной спирали, полимеризация обы-
чно не идет. Однако, если на этом этапе
все-таки произойдет ошибка, она может
быть исправлена раньше, чем будет при-
соединен следующий нуклеотид. Таким
образом, ДНК-полимераза I проверяет ре-
зультат каждого проведенного акта поли-
меризации, прежде чем перейти к следую-
щему.
Кроме того, ДНК-полимераза I может
гидролизовать ДНК, начиная с 5'-конца це-
пи. Эта 5'—>3'-нуклеазная активность
(рис. 24.29) существенно отличается от об-
суждавшейся выше 3'—>5'-экзонуклеазной
активности. Во-первых, расщепляемая
связь должна находиться в двухспираль-
ном участке. Во-вторых, может происхо-
дить расщепление как концевой фосфодиэ-
фирной связи, так и связи, расположенной
на расстоянии нескольких нуклеотидов от
5'-конца (который может иметь свободную
или фосфорилированную гидроксильную
группу). В-третьих, 5'—>3'-нуклеазная ак-
тивность увеличивается, если одновремен-
но идет синтез ДНК. В-четвертых, ак-
тивный участок 5'—>3'-нуклеазной актив-
ности четко отделен от активных участков
полимеризации и 3'—>5'-гидролиза. ДНК-
полимеразу I можно расщепить протеоли-
тическими ферментами на фрагмент с мас-
сой 36 кДа, содержащий всю 5'—>
—>3'-нуклеазную активность, и фрагмент
с массой 75 кДа, содержащий всю полиме-
разную и всю 3'—>5'-экзонуклеазную ак-
тивности. Таким образом, ДНК-полимера-
за I содержит по меньшей мере два
Рис. 24.28. 3'—>5'-экзонуклеазная актив-
ность ДНК-полимеразы I.
Рис. 24.29. 5'—>3'-нуклеазная активность
ДНК-полимеразы I.
различных фермента в одной полипептид-
ной цепи. 5'—>3'-нуклеаза дополняет 3'—>
—>5'-экзонуклеазную активность, исправляя
ошибки другого рода. Например, 5'—>
—>3'-нуклеаза участвует в вырезании пири-
24. ДНК: генетическая роль,
структура и репликация
25

Рис. 24.30. ДНК-лигаза катализирует со-
единение двух цепей ДНК, вхо-
дящих в состав одной двухспи-
ральной молекулы.
Рис. 24.31. Ковалентный промежуточный
комплекс фермент—AMP.
мидиновых димеров, образующихся при
облучении ДНК ультрафиолетом (разд.
24.24). Более того, 5'—>3'-нуклеазная ак-
тивность играет ключевую роль в самой
репликации ДНК (разд. 24.19).
24.15. ДНК-лигаза соединяет
фрагменты ДНК
ДНК-полимераза I может присоединять
дезоксирибонуклеотиды к затравочной це-
пи, но она не способна катализировать со-
единение двух цепей ДНК или замыкание
одной цепи ДНК. Обнаружение кольцевой
ДНК указывало, что такой фермент дол-
жен существовать. В 1967 г. в нескольких
лабораториях одновременно была открыта
ДНК-лигаза - фермент, катализирующий
образование фосфодиэфирной связи между
двумя цепями ДНК (рис. 24.30). Фермент
этот активен при наличии свободной
ОН-группы на 3'-конце одной цепи ДНК и
26
Часть IV.
Информация
фосфатной группы на 5'-конце другой. Об-
разование фосфодиэфирной связи между
этими группами - эндергоническая реакция.
Следовательно, для реакции соединения це-
пей требуется источник энергии. У Е. coli
и других бактерий эту роль выполняет
NAD
+
, тогда как в клетках животных и за-
раженных бактериофагом клетках данная
реакция осуществляется за счет энергии
АТР.
Заслуживает внимания и еще один ас-
пект работы ДНК-лигазы: ДНК-лигаза не
может соединить две молекулы одноцепо-
чечной ДНК. Цепи ДНК, соединяемые
ДНК-лигазой, должны быть частью двух-
цепочечной молекулы ДНК. Исследования
модельных систем дают основание думать,
что ДНК-лигаза образует фосфодиэфир-
ную связь только в том случае, если вбли-
зи от места разрыва имеется хотя бы не-
сколько пар оснований. В действительно-
сти ДНК-лигаза заделывает одноцепо-
чечные разрывы в остове двухспиральной
ДНК. Этот процесс необходим для нор-
мального синтеза ДНК, для репарации по-
врежденной ДНК и для сращивания
(сплайсинга) цепей ДНК при генетической
рекомбинации.
Рассмотрим механизм этой реакции,
установленный Робертом Леманом (Robert
Lehman). ATP или NAD
+
вступают в реак-
цию с ДНК-лигазой и образуют ковалент-
ный комплекс фермент-AMP, в котором
AMP связан с ε-аминогруппой лизинового
остатка фермента фосфоамидной связью
(рис. 24.31). Остаток AMP активирует фос-
фатную группу на 5'-конце ДНК. Послед-
няя стадия - нуклеофильная атака активи-
рованного атома фосфора 3'-ОН-группой.
В результате образуется фосфодиэфирная
связь и освобождается AMP. Движущая
сила этой последовательности реакций - ги-
дролиз пирофосфата, отщепляющегося при
образовании комплекса фермент—адени-
лат. Таким образом, на образование фосфо-
диэфирной связи в остове ДНК расходуют-
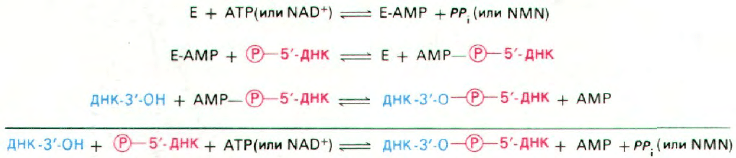
Рис. 24.32. Механизм реакции, катализи-
руемой ДНК-лигазой.
ся две богатые энергией фосфатные связи.
если источником энергии служит АТР.
24.16. Открытие ДНК-полимераз II и III
Мы видели, что ДНК-полимераза I может
синтезировать и репарировать ДНК in vitro.
Выполняет
ли она эти
функции
in
vivo?
Во-
прос вполне правомерный, так как фермент
не всегда способен осуществлять in vivo ту
реакцию, которую он катализирует in vitro.
Условия, существующие в клетке, могут от-
личаться от условий, используемых при по-
становке опытов in vitro, и, кроме того,
в клетке могут присутствовать другие фер-
менты. Действительно, в клетке E.coli
имеются по меньшей мере две другие ДНК-
полимеразы, названные полимеразами II
и III, которые были обнаружены примерно
через 15 лет после открытия ДНК-полиме-
разы I. Чем же объясняется такое запазды-
вание? Дело в том, что активность ДНК-по-
лимераз II и III маскировалась высокой
активностью полимеразы I.
Ситуация изменилась в 1969 г., когда Пау-
ла Де Лусия и Джон Кэрнс (Paula DeLucia,
John Cairns) выделили мутантную форму
E.coli, в экстракте которого обнаруживалось
от 0,5 до 1% нормальной полимеразной ак-
тивности ДНК-полимеразы I по сравнению
с обычными клетками. Этот мутант (обо-
значенный polA 1) размножался с такой же
скоростью, как и родительский штамм.
Кроме того, многие фаги размножались
в клетках polA 1 так же хорошо, как и в ро-
дительских клетках. Однако этот мутант го-
раздо быстрее погибал под действием уль-
трафиолетового облучения. К тому же
мутант polA 1 был более чувствителен к ле-
тальному действию химического мутагена
метилметансульфоната. Де Лусия и Кэрнс
сделали вывод, что репликация ДНК в клет-
ках полученного ими мутанта polA 1 идет
нормально, но репарация ДНК существенно
нарушена. Они предположили, что для син-
теза ДНК нужна какая-то другая полимера-
за, отличная от ДНК-полимеразы I.
Низкий фон активности полимеразы I
у мутанта polA 1 облегчил поиск новых
ДНК-полимераз. Вскоре в нескольких лабо-
раториях были выделены и охарактеризо-
ваны два таких фермента. ДНК-полимеразы
II и III подобны полимеразе I в следующих
отношениях:
1. Они катализируют направляемый ма-
трицей синтез ДНК из предшественников
дезоксирибонуклеозидтрифосфатов.
2. Для проявления их активности необхо-
дима затравка со свободной 3'-ОН-группой,
3. Синтез идет в направлении 5'—>3'.
4. Они обладают 3'—>5'-экзонуклеазной
активностью. ДНК-полимераза III (но не II)
является также 5'—>3'-нуклеазой.
Эти полимеразы различаются по характе-
ру предпочитаемых ими матриц. Для поли-
мераз II и III оптимальными матрицами
служат двухцепочечные ДНК, имеющие ко-
роткие одноцепочечные пробелы. Полиме-
раза I, наоборот, предпочитает протя-
женные одноцепочечные участки, сосед-
ствующие с двухспиральными участками.
Максимальные скорости катализа in vitro
для этих ферментов также различаются: по-
лимераза I присоединяет 10 нуклеотидов
в секунду, а полимераза II - 0,5 и полимераза
III - 150 нуклеотидов в секунду. В физиоло-
гически активном состоянии ДНК-полиме-
раза III ассоциирована с некоторыми други-
ми белками. Этот мультисубъединичный
комплекс называют голоферментом ДНК-
полимеразы III.
Какова роль этих полимераз in vivo?
Вскоре мы расскажем о том, что мультифер-
ментный комплекс, содержащий ДНК-поли-
меразу III, синтезирует большую часть но-
вообразующейся ДНК, а ДНК-полимераза
I удаляет затравку и заполняет пробелы.
Роль ДНК-полимеразы II пока не устано-
влена. Проведенные в последнее время био-
24. ДНК: генетическая роль,
структура и репликация
27
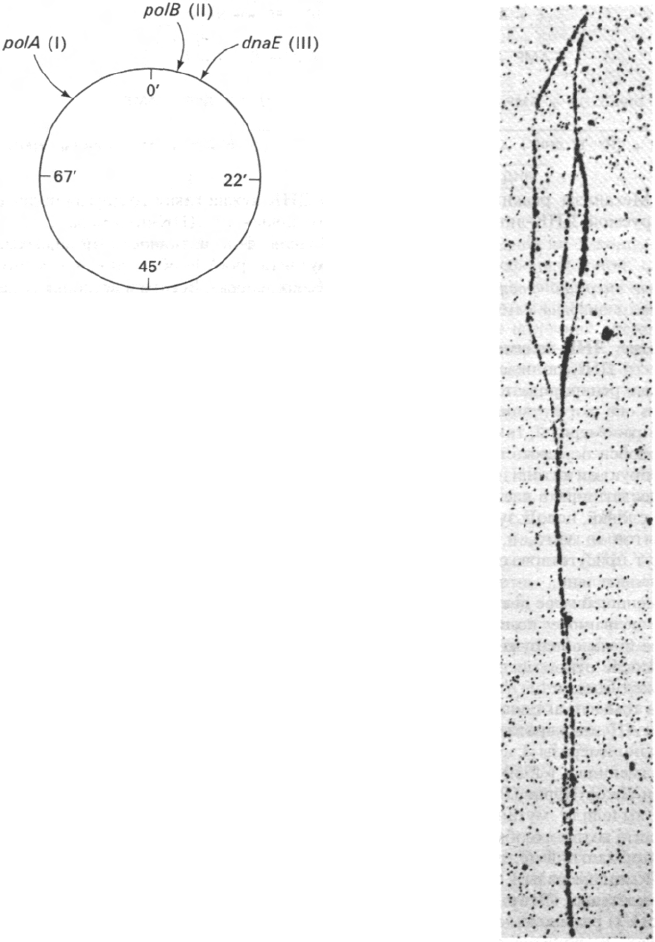
Рис. 24.33. Положение структурных генов
трех ДНК-полимераз Е. coli.
Ген ДНК-полимеразы I распо-
ложен в локусе polA, ген ДНК-
полимеразы II - в локусе polB
и ген ДНК-полимеразы III - в
локусе dnaE.
химические и генетические исследования по-
казали, что, кроме ДНК-полимераз I и II
и ДНК-лигазы, для репликации ДНК в клет-
ке E.coli необходимо более 10 белков. Пре-
жде чем рассмотреть взаимодействие этих
белков с ДНК, познакомимся в общих чер-
тах с репликацией на уровне целой хромо-
сомы.
24.17. Расплетание родительской ДНК
и синтез новой ДНК происходят
в репликационной вилке
Изображения ДНК во время репликации
были получены с помощью радиоавтогра-
фии и электронной микроскопии. При ра-
диоавтографии изображение образуется
в результате распада подходящего изотопа,
например трития. Испускаемые электроны
взаимодействуют с гранулами серебра фо-
тографической эмульсии. После проявления
пленки возникают черные точки. Метод ра-
диоавтографии имеет довольно низкую раз-
решающую способность - порядка несколь-
ких сотен ангстрем. Однако у этого метода
есть определенное преимущество: он позво-
ляет видеть лишь те молекулы, которые со-
держат метку. Для того чтобы сделать ДНК
видимой при радиоавтографии, в нее вклю-
чают тимин или тимидин, меченный три-
тием.
28
Часть IV.
Информация
Рис. 24.34. Радиоавтограф реплицирую-
щейся ДНК Е. coli. (Печатается
с любезного разрешения д-ра
John Gairns.)
На радиоавтографах и электронных ми-
крофотографиях видно, что реплицирую-
щаяся ДНК E.coli имеет форму замкнутого
кольца с внутренней петлей (рис. 24.34). Мо-
лекулы такой формы называют тета-струк-
турами, так как они напоминают греческую
букву θ (рис. 24.35). Тета-структуры показы-
вают, что молекулы ДНК сохраняют во вре-
мя репликации кольцевую форму. Разреше-
ние этого метода недостаточно велико,
чтобы различить свободные концы. Однако
очевидно, что длинных нитей одноцепочеч-
ной ДНК в молекуле нет. Таким образом,
эти изображения позволяют отвергнуть ме-
ханизм репликации, согласно которому це-
пи родительской ДНК сначала полностью
раскручиваются, и только затем исполь-
зуются в качестве матриц при синтезе новой
ДНК. Напротив, синтез новой ДНК сопря-
жен с одновременным раскручиванием роди-
тельской ДНК. Участок, где происходит
одновременное расплетание и синтез, назы-
вается репликационной вилкой.
24.18. Репликация ДНК начинается в строго
определенном месте и продолжается
последовательно в обоих направлениях
Начинается ли репликация ДНК E.coli
в произвольном месте хромосомы, или же
в хромосоме имеется определенный участок
инициации? Репликация ДНК - строго регу-
лируемый процесс, поэтому a priori кажет-
ся гораздо более вероятным, что она на-
чинается в определенном месте. Действи-
тельно, как показали работы по определе-
нию относительного числа различных генов
в условиях быстрого синтеза ДНК, реплика-
ция в клетках E.coli начинается в одном
определенном месте хромосомы. Рассмо-
трим два гена - а и b. Предположим, что ген
а расположен вблизи от точки начала репли-
кации, а ген b - вблизи от конца. Тогда ген
а будет реплицироваться намного раньше,
чем ген b. В быстро растущей культуре на
один ген b будет приходиться примерно два
гена а. Если же, наоборот, репликация ДНК
начинается в случайной точке, количество
генов а и b будет одинаковым. Относитель-
ное число генов было определено с по-
мощью метода гибридизации, который рас-
сматривается ниже (разд. 25.5). Результаты
этих экспериментов ясно показали, что от-
носительное число генов действительно за-
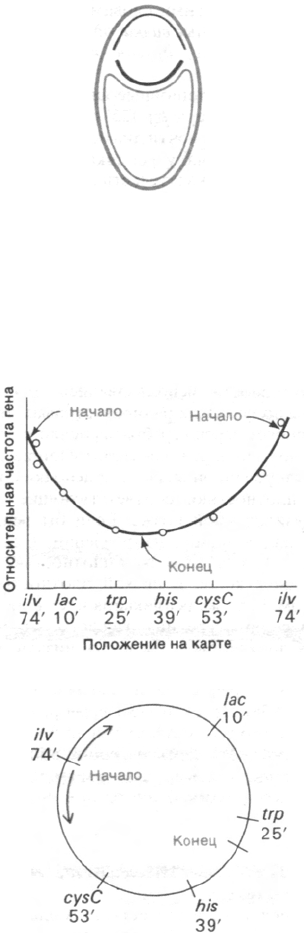
висит от их положения на карте (рис. 24.36).
Эти данные позволили сделать следующие
выводы.
1. Репликация начинается в строго опре-
деленном уникальном участке - вблизи гена
ilv, локализованного на 74' на стандартной
генетической карте E.coli.
2. Репликация идет одновременно в обо-
их направлениях с примерно одинаковой
Рис. 24.35. Схематическое изображение
кольцевой хромосомы Е. coli во
время репликации. Синими
линиями в этой тета-структуре
показана родительская ДНК,
красными - новообразованная
ДНК.
Рис. 24.36. Относительные количества
различных генов в условиях
быстрого синтеза ДНК у Е. coli
в зависимости от их положения
на генетической карте.
24. ДНК: генетическая роль,
структура и репликация
29
скоростью. Другими словами, существуют
две репликационные вилки: одна движется по
часовой стрелке, другая - против часовой
стрелки.
3. Две репликационные вилки встречают-
ся вблизи маркера trp (25' на генетической
карте) - в точке, почти диаметрально проти-
воположной началу репликации.
Еще одно доказательство двунаправлен-
ности репликации ДНК у E.coli было полу-
чено методом радиоавтографии. Для этого
вначале репликацию проводили в среде, со-
державшей тимин, меченный тритием до
умеренной удельной радиоактивности. Че-
рез несколько минут инкубации бактерии
перенесли в среду, содержавшую высокоме-
ченный тритием радиоактивный тимин.
Пробы с двумя различными уровнями ра-
диоактивности использовались для того,
чтобы получить на радиоавтографах два ти-
па цепочек зерен серебра: цепочки с низкой
плотностью зерен, соответствующие ДНК,
синтезированной вначале, и цепочки с высо-
кой плотностью, соответствующие ДНК,
синтезированной позже. Если бы реплика-
ция шла в одном направлении, были бы
видны цепочки с высокой плотностью зерен
на одном конце и низкой плотностью на
другом. Если же репликация идет в двух на-
правлениях, середина каждого отпечатка
ДНК должна была бы иметь низкую плот-
ность зерна, а концы - высокую (рис. 24.37).
Радиоавтографы дали наглядный ответ
(рис. 24.38). Цепочки зерен серебра (отпечат-
ки ДНК) во всех случаях имели более высо-
кую плотность зерен на обоих концах, чем
посередине, указывая тем самым, что репли-
кация хромосомы E.coli идет в двух напра-
влениях.
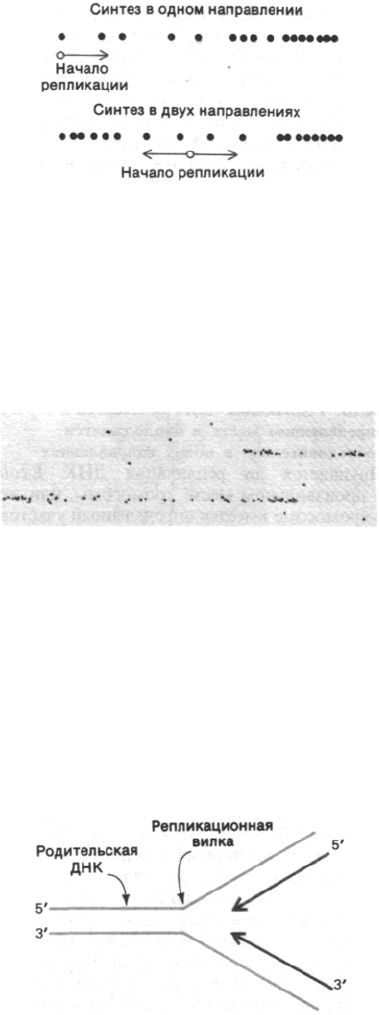
24.19. Одна цепь ДНК синтезируется
прерывисто
Вернемся к взаимодействию молекул при
репликации. В области репликационной
вилки обе цепи родительской ДНК служат
матрицами для синтеза новой ДНК. Напом-
ним, что цепи родительской ДНК антипа-
раллельны. Следовательно, общее направле-
ние синтеза ДНК должно быть 5'—>3' для
одной из дочерних цепей и 3'—>5' для другой
(рис. 24.39). Однако все известные ДНК-по-
лимеразы синтезируют ДНК в направлении
5'—>3', а не 3'—>5'. Как же тогда происходит
30
Часть IV.
Информация
Рис. 24.37. Предполагаемые результаты
радиоавтографии в случае
одно- и двунаправленной ре-
пликации, если бактерий пере-
носят со среды, содержащей ти-
мин с умеренной радиоактив-
ностью, на среду с высокора-
диоактивным тимином.
Рис. 24.38. Радиоавтограф ДНК Е. coli во
время репликации (условия
опыта указаны в подписи
к рис. 24.37). Наблюдаемое
распределение зерен серебра
показывает, что репликация
идет в двух направлениях.
[Prescott D. M., Kuempel P.L.,
Proc. Nat. Acad. Sci, 69, 2842
(1972).]
Рис. 24.39. При низком разрешении кажу-
щееся направление репликации
ДНК будет 5'—>3' для одной
дочерней цепи и 3'—>5' для
другой. На самом деле обе цепи
синтезируются в направлении
5'—>3', как показано на
рис. 24.40.
