Страйер Л. Биохимия. Том 3
Подождите немного. Документ загружается.


Рис. 32.5. Синтез UDP-NAG.
Рис. 32.6. Синтез UDP-NAM.
единиц и потому высокогидрофобный в от-
личие от UDP. По-видимому, именно бла-
годаря гидробофному характеру этого
С
55
-липида новообразованное углевод-пеп-
тидное звено преодолевает барьер прони-
цаемости, которым служит клеточная мем-
брана.
Вспомним, что другой высокогидро-
фобный переносчик - долихолфосфат - уча-
ствует в синтезе олигосахаридов, соста-
вляющих сердцевину (олигосахаридного
«ядра») гликопротеинов у эукариот
(разд. 29.31).
32.5. Синтез дисахарид-пептидного звена,
прикрепленного к липидному переносчику
Следующий этап - присоединение NAG
к остатку NAM в углевод-пептидном звене,
прикрепленном к липидному переносчику.
Донор активированного углевода UDP-
NAG вступает в реакцию с С-4 остатка NAM
и между этими сахарами образуется β-1,4-
гликозидная связь (рис. 32.9). Далее в ходе
АТР-зависимой реакции NH
4
+
амидирует
свободную α-карбоксильную группу D-глу-
таминовой кислоты в пептиде. Вслед за этим
на ε-аминогруппе остатка лизина в пептиде
выстраивается пентаглициновый мостик.
32. Оболочки бактериальных
клеток
221

Рис. 32.7. Синтез пентапептида на
UDP-NAM.
Рис. 32.8. Структура липидного перено-
счика, участвующего в биосин-
тезе клеточных стенок.
Рис. 32.9. Синтез дисахарид-пептидного
звена на липидном переносчи-
ке.
Этот пентапептид синтезируется путем по-
следовательного присоединения глициновых
остатков, доставляемых глицил-тРНК. Это
единственный случай, когда тРНК служит
донором аминокислот в ходе внерибосом-
ного синтеза пептида. На этом завершается
образование основной структурной еди-
ницы клеточной стенки.
32.6. Перенос дисахарид-пептидного звена
на растущую полисахаридную цепь
Дисахарид-пептидное звено переносится ли-
пидным переносчиком на нередуцирующий
конец растущей полисахаридной цепи. Реак-
222
Часть V.
Молекулярная физиология
ция протекает таким ооразом. Атом углеро-
да С-1 остатка NAM находится в активиро-
ванном состоянии, поскольку он связан
с липидным переносчиком пирофосфатной
связью. Поэтому он вступает в реакцию
с С-4 концевого остатка NAG растущей по-
лисахаридной цепи, образуя в итоге β-1,4-
гликозидную связь (рис. 32.10).
Липидный переносчик высвобождается
в форме пирофосфата и далее гидролизует-
ся до монофосфата специфической фосфата-
зой. Этот этап дефосфорилирования пред-
ставляет собой, по существу, регенерирова-
ние переносчика, способного акцептировать
углевод-пептидное звено от UDP. Известен
пептидный антибиотик бацитрацин, ингиби-
рующий биосинтез клеточных стенок путем
торможения этого этапа:
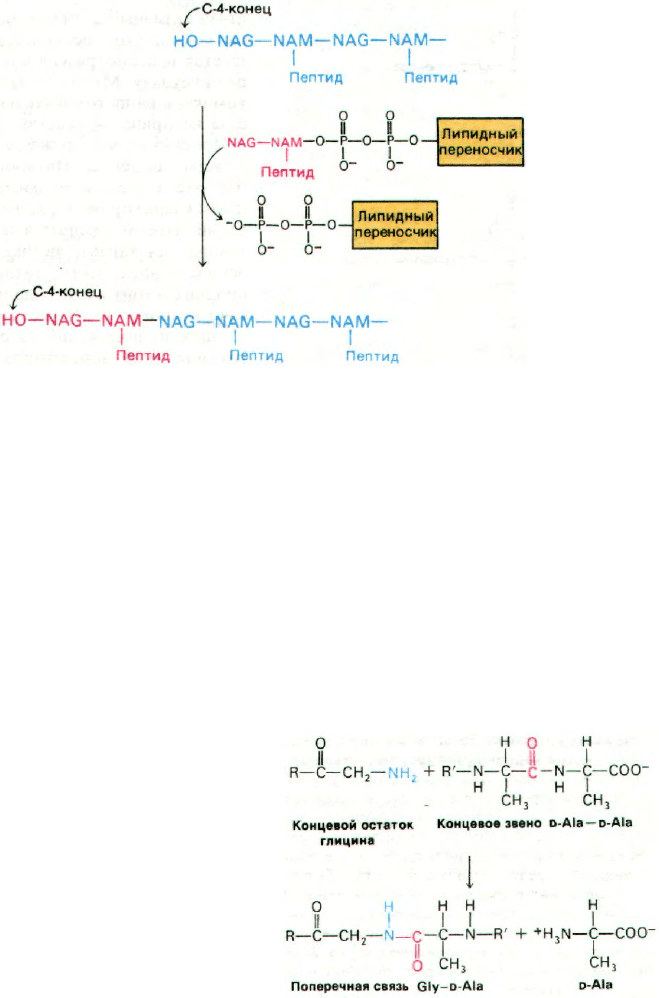
Рис. 32.10. Перенос дисахарид-пептидно-
го звена на растущую полиса-
харидную цепь.
32.7. Поперечные мостики между
полисахаридными цепями образуются
в реакции транспептидирования
В результате реакции транспептидирования
между полисахаридными цепями образуют-
ся поперечные сшивки, что приводит к фор-
мированию одной огромной молекулы, на-
поминающей по виду мешок. В ходе
транспептидирования концевая аминогруппа
одного пентаглицинового мостика атакует
пептидную связь между остатками
D-Ala-D-Ala другой пептидной единицы
(рис. 32.11). При этом образуется пептидная
связь между глицином и одним из остатков
D-аланина, а второй остаток D-аланина выс-
вобождается. Фермент, катализирующий
эту реакцию,- гликопептид-транспептидаза.
Обратите внимание, что синтез этой попе-
речной связи не требует расхода АТР: реак-
ция идет за счет свободной энергии, уже со-
держащейся в связи D-Аlа-D-Аlа. Формиро-
вание пептидной связи таким необычным
способом определяется, очевидно, тем, что
реакция протекает вне клетки, т.е. в остсут-
ствие АТР. Вспомните, что путем трансами-
нирования без использования АТР обра-
зуются пептидные связи при поперечной
сшивке нитей фибрина (разд. 8.21).
32.8. У грам-положительных бактерий
пептидогликан покрыт тейхоевой кислотой
Поверхность грам-положительных бакте-
рий состоит из тейхоевой кислоты, которая
представляет собой полимер остатков гли-
церола (или другого углевода, например ри-
битола), соединенных фосфодиэфирными
мостиками (рис. 32.12). Свободные гидрок-
сильные группы этерифицируются с алани-
ном или сахарами, в частности с глюкозой.
Тейхоевая кислота присоединяется к скелету
пептидогликана - последовательности
остатков NAG-NAM - фосфодиэфирной
связью. Удлинение цепей тейхоевой кис-
лоты происходит путем переноса глицерол-
фосфата от CDP-глицерола на свободную
концевую ОН-группу цепи. Остатки глю-
козы присоединяются к гидроксильным
группам скелета тейхоевой кислоты в ходе
реакции с UDP-глюкозой.
Рис. 32.11. Аминогруппа пентаглициново-
го мостика атакует пептидную
связь между двумя остатками
D-Ala; в результате форми-
руется поперечная связь (сшив-
ка).
32. Оболочки бактериальных
клеток
223

Рис. 32.12. Строение тейхоевой кислоты.
32.9. Пенициллин вызывает гибель
растущих бактерий, ингибируя синтез
клеточных стенок
Пенициллин был открыт в 1928 г. Алексан-
дером Флемингом (Alexcander Fleming) до-
вольно случайно.
При работе с различными штаммами стафи-
лококка часть чашек с культурами откладыва-
ли в лабораторную коллекцию и время от
времени просматривали. Поскольку, когда
чашки просматривали, их приходилось откры-
вать, в чашки неизбежно попадали из воздуха
различные микроорганизмы. Обратили внима-
ние на то, что вокруг большой колонии пророс-
шей плесени колонии стафилококка стали про-
зрачными и явно подвергались лизису.
Плесень пересеяли и далее стали проводить
предварительное изучение того бактериологи-
ческого вещества, которое, очевидно, синтези-
ровалось плесенью и диффундировало в окру-
жающую среду. Оказалось, что бульон,
в котором на протяжении 1-2 недель при ком-
натной температуре культивировали плесень,
приобретал выраженные ннгибирующие, бак-
терицидные и бактериолитические свойства
в отношении многих распространенных пато-
генных бактерий.
Далее было обнаружено, что экстракт из
плесени Pinicillium при введении животным
не оказывал заметного токсического дей-
ствия. Это послужило стимулом для даль-
нейших исследований. Однако, когда Фле-
минг попытался сконцентрировать и очи-
224
Часть V.
Молекулярная физиология
стить активный антибиотик, по его словам,
оказалось, что «пенициллин легко разру-
шается, и, несмотря на все усилия, мы потер-
пели неудачу. Мы были бактериологи, а не
химики, и наши относительно простые при-
емы не принесли успеха».
Прошло 10 лет, прежде чем к пеницилли-
ну вернулись снова. Патолог Хоуард Флори
(Howard Florey) и биохимик Эрнст Чейн
(Ernst Chain) провели ряд глубоких исследо-
ваний, итогом которых явилось выделение,
химическая характеристика и клиническое
использование этого антибиотика. Пени-
циллин состоит из тиазолидинового кольца,
сочлененного с β-лактамным кольцом,
в одном из положений которого находится
тот или иной заместитель (R), присоеди-
ненный с помощью пептидной связи. В бен-
зилпенициллине, например, R является бен-
зильной группой (рис. 32.13 и 32.14). Эта
структура может подвергаться различным
трансформациям, что служит причиной ла-
бильности пенициллина, с которой впервые
столкнулся Флеминг. Особенно неустойчи-
во β-лактамное кольцо. Как будет показано
ниже, это свойство имеет прямое отношение
к антибиотической активности пеницил-
лина.
В 1957 г. Джошуа Ледерберг (Joshua
Lederberg) показал, что бактерии, в обычных
условиях чувствительные к пенициллину,
могут расти в присутствии этого антибиоти-
ка, если используется гипертоническая сре-
да. Выращенные таким образом микроорга-
низмы, так называемые протопласты, ли-
Рис. 32.13. Высокореакционноспособный
участок пенициллина - пептид-
ная связь β-лактамного кольца.
В положении R могут стоять
различные заместители (вариа-
бельная группа); в бензилпени-
циллине R - бензильная группа.
шены клеточных стенок и потому при
переносе в обычную среду подвергаются ли-
зису. Отсюда был сделан вывод, что пени-
циллин препятствует синтезу клеточных сте-
нок бактерий. В 1965 г. Джеймс Парк
и Джек Стромингер (James Park, Jack
Strominger) независимо друг от друга при-
шли к выводу, что пенициллин блокирует
последний этап биосинтеза, а именно обра-
зование поперечных сшивок.
32.10. Пенициллин блокирует синтез
клеточных стенок путем ингибирования
реакции транспептидирования
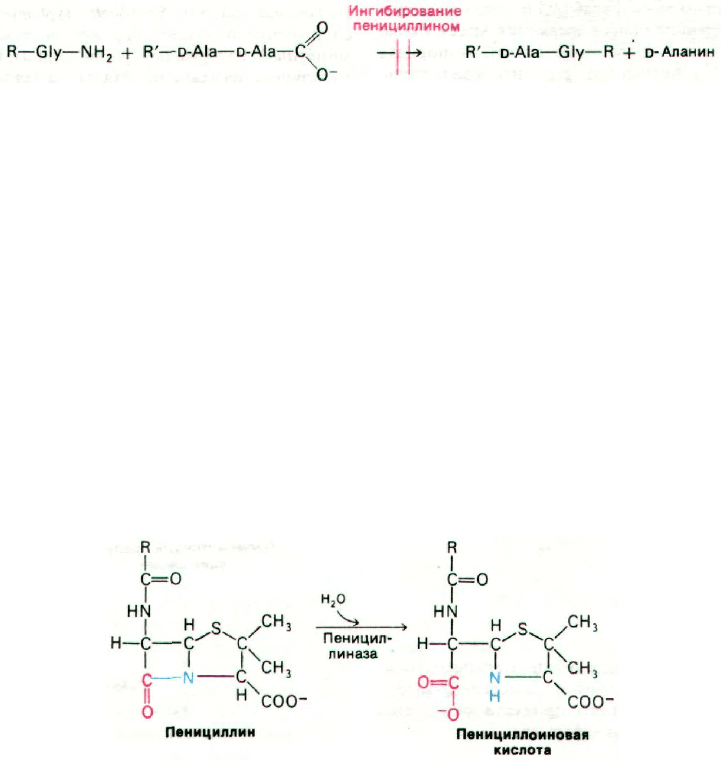
Пенициллин ингибирует транспептидазу,
поперечно сшивающую цепи протеоглика-
на:
При нормальном течении реакции транс-
пептидаза образует в качестве промежуточ-
ного продукта ацильное производное с остат-
ком D-аланина в предпоследнем положении
пептида (рис. 32.15). Этот промежуточный
продукт взаимодействует далее с амино-
группой концевого глицина другого пепти-
да. Как показали недавно проведенные ис-
следования, пенициллин ингибирует транс-
пептидазу путем образования ковалентной
связи с остатком серина в активном центре
фермента (рис. 32.16). Комплекс пеницилли-
ноил-фермент не подвергается деацилирова-
нию. В результате ингибирование транспеп-
тидазы пенициллином оказывается необра-
тимым.
Почему пенициллин является столь эф-
фективным ингибитором транспептидазы?
С помощью молекулярных моделей было
выявлено, что пенициллин сходен с одним из
субстратов фермента, а именно с ацил-D-
Ala-D-Ala (рис. 32.17). Кроме того, четырех-
членное β-лактамное кольцо пенициллина
имеет напряженную конформацию, вслед-
ствие чего пептидная связь в нем становится
высокореакционноспособной. В сущности,
пенициллин имеет, по-видимому, структуру
переходного состояния нормального суб-
страта этого фермента. Другими словами.
пенициллин - аналог переходного состояния.
Любопытно сравнить пенициллин с дру-
гими необратимыми ингибиторами фермен-
тов. Стабильный, неактивный пеницилли-
ноил-ферментный комплекс совершенно
аналогичен фосфорил-ферментному ком-
плексу, образующемуся при взаимодействии
органических фторфосфатов с ацетилхолин-
эстеразой или сериновыми протеиназами.
Однако специфичность пенициллина намно-
го выше, чем у фторфосфатных ингибито-
ров. Мишень действия пенициллина очень
строго задана его структурным сходством
с концевым участком D-Аlа-D-Аlа новообра-
зующейся цепи пептидогликана. След-
ствием этой исключительной специфичнос-
ти является низкая токсичность пеницилли-
на, столь ценная при клиническом использо-
вании. В организме человека нет ни одного
фермента, распознающего D-Ala-D-Ala, а по-
тому пенициллин не может помешать рабо-
те наших ферментов.
32.11. Некоторые бактерии резистентны
к пенициллину, так как синтезируют
разрушающий его фермент
Ряд бактерий синтезирует пенициллиназу -
фермент, способный расщеплять амидную
связь в β-лактамном кольце пенициллина
с образованием пенициллоиновой кислоты,
лишенной антибиотической активности:
32. Оболочки бактериальных
клеток
225

Рис. 32.14. Модель бензилпенициллина.
Был выделен целый ряд близких по струк-
туре пенициллиназ, имеющих массу около
30 кДа и высокое число оборотов (порядка
10
3
с
-1
). Активность фермента в значитель-
ной мере зависит от природы R-группы,
присоединенной к β-лактамному кольцу пе-
нициллина. Поэтому полусинтетические пе-
нициллины с R-группами, защищающими
их от действия пенициллиназы, представ-
ляют большую ценность для клинических
целей.
Ген, кодирующий пенициллиназу, локали-
зован в различных плазмидах (разд. 31.6).
Эти внехромосомные генетические эле-
менты у некоторых видов бактерий спо-
собны быстро появляться и исчезать. В ряде
бактериальных штаммов пенициллиназа
является индуцируемым ферментом. По-ви-
димому, пенициллиназа возникла в ходе эво-
люции как механизм детоксикации, посколь-
ку она свойственна только микроорганиз-
Рис. 32.15. В ходе реакции транспептиди-
рования в качестве промежу-
точного продукта образуется
ацил—фермент.
226
Часть V.
Молекулярная физиология
мам, клеточная стенка которых образована
пептидогликаном. Судя по тому, что утрата
гена пенициллиназы не вызывает поврежде-
ния клетки в отсутствие антибиотика, у фер-
мента, видимо, нет иной функции, кроме
инактивации пенициллина. К тому же
имеется хорошая корреляция между сте-
пенью устойчивости к действию пеницил-
лина и общей пенициллиназной актив-
ностью.
32.12. Грам-отрицательные бактерии
окружены наружной мембраной,
богатой липополисахаридами
Как уже упоминалось, клеточная оболочка
грам-отрицательных бактерий устроена бо-
лее сложно, чем клеточная оболочка грам-
положительных бактерий. У грам-отрица-
тельных микроорганизмов (например,
Escherichia coli или Salmonella typhimurium)
слой пептидогликана окружен наружной
мембраной, содержащей фосфолипиды, бел-
ки и липополисахариды. Эта наружная мем-
брана, подобно плазматической, имеет
структуру бислоя. Итак, грам-отрица-
тельные бактерии имеют две мембраны,
а грам-положительные - одну. Особенность
грам-отрицательных бактерий состоит так-
же в наличии водной прослойки между плаз-
матической мембраной и пептидогли-
кановым слоем. В этом периплазматичес-
ком пространстве содержится много бел-
ков, участвующих в связывании и транспор-
те сахаров и других питательных веществ
(разд. 37.20).
Липополисахариды (ЛПС) наружной мем-
браны представляют собой крайне необыч-
ные соединения, молекулы которых состоят
из трех частей: липида А, олигосахаридов
сердцевины («ядра») и О-боковой цепи

Рис. 32.16. Образование пенициллином
ферментного комплекса, обла-
дающего неограниченной ста-
бильностью.
Рис. 32.17. Конформация пенициллина
в области высокореакционно-
способной пептидной связи (А)
сходна с предполагаемой кон-
формацией структуры R-D-
Ala-D-Ala (Б) в переходном
состоянии при протекании
реакции транспептидирования.
[Lee В., J.Mol.Biol., 61, 464
(1971).]
(рис. 32.18). Липид А - это гидрофобная
часть большой (10 кДа) амфипатической
молекулы. Он включает шесть цепей насы-
щенных жирных кислот, присоединенных
к двум остаткам глюкозамина. Эти
ацильные цепи составляют примерно поло-
вину наружного слоя наружной мембраны.
Внутренний слой вместо цепей жирных кис-
лот содержит фосфолипиды (рис. 32.19). Да-
лее в молекуле липополисахарида идет
Рис. 32.18. Молекула липополисахарида
состоит из трех частей: липи-
да А, олигосахаридного «ядра»
и О-боковой цепи. Здесь пока-
зана последовательность саха-
ров, характерная для Salmonella
typhimurium. Сокращения:
Abe - абеквоза; EtN - этанол-
амин; Gal-галактоза; Glc-
глюкоза; GlcN - глюкоза-
мин; GlcNAc - N-ацетил-
глюкозамин; Hep - гептуле-
за; KDO - 2-кето-3-дезокси-
октонат; Man - манноза;
Rha - L-рамноза.
область олигосахаридного «ядра». Здесь де-
сять углеводных единиц вынесено кнаружи
от липида А; еще более наружно распола-
гается О-боковая цепь, состоящая из боль-
шого числа повторяющихся тетрасаха-
32. Оболочки бактериальных
клеток
227

Рис. 32.19. Молекулы липополисахаридов
локализованы в наружном
слое, тогда как фосфолипиды -
во внутреннем слое наружной
мембраны.
Рис. 32.20. Формулы ряда редких сахаров,
входящих в состав липополиса-
харидов.
ридных единиц. В этих двух областях
содержится несколько крайне редких в при-
роде углеводов, а именно 8-углеродный са-
хар 2-кето-3-дезоксиоктонат (КДО, KDO),
7-углеродный сахар гептоза, а также 6-угле-
родные сахара L-рамноза и абеквоза, в мо-
лекуле которых в положении С-6 стоит
—СН
3
вместо —СН
2
ОН (рис. 32.20). В от-
личие от ацильной части липида А олигоса-
228
Часть V.
Молекулярная физиология
хариды сердцевины и О-боковая цепь
высоко гидрофильны. Ряд сахаров в липо-
полисахариде фосфорилирован, и потому
молекула полисахарида в целом имеет от-
рицательный заряд.
Липополисахариды синтезируются в плаз-
матической мембране и затем транспорти-
руются в наружную мембрану. Сначала син-
тезируется липид А, а затем путем последо-
вательного присоединения сахаров (донора-
ми активированных сахаров служат соеди-
нения типа UDP-глюкозы или UDP-галак-
тозы) образуется полисахаридное «ядро».
О-боковая цепь собирается иным путем.
Ее повторяющееся тетрасахаридное зве-
но синтезируется на том же самом
С
55
-изопреноидном липидном переносчике,
который участвует в синтезе пептидоглика-
на (разд. 32.4). Растущая цепь таких единиц
удлиняется путем переноса олигосахарида
с одной молекулы переносчика на тетраса-
харидное звено, связанное с другой молеку-
лой переносчика (рис. 32.21). Аналогичный
способ удлинения имеет место при синтезе
жирных кислот (разд. 17.18) и белков
(разд. 27.16). Наконец, О-боковая цепь при-
соединяется к концу олигосахаридного
«ядра». По-видимому, повторяющийся те-
трасахарид О-боковой цепи образуется во
внутреннем слое плазматической мем-
браны, затем переносится в наружный слой
и там присоединяется к растущей цепи. Пол-
ностью сформированная молекула липопо-
лисахарида транспортируется из плазмати-
ческой мембраны в наружную, по-видимо-
му, в тех участках, в которых эти структуры
соприкасаются.
32.13. Благодаря разнообразию
О-боковых цепей грам-отрицательные
бактерии противостоят защитным силам
организма-хозяина
Липополисахариды содержат в высшей
степени необычные сахара и своеобразные
химические связи. Что дает такая вычур-
Рис. 32.21. Способ удлинения О-боковых
цепей.

Рис. 32.22. Изменение структуры О-бо-
ковых цепей бактерии Sal-
monella при заражении уме-
ренным фагом Р22.
ность? Ключ к решению этого вопроса был
получен при изучении мутантов, дефектных
по синтезу липополисахаридов. Липид А
и прилегающие к нему КДО олигосахарид-
ного «ядра», по-видимому, абсолютно необ-
ходимы для выживания. Цепи насыщенных
жирных кислот вносят определенный вклад
в барьерную функцию наружной мембраны,
благодаря которой периплазматические
белки не выходят наружу, а наиболее ядо-
витые вещества не проникают в клетку. Так,
пенициллин довольно плохо проходит
сквозь клеточную мембрану грам-отрица-
тельных бактерий. Кроме того, липид
А придает наружной мембране жесткость.
В отличие от липида А и олигосахаридного
«ядра» О-боковые цепи не являются жиз-
ненно важными. Например, любимый мно-
гими биохимиками штамм К12 Е. coli вооб-
ще лишен О-боковых цепей. Все же
в естественных условиях грам-отрица-
тельные бактерии почти всегда имеют О-бо-
ковые цепи. Полисахаридная наружная обо-
лочка придает поверхности бактериальных
клеток высокую степень гидрофильности,
что повышает их устойчивость к фагоцитозу
клетками хозяина. О-боковые цепи полиса-
харидов крайне разнообразны; показанная
на рис. 32.18 структура - это только одна из
многих известных. Грам-отрицательные
бактерии способны быстро мутировать, из-
меняя таким путем состав своих О-боковых
цепей. В результате популяция клеток хозя-
ина, встретившись с новой для себя поверх-
ностной структурой, не имеет на первых по-
рах достаточного количества антител про-
тив О-боковых цепей. Следовательно, ви-
доизменяя О-боковые цепи, микроорганизмы
на один шаг опережают систему иммуноло-
гической защиты организма-хозяина.
Источником генетической информации,
необходимой для изменения О-боковых це-
пей, может служить включение умеренного
фага в грам-отрицательные бактерии. На-
пример, фаг Р22 обеспечивает бактериаль-
ную клетку геном фермента, добавляющего
глюкозу к повторяющемуся тетрасахарид-
ному звену в О-боковых цепях (рис. 32.22).
Такое изменение называют фаговой конвер-
сией. Приведенный пример демонстрирует
удивительное взаимодействие между бакте-
риальными и вирусными генами и те пре-
имущества в эволюции, которые возникают
в результате такого симбиоза.
32.14. Порин образует в наружной мембране
каналы для небольших полярных молекул
В наружной мембране бактериальной клет-
ки содержится большое количество (~10
5
)
молекул порина - трансмембранного белка
массой 37 кДа. Тримеры порина форми-
руют каналы, по которым небольшие по-
лярные молекулы быстро диффундируют,
проходя сквозь мембрану (рис. 32.23). По-
скольку диаметр канала 10 А, он пропу-
скает молекулы массой, не превышающей
600 Да. Гидрофобные молекулы независимо
от своего размера плохо проходят по кана-
лу; из этого следует, что пориновый канал
наполнен водой и выстлан полярными груп-
пами. Следовательно, канал приспособлен
для пропускания небольших полярных ме-
таболитов типа моносахара. Что касается
полярных соединений с большей молеку-
лярной массой, то для некоторых из них су-
ществуют специфические системы транс-
порта через наружную мембрану; примером
может служить система транспорта маль-
тозы. Диффузия мальтозы (дисахарида)
и мальтотриозы по пориновому каналу идет
очень медленно; для их переноса через мем-
брану существует специальная система
транспорта. Известны также специфические
системы транспорта витамина В
12
и хелатов
железа. Некоторые фаги проникают в бакте-
риальные клетки путем связывания со спе-
цифическими переносчиками. Так, фаг λ ис-
пользует рецептор мальтозы.
Среди белков наружной мембраны коли-
чественно преобладает (~ 7•10
5
молекул на
32. Оболочки бактериальных
клеток
229

Рис. 32.23. А. Электронная микрофото-
графия Е. coli. Видно располо-
жение негативно окрашенных
пориновых каналов. Б. Изобра-
жение пориновых каналов, по-
лученное после обработки
и фильтрации (обесцвечивания
фона) микрофотографии, при-
веденной на рис. А. В. Разъ-
ясняющая схема: показана
проекция каналов порина
при низком разрешении. [Ste-
ven А, С., Heggeler В. Ten, Mu-
ller R., Kistler J., Rosenbusch J.
P., J. Cell Biol., 72, 292 (1977).]
клетку) небольшой липопротеин, содержа-
щий всего лишь 58 остатков аминокислот.
Этот белок характеризуется высокой сте-
пенью α-спирализованности; к его N-конце-
вому цистеину ковалентно присоединены
три жирные кислоты. Примерно 1/3 моле-
кул липопротеина через ε-аминогруппы
своего С-концевого лизина связана
с СООН-группами расположенного над
ним пептидогликана. Таким образом, рас-
сматриваемый липопротеин прикрепляет на-
ружную мембрану к подлежащему пептидо-
гликанному слою и тем самым способствует
механической устойчивости клеточной обо-
лочки.
32.15. Новообразованные белки
наружной мембраны содержат отщепляемую
сигнальную последовательность
Белки, синтезируемые грам-отрицательны-
ми бактериями, могут локализоваться в ци-
гозоле, плазматической мембране, пери-
230
Часть V.
Молекулярная физиология
плазматическом пространстве, наружной
мембране или внеклеточной среде. Каким
образом новосинтезированная молекула по-
падает в нужное место, выбирая из пяти воз-
можных направлений правильное? Для вы-
яснения этого вопроса очень важное значе-
ние имеет следующий факт: как оказалось,
липопротеин наружной мембраны синтези-
руется в виде пролипопротеина, содержаще-
го на N-конце 20 дополнительных остатков
Рис. 32.24. Последовательность амино-
кислот N-концевой части про-
липопротеина. Эта сигнальная
последовательность содержит
много гидрофобных остатков
(показаны желтым цветом).
