Страйер Л. Биохимия. Том 3
Подождите немного. Документ загружается.

что существует несколько сотен генов ва-
риабельных областей х-легких (V
χ
) и тя-
желых цепей (V
H
). 300 генов V
χ
и 300 генов
V
H
, соединяясь в различных комбинациях
(300 х 300), способны были бы кодировать
9•10
4
вариантов молекул антител, разли-
чающихся по специфичности. Этот рас-
четный максимум (9•10
4
) намного ниже
реального числа антител различной специ-
фичности, синтезирующихся в организме
животного; считается, что число таких анти-
тел значительно превышает 10
6
. Расхожде-
ние между расчетом и реальной величиной
еще выше в отношении легких цепей λ, ко-
торые, как было показано, кодируются ме-
нее, чем 10 генами V
λ
. В целом число генов
вариабельных областей в клетках зародыше-
вого пути оказалось слишком малым, чтобы
полностью обеспечить все разнообразие ан-
тител. Очевидно, в ходе дифференцировки
лимфоцитов на протяжении жизни живот-
ного появляются какие-то дополнительные
факторы, повышающие степень разнообра-
зия.
33.21. Открытие генов J (соединяющих) -
дополнительного источника разнообразия
антител
Следующий шаг в изучении механизма,
обеспечивающего разнообразие антител,
был сделан при определении последователь-
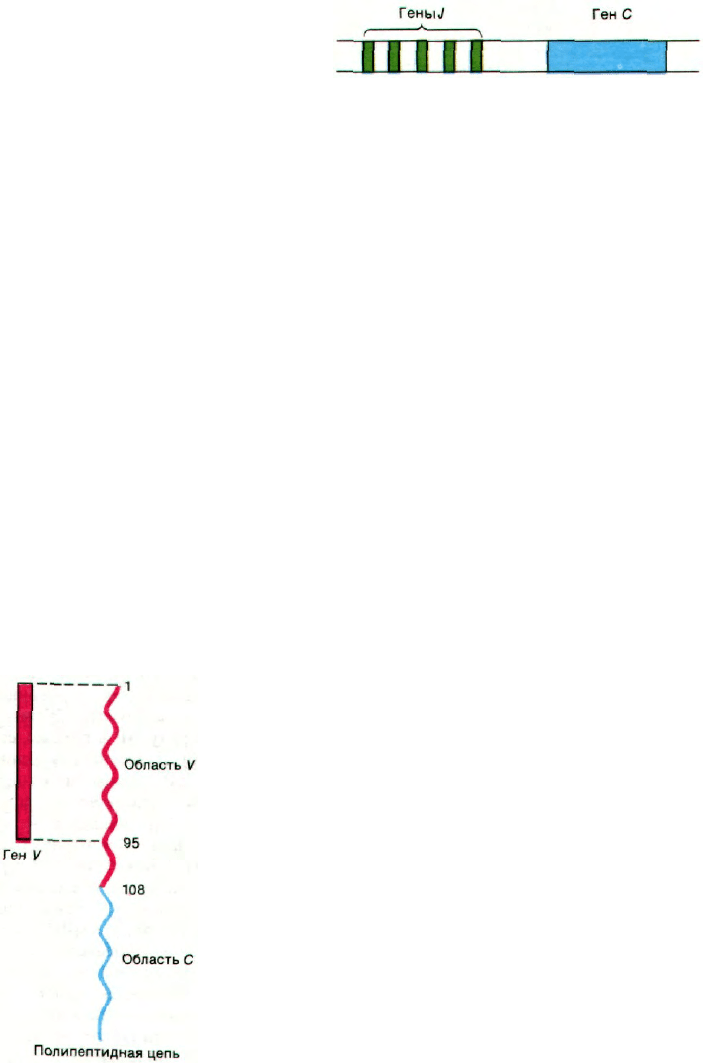
Рис. 33.24. Ген V, выделенный из эмбрио-
нальных клеток, укорочен. Он
не кодирует последние 13 ами-
нокислотных остатков вариа-
бельной (V) области полипеп-
тидной цепи.
Рис. 33.25. Расположение тандемом
группы генов J, кодирующих
часть последнего гипервариа-
бельного участка вариабель-
ной области; гены J локализо-
ваны вблизи гена С.
ностей оснований клонированных генов, ко-
дирующих иммуноглобулины в эмбрио-
нальных и миеломных клетках. Эти исклю-
чительно продуктивные исследования были
проведены Тонегавой, Филиппом Ледером
и Лероем Худом (Tonegawa, Philip Leder.
Leroy Hood). Прежде всего, совершенно не-
ожиданно выяснилось, чем в эмбриональных
клетках гены V кодируют вариабельные обла-
сти L- и Н-цепей вовсе не целиком. Ген V эм-
бриональных клеток (и клеток зародышево-
го пути) заканчивается кодом для аминокис-
лотного остатка 95, а не 108, который
составляет конец вариабельной области
полипептидной цепи иммуноглобулина
(рис. 33.24). Где же находится ДНК, которая
кодирует последние 13 остатков вариабель-
ной области? В эмбриональных клетках
этот отрезок ДНК локализован в неожидан-
ном месте: вблизи гена С. Указанный отре-
зок ДНК назвали геном J (от англ. join - сое-
динять), потому что в дифференцированных
клетках он соединяет гены V и С. В сущно-
сти, в эмбриональных клетках вблизи гена
С локализована целая группа располо-
женных тандемом генов J (рис. 33.25). При
дифференцировке клеток, продуцирующих
антитела, происходит транслокация гена V
в участок, расположенный рядом с геном С;
эта транслокация осуществляется путем
внутрихромосомной рекомбинации. При
этом ген V сращивается (сплайсинг) с геном
J и формируется общий ген, полностью ко-
дирующий вариабельный участок. Каждый
из указанных генов содержит короткую па-
линдромную (разд. 24.27) последователь-
ность, расположенную рядом с участком ре-
комбинации. Эти палиндромы служат, ве-
роятно, элементами узнавания в процессе
рекомбинации.
Гены J вносят большой вклад в разно-
образие антител, так как они кодируют
33. Иммуноглобулины
251

Рис. 33.26. Неточность места соединения
генов V и J служит еще одним
источником разнообразия ан-
тител.
часть последнего гипервариабельного
участка L- и Н-целей. При формировании
полного гена V
χ
любой из нескольких сотен
генов V может присоединиться к любому из
пяти генов J. Например, в результате ком-
бинации 300 неполных генов V с пятью ге-
нами J может образоваться 1500 вариантов
полного (непрерывного) гена V. Следова-
тельно, соматическая рекомбинация этих
генных сегментов усиливает разнообразие,
заложенное уже в клетках зародышевого
пути.
33.22. Соединение генов V и J
в различных рамках также способствует
разнообразию антител
Второе удивительное открытие состояло
в том, что набор из пяти генов J обеспечи-
вал синтез не пяти, а большего числа после-
довательностей аминокислот для соответ-
ствующих областей легкой цепи. Анализ
последовательностей аминокислот и осно-
ваний показал, что рекомбинация генов V
и J происходит не абсолютно точно. Как
оказалось, рекомбинация этих генов может
иметь место по тому или иному из основа-
ний вблизи кодона, детерминирующего
остаток 95 (рис. 33.26). Следовательно, раз-
личие рамок, в которых происходит сращива-
252
Часть V.
Молекулярная физиология
ние генов V и J, вносит дополнительный
вклад в разнообразие антител в организме.
Похоже, что иммунная система получает
удовольствие от мелких погрешностей!
В каждом данном лимфоците экспресси-
рован только один из двух аллельных генов.
Следовательно, все участки, связывающие
антиген, продуцируемые отдельной клет-
кой, одинаковы. Обнаружена структурная
основа такого избирательного выражения
гена (называемого аллельным исключением).
Как показал анализ фрагментов, полу-
ченных после рестрикции, неполный ген V
правильно соединяется с геном J только
в одной из двух гомологичных хромосом;
экспрессируется же только правильно ре-
комбинированный ген иммуноглобулина.
33.23. мРНК для L- и Н-цепей образуются
путем сращивания (сплайсинга) первичных
продуктов транскрипции
мРНК легких χ-цепей содержит около 1250
оснований (рис. 33.27). Как и в других
мРНК эукариот, в ней содержатся poly(A)-
последовательность, присоединенная к
3'-концу, и нетранслируемые последователь-
ности на 3'- и 5'-концах. Лидерная последова-
тельность вблизи 5'-конца мРНК χ-цепи
кодирует гидрофобную N-концевую
область синтезируемой χ-цепи. Образую-
щаяся сигнальная последовательность
(рис. 33.28) направляет рибосому к эндо-
плазматическому ретикулуму и определяет
способность новосинтезированной полипеп-
тидной цепи иммуноглобулина проходить
через мембрану ЭР в просвет его трубочек
(разд. 29.30). Далее на внутренней стороне
мембраны ЭР происходит отщепление сиг-
нальной последовательности под действием
пептидазы. Вариабельная и константная
области легкой цепи кодируются смежной
областью мРНК, которая следует непосред-
ственно за лидерной последовательностью.
Первичный продукт транскрипции, из ко-
торого образуется эта мРНК, содержит две
вставочные последовательности (рис. 33.29).
Одна из них отделяет лидерную последова-
тельность от начала мРНК, кодирующей
вариабельную область, а вторая расположе-
на между дистальным концом последова-
тельности, комплементарным гену J, и нача-
лом последовательности, комплементарной
гену С (т.е. кодирующей константный уча-
сток). При превращении первичного продукта
в мРНК (процессинг) происходит удаление
этих вставочных последовательностей. Лю-
бопытно, что ген J несет информацию для

Рис. 33.27. Структура мРНК, кодирую-
щей L-цепь.
Рис. 33.28. Сигнальная последователь-
ность новосинтезированной
L-цепи. Желтым цветом отме-
чены гидрофобные остатки.
сплайсинга (сращивания) двух типов:
одно - на уровне ДНК (слияние генов V и J)
и другую - на уровне РНК (соединение J-
и С-участков).
Какова структура гена, кодирующего тя-
желую цепь? Вспомним, что Н-цепь состоит
из четырех доменов: V
H
, С
H
1, С
H
2 и C
H
3.
Недавно было осуществлено клонирование
фрагмента ДНК, определяющего констант-
ную область тяжелой цепи IgG. Электрон-
но-микроскопические исследования показа-
ли, что С
H
1, С
H
2 и С
H
3 кодируются
разными участками ДНК (рис. 33.30). Еще
один участок ДНК кодирует шарнирное со-
единение между С
H
1 и С
H
2. В целом до-
менная структура иммуноглобулинов
(разд. 33.14) является отражением архи-
тектуры соответствующих генов. Благода-
ря сплайсингу организмы оказались спо-
Рис. 33.29. Первичный транскрипт - пред-
шественник мРНК L-цепи.
собными создавать в ходе эволюции новые
белки путем объединения участков ДНК, ко-
дирующих разные домены.
33.24. Разные классы антител образуются
в результате перескока генов V
H
Как уже упоминалось, существует пять
классов иммуноглобулинов. Клетки, проду-
цирующие антитела, сначала продуцируют
IgM, а затем IgG, IgA, IgD или IgE той же
самой специфичности. При этом переключе-
нии от IgM на другой класс иммуноглобу-
линов легкая цепь остается неизменной. Бо-
лее того, неизменной остается и вариабель-
ная область тяжелой цепи. Меняется
только константная область тяжелой це-
пи, и потому этот этап дифференцировки
клетки, продуцирующей антитела, назы-
вают С
H
-переключением (рис. 33.31).
В эмбриональных клетках мыши гены, ко-
дирующие константные области μ-, γ- и α-
тяжелых цепей (и обозначаемых соответ-
ственно С
μ
, С
γ
и C
α
), расположены в ряд,
один за другим (рис. 33.32). Как оказалось,
существует четыре гена константных участ-
ков γ-цепей, что полностью соответствует
данным генетического анализа, выявившего
четыре подкласса IgG. Рядом с геном С
μ
ло-
кализуется набор расположенных тандемно
генов J, кодирующих последний гиперва-
риабельный участок вариабельной области.
Полный ген тяжелой цепи IgM образутся
путем транслокации гена V
H
к гену J
H
(рис. 33.33). В результате этой транслокации
гены V
H
, J
H
и C
μ
соединяются в функцио-
нально единый ген. Вставочные последова-
тельности между лидерным отрезком и на-
33. Иммуноглобулины
253
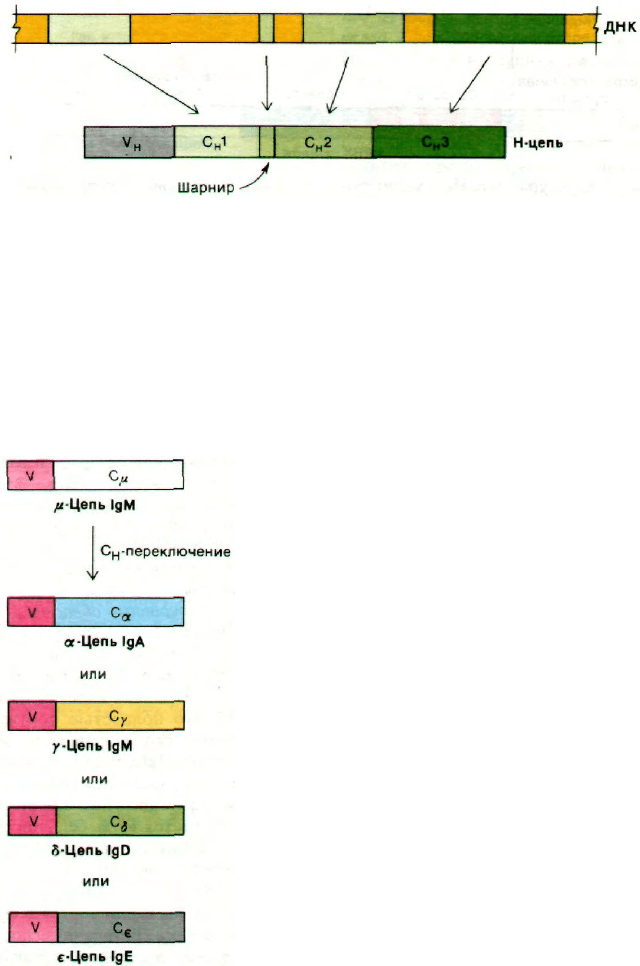
Рис. 33.30. Три домена константной (С)
области тяжелой цепи и шар-
нирный участок кодируются
разными участками гена.
чалом гена вариабельной области, между
концом гена J
H
и началом гена С
μ
, а также
в пределах гена С
μ
выстригаются в ходе пре-
вращения первичного траскрипта в мРНК
для μ-цепи.
Рис. 33.31. Синтез различных классов им-
муноглобулинов. В результате
того, что ген V
H
-области снача-
ла соединяется с геном
С
μ
-области, а затем с каким-ли-
бо другим из генов С-области,
формируются Н-цепи разных
классов иммуноглобулинов.
254
Часть V.
Молекулярная физиология
Как показал анализ продуктов рестрик-
тазного расщепления ДНК из эмбрио-
нальных и миеломных клеток, С
H
-пере-
ключение происходит на уровне ДНК,
а не РНК. Так, при переключении от
IgМ к IgA ген V
H
J
H
, расположенный рядом
с геном С
μ
, перемещается в участок, распо-
ложенный рядом с геном C
α
(рис. 33.34).
При этой рекомбинации гены между С
μ
и C
α
образуют петлю и выстригаются. Не исклю-
чено, что участки ДНК, претерпевающие ре-
комбинацию, несут палиндромную последо-
вательность. Именно транслокация всего
гена V
H
J
H
лежит в основе того факта, что
IgA, продуцируемый определенной клеткой,
идентичен по антигенной специфичности
IgM, синтезированному той же клеткой на
более ранней стадии развития. Каким обра-
зом клетка выбирает для транслокации
один из нескольких генов С
H
, остается не-
известным. Биологическое значение
С
H
-переключения состоит в том, что весь
домен, ответственный за узнавание (вариа-
бельный домен), перемещается от первона-
чальной константной области (С
μ
) к дру-
гим константным областям, кодирующим
полипептидные цепи с иными эффекторными
функциями.
33.25. Разнообразие антител обусловлено
соматической рекомбинацией многих генов
клеток зародышевого пути
и соматической мутацией
Подытожим теперь те механизмы, которые
обеспечивают разнообразие антител. Клет-
ки зародышевого пути содержат довольно
большой набор генов вариабельных обла-
стей. Легкая цепь х кодируется несколькими
сотнями (скажем, 300) генов V и пятью гена-
ми J. Существует по крайней мере три рам-
ки, в которых происходит соединение генов
V и J. Отсюда следует, что общее число пол-
ных генов V
χ
, образующихся при всех воз-
можных сочетаниях генов V и J, составляет
300•5•3 = 4500. Подобным же путем может
возникнуть аналогичное число вариантов

Рис. 33.32. Гены константных областей μ-,
γ- и α-цепей расположены в ряд,
один за другим. Положение ге-
нов C
δ
и C
ε
еще не установлено.
тяжелых цепей. Соединение 4500 L-цепей
с 4500 Н-цепями дает 4500•4500 = 2•10
7
раз-
личных по антигенной специфичности анти-
тел. Это число достаточно велико, чтобы
обеспечить то большое разнообразие анти-
тел, которое образуется в организме живот-
ного.
Как упоминалось выше, генов V
λ
гораздо
меньше, чем генов V
χ
. Так, у мышей имеет-
ся, по-видимому, только 2 гена V
λ
. Однако
соответствующих этому гену последова-
тельностей аминокислот обнаружено на-
много больше. Представляется вероятным,
что разнообразие легких цепей λ возникает
в результате соматических мутаций. В це-
лом, как мы видим, природа использует
каждый из трех обсуждавшихся выше
(разд. 33.19) источников разнообразия -
большой набор генов клеток зародышевого
пути, соматические рекомбинации и сомати-
ческие мутации: в итоге возникает тот бо-
гатейший набор антител, который необхо-
дим для защиты организма от вторжения
чужеродных веществ.
33.26. Клонально-селекционная теория
образования антител
В 50-х годах Нилс Ерне, Макферлейн Бёр-
нет, Дэвид Тэлмедж и Джошуа Ледерберг
(Niels Jerne, Macfarlane Burnet, David
Talmage, Joshua Lederberg) разработали кло-
нально-селекционную теорию, дающую
обобщенное описание иммунного ответа.
Рис. 33.33. В результате соединения генов
V
H
и J
H
образуется ген, коди-
рующий μ-цепь.
Основные положения этой ныне общепри-
нятой теории следующие.
1. Клетка, продуцирующая антитела, со-
держит ДНК с уникальной последователь-
ностью оснований, определяющей последо-
вательность аминокислот, характерную для
синтезируемых ею цепей иммуноглобулина.
Специфичность антитела целиком опреде-
ляется последовательностью аминокислот.
2. Каждая отдельная клетка продуцирует
антитела только одной специфичности. Сле-
довательно, способность к синтезу опреде-
ленного антитела заложена в клетке еще до
контакта с антигеном.
3. Начинающая созревать клетка проду-
цирует небольшие количества антител
одной специфичности. Часть из них прикре-
пляется к поверхности клетки. Если такая
незрелая клетка встречается с антигеном,
против которого оказались направлены ее
антитела, то она погибает. Вследствие этого
животное обычно не производит антител
против собственных макромолекул, т. е. оно
обладает толерантностью к своему. Дей-
ствительно, клетки, продуцирующие антите-
ла против собственных антигенов, элимини-
руются на протяжении эмбрионального
развития. На зрелые клетки в отличие от не-
зрелых встреча с антигеном действует сти-
мулирующим образом: усиливается синтез
антител и запускается клеточное деление.
Потомки одной клетки составляют клон,
обладающий всеми генетическими особен-
ностями исходной клетки. Следовательно,
деление клетки, инициированное контактом
с антигеном, приводит к появлению клона
клеток, синтезирующих антитела той же
специфичности.
33. Иммуноглобулины
255
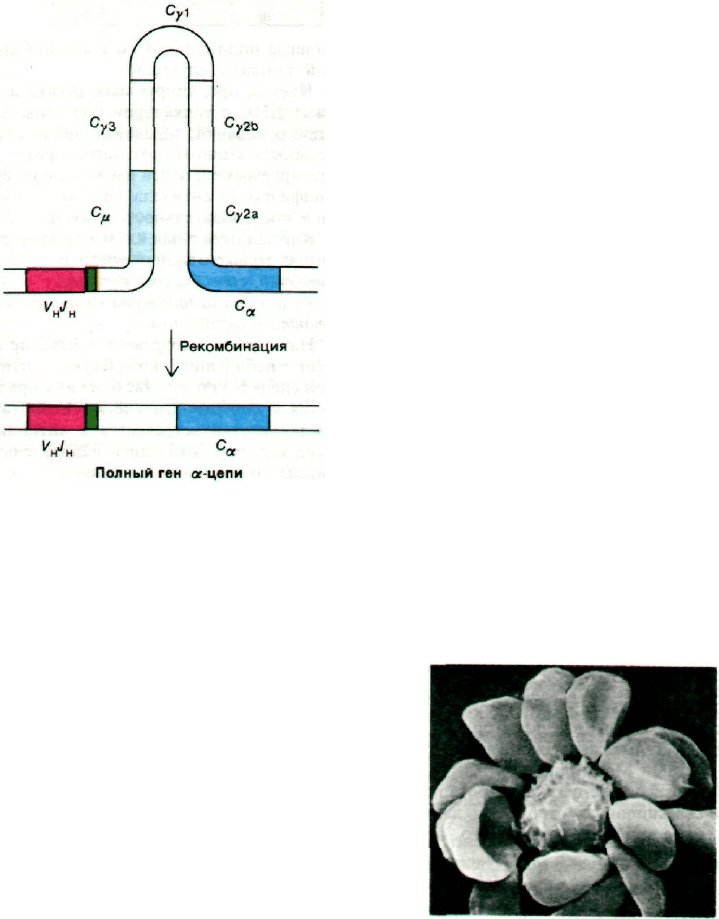
Рис. 33.34. Структурная основа С
H
-пере-
ключения. В результате вну-
трихромосомной рекомбина-
ции ген V
H
J
H
, находивший-
ся возле гена С
μ
, оказывается
рядом с геном C
α
.
4. Клон проявляет тенденцию к сохране-
нию и после исчезновения антигена. В слу-
чае нового появления того же антигена про-
исходит стимуляция этих клеток, что
и обусловливает иммунологическую память.
33.27. На поверхности клеток, продуцирую-
щих антитела, имеются рецепторы
антигенов
Молекулы специфических антител располо-
жены на поверхности продуцирующих их
клеток. Клетками-предшественниками
являются лимфоциты. В обычных условиях
они делятся медленно. Однако в результате
стимуляции антигеном лимфоцит превра-
щается в плазматическую клетку, очень ак-
тивно синтезирующую и продуцирующую
антитела. Если популяцию лимфоцитов
пропустить через колонку, содержащую ко-
валентно присоединенные динитрофе-
нильные (ДНФ) группы, то на колонке свя-
жется только очень небольшая часть клеток,
256
Часть V.
Молекулярная физиология
а именно те, которые синтезируют антитела
против ДНФ и несут молекулы таких анти-
тел на своей поверхности. Не задержавшие-
ся на колонке лимфоциты таких антител
против ДНФ не вырабатывают.
Как происходит стимуляция лимфоцитов
под действием специфических антител?
В отсутствие антигена молекулы антител на
поверхности лимфоцита распределены слу-
чайным образом. Добавление антигена
оказывает поразительный эффект: располо-
женные на поверхности лимфоцита антите-
ла вместе с присоединенными антигенами
собираются вместе на одном конце клетки.
образуя так называемый «колпачок» («кэп»).
По завершении перераспределения моле-
кулы антител оказываются внутри клетки.
Образование «колпачка» идет с потребле-
нием энергии и при участии сократительных
элементов клетки. Итак, формирование на
поверхности клетки решетки из комплексов
антиген—антитело ведет к образованию
«колпачка», а это стимулирует клеточное
деление. Антиген должен быть полива-
лентным (т. е. содержать более одной специ-
фической детерминанты) для того, чтобы
создать перекрестные связи между молеку-
лами антител на поверхности лимфоцита.
Вопрос о зависимости митотической актив-
ности клеточного ядра от этих событий,
Рис. 33.35. Полученное в сканирующем
электронном микроскопе изо-
бражение бараньих эритроци-
тов, связавшихся с челове-
ческим Т-лимфоцитом (в цен-
тре). Поверхность этого лим-
фоцита имеет рецепторы, спе-
цифичные в отношении компо-
нентов бараньих эритроцитов.
(Печатается с любезного разре-
шения д-ра J. Thornthwaite,
д-ра R. Life и д-ра М. Сауег.)
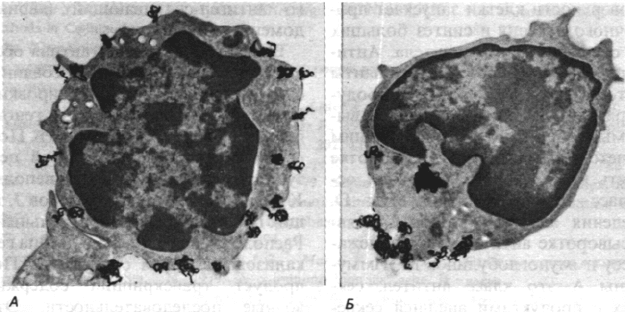
Рис. 33.36. Полученное методом радиоав-
тографии изображение имму-
ноглобулинов, образовавших
«колпачок» на поверхности
В-лимфоцита. Темные включе-
ния - меченные
125
I антитела
против иммуноглобулинов, до-
бавленные к В-лимфоцитам из
селезенки мыши. А - при 4°С
молекулы иммуноглобулинов
равномерно распределяются
на поверхности клетки; Б - пос-
ле инкубации при 37°С метка
концентрируется в виде «кол-
пачка» на одном полюсе клетки
и затем попадает внутрь по-
средством эндоцитоза. (Печа-
тается с любезного разрешения
д-ра Е. Unanue.)
разыгрывающихся на поверхности клетки,
составляет интересную и важную область
исследований.
33.28. Биологическое значение клональной
селекции
Сущность теории селекции клонов в форму-
лировке Бёрнета состоит в следующем:
Ни один участок связывания антигена
не адаптирован в эволюционном смысле
в какой-либо определенной антигенной
детерминанте. Структура участка, связы-
вающего антиген, существует как таковая,
и если она оказывается подходящей в том
смысле, что сродство к данной антиген-
ной детерминанте превышает какой-то
определенный уровень, то инициируется
иммунологически значимая реакция.
Отбор предсуществующих вариантов,
возникающих случайным образом,- это не
новая тема в биологии. В самом деле, в этом
суть теории Дарвина. Любопытно отме-
тить, что инструктивные теории предше-
ствуют селекционным теориям: теория Ла-
марка предшествовала теории Дарвина,
инструктивная теория в иммунологии была
сформулирована раньше, чем клонально-се-
лекционная теория.
Ерне высказал предположение, что меха-
низмы отбора могут играть роль в функцио-
нировании нервной системы, например в ме-
ханизмах памяти. По существу, инструктив-
ная и селекционная теории обучения были
сформулированы очень давно. Локк (Lock)
считал, что мозг человека подобен чистому
листу бумаги, на котором опыт выписывает
почти бесконечные узоры. Сократ, напро-
тив, утверждал, что «все обучение - это на-
поминание о том, что уже существует в моз-
гу». Будем надеяться, что эта глава вам
кажется чем-то давно знакомым!
Заключение
Антитело - это белок, который синтезирует-
ся в организме животного в ответ на про-
никновение чужеродного макромолекуляр-
ного соединения (называемого антигеном
или иммуногеном) и который обладает вы-
соким сродством к нему. Небольшие чуже-
родные молекулы (гаптены) вызывают
образование специфических антител только
в том случае, если такие гаптены присоеди-
нены к макромолекулам. Синтез антител
определяется действием отбора, а не ин-
струкции. Антиген связывается на поверхно-
сти тех лимфоцитов, которые исходно син-
тезируют антитела, специфичные к данному
антигену. Присоединение антигена к рецеп-
33. Иммуноглобулины
257
тору на поверхности клетки запускает про-
цесс клеточного деления и синтез больших
количеств специфического антитела. Анти-
тела против специфической детерминанты
обычно гетерогенны, поскольку они проду-
цируются разными клетками. Антитела, вы-
рабатываемые одной клеткой или одним
клоном клеток, гомогенны. В сыворотке
имеется пять классов антител, причем ос-
новной класс - это иммуноглобулины D.
После введения антигена первыми появ-
ляются в сыворотке антитела, принадлежа-
щие к классу иммуноглобулинов М. Имму-
ноглобулины А - это класс антител, сек-
ретируемых с продуктами внешней секре-
ции. Роль иммуноглобулинов D и Е пока
еще не установлена.
Антитела состоят из легких (L) и тяжелых
(Н) цепей. Иммуноглобулин G, имеющий
субъединичную структуру L
2
H
2
, содержит
два участка связывания антигена. При фер-
ментативном расщеплении иммуноглобу-
лина G образуются два F
ab
-фрагмента, ко-
торые связывают антиген, но не дают с ним
осадка, а также один F
с
-фрагмент, обладаю-
щий функцией эффектора (в частности,
связывает комплемент). Сравнение последо-
вательностей аминокислот в миеломных
иммуноглобулинах показало, что L- и Н-це-
пи состоят из вариабельной (V) области (N-
концевая последовательность, обычно из
108 остатков) и константной (С) области.
Участки связывания антигена сформиро-
ваны из остатков аминокислот, принадле-
жащих гипервариабельным участкам вариа-
бельных областей как L-, так и Н-цепей.
Молекулы антител свертываются в ком-
пактные домены, содержащие примерно по
108 аминокислотных остатков в виде гомо-
логичных последовательностей. Полагают,
что домены константной области, выпол-
няющие эффекторные функции, возникли
в процессе эволюции путем удвоения и по-
следующего расхождения гена, кодирующе-
го антиген-связывающий (вариабельный)
домен.
Вариабельная и константная области ко-
дируются разными генами, соединяющими-
ся в процессе дифференцировки клеток.
Имеется несколько сотен генов вариа-
бельных участков L- и Н-цепей. Полный ген
вариабельного участка легкой цепи обра-
зуется путем рекомбинации неполного гена
V и одного из нескольких генов J, кодирую-
щих последний гипервариабельный участок.
Расположенная тандемно группа генов J ло-
кализована рядом с геном С. Первичный
продукт транскрипции содержит вста-
вочные последовательности. Эти вста-
вочные последовательности удаляются, и
в результате образуется мРНК, кодирую-
щая вариабельные и константные области
иммуноглобулина, а также N-концевую ги-
дрофобную сигнальную последователь-
ность, которая в последующем отщепляется
от новосинтезированной полипептидной це-
пи. Синтез тяжелой μ-цепи IgM кодируется
полным геном, также образовавшимся в ре-
зультате сращивания генов V и J. Тяжелые
цепи иммуноглобулинов других классов (в
частности IgG) синтезируются после транс-
локации полного гена V
H
к другому гену С
(С
γ
). Этот перескок генов называется
С
H
-переключением. Разнообразие легких х-
цепей, а также тяжелых цепей обусловлено
соматической рекомбинацией довольно
большого числа гаметных генов (т.е. генов
клеток зародышевого пути) вариабельных
областей и участков соединения. Степень
разнообразия возрастает также в результате
соединения генов в различных рамках. Раз-
нообразие легких цепей обусловлено, по-ви-
димому, соматическими мутациями. Соче-
тание нескольких тысяч видов L-цепей
с таким же количеством видов Н-цепей
обеспечивает то огромное число различных
антител, которое синтезируется в организме
животного.
РЕКОМЕНДУЕМАЯ
ЛИТЕРАТУРА
С чего начать
Capra J.D., Edmundson А.В., 1977. The
antibody combining site, Sci. Amer.,
236(1), 50-59.
Milstein C., 1980. Monoclonal
antibodies, Sci. Amer., 243(4), 66-74.
Porter R.R., 1973. Structural studies of
immunoglobulins, Science, 180,
713-716.
Edelman G.M., 1973. Antibody struc-
ture and molecular immunology,
Science, 180, 830-840.
Книги
Hood L.E., Weissman I.L., Wood
W.B., 1978. Immunology, Benjamin.
(Ясное, легко читаемое изложение ос-
нов иммунологии.)
Kabat E.A., 1976. Structural Concepts
in Immunology and Immunochemistry,
(2nd ed.), Holt, Rinehart, and Winston.
(Прекрасное описание структуры им-
муноглобулинов и ее связи со специ-
фичностью связывания антигенов.)
258
Часть V.
Молекулярная физиология
Mishell B.B., Shiigi S.M. (eds.), 1980.
Selected Methods in Cellular Immuno-
logy, Freeman. (Очень хорошее руко-
водство по экспериментальным ме-
тодам в иммунологии.)
Структура иммуноглобулинов
Amzel L.M., Poljak R.J., 1979. Three-
dimensional structure of immunogl-
obulins, Ann. Rev. Biochem., 48,
961-967.
Silverton E.W., Navia M.A., Davi-
es D.R., 1977. Three-dimensional struc-
ture of an intact human immunogl-
obulin, Proc. Nat. Acad. Sci., 74,
5140-5144.
Valentine R.C, Green N.M., 1967.
Electron microscopy of an antibody-
hapten complex, J. Mol. Biol., 27,
615-617.
Архитектура генов
Tonegawa S., Maxam A.M., Tizard R.,
Bernard O., Gilbert W., 1978. Sequence
of a mouse germ-line gene for a variable
region of an immunoglobulin light
chain, Proc. Nat. Acad. Sci., 75,
1485-1489.
Sakano H., Rogers J.H., Huppi K.,
Brack C., Traunecker A., Maki R.,
Wall R., Tonegawa S., 1979. Domains
and the hinge region of an immunogl-
obulin heavy chain are encoded in
separate DNA segments, Nature, 277,
627-633.
Механизмы, создающие разнообразие
антител
Seidman J.G., Leder A., Nau M,
Norman B., Leder P., 1978. Antibody
diversity, Science, 202, 11-17.
Sakano H., Huppi K., Heinrich G.,
Tonegawa S., 1979. Sequences at the
somatic recombination sites of immun-
oglobulin light-chain genes, Nature,
280, 288-294.
Seidman J.G., Max E.E., Leder P.,
1979. A χ-immunoglobulins gene is
formed by site-specific recombination
without further somatic mutation,
Nature, 280, 370-375.
Schilling J., Clevinger В., Davie J.M.,
Hood L., 1980. Amino acid sequence of
homogeneous antibodies to dextran and
DNA rearrangements in heavy chain
V-region gene segments, Nature, 283,
35-40.
Kataoka Т., Kawakami Т., Takahashi-
N., Honjo Т., 1980. Rearrangement of
immunoglobulin γ
1
-chain gene and
mechanism for heavy-chain class switch,
Proc. Nat. Acad. Sci, 77, 919-923.
Davis M.M., Calame K., Early P.W.,
Livant D.L., Joho R., Weissman I.L.,
Hood L., 1980. An immunoglobulin
heavy-chain gene is formed by at least
two recombinational events, Nature,
283, 733-739.
Эффекторные функции иммуноглобу-
линов
Porter R.R., Reid K.B.M., 1978. The
biochemistry of complement, Nature,
275, 699-704.
Metzger H., 1978. The IgE-mast cell
system as a paradigm for the study of
antibody mechanisms, Immunol. Rev.,
41, 186-199.
Селекция клонов и клеточная иммуно-
логия
Burnet F.M., 1959. The Clonal
Selection Theory of Acquired
Immunity, Cambridge University Press.
Jerne N.K., 1967. Antibodies and
learning: selection versus instruction.
In: Quarton G.C, Melnechuk T. and
Schmitt F.O. (eds.), The Neurosciences:
A Study Program, Rockefeller
University Press.
Cunningham B.A., 1977. The structure
and function of histocompatability
antigens, Sci. Amer., 237(4), 96-107.
Raff M.C., 1976. Cell-surface immunol-
ogy, Sci. Amer., 234(5), 30-39.
Jerne N.K., 1973. The immune system,
Sci. Amer., 229(1), 52-60.

ГЛАВА 34
Мышечное сокращение
и подвижность клеток
Каким образом энергия химических связей
трансформируется в координированное
движение? Это один из самых острых воп-
росов современной молекулярной биоло-
гии. Направленное движение имеет место
при расхождении хромосом в процессе кле-
точного деления, при внедрении ДНК бакте-
риофага в бактериальную клетку, при бие-
нии ресничек и жгутиков, при активном
транспорте молекул, при перемещении РНК
в ходе белкового синтеза и - в наиболее оче-
видной форме - при мышечном сокращении.
В данной главе мы будем рассматривать
главным образом структурную основу про-
цесса сокращения поперечнополосатых
мышц позвоночных, поскольку этот процесс
изучен наиболее полно. Сократительная си-
стема поперечнополосатой мышцы состоит
из перекрывающихся белковых нитей, ко-
торые скользят относительно друг друга.
Сокращение происходит за счет энергии,
высвобождающейся при гидролизе АТР.
В поперечнополосатой мышце оно зависит
от концентрации Са
2+
, которая в свою оче-
редь регулируется саркоплазматическим ре-
тикулумом - специализированной системой
мембран, накапливающей Са
2+
в состоянии
покоя и высвобождающей его при воздей-
ствии на мышечное волокно нервного им-
пульса.
34.1. Мышца состоит из взаимодействующих
друг с другом толстых и тонких
белковых нитей
Произвольные мышцы позвоночных в све-
товом микроскопе выглядят поперечно ис-
черченными (рис. 34.1). Они состоят из кле-
260
Часть V.
Молекулярная физиология
ток, окруженных электровозбудимой мем-
браной - сарколеммой. Мышечная клетка
содержит большое число параллельных
миофибрилл диаметром около 1 мкм каж-
дая. Миофибриллы погружены во внутри-
клеточную жидкость, называемую сарко-
плазмой. В саркоплазме имеются гликоген,
АТР, фосфокреатин и гликолитические фер-
менты. В активно функционирующих мыш-
цах обнаруживается также много митохон-
дрий, регулярно расположенных вдоль мио-
фибрилл.
Рис. 34.1. Волокно скелетной мышцы
в фазово-контрастном свето-
вом микроскопе. Диаметр во-
локна около 50 мкм. А-диски —
темные, I-диски - светлые. (Пе-
чатается с любезного разреше-
ния д-ра Hugh Huxley.)
