Сталл Д. Вестрам Э. Зинке Г. Химическая термодинамика органических соединений
Подождите немного. Документ загружается.

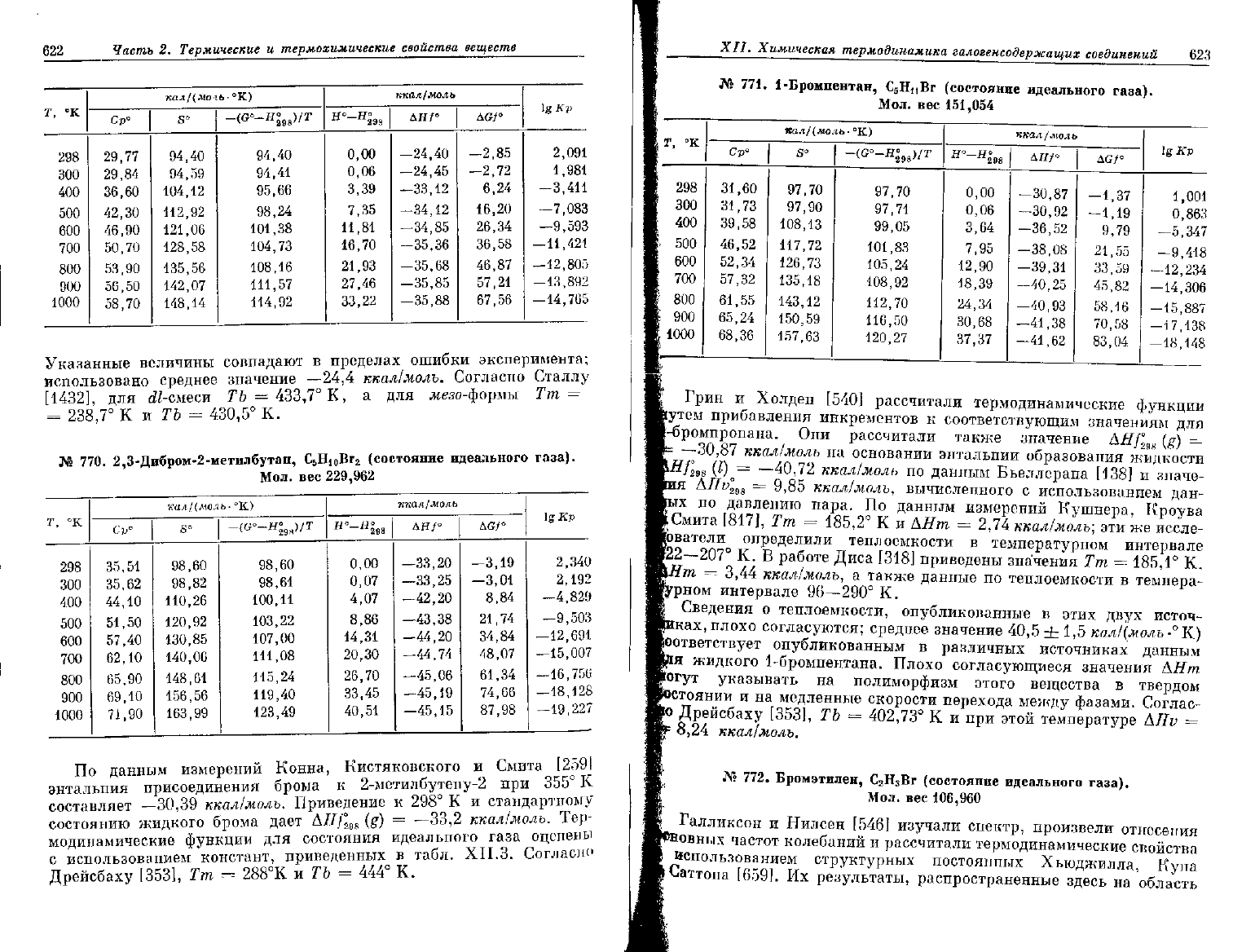
622
Часть
2.
Термические
и
термохимические
свойства
веществ
Т, °К
298
300
400
500
600
700
800
900
1000
кал/(лк>1Ь-°К)
Ср°
29,77
29,84
36,60
42,30
46,90
50,70
53,90
56,50
58,70
s°
94,40
94,59
104,12
112,92
121,06
128,58
135,56
142,07
148,14
-(G°-H°
98
)/r
94,40
94,41
95,66
98,24
101,38
104,73
108,16
111,57
114,92
икал/моль
H
°-
H
29S
0,00
0,06
3,39
7,35
11,81
16,70
21,93
27,46
33,22
дя/°
-24,40
—24,45
—33,12
-34,12
—34,85
—35,36
-35,68
—35,85
—35,88
AG/°
—2,85
—2,72
6,24
16,20
26,34
36,58
46,87
57,21
67,56
lgifp
2,091
1,981
-3,411
—7,083
—9,593
-11,421
—12,805
—13,892
—14,765
Указанные величины совпадают в пределах ошибки эксперимента;
использовано среднее значение
—24,4
ккал/молъ. Согласно Сталлу
[1432], для dZ-смеси ТЪ —
433,7°
К, а для жезо-формы Тт =
=
238,7°
КиГ6 =
430,5°
К.
Л» 770. 2,3-Дибром-2-метилбутан, С
6
Н
10
Вг
2
(состояние идеального газа).
Мол.
вес
229,962
Г, °К
298
300
400
500
600
700
800
900
1000
кал
1
(моль
•
°К)
Ср°
35,51
35,62
44,10
51,50
57,40
62,10
65,90
69,10
71,90
Со
98,60
98,82
110,26
120,92
130,85
140,06
148,61
156,56
163,99
-(G°-HJ
e
»)/T
98,60
98,61
100,11
103,22
107,00
111,08
115,24
119,40
123,49
ккал/моль
Н
°-Щп |
0,00
0,07
4,07
8,86
14,31
20,30
26,70
33,45
40,51
ДН/°
—33,20
—33,25
-42,20
—43,38
—44,20
-44,74
-45,06
-45,19
—45,15
AGf°
—3,19
—3,01
8,84
21,74
34,84
48,07
61,34
74,66
87,98
2,340
2,192
-4,829
—9,503
—12,691
—15,007
-16,756
—18,128
-19,227
По
данным измерений
Конна,
Кистяковского и Смита
[259J
энтальпия присоединения брома к 2-метилбутену-2 при
355°
К
составляет
—30,39
ккал/молъ. Приведение к
298°
К и стандартному
состоянию жидкого брома дает
AHf
2Sf
,
(g) =
—33,2
ккал/молъ. Тер-
модинамические функции для состояния идеального газа оценены
с использованием констант, приведенных в табл. XII.3. Согласно
Дрейсбаху [353], Тт =
288°К
и ТЪ =
444°
К.
XII.
Химическая
термодинамика
галогенсодержащих
соединений
623
JVs 771.
1-Бромпентан,
С
5
НцВг
(состояние
идеального
газа).
Мол.
вес
151,054
т °к
298
300
400
. 500
600
700
800
900
1000
Ср°
31,60
31,73
39,58
46,52
52,34
57,32
61,55
65,24
68,36
кал/
(моль•"
S°
97,70
97,90
108,13
117,72
126,73
135,18
143,12
150,59
157,63
К)
(G°—Н
97
97
99
101,
105,
108,
112,
116,
120,
2
°98>/
Г
70
71
05
83
24
92
70
50
27
н°—
0
0
3
7
12,
18,
24,
30,
37,
Н
298
00
06
64
95
90
39
34
68
37
ккал/люль
ДН/°
-30,87
-30,92
—36,52
—38,08
-39,31
—40,25
—40,93
-41,38
-41,62
ДО/
0
—1,37
—1,19
9,79
21,55
33,59
45,82
58,16
70,58
83,04
lg Кр
1,001
0
863
—5,347
—9
418
—12,234
-14,306
—15,887
—17
138
—18,148
Грин и Холден [540] рассчитали термодинамические функции
кутем прибавления инкрементов к соответствующим значениям для
|-бромпропана. Они рассчитали также значение
ДЯ/°
И
(g) =
-30,87
ккал/молъ
на основании энтальпии образования жидкости
^/•298
(0
=
—40,72
ккал/молъ
по данным Бьеллерапа [138] и значе-
t
AHv°
2iS
= 9,85 ккал/молъ, вычисленного с использованием дан-
ях по давлению пара. По данным измерений Кушнера, Кроува
I
Смита [817], Тт =
185,2°
К и АНт = 2,74 ккал/молъ; эти же иссле-
'ователи определили теплоемкости в температурном интервале
-207°
К. В работе Диса [318] приведены значения Тт =
185,1°
К.
1т = 3,44 ккал/молъ, а также данные по теплоемкости в темпера-
ррном интервале
96—290°
К.
Сведения о теплоемкости, опубликованные в этих
двух
источ-
аках, плохо согласуются; среднее значение 40,5 ±1,5
кал/{моль
-° К)
оответствует опубликованным в различных источниках данным
ря
жидкого 1-бромпентана. Плохо согласующиеся значения АНт
рогут
указывать на полиморфизм этого вещества в твердом
стоянии
и на медленные скорости перехода между фазами. Соглас-
• Дрейсбаху [353], ТЬ =
402,73°
К и при этой температуре AHv =
8,24 ккал/молъ.
№ 772. Бромэтилен, С
2
Н
3
Вг (состояние идеального газа).
Мол.
вес
106,960
Галликсон и Нилсен [546] изучали спектр, произвели отнесения
новных частот колебаний и рассчитали термодинамические свойства
использованием структурных постоянных Хьюджилла, Купа
>Саттона [659]. Их результаты, распространенные здесь на область
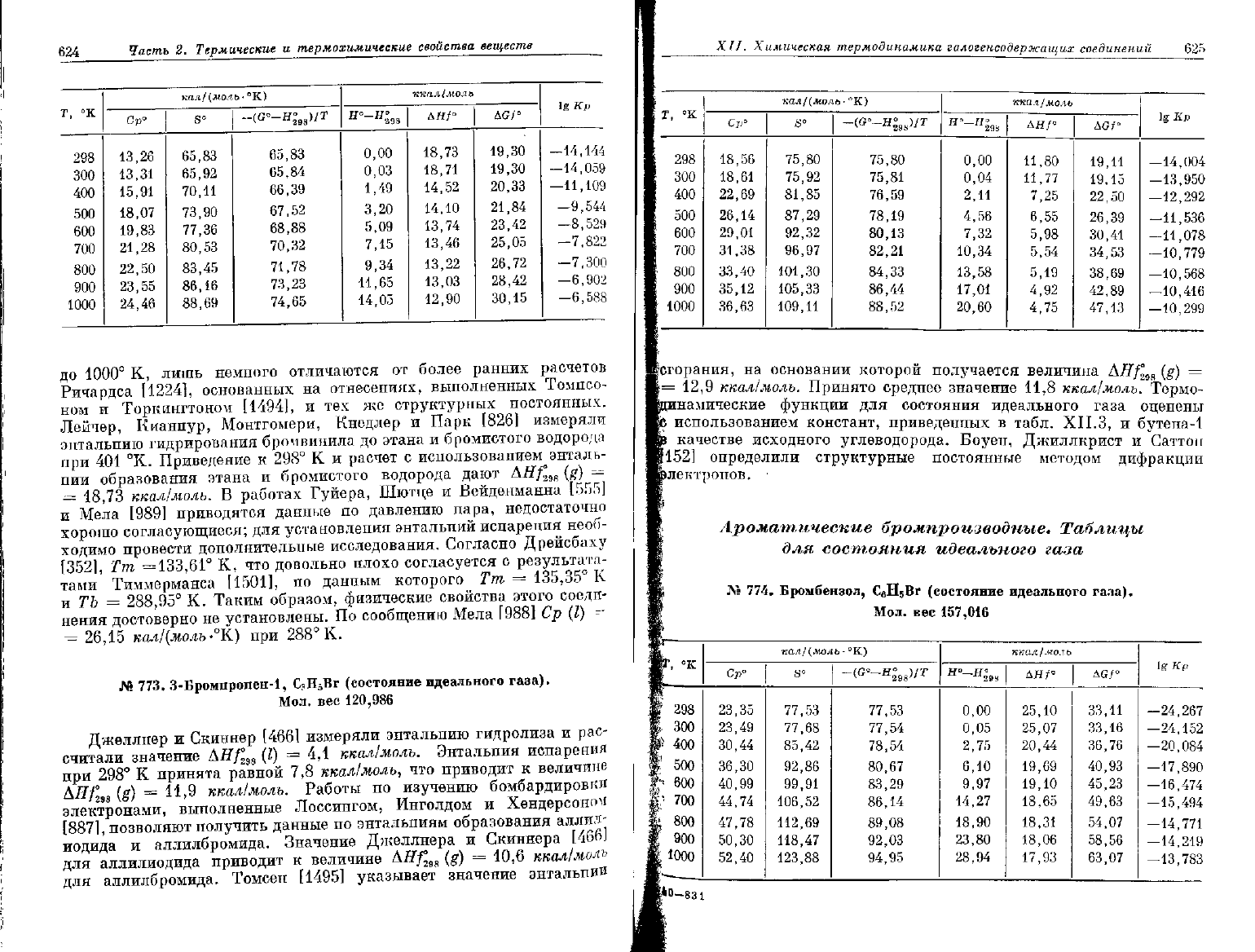
624
Часть
2.
Термические
и
термохимические свойства веществ
г,
°к
298
300
400
500
600
700
800
900
1000
•кал/(моль
°К)
Ср°
13,26
13,31
15,91
18,07
19,83
21,28
22
50
23,55
24,46
65,83
65,92
70,11
73,90
77,36
80,53
83,45
86,16
88,69
-<е->-н;
м
>/т
65,83
65,84
66,39
67,52
68,88
70,32
71,78
73,23
74,65
ккал/моль
0,00
0,03
1,49
3,20
5,09
7,15
9,34
11,65
14,03
дн/»
18,73
18,71
14,52
14,10
13,74
13,46
13,22
13,03
12,90
AG/°
19,30
19,30
20,33
21,84
23,42
25,05
26,72
28,42
30,15
lg-fO,
-14,144
—14,059
—11,109
—9,544
—8,529
—7,822
—7,300
-6,902
—6,588
до
1000°
К, лишь немного отличаются
от
более ранних расчетов
Ричардса [1224], основанных
на
отнесениях, выполненных Томпсо-
ном
и
Торкингтоном [1494],
и тех же
структурных постоянных.
Лейчер, Кианпур, Монтгомери, Кнедлер
и
Парк [826] измеряли
энтальпию гидрирования бромвинила до этана
и
бромистого водорода
при
401 °К. Приведение
к
298°
К и
расчет
с
использованием энталь-
пии
образования этана
и
бромистого водорода
дают
ДЯ/°
98
(g)
=
=
18,73
ккал/молъ.
В
работах Гуйера, Шютце
и
Вейденманна
[555]
и
Мела [989] приводятся данные
по
давлению пара, недостаточно
хорошо согласующиеся; для установления энтальпий испарения необ-
ходимо провести дополнительные исследования. Согласно Дрейсбаху
[352], Тпг
=133,61°
К, что довольно плохо согласуется
с
результата-
тами Тиммерманса [1501],
по
данным которого Ттп
=
135,35°
К
и
ТЪ
=
288,95°
К. Таким образом, физические свойства этого соеди-
нения
достоверно не установлены. По сообщению Мела [988]
Ср
(Г)
—
-=
26,15
кал/(молъ
-°К) при
288°
К.
№ 773. З-Бромпропен-1, С
?
Н
5
Вг (состояние идеального газа).
Мол.
вес
120,986
Джеллнер
и
Скиннер [466] измеряли энтальпию гидролиза
и
рас-
считали значение
&Hfl
9S
(I) =4,1
ккал/молъ.
Энтальпия испарения
при
298°
К
принята равной
7,8
ккал/молъ,
что приводит
к
величине
A-Hj^gg
(g)
=
11,9
ккал/молъ.
Работы
по
изучению бомбардировки
электронами, выполненные Лоссингом, Инголдом
и
Хендерсоном
[887], позволяют получить данные по энтальпиям образования аллил-
иодида
и
аллилбромида. Значение Джеллнера
и
Скиннера
[466]
для аллилиодида приводит
к
величине
Л#/^„
а
(g)
=
10,6
ккал/молъ
для аллилбромида. Томсен
[1495]
указывает значение энтальпия
XII.
Химическая термодинамика
галогенсодержащих
соединений
625
298
300
400
500
600
700
800
900
1000
кал/(моль
•
°К)
Ср°
18,56
18,61
22,69
26,14
29,01
31,38
33,40
35,12
36,63
S"
75,80
75,92
81,85
87,29
92,32
96,97
101,30
105,33
109,11
-<е--я;
и
>/т
75,80
75,81
76,59
78,19
80,13
82,21
84,33
86,44
88,52
ккал/моль
H
°~
H
29S
0,00
0,04
2,11
4,56
7,32
10,34
13,58
17,01
20,60
дн/°
11,80
11,77
7,25
6,55
5,98
5,54
5,19
4,92
4,75
AGf°
19,11
19,15
22,50
26,39
30,41
34,53
38,69
42,89
47,13
lg
Кр
—14,004
-13,950
—12,292
-11,536
—11,078
-10,779
—10,568
—10,416
—10,299
сгорания,
на
основании которой получается величина
ДЯ/°
И
(g)
=
— 12,9
ккал/молъ.
Принято среднее значение 11,8
ккал/молъ.
Термо-
;инамические функции
для
состояния идеального газа оценены
использованием констант, приведенных
в
табл. XII.3,
и
бутена-1
качестве исходного углеводорода. Боуен, Джиллкрист
и
Саттон
152] определили структурные постоянные методом дифракции
лектронов.
•
Ароматические бромпроизводные. Таблицы
для состояния идеального газа
№
774.
Бромбензол,
С
0
Н
5
Вг
(состояние
идеального
газа).
Мол.
вес
157,016
i
298
1
30
°
$
400
I
1
500
Ь
боо
С
700
&
800
|
900
I
1000
кал/
(моль
-°К)
Ср°
23,35
23,49
30,44
36,30
40,99
44,74
47,78
50,30
52,40
СО
77,53
77,68
85,42
92,86
99,91
106,52
112,69
118,47
123,88
-<G--HJ
ee
)/T
77,53
77,54
78,54
80,67
83,29
86,14
89,08
92,03
94,95
ккал/моль
Н
°~
Н
298
0,00
0,05
2,75
6,10
9,97
14,27
18,90
23,80
28,94
дя/°
25,10
25,07
20,44
19,69
19,10
18,65
18,31
18,06
17,93
AG/°
33,11
33,16
36,76
40,93
45,23
49,63
54,07
58,56
63,07
lg
Кр
—24,267
—24,152
—20,084
—17,890
—16,474
—15,494
—14,771
—14,219
—13,783
*0-831
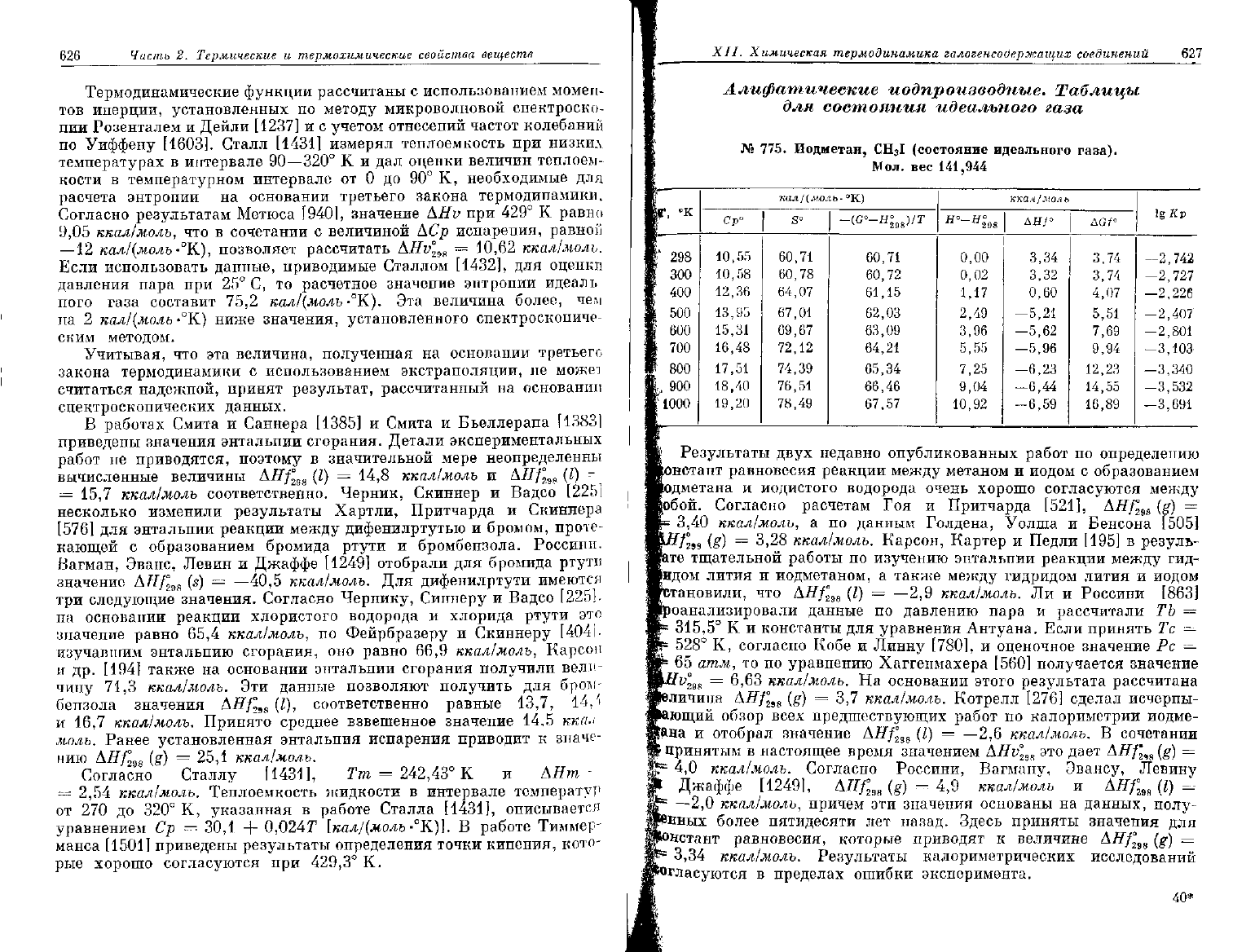
626
Часть
2.
Термические
и
термохимические свойства веществ
Термодинамические функции рассчитаны
с
использованием момен-
тов инерции, установленных
по
методу микроволновой спектроско-
пии
Розенталем
и
Дейли
[1237]
и с
учетом отнесений частот колебаний
по
Уиффену [1603]. Сталл
[1431]
измерял теплоемкость
при
низких
температурах
в
интервале
90—320°
К и
дал
оценки величин теплоем-
кости
в
температурном интервале
от 0 до 90°
К,
необходимые
для
расчета энтропии
на
основании третьего закона термодинамики.
Согласно результатам Метюса [940], значение
AHv при
429°
К
равно
9,05 ккал/молъ,
что
в
сочетании
с
величиной
АСр
испарения, равной
—
12
кал/(моль'°К),
позволяет рассчитать
AHv°
29S
=
10,62
ккал/молъ.
Если использовать данные, приводимые Сталлом [1432],
для
оценки
давления пара
при
25°
С,
то
расчетное значение энтропии идеаль
ного газа составит
75,2
кал/(моль-°К).
Эта
величина более,
чел
на
2
кал/(молъ
-°К) ниже значения, установленного спектроскопиче-
ским
методом.
Учитывая,
что
эта
величина, полученная
на
основании третьего
закона
термодинамики
с
использованием экстраполяции,
не
может
считаться надежной, принят результат, рассчитанный
на
основании
спектроскопических данных.
В работах Смита
и
Саннера
[1385]
и
Смита
и
Бьеллерапа
[13831
приведены значения энтальпии сгорания. Детали экспериментальных
работ
не
приводятся, поэтому
в
значительной мере неопределенны
вычисленные величины
AHf
M8
(I)
=
14,8
ккал/молъ
и
AHf
i9i
(I)
=
=
15,7
ккал/молъ
соответственно. Черник, Скиннер
и
Вадсо
[2251
несколько изменили результаты Хартли, Притчарда
и
Скиннера
[576]
для
энтальпии реакции между дифенилртутью
и
бромом, проте-
кающей
с
образованием бромида ртути
и
бромбензола. Россини.
Вагман, Эванс, Левин
и
Джаффе
[1249]
отобрали
для
бромида ртути
значение
ДЯ/°
И
(s)
=
—40,5
ккал/молъ.
Для
дифенилртути имеются
три следующие значения. Согласно Чернику, Синнеру
и
Вадсо [2251-
па основании реакции хлористого водорода
и
хлорида ртути
это
значение равно
65,4
ккал/молъ,
по
Фейрбразеру
и
Скиннеру [4041.
изучавшим энтальпию сгорания,
оно
равно
66,9
ккал/молъ, Карсои
и
др. [194]
также
на
основании энтальпии сгорания получили вели-
чину
71,3
ккал/молъ.
Эти
данные позволяют получить
для
бром-
бензола значения
AHf
itg
(I), соответственно равные
13,7,
14,
•
и
16,7
ккал/молъ. Принято среднее взвешенное значение
14,5
вка-<
моль.
Ранее установленная энтальпия испарения приводит
к
значе-
нию
AHf
29g
(g)
=
25,1
ккал/молъ.
Согласно Сталлу [1431],
Тт =
242,43°
К и АНт ~
=
2,54
ккал/молъ. Теплоемкость жидкости
в
интервале температур
от
270 до
320°
К,
указанная
в
работе Сталла [1431], описывается
уравнением
Ср =
30,1
+
0,024Г
[кал/(моль-°К)].
В
работе Тиммер-
манса
[1501]
приведены результаты определения точки
кипения,
кото-
рые хорошо согласуются
при
429,3°
К.
XII. Химическая термодинамика
галогенсодержащих
соединений
627
Алифатические иодпроизводиые. Таблицы
для состояния идеального газа
№
775.
Иодметан,
СН
3
1
(состояние
идеального
газа).
Мол.
вес
141,944
Ш,
-к
I
I"
298
К
300
I
400
1
500
Ж
боо
1
700
I
800
•,„
900
§1000
кал/(моль-
°К)
Ср°
10,55
10,58
12,36
13,95
15,31
16,48
17,51
18,40
19,20
ч°
60,71
60,78
64,07
67,01
69,67
72,12
74,39
76,51
78,49
-(С°-н°
98
)/г
60,71
60,72
61,15
62,03
63,09
64,21
65,34
66,46
67,57
ккал/моль
Н
°~
Я
298
0,00
0,02
1,17
2,49
3,96
5,55
7,25
9,04
10,92
дн/°
3,34
3,32
0,60
—5,21
—5,62
—5,96
—6,23
—6,44
-6,59
AGf°
3,74
3,74
4,07
5,51
7,69
9,94
12,23
14,55
16,89
lg
Кр
—2,742
—2,727
—2,226
—2,407
-2,801
-3,103
—3,340
—3,532
—3,691
Результаты
двух
недавно опубликованных работ
по
определению
онстант равновесия реакции между метаном
и
иодом
с
образованием
одметана
и
йодистого водорода очень хорошо согласуются между
|обой. Согласно расчетам
Гоя и
Притчарда [521],
AHf\
w
(g)
=
3,40 ккал/молъ,
а по
данным Голдена, Уолша
и
Бенсоыа
[505]
Ifl»s
(§)
=
3,28
ккал/молъ. Карсон, Картер
и
Педли
[195]
в
резуль-
ате тщательной работы
по
изучению энтальпии реакции между
гид-
Цидом лития
и
иодметаном,
а
также между гидридом лития
и
иодом
становили,
что
AHf
2w
(I)
=
—2,9
ккал/молъ.
Ли и
Россини
[863]
роанализировали данные
по
давлению пара
и
рассчитали
ТЪ
=
315,5°
К и
константы
для
уравнения Антуана. Если принять
Тс
=
528°
К,
согласно Кобе
и
Линну [780],
и
оценочное значение
Рс =
65 атм,
то
по
уравнению Хаггенмахера
[560]
получается значение
ГУ°
98
=
6,63
ккал/молъ.
На
основании этого результата рассчитана
личина
AHf
2>s
(g)
= 3,7
ккал/молъ. Котрелл
[276]
сделал исчерпы-
ющий обзор всех предшествующих работ
по
калориметрии иодме-
и
отобрал значение
АЩ°
Ш
(I)
=
—2,6
ккал/молъ.
В
сочетании
принятым
в
настоящее время значением
AHv°
29H
это
дает
AHf\^
(g)
=
4,0 ккал/молъ. Согласно Россини, Вагману, Эвансу, Левину
Джаффе [1249],
АЯ/°
98
(g)
= 4,9
ккал/молъ
и
АЩ°
Ш
(I)
=
—2,0 ккал/молъ, причем
эти
значения основаны
на
данных, полу-
нных более пятидесяти
лет
назад. Здесь приняты значения
для
нстант равновесия, которые приводят
к
величине
AHf
2iH
(g)
=
3,34 ккал/молъ. Результаты калориметрических исследований
гласуются
в
пределах ошибки эксперимента.
40*
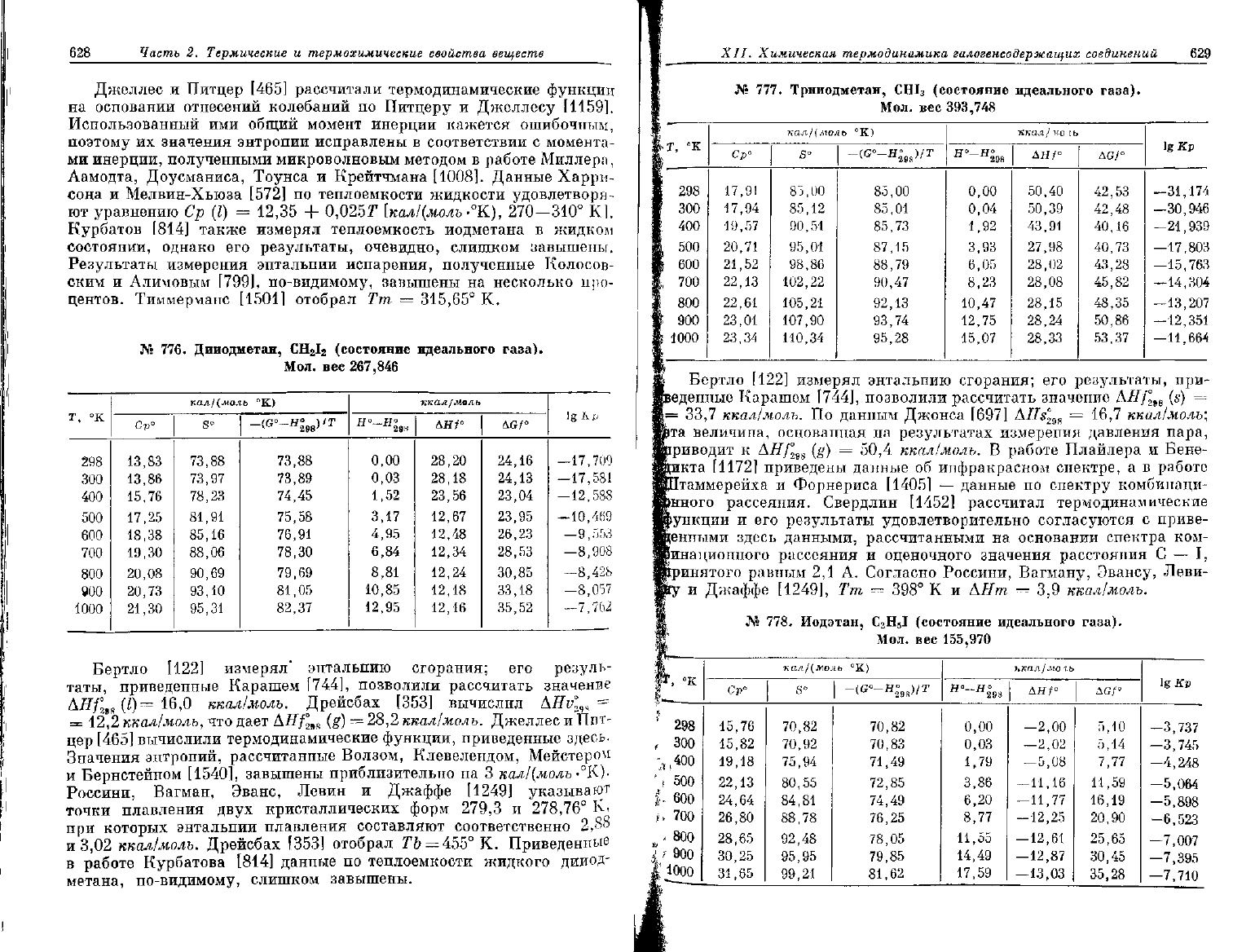
628
Часть
2. Термические и
термохимические
свойства
веществ
Джеллес
и
Питцер
[465]
рассчитали термодинамические функции
на
основании отнесений колебаний
по
Питцеру
и
Джеллесу [1159].
Использованный
ими
общий момент инерции кажется ошибочным,
поэтому
их
значения энтропии исправлены
в
соответствии
с
момента-
ми
инерции, полученными микроволновым методом
в
работе Миллера,
Аамодта,
Доусманиса, Тоунса
и
Крейтчмана [1008]. Данные Харри-
сона
и
Мелвин-Хыоза
[572] по
теплоемкости жидкости удовлетворя-
ют уравнению
Ср (Z) = 12,35 +
0,025Г
[кал/(молъ
-°К),
270—310°
К1.
Курбатов
[814]
также измерял теплоемкость подметана
в
жидком
состоянии,
однако
его
результаты, очевидно, слишком завышены.
Результаты измерения энтальпии испарения, полученные Колосов-
ским
и
Алимовым [799], по-видимому, завышены
на
несколько
про-
центов.
Тиммерманс
[1501]
отобрал
Тт =
315,65°
К.
№
776.
Дииодметан,
СН
2
1г
(состояние
идеального
газа).
Мол.
вес 267,846
г, °к
298
300
400
500
600
700
800
900
1000
кал/(моль
°К)
Ср°
13,83
13,86
15,76
17,25
18,38
19,30
20,08
20,73
21,30
s°
73,88
73,97
78,23
81,91
85,16
88,06
90,69
93,10
95,31
-<
G
°-
H
2V
T
73,88
73,89
74,45
75,58
76,91
78,30
79,69
81,05
82,37
ккал/моль
Н
°-
Н
2в»
0,00
0,03
1,52
3,17
4,95
6,84
8,81
10,85
12,95
днл
28,20
28,18
23,56
12,67
12,48
12,34
12,24
12,18
12,16
AGf°
24,16
24,13
23,04
23,95
26,23
28,53
30,85
33,18
35,52
igkp
—17,709
-17,581
—12,588
—10,469
—9,553
—8,908
-8,428
—8,057
—7,762
Бертло
[122]
измерял" энтальпию сгорания;
его
резуль-
таты, приведенные Карашем [744], позволили рассчитать значение
AHf°
ZiS
(Z)=
16,0
ккал/молъ.
Дрейсбах
[353]
вычислил
АЯ^,, =
=
12,2
ккал/молъ,
что
дает
АЯ/",,
(g) = 28,2
ккал/молъ.
Джеллес
и
Ппт-
цер [465] вычислили термодинамические функции, приведенные здесь.
Значения
энтропии, рассчитанные Волзом, Клевелендом, Мейстером
и
Бернстейном [1540], завышены приблизительно
на 3
кал/(молъ
-"Ю-
Россини,
Вагман, Эванс, Левин
и
Джаффе
[1249]
указывают
точки плавления
двух
кристаллических форм
279,3
и
278,76°
К,
при
которых энтальпии плавления составляют соответственно
2,88
и
3,02
ккал/молъ.
Дрейсбах
[353]
отобрал Г&
= 455° К.
Приведенные
в
работе Курбатова
[814]
данные
по
теплоемкости жидкого дииоД-
метана, по-видимому, слишком завышены.
XII.
Химическая
термодинамика
галогенсодержащих
соединений
629
№
777.
Трииодметан,
СН1
3
(состояние
идеального
газа).
Мол.
вес 393,748
Г,
°К
298
300
400
500
600
700
800
900
1000
кал/(моль
°К)
Ср°
17,91
17,94
19,57
20,71
21,52
22,13
22,61
23,01
23,34
s°
83,00
85,12
90,51
95,01
98,86
102,22
105,21
107,90
110,34
-<G°-HJ,
B
)/T
85,00
85,01
85,73
87,15
88,79
90,47
92,13
93,74
95,28
ккал/мо
!Ь
тто по
Н
~
Н
298
0,00
0,04
1,92
3,93
6,05
8,23
10,47
12,75
15,07
дя/°
50,40
50,39
43,91
27,98
28,02
28,08
28,15
28,24
28,33
AGf°
42,53
42,48
40,16
40,73
43,28
45,82
48,35
50,86
53,37
lg Кр
-31,174
—30,946
-21,939
-17,803
-15,763
-14,304
—13,207
-12,351
—11,664
Бертло
[122]
измерял энтальпию сгорания;
его
результаты,
при-
веденные Карашем [744], позволили рассчитать значение
AHf
zti
(s) =
|=
33,7
ккал/молъ.
По
данным Джонса
[697] AHs°
MS
= 16,7
ккал/молъ;
Вта величина, основанная
на
результатах
измерения давления пара,
приводит
к
AHf°
29S
(g) = 50,4
ккал/молъ.
В
работе Плайлера
и
Бене-
акта
[1172]
приведены данные
об
инфракрасном спектре,
а в
работе
1таммерейха
и
Форнериса
[1405]
—
данные
по
спектру комбинаци-
онного
рассеяния. Свердлин
[1452]
рассчитал термодинамические
функции
и его
результаты удовлетворительно согласуются
с
приве-
денными
здесь данными, рассчитанными
на
основании спектра
ком-
бинационного
рассеяния
и
оценочного значения расстояния
С — I,
принятого
равным
2,1 А.
Согласно Россини, Вагману, Эвансу, Леви-
и
Джаффе [1249],
Тт = 398° К и АНт = 3,9
ккал/молъ.
№
778.
Иодэтан, С
2
Н
5
1 (состояние идеального газа).
Мол.
вес
155,970
'
298
t
300
"
л
,400
',
500
1-
600
1, 700
.
800
fciuoo
пал/(моль
°К)
Cv°
15,76
15,82
19,18
22,13
24,64
26,80
28,65
30,25
31,65
s°
70,82
70,92
75,94
80,55
84,81
88,78
92,48
95,95
99,21
70,82
70,83
71,49
72,85
74,49
76,25
78,05
79,85
81,62
кпал/могь
H
°-
H
2°9S
0,00
0,03
1,79
3,86
6,20
8,77
11,55
14,49
17,59
AHf°
—2,00
—2,02
—5,08
—11,16
—11,77
—
12,25
-12,61
—12,87
-13,03
дел
5,10
5,14
7,77
11,59
16,19
20,90
25,65
30,45
35,28
-3,737
-3,745
—4,248
-5,064
—5,898
-6,523
-7,007
—7,395
—7,710
630
Часть
2. Термические и
термохимические
свойства
веществ
Отнесения основных частот этилгалогинидов выполнено Шеппар-
дом [1341].
По
мнению Грина
и
Холдена [540], отнесение частот хлор-
этана
и
бромэтана
следует
пересмотреть,
в
соответствии
с
этим часто-
та
для
иодэтана, согласно Шеппарду,
985 см'
1
,
оценена
как 1245 см~\
Касуя
и Ока [724]
вычислили момент инерции
по
микроволновым
данным,
а
Касуя
[723]
установил барьер внутреннего вращения
по
расщеплению полос, равный
3220
кал/моль.
Термодинамические
функции
рассчитаны
с
использованием указанных значений.
На
основании результатов измерения энтальпии сгорания Сприц-
галл
и
Уайт
[1402]
вычислили Д#/°
98
(I) = -8,4
ккал/молъ.
Карсон,
Хартли
и
Скиннер
[196]
измеряли энтальпию реакции диэтилцинка
с водой
и с
иодом
и
установили,
что
AHf
2i8
(Z) = —9,1
ккал/молъ.
Найденная
ими из
данных
по
реакции гидролиза энтальпия образо-
вания
диэтилцинка хорошо соответствует результатам измерения
энтальпии сгорания, полученным Лонгом
и
Норришем [882].
Харт-
ли,
Притчард
и
Скиннер
[576]
определяли энтальпию реакции
ди-
этилртути
с
иодом
и
иодидом ртути. Карсон, Карсон
и
Уилмшарст
[194] использовали данные Хартли
и др. в
сочетании
с
результатами
собственных измерений энтальпии сгорания диэтилртути
и
рассчи-
тали
ДЯ/°
98
(I)
=
—10,13
ккал/моль.
По
данным измерений Метюса
1940]
AHv = 7,115
ккал/моль
при 345° К, а по
данным Колосовского
и
Алимова
[799] AHv = 7,66
ккал/моль
при 303° К.
Приведение этих
результатов
к 298° К с
учетом
оценочного значения
—12
кал/(моль-°К)
для
АСр
испарения позволяет получить хорошо согласующиеся
значение
AHv°
M8
= 7,7
ккал/моль. Бенсон
и Боз [106]
измеряли
константу равновесия пиролиза этилиодида
до
этилена
и
йодистого
водорода
при 630° К и на
основании полученных данных
рас-
считали Л#У°
9
,
(g) = —3,0
ккал/молъ.
Принято среднее значение
ДяДчч
(g) = —2,0
ккал/моль. Россини, Вагман, Эванс, Левин
и
Джаф-
фе
[1249]
приводят значение AHf
us
(l)
= —7,4
ккал/молъ,
основан-
ное
на
старых ненадежных данных
по
измерению энтальпии сгорания.
С°
глас
но Тиммермансу [1501],
Тт = 162,3° К. Ли и
Россини
1863] сделали обзор данных
по
давлению пара
и
отобрали значение
ТЪ
= 345,5° К.
Теплоемкость жидкости измерял Курбатов [814],
однако
его
данные, по-видимому,
не
отличаются точностью.
№
779.
1,2-Дииодэтан,
С
2
Н
4
1
2
(состояние идеального газа).
Мол.
вес
281,872
Бенсон
и
Амано
[105]
определяли равновесный состав системы
этилен
— иод —
дииодэтан
и
использовали полученные данные
в сочетании
с
результатами более ранних измерений Абрамса
и
Деви-
са
[1], а
также Катбертсона
и
Кистяковского
[301] для
расчета значе-
ний
Д#/и
8
(£) = 15,9
ккал/молъ
и S°
M8
(g) = 83,3
кал/(моль
-°К)-
Более старые данные Муни
и
Ладлама
[1022]
не
согласуются
с
этими
результатами.
И
XII.
Химическая
термодинамика
галогенсодержащих
соединений
631
т,
°к
298
300
400
500
600
700
800
900
1000
кагЦмоль
°К)
Ср"
19,67
19,72
22,94
25,70
27,92
29,79
31,37
32,70
33,84
со
83,30
83,43
89,55
94,98
99,86
104,31
108,40
112,17
115,68
-(С»-н°
98
)/г
83,30
83,31
84,12
85,76
87,71
89,77
91,84
93,90
95,90
ккал/мо
гь
0,00
0,04
2,18
4,61
7,30
10,19
13,25
16,45
19,78
AHf°
15,90
15,88
10,96
—0,16
—0,53
—0,79
—0,96
—1,06
—1,08
AGf°
18,76
18,78
20,05
23,39
28,13
32,93
37,76
42,61
47,47
-13,753
—13,680
—10,953
-10,223
—10,247
-10,282
—10,316
-10,347
-10,374
Оценка величин теплоемкости сделана
с
использованием констант,
приведенных
в
табл. XII.4. Согласно Дрейсбаху [353],
Тт = 354° К
и
ТЪ = 473° К.
По
данным измерения энтальпии сгорания Бертло
[122]
вычислил
flns
(s) = —0,1
ккал/молъ.
Абраме
и
Девис
[1] на
основании
дан-
ых
по
давлению пара, опубликованных Муни
и
Ладламом [1022],
рассчитали
AHs°
29S
(g) = 15,7
ккал/моль. Расчетное
/298
(ё)
=
15,6
ккал/молъ
хорошо согласуется
с
эавновесным значением.
ГАЯ/;
значение
вышеуказанным
№
780.
1-Иодпропан,
С
3
Н
7
1
(состояние
идеального
газа).
Мол. вес 169,996
1г,
°к
1
298
300
400
500
600
700
800
900
1000
кал/(лшль-°К)
Ср"
21,48
21,56
26,27
30,52
34,11
37,17
39,80
42,07
44,03
S'
80,32
80,46
87,32
93,65
99,54
105,03
110,17
114,99
119,53
80,32
80,33
81,23
83,09
85,34
87,77
90,25
92,73
95,19
кьал/моль
Н
°~~
Н
298
0,00
0,04
2,44
5,29
8,52
12,09
15,94
20,04
24,34
АН/»
-7,30
—7,33
-10,69
—17,01
-17,80
-18,41
-18,86
—19,17
—
19,34
6,68
6,76
11,75
17,99
25,06
32,26
39,53
46,85
54,20
lg Кр
—4,894
—4,926
—6,421
—7,862
-9,128
—10,072
—10,797
-11,376
-11,845
Мортимер, Притчард
и
Скиннер
[1030]
измеряли энтальпии реак-
I
Ции дипропилртути
с
бромом
и с
иодом. Полученные данные связаны

632
Часть
2. Термические и
термохимические
свойства
веществ
с энтальпиями образования 1-бромпропана, 1-иодпропана,
бро-
мида ртути
и
иодида ртути.
Для
1-иодпропана получено значение
ДЯ/°,
8
(Г)
= —16,3
ккал/молъ, которое основано
на
использовании
энтальпий образования бромида
и
иодида ртути, приведенных
в ра-
боте Россини, Вагмана, Эванса, Левина
и
Джаффе [1249],
и
энтальпии
образования 1-бромпропана, принятой
в
этой главе. Дрейсбах
[353]
отобрал значение
AHv°
M8
= 8,6
ккал/молъ, которое дает А#/°
98
(g) =
-=
—7,7
ккал/молъ. Андреевский
и
Рожнов
[22]
измеряли равновесие
между 1-иодпропаном
и
2-иодпропаном.
Их
результаты
в
сочетании
с отобранным здесь значением энтальпии образования 2-иодпропана
приводит
для
1-иодпропана
к
величине
AHf
2ig
(g) = —6,9
ккал/молъ.
Принято
среднее значение, равное
—7,3
ккал/молъ.
Термодинамические функции
для
состояния идеального газа
оценены
с
использованием констант, приведенных
в
табл. XII.4.
Тиммерманс
[1501]
указывает
ТЪ 375,6° К на
основании четырех
хорошо согласующихся результатов определения точки
кипения,
однако
его
данные относительно точки плавления
Ттп
175,5° К
расхо-
дятся
со
значением Дрейсбаха [353], равным
171,9° К.
№
781.
2-Иодпропае,
С
3
Н
7
1
(состояние
идеального
газа).
Мол.
вес
169,996
298
300
400
500
600
700
800
900
1000
кал/(могь
°К)
Ср°
21,53
21,61
26,59
30,96
34,58
37,62
40,21
42,42
44,34
s°
77,55
77,69
84,60
91,02
96,99
102,56
107,75
112,62
117,19
77,55
77,56
78,46
80,34
82,62
85,08
87,59
90,11
92,59
Н
°-
Н
298
0,00
0,04
2,46
5,34
8,63
12,24
16,13
20,27
24,61
ккал/мо1Ъ
ДЯ/°
-10,00
—10,03
—13,37
—19,65
—20,40
—20,96
—21,37
—21,64
—21,78
&Gf°
4,80
4,89
10,16
16,66
23,99
31,44
38,95
46,51
54,10
lg
Кр
—3,521
—3,565
—5,550
-7,282
—8,739
-9,816
—10,641
—11,294
-11,823
Термодинамические функции рассчитаны
с
использованием
отнесений колебаний
по
Шеппарду [1344], средних длин связей,
рекомендованных Саттоном [1449],
и
оценочного значения барьера
внутреннего вращения
4,0
ккал/молъ. Самой нижней основной часто-
те,
не
указанной Шеппардом,
по
оценке было приписано
250 см'
1
-
Эти функции
в
сочетании
с
константами равновесия реакции диссо-
циации
до
пропилена
и
йодистого водорода
при 511,7° К,
приводимы-
ми
в
работе Бозе
и
Бенсона [149], дают
AHf
2s8
(g) = —10,5
ккал/молъ.
Мортимер, Притчард
и
Скиннер
[1030]
измеряли энтальпию реакций
XII.
Химическая
термодинамика
галогенсодержащих
соединений
633
диизопропилртути
с
бромом
и
иодом. Если использовать энтальпии
образования бромида ртути
и
иодида ртути, отобранные Россини,
Вагманом, Эвансом, Левиным
и
Джаффе [1249],
и
энтальпию обра-
зования
2-бромпропана, принятую
в
этой главе,
то
получается вели-
чина
AHf
29S
(I)
— —18,1
ккал/молъ. Мортимер
и др. на
основании
s опубликованных данных
по
давлению пара рассчитали
AHvzas
=
=
8,7
ккал/молъ,
а это
дает
AHf
2ss
(g) = —9,4
ккал/молъ. Принято
среднее значение
АЯ/°,
8
(g) = —10,0
ккал/молъ.
Согласно Тиммермансу [1501],
ТЪ = 362,6° К и Тт = 183,2° К.
№
782. 1,2-Дииодпропан,
С
3
Н
в
1
2
(состояние
идеального
газа).
Мол.
вес
295,898
Г,
°К
298
300
400
500
600
700
800
900
1000
пал/(моль
°К)
-<с°-я;
вв
)/г
24,77
24,86
29,83
34,07
37,51
40,43
42,85
44,92
46,74
94,60
94,76
102,61
109,74
116,26
122,27
127,83
133,00
137,83
94,60
94,61
95,64
97,76
100,31
103,02
105,78
108,52
111,21
ккал!моль
Я°—Я,
298
0,00
0,05
2,79
5,99
9,58
13,48
17,64
22,04
26,62
дя/°
8,60
8,57
3,32
-8,06
-8,60
-8,98
-9,21
-9,32
-9,30
17,81
17,86
21,31
26,91
33,96
41,09
48,25
55,44
62,64
lgKv
-13,051
-13,011
-11,644
-11,763
-12,368
-12,827
-13,181
-13,463
-13,690
Бенсон
и
Амано
[105]
измеряли равновесные составы системы
ропилен
— иод —
1,2-дииодпропан
и
рассчитали
АЯ/°„ (g) =
8,6
ккал/молъ
и S°
MS
(g) = 94,6
кал/(моль-°К).
Теплоемкости
ри
температурах, превышающих
298° К,
оценены
с
использованием
энстант, приведенных
в
табл. XII.4.
f
i
д
№ 783.
2-Иод-2-ыетилпропан,
С
4
Н
9
1
(состояние
идеального
газа).
^
Мол. вес
184,022
**'
Термодинамические функции рассчитаны
на
основании отнесе-
ний
колебаний
по
Тобину [1509], структурных параметров
по
Уильям-
|
е
У
и
Горди [1615],
а
также
по
Боуену, Джилкристу
и
Саттону
[152]
Ш оценочной величине барьера внутреннего вращения
4,4
ккал/молъ.
in*
0HC
и
®
гг
1700]
опубликовали данные
по
равновесию реакции
а$
ег
идрогалогенирования
до
изобутена
и
йодистого водорода. Исполь-
^*У
Я
функции энергии Гиббса, принятые
в
данной книге,
мы
рассчи-
°
среднюю энтальпию реакции при298°К, равную
19,74
ккал/молъ.
-634
Часть
2
Термические
и
термохимические
свойства
веществ
г,
°к
298
300
400
500
600
700
800
900
1000
Ср°
28,27
28,40
35,27
41,12
45,82
49,61
52,85
55,58
57,91
па г/(мо
S
0
81,79
81,97
91,11
99,63
107,55
114,91
121,75
128,13
134,12
ib
-К)
-(
00
-
н
м8>/
г
81,79
81,80
82,99
85,48
88,51
91,76
95,08
98,41
101,68
ккал/могь
Н
°~
Н
298
0,00
0,06
3,25
7,08
11,43
16,21
21,34
26,76
32,44
АН/°
-17,60
—17,63
-21,14
—27,49
-28,24
-28,77
-29,11
-29,28
—29,31
^Gf
o
5,65
5,79
13,92
23,32
33,55
43,89
54,29
64,74
75,19
lg
Ki
—4,142
—4,220
—7,606
-10
191
—12,219
—
13,70.
—
14,831
—15,719
-16,432
В
сочетании
с
энтальпиями
образования
йодистого водорода
и
изо-
бутена
это
значение
позволяет
получить
AHf
us
(g)
=
—17,6
ккал/моль
для
2-иод-2-метилпропана.
Милаццо
[999]
измерял
давление
пара
твердого
и
жидкого
2-иод-2-метилпропана
и
установил,
что
АНтп
=
3,47
ккал/молъ
при
температуре
плавления,
ТЪ
=
235,0°
К.
№
784.
1,2-Дииодбутан,
С
4
Н
8
1
2
(состояние
идеального
газа).
Мол.
вес
309,924
т,
°к
298
300
400
500
600
700
800
900
1000
пал/(моль
°К)
Ср°
30,58
30,69
36,81
42,19
46,60
50,30
53,50
56,20
58,50
s°
101,80
101,99
111,68
120,49
128,58
136,05
142,98
149,44
155,49
101,80
101,81
103,08
105,70
108,85
112,21
115,62
119,03
122,37
Н
~
Н
298
0,00
0,06
3,44
7,40
11,85
16,70
21,89
27,38
33,12
ккал/мо
гь
АН/»
2,85
2,81
—2,74
-14,37
—15,14
-15,69
-16,06
—16,26
—16,32
AGf
°
19,62
19,72
25,76
34,02
43,77
53,63
63,56
73,53
83,51
Ig
Кр
—14,381
-14,367
—14,074
-14,868
—15,941
-16
744
-17,362
—17,854
-18
251
Клайн
и
Кистяковский
[236]
измеряли
равновесные
составы
системы
бутен-1
—
иод
—
дииодбутан
и
рассчитали
АНг =
=
—12,0
ккал/молъ, откуда следует
АЯ/°
98
(g)
=
2,85
ккал/молъ-
Термодинамические
функции
идеального газа
оценены
с
использова-
нием
констант,
приведенных
в
табл. XII.4.
XII.
Химическая
термодинамика
галогенсодержащих
соединений
№
785.
З-Иодпропен-1,
С
3
Н
5
1
(состояние
идеального
газа).
Мол.
вес
167,980
635
т,
°к
298
300
400
500
600
700
800
900
1000
пал
1
{моль
°К)
Ср°
19,75
19,84
23,89
27,25
30,00
32,20
34,20
35,80
37,20
s°
76,46
76,59
82,87
88,57
93,79
98,58
103,02
107,14
110,98
-<G°-H°
9S
)/r
76,46
76,47
77,29
78,99
81,03
83,20
85,40
87,59
89,74
кка
ijмо
гь
Н
°~
Н
298
0,00
0,04
2,23
4,80
7,66
10,77
14,10
17,60
21,25
дн/°
22
90
22,88
20,01
14,11
13,64
13,28
13,01
12,82
12,71
&Gf°
28,72
28,76
30,93
34,24
38,31
42,45
46,63
50,85
55,09
lg
Кр
—21,053
-20,949
—16,900
—14,965
-13,953
—13,253
—12,739
-12,348
—12,039
Джеллнер
и
Скиннер
[466]
измеряли
энтальпию
гидролиза
2-иодпропена-1
и
рассчитали
AHf
29s
(I)
=
14,0
ккал/молъ.
Согласно
Дрейсбаху
[353],
Тт =
173,85°
К,
ТЪ
=
375°
К и
АЯУ°
98
=
=
8,9
ккал/молъ,
что
дает
AHf
2es
(g)
=
22,9
ккал/молъ.
Термодинами-
ческие
функции
для
состояния
идеального газа
оценены
с
использо-
ванием
констант,
приведенных
в
табл. XII.4,
при
этом
в
качестве
исходного
углеводорода брали
бутен-1.
Боуен,
Джилкрист
и
Саттон
[152] определяли структуру методом
дифракции
электронов.
Лишь
исторический
интерес
имеют
данные
по
энтальпии
сгорания,
полу-
ченные
Бертло
и
цитируемые
Карашем
[744],
которые,
вероятно,
аавышены
на
несколько
килокалорий.
Ароматические иодпроизводные. Таблица
для состояния идеального газа
№
786.
Иодбензол,
С
в
Н
5
1
(состояние
идеального
газа).
Мол.
вес
204,010
Хартли,
Притчард
и
Скиннер
[576]
измеряли
энтальпию
реакции
|(
между дифенилртутыо
и
иодом
с
образованием
иодида ртути
и
иод-
.
бензола.
Полученные
этими
исследователями
значения
были
немного
изменены
Черникой,
Скиннером
и
Вадсо [225],
которые
измеряли
также
энтальпию
реакции
дифенилртути
с
хлористым водородом.
Использование
этих данных
и
величин
энтальпий
образования
хлор-
ной
ртути
и
йодной
ртути
(—53,5
и
—25,2 ккал/молъ соответственно)
Дает
для
иодбензола
AHf
298
(I)
=
26,7
ккал/молъ.
Смит
[1382]
на
основании
данных
Карлссона
[719]
вновь
рассчитал
энтальпию
сго-
рания
и
получил
AHfl
w
(I)
=
28,0
ккал/молъ. Грехэм,
Ничол
и
Убел-
лоде
[522]
измеряли
энтальпию
реакции
фенилмагнийбромида

636
Часть
2.
Термические
и
термохимические
свойства
веществ
Т,
°К
298
300
400
500
600
700
800
900
1000
ьа
1/(моль
°К)
Gp°
24,08
24,22
31,10
36,86
41,43
45,08
48,07
50,55
52,60
со
79,84
79,99
87,93
95,51
102,65
109,32
115,54
121,35
126,78
-<
е
°-
Я
29
8
)/
г
79,84
79,85
80,88
83,06
85,73
88,63
91,61
94,60
97,55
ккал/моль
Я
°-«298
0,00
0,05
2,83
6,23
10,16
14,49
19,15
24,08
29,24
дн/°
38,85
38,83
35,80
29,79
29,25
28,83
28,52
28,30
28,18
AGf
44,88
44,92
47,19
50,63
54,85
59,15
63,50
67,89
72,30
lg Кр
—32,898
—32,721
—25,784
—22,130
-19,976
—18,468
—17,347
—16,485
—15,800
с йодистым водородом
и
иодом
и
получили значение
AHfl
ig
(Г)
=
=
21,9 ккал/молъ для иодбензола. Принято среднее взвешенное зна-
чение 27,0 ккал/молъ.
Сталл
[1431]
измерял теплоемкость
в
интервале температур
от
90
до
290°
К
и,
кроме того, получил следующие данные:
Ттп
=
=
241,83°
К
и
АНш
=
2,33 ккал/молъ. Согласно Дрейсбаху [351],
А//у
29Я
=
11,85 ккал/молъ
и
AHv
=
9,44 ккал/молъ
при
ТЪ
=
=
461,48°
К. Уиффен
[1603]
произвел отнесения частот колебаний
и
рассчитал термодинамические функции для состояния идеального
газа. Энтропия, полученная на основании данных по низкотемпера-
турным свойствам, недостаточно хорошо согласуется со значением,
рассчитанным Уиффеном. Учитывая, что экстраполяция
от 90 до
0° К вносит значительную неопределенность, принято указанное
выше рассчитанное значение.
Глава
XIII
ХИМИЧЕСКАЯ
ТЕРМОДИНАМИКА СЕРУСОДЕРЖАЩИХ
ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
Введение
Хотя
о
термохимическом изучении некоторых простейших тио-
|«пиртов (меркаптанов, алкантиолов) и тиоэфиров (диалкилсульфидов,
|тиаалканов) сообщалось еще
в
1886
г.
Томсеном [1495], химической
«термодинамикой серусодержащих органических соединений
в
основ-
Цном
пренебрегали вплоть до самого недавнего времени. Когда Парке
|и
Хаффман писали свою монографию [1105], термодинамические дан-
ные
были получены только для
двух
таких соединений [сероуглерода
*и
сероокиси углерода (карбонилсульфида)]. В 1949 г. Барроу и Пит-
|пер [78] смогли найти для своего обзора компилляционные данные
Цтолько по семи соединениям. Благодаря использованию теоретиче-
ских расчетов им удалось составить сравнительно полные сводки
для трех тиоспиртов,
двух
тиоэфиров, одного сульфона
и
одного
Сульфоксида. Однако эти расчеты основывались
на
неадекватных
данных, которые,
за
редким исключением, отличались низкой точ-
ностью. К настоящему времени главным образом благодаря усилиям
теных
двух
лабораторий — Нефтяного исследовательского центра
Бартлесвиле (США)
и
Термохимической лаборатории Лундского
етяиверситета
(Швеция)
— точные значения энергии Гиббса измере-
ры более чем для
20
серусодержащих органических соединений.
Текущая программа изучения серусодержащих органических соеди-
аений
в
Бартлесвильской лаборатории предусматривает детальные
исследования более
60
индивидуальных соединений серы, каждое
из
которых является «ключевым» членом одного или нескольких
Гомологических рядов. Информация, полученная при изучении этих
Индивидуальных соединений, позволит точно
и
полно рассчитать
АТаблицы термодинамических свойств примерно для
2000
других
^Соединений
серы. Расчеты такого типа быстро и экономно выполняют-
ся
автоматическими счетными машинами. Что касается имеющихся
/в настоящее время данных по сероокиси углерода,
то
они лишь
немного лучше допускавшейся Парксом
и
Хаффманом оценки
•в
2
ккал/молъ,
а
это во всяком случае показывает полноту наших
Знаний
в
соответствующей области. Теперь на прочной основе нахо-
Дятся наши знания о таких важных классах соединений, как тиоэфи-
ры
и
тиоспирты; данные для этих соединений отличаются высокой
Точностью.
Малый
объем химико-термодинамической информации
о
соедине-
ниях
серы, полученной
до
последнего десятилетия, обусловлен

638
Часть
2.
Термические
и
термохимические
свойства
веществ
несколькими
причинами. Прежде всего тем, что термодинамики,
изучавшие органические соединения, вполне естественно обращали
основное
внимание на углеводороды, поскольку этот класс соедине-
ний
имеет гораздо большее экономическое значение, чем соединения
серы. Большой и все возрастающий объем доступных термодинами-
ческих данных по углеводородам продолжал накапливаться, в то
время как многие
другие
классы органических соединений изучались
явно
недостаточно. Физико-химики не занимались соединениями
серы еще и потому, что, как правило, некоторые свойства этих
соединений
весьма неприятны. Наконец, изучение соединений серы
связано
с решением
трудных
проблем (некоторые из них обсуждаются
ниже),
а без этого нельзя ожидать серьезных успехов. Обстановка
в
настоящее время быстро изменяется, и быстрота накопления термо-
динамических данных для органических соединений серы превышав!
темпы роста исследований любого сравнительно большого класса
веществ. Помимо уже упомянутых выше лабораторий, лаборатория
Бельфастского университета в последнее время получила много тер-
модинамических данных по соединениям серы благодаря усилиям
Хенри Мейкла и его сотрудников.
Теплоты сгорания соединений серы были определены такими изве-
стными
термохимиками, как Бертло, Андрэ и Матиньон [123], Рот
и
Рист-Шумахер [1254], а также Хаффман и Эллис [646, 647], однако
по
причинам, обсуждаемым Уаддингтоном, Саннером и Хаббардом
[1551], полученные результаты оказались не столь точными, какими
они
должны были бы быть при применении тщательно разработан-
ного метода калориметрии сгорания. Таким образом, значения, ука-
занные
в компилляционной работе Караша [744], не являются вполне
достоверными. Впервые методом сжигания данные со средней сте-
пенью точности были получены Хаффманом и Эллисом [646], приме-
нявшими
обычную стальную бомбу, в которую не вводилась вода.
Воздух
не удалялся из бомбы, поскольку азот был необходим как
катализатор окисления серы до серной кислоты. Образующаяся
концентрированная
серная кислота создавала туман в калориметри-
ческой бомбе, при этом предполагалось, что ее концентрация была
одинаковой
по всему объему бомбы. Можно показать, что результаты,
полученные по этому
методу
Хаффмана и Эллиса, достаточно точны.
если сравнивать значения для тиофена, измеренные этим методом,
с соответствующими величинами, полученными более точным мето-
дом вращающейся калориметрической бомбы. Работы с тиофеном
по
методу
Хаффмана и Эллиса были выполнены также Уаддингто-
ном,
Ноултоном, Скоттом, Оливером, Тоддом, Хаббардом, Смитом
и
Хаффманом [1548], Муром, Ренквистом и Парксом
[1025]
и Франк-
лином
и Лампкином [440]. Все результаты согласуются в предела^
0,5
ккал/молъ
с принятым здесь значением.
Ввиду
неравномерного распределения серной кислоты в объеме
бомбы метод Хаффмана и Эллиса приводит к менее достоверным
XIII.
Химическая
термодинамика
серусодержащих
соединений
639
результатам, нежели метод вращающейся калориметрической бом-
бы,
при котором в бомбу вводится сравнительно большое количество
воды, а благодаря вращению обеспечивается однородность и опре-
деленный состав конечных продуктов. Работы по совершенствованию
метода вращающейся бомбы проводились Саннером в Лундском уни-
верситете и Уаддингтоном с сотрудниками в Бартлесвильской лабо-
ратории Горного бюро США. Дальнейшее улучшение результатов
Может быть достигнуто благодаря применения принципа сравнитель-
ных измерений, когда теплота сгорания смеси предельного
угле-
водорода и ромбической серы в соответствующих концентрациях
Ьравнивается с теплотой сгорания того соединения, для которого
Хотят установить теплоту образования. Подробное описание бомбо-
вой
калориметрии соединений серы и методов внесения поправок
для приведения к стандартному состоянию дано в работах
Хаббарда,
котта и Уаддингтона [637] и Уаддингтона, Саннера и
Хаббарда
1551]. В качестве стандартного вещества для калориметрии сгора-
я
соединений серы был предложен тиантрен.
Для серы приняты следующие стандартные состояния, указан-
:ые в работе Сталла и Зинке [1437]: ромбическая твердая сера от
198 до
368,6°
К, моноклинная твердая сера от
368,6
до
392°
К, равно-
осная
жидкость от 392 до
717,75°
К и состояние идеального
двух-
томного газа от
717,75
до
1000°
К. Это последнее стандартное
юстояние приводит к небольшим совершенно явным отклонениям
табулированных значениях энергии Гиббса для соединений серы
и
800°
К ввиду того, что пары серы при этой температуре содержат
:е только двухатомные, но и более крупные молекулы; однако пока
ще не получены точные данные, которые позволили бы определить
став паров серы при температурах несколько выше точки
кипения.
Несмотря
на это, табулированные значения энергии Гиббса
дают
основном
правильные представления о стабильности того или иного
единения
по сравнению с входящими в его состав элементами. Хотя
;спользование двухатомного газа в качестве стандартного состояния
является вполне правомерным во всем температурном интервале
298 до
1000°
К, все же это может привести к ошибочным представ-
юниям
об устойчивости того или иного соединения при низких
мпературах. Поэтому в
случае
необходимости переход от одного
•андартного состояния к
другому
легко сделать с помощью таблиц
алла и Зинке [1437].
При
расчете энтальпии образования по опубликованным значе-
ям
теплот сгорания данные относились к среднему значению
•альпии
образования водной серной кислоты согласно недавним
'Пределениям
Нефтяного исследовательского центра в Бартлесвиле
~~'9] и Термохимической лаборатории в
Лупде
[926]. Их значения
2
98
для реакции
S(c,
840
Часть
2.
Термические
и
термохимические
свойства
веществ
соответственно равны •—
212,17
и
—212,24
ккал/моль, а среднее
значение
составляет
—212,20
ккал/моль. Теплота образования S
2
(g)
2S(c,
rhombic)
=
S
2
(g),
равная
AHfl
9Siie
=
30,84
±- 0,15
ккал/молъ
и принятая Эвансом
и
Вагманом [399], использовалась и в настоящей работе.
Д-р Пилчер любезно предоставил его расчетные данные по орга-
ническим
соединениям серы (для целей сравнения) до их опублико-
вания.
Соединения
серы
служат
хорошим примером экстраполяции дан-
лых, относящихся к избранным
«ключевым»
членам отдельных клас-
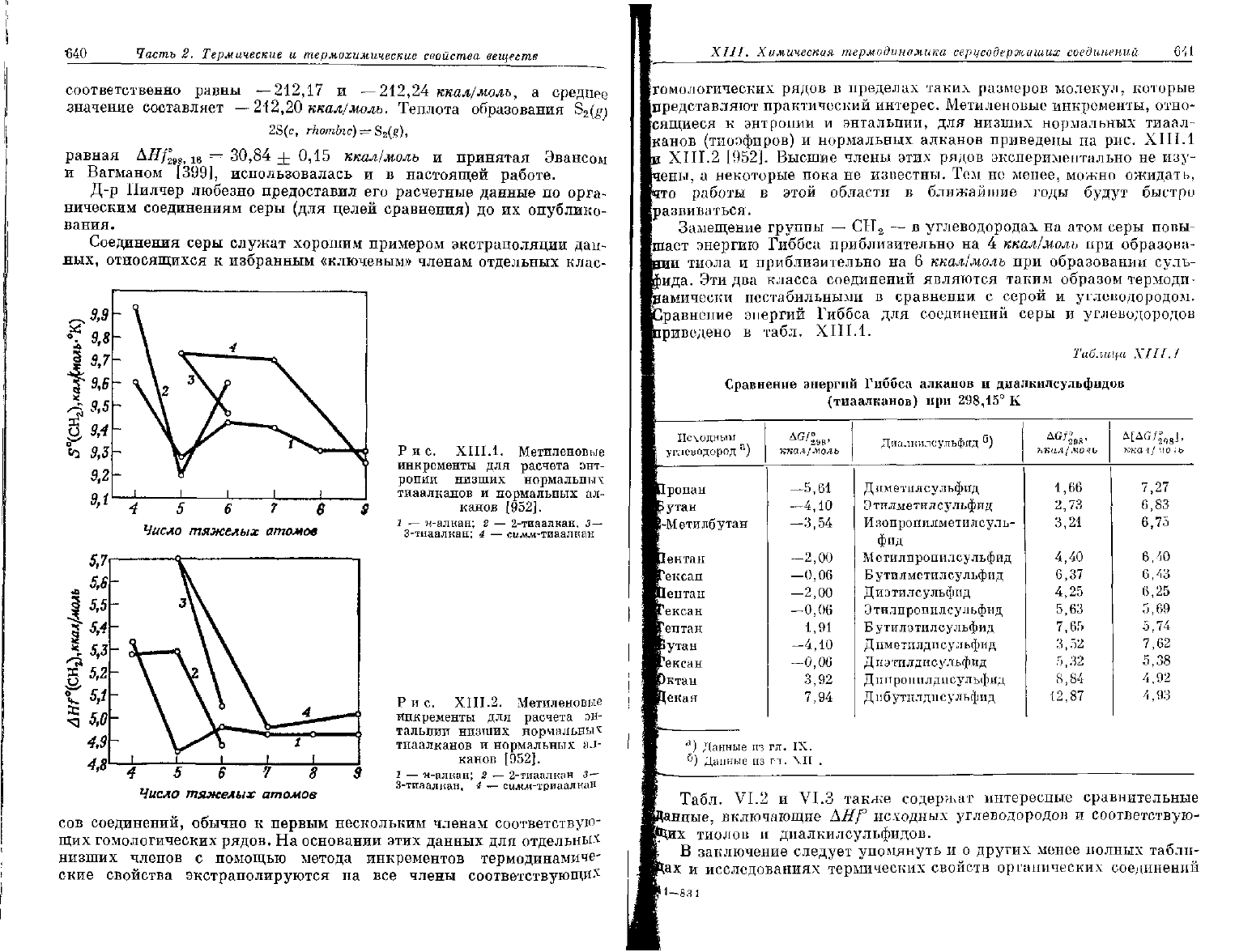
4 5 6 7 6
Число
тяжелых
атомов
Рис.
XIII.1.
Метиленовые
инкременты
для
расчета
энт-
ропии
низших нормальных
тиаалканов
и
нормальных
ал-
канов
[952].
1
•— и-алкан; 2 — 2-тиаалкан, 3—
3-тиаалкан; 4 — сижж-тиаалкан
XIII.
Химическая
термодинамика
серцсодержаших
соединений
641
4
5 6 7 8
Число тяжелых атомов
Р
и с.
XIII.2. Метиленовые
инкременты
для
расчета
эн-
тальпии низших нормальных
тиаалканов
и
нормальных
ал-
канов
[952].
1
— и-алкан; 2 — 2-тиаалкан 3—
3-тиаалкан, 4 — силии-триаалкая
сов соединений, обычно к первым нескольким членам соответствую-
щих гомологических рядов. На основании этих данных для отдельных
низших
членов с помощью метода инкрементов термодинамиче-
ские
свойства экстраполируются на все члены соответствующих
гомологических рядов в пределах таких размеров молекул, которые
представляют практический интерес. Метиленовые инкременты, отно-
сящиеся
к энтропии и энтальпии, для низших нормальных тиаал-
канов
(тиоэфиров) и нормальных алканов приведены на рис. ХШ.1
XIII.2 [952]. Высшие члены этих рядов экспериментально не изу-
чены,
а некоторые пока не известны. Тем не менее, можно ожидать,
что работы в этой области в ближайшие годы
будут
быстро
развиваться.
Замещение
группы — СН
2
— в
углеводородах
на атом серы повы-
шает энергию Гиббса приблизительно на 4
ккал/молъ
при образова-
нии
тиола и приблизительно на 6
ккал/моль
при образовании суль-
фида. Эти два класса соединений являются таким образом термоди-
аамически нестабильными в сравнении с серой и углеводородом.
Сравнение
энергий Гиббса для соединений серы и углеводородов
•фиведено в табл. XII 1.1.
Таблица
XIII.1
Сравнение энергий Гиббса алканов
и
диалкилсульфидов
(тиаалканов)
при 298,15° К
Исходный
углеводород
а
)
1ропан
эутан
^-Метилбутан
1ентан
Гексан
1ентан
Гексан
Гептан
teKcaH
)ктан
1екан
-5,61
-4,10
-3,54
-2,00
-0,06
-2,00
-0,06
1,91
-4,10
-0,06
3,92
7,94
Диалкилсульфид
б
)
Диметилсульфид
Этилметилсульфид
Изопропилметилсуль-
Фид
Метилпропилсульфид
Бутилметилсульфид
Диэтилсульфид
Отилпропилсульфид
Б
утилэтилсульфид
Диметилдисульфид
Диэтилдисульфид
Дипропилдисульфид
Дпбутилдпсульфид
пкал/мочь
угкач[
но i
1,66
2,73
3,21
4,40
6,37
4,25
5,63
7,65
3,52
5,32
8,84
12,87
7,27
6,83
6,75
6,40
6,43
6,25
5,69
5,74
7,62
5,38
4,92
4,93
а
)
Данные из гл. IX.
б) Данные из п. "VII .
Табл. VI.2 и VI.3 также содержат интересные сравнительные
анные,
включающие Л#/° исходных углеводородов и соответствую-
IX тиолов и диалкилсульфидов.
В заключение
следует
упомянуть и о
других
менее полных табли-
IX и исследованиях термических свойств органических соединений
М-831
