Сталл Д. Вестрам Э. Зинке Г. Химическая термодинамика органических соединений
Подождите немного. Документ загружается.

582
Часть
2.
Термические
и
термохимические
свойства
веществ
зом [572],
а
также Ричардсом
и
Уоллесом [1225], хорошо согласуются
между собой
и с
результатами, полученными Хиксом,
Хулееч
и
Стефенсоно.м [594]. Экспериментальные точки
в
интервале
от 250
до
340°
К
описываются
с
точностью
до
1 %
уравнением
Ср
(Г)
—
=
27,65
+
0,0137
Ыал(молъ-°К)].
Из
многочисленных расчетов термодинамических функций
по
спектроскопическим
данным можно упомянуть следующие:
Сте-
венсона
и
Бича [1419], Волда [1545], Черни
и
Эрдоса [207], Свердлина
[1451], Джеллеса
и
Питцера [465],
а
также Мадигана
и
Клевеленда
[912]. Принятые здесь значения взяты
из
работы Олбрайта, Джейле-
гара
и
Иннеса
[8],
в
которой вносились исправления
в
приближении
ангармоничности
на
основе теплоемкостей дифтордихлорметана
в
па-
рообразном состоянии, опубликованных Мейси [935].
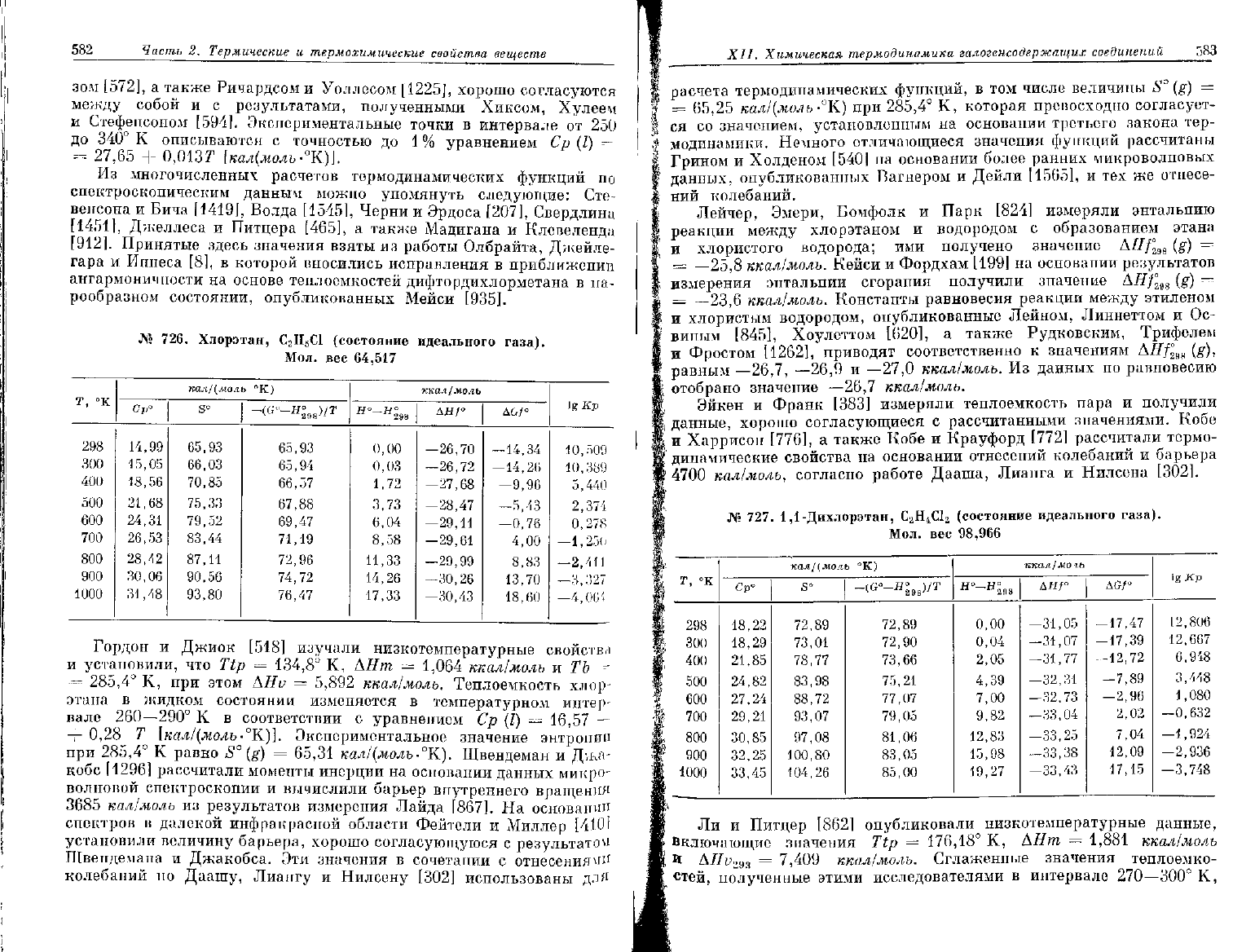
№
726.
Хлорэтан, С
2
Н
5
С1 (состояние идеального газа).
Мол.
вес
64,517
298
300
400
500
600
700
800
900
1000
кал/(моль
°К)
Ср"
14,99
15,05
18,56
21,68
24,31
26,53
28,42
30,06
31,48
s°
65,93
66,03
70,85
75,33
79,52
83,44
87,11
90,56
93,80
-<С°-Я;
м
)/Т
65,93
65,94
66,57
67,88
69,47
71,19
72,96
74,72
76,47
ккал^моль
Я
°-
Н
298
0,00
0,03
1,72
3,73
6,04
8,58
11,33
14,26
17,33
дн/°
—26,70
—26,72
-27,68
—28,47
—29,11
—29,61
-29,99
—30,26
-30,43
-14,34
—14,26
—9,96
—5,43
—0,76
4,00
8,83
13,70
18,60
Ig
Кр
10,509
10,389
5,440
2,374
0,278
—1,25(1
—2,411
—3,327
—4,004
Гордон
и
Джиок
[518]
изучали низкотемпературные свойства
и
установили,
что Ttp
=
134,8°
К,
АНпг
=
1,064
ккал/молъ
и
ТЪ
-=
=
285,4°
К, при
этом
AHv
=
5,892
ккал/молъ. Теплоемкость хлор-
этана
в
жидком состоянии изменяется
в
температурном интер-
вале
260—290°
К
в
соответствии
с
уравнением
Ср
(I)
=
16,57 —
+
0,28
Т
[кал/(молъ-°К)].
Экспериментальное значение энтропии
при
285,4°
К
равно
S°
(g)
=
65,31
кал/(моль-°К).
Швендеман
и
Джа-
кобс
[1296]
рассчитали моменты инерции
на
основании данных микро-
волновой спектроскопии
и
вычислили барьер внутреннего вращения
3685
кал/моль
из
результатов измерения Лайда [867].
На
основании
спектров
в
далекой инфракрасной области Фейтели
и
Миллер
[4101
установили величину барьера, хорошо согласующуюся
с
результатом
Швендемана
и
Джакобса.
Эти
значения
в
сочетании
с
отнесениями
колебаний
по
Даашу, Лиангу
и
Нилсену
[302]
использованы
для
XII.
Химическая термодинамика
галогенсодержащих
соединений
583
расчета термодинамических функций,
в
том
числе величины
S°
{g)
=
=
65,25
кал/(молъ
-°К)
при 285,4°
К,
которая превосходно согласует-
ся
со
значением, установленным
на
основании третьего закона
тер-
модинамики.
Немного отличающиеся значения функций рассчитаны
Грином
и
Холденом
[540]
на
основании более ранних микроволновых
данных, опубликованных Вагнером
и
Дейли [1565],
и тех же
отнесе-
ний
колебаний.
Лейчер, Эмери, Бомфолк
и
Парк
[824]
измеряли энтальпию
реакции
между хлорэтаном
и
водородом
с
образованием этана
и
хлористого водорода;
ими
получено значение
Ai7/°
98
(g)
=
=
—25,8
ккал/молъ. Кейси
и
Фордхам
[199]
на
основании результатов
измерения
энтальпии сгорания получили значение
ДЯ/°
98
(g)
=
=
—23,6
ккал/молъ. Константы равновесия реакции между этиленом
и
хлористым водородом, опубликованные Лейном, Линнеттом
и
Ос-
виным
[845], Хоулеттом [620],
а
также Рудковским, Трифелем
и
Фростом [1262], приводят соответственно
к
значениям
Д/Г/°
98
(g),
равным —26,7,
—26,9
и
—27,0
ккал/молъ.
Из
данных
по
равновесию
отобрано значение
—26,7
ккал/молъ.
Эйкен
и
Франк
[383]
измеряли теплоемкость пара
и
получили
данные,
хорошо согласующиеся
с
рассчитанными значениями. Кобе
и
Харрисон [776],
а
также Кобе
и
Крауфорд
[772]
рассчитали термо-
динамические свойства
на
основании отнесений колебаний
и
барьера
4700
кал/моль, согласно работе Дааша, Лианга
и
Нилсена [302].
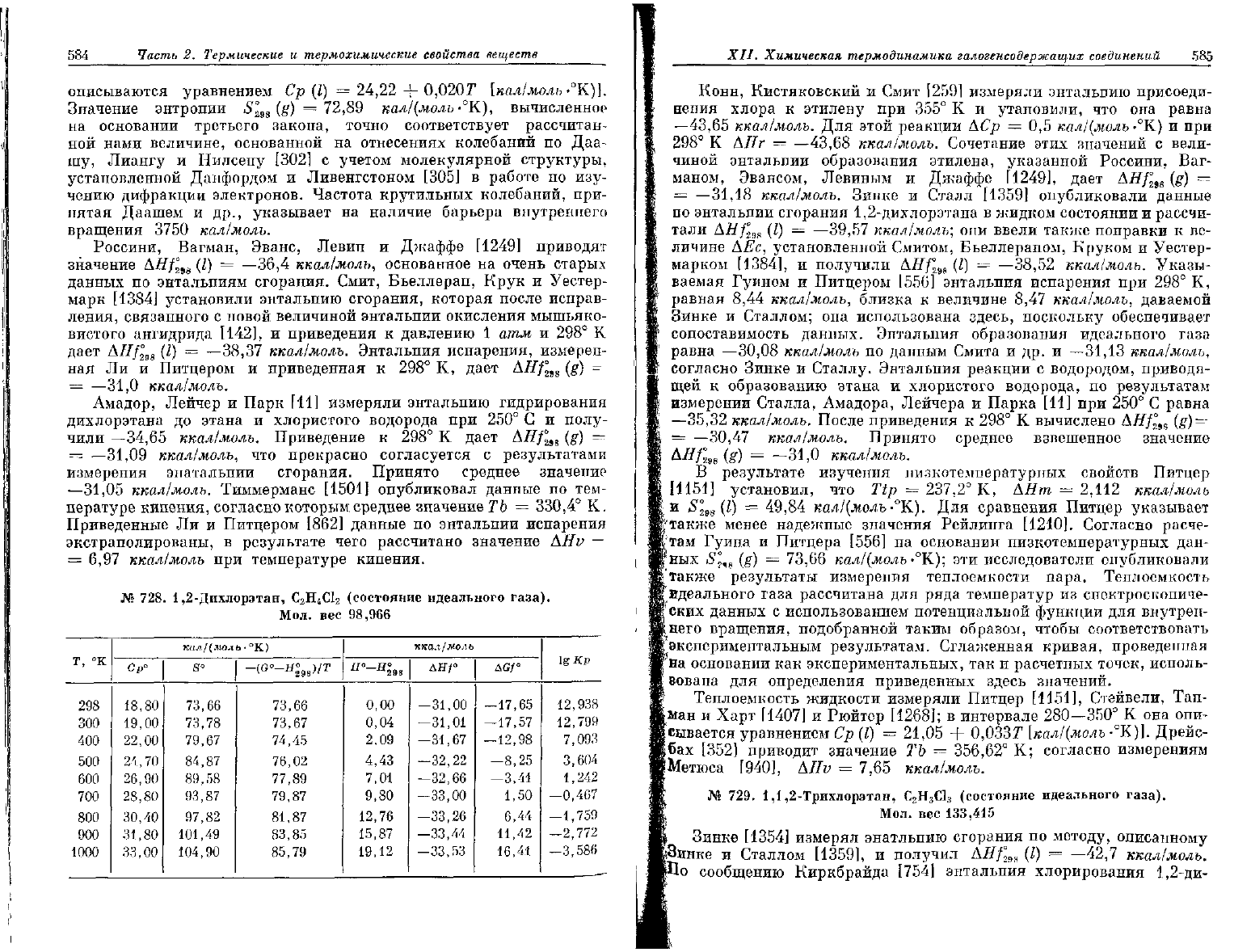
№
727.
1,1-Дихлорэтан,
С
2
Н
4
С1
2
(состояние идеального газа).
Мол.
вес
98,966
Т, °К
298
300
400
500
600
700
800
900
1000
пал/(моль
°К)
Ср"
18,22
18,29
21,85
24,82
27,24
29,21
30,85
32,25
33,45
S"
72,89
73,01
78,77
83,98
88,72
93,07
97,08
100,80
104,26
-(
G
°-
H
298^
T
72,89
72,90
73,66
75,21
77,07
79,05
81,06
83,05
85,00
ккал/могь
Я
°~
Н
298
0,00
0,04
2,05
4,39
7,00
9,82
12,83
15,98
19,27
ЛЯ/"
-31,05
—31,07
—31,77
—32,31
—32,73
-33,04
—33,25
-33,38
—33,43
AGf"
—17,47
-17,39
—
12,72
—7,89
—2,96
2,02
7,04
12,09
17,15
12,806
12,667
6,948
3,448
1,080
-0,632
-1,924
-2,936
—3,748
Ли
и
Питцер
[862]
опубликовали низкотемпературные данные,
включающие значения
Ttp
=
176,18°
К, АНш
=
1,881
ккал/молъ
И
АНи
2
9з
=
7,409
ккал/молъ. Сглаженные значения теплоемко-
стей, полученные этими исследователями
в
интервале
270—300°
К,
584
Часть
2. Термические и
термохимические
свойства
веществ
описываются уравнением
Ср (I) =
24,22
+
0,020Т
[кал/моль-°К)].
Значение энтропии
S°
MS
(g) =
72,89 кал
/
(моль-°К),
вычисленное
на
основании третьего закона, точно соответствует рассчитан-
ной
нами величине, основанной
на
отнесениях колебаний
по Даа-
шу, Лиангу
и
Нилсену
[302] с
учетом молекулярной структуры,
установленной Данфордом
и
Ливенгстоном
[305] в
работе
по изу-
чению дифракции электронов. Частота крутильных колебаний,
при-
нятая
Даашем
и др.,
указывает
на
наличие барьера внутреннего
вращения
3750
кал/моль.
Россини,
Вагман, Эванс, Левин
и
Джаффе
[1249]
приводят
значение
AHf°
2iS
(I)
=
—36,4
ккал/молъ, основанное
на
очень старых
данных
по
энтальпиям сгорания. Смит, Бьеллерап, Крук
и
Уестер-
марк
[1384]
установили энтальпию сгорания, которая после исправ-
ления,
связанного
с
новой величиной энтальпии окисления мышьяко-
вистого ангидрида [142],
и
приведения
к
давлению
1 атм и 298° К
дает
AHf
MS
(I)
=
—38,37
ккал/молъ. Энтальпия испарения, измерен-
ная
Ли и
Питцером
и
приведенная
к 298° К,
дает
AHf
2iS
(g) —
=
—31,0
ккал/молъ.
Амадор, Лейчер
и
Парк
[11]
измеряли энтальпию гидрирования
дихлорэтана
до
этана
и
хлористого водорода
при 250° С и
полу-
чили
—34,65
ккал/молъ. Приведение
к 298° К
дает
AHf
2ig
(g) =
=
—31,09
ккал/молъ,
что
прекрасно согласуется
с
результатами
измерения энатальпии сгорания. Принято среднее значение
—31,05
ккал/молъ. Тиммерманс
[1501]
опубликовал данные
по тем-
пературе кипения, согласно которым среднее значение ТЪ
= 330,4° К.
Приведенные
Ли и
Питцером
[862]
данные
по
энтальпии испарения
экстраполированы,
в
результате чего рассчитано значение
AHv —
=
6,97
ккал/молъ
при
температуре кипения.
№
728.
1,2-Дихлорэтан,
С
2
Н
4
С1
2
(состояние идеального газа).
Мол.
вес
98,966
Т,
"К
298
300
400
500
600
700
800
900
1000
кал/(молЬ'°К)
Ср°
18,80
19,00
22,00
24,70
26,90
28,80
30,40
31,80
33,00
s°
73,66
73,78
79,67
84,87
89,58
93,87
97,82
101,49
104,90
-<.G°-H°
29S
)/T
73,66
73,67
74,45
76,02
77,89
79,87
81,87
83,85
85,79
икал/моль
тто
иго
0,00
0,04
2,09
4,43
7,01
9,80
12,76
15,87
19,12
АН)"
—31,00
—31,01
-31,67
-32,22
—32,66
-33,00
—33,26
-33,44
—33,53
AGf°
-17,65
—17,57
—12,98
—8,25
-3,41
1,50
6,44
11,42
16,41
lg Кр
12,938
12,799
7,093
3,604
1,242
-0,467
-1,759
—2,772
—3,586
XII.
Химическая
термодинамика
галогенсодержащих
соединений
585
Конн,
Кистяковский
и
Смит
[259]
измеряли энтальпию присоеди-
нения
хлора
к
этилену
при 355° К и
утановили,
что она
равна
—43,65
ккал/молъ.
Для
этой реакции
АСр — 0,5
кал/(молъ
-°К)
и при
298°
К АНг =
—43,68
ккал/молъ. Сочетание этих значений
с
вели-
чиной
энтальпии образования этилена, указанной Россини,
Ваг-
маном, Эвансом, Левиным
и
Джаффе [1249], дает
AHf
29S
(g) —
=
—31,18
ккал/молъ. Зинке
и
Сталл
[1359]
опубликовали данные
по
энтальпии сгорания 1,2-дихлорэтана
в
жидком состоянии
и
рассчи-
тали
AHf°
iaa
(Г)
=
—39,57
ккал/молъ;
они
ввели также поправки
к ве-
личине
АЕс,
установленной Смитом, Бьеллерапом, Круком
и
Уестер-
марком [1384],
и
получили
AHf\
w
(I)
=
—38,52
ккал/молъ. Указы-
ваемая Гуином
и
Питцером
[556]
энтальпия испарения
при 298° К,
равная
8,44
ккал/молъ, близка
к
величине
8,47
ккал/молъ, даваемой
Зинке
и
Сталлом;
она
использована здесь, поскольку обеспечивает
сопоставимость данных. Энтальпия образования идеального газа
равна
—30,08
ккал/молъ
по
данным Смита
и др. и
—31,13
ккал/молъ,
согласно Зинке
и
Сталлу. Энтальпия реакции
с
водородом, приводя-
щей
к
образованию этана
и
хлористого водорода,
по
результатам
измерении Сталла, Амадора, Лейчера
и
Парка
[11] при 250° С
равна
—35,32
ккал/молъ. После приведения
к 298° К
вычислено
A/7/°
9S
(g)~
=
—30,47
ккал/молъ. Принято среднее взвешенное значение
AHfl
ss
(g) = —31,0
ккал/молъ.
В результате изучения низкотемпературных свойств Питцер
[1151]
установил,
что Ttp = 237,2° К, АНт = 2,112
ккал/молъ
и
'S'-MS
(0
=
49,84
кал/(моль-°К).
Для
сравнения Питцер указывает
^
также менее надежные значения Рейлинга [1210]. Согласно расче-
'.
там
Гуина
и
Питцера
[556] на
основании низкотемпературных
дан-
fx
S
24S
(g) =
73,66
кал/(молъ
*°К);
эти
исследователи опубликовали
также результаты измерения теплоемкости пара. Теплоемкость
' идеального газа рассчитана
для
ряда температур
из
спектроскопиче-
ских данных
с
использованием потенциальной функции
для
внутрен-
1него вращения, подобранной таким образом, чтобы соответствовать
['экспериментальным результатам. Сглаженная кривая, проведенная
J
На основании
как
экспериментальных,
так и
расчетных точек, исполь-
зована
для
определения приведенных здесь значений.
Теплоемкость жидкости измеряли Питцер [1151], Стейвели,
Тап-
|ман
и
Харт
[1407]
и
Рюйтер [1268];
в
интервале
280—350°
К она опи-
|сывается уравнением
Ср
(I)
= 21,05 +
0,033Г
[кал/(молъ
-°К)]. Дрейс-
|бах
[352]
приводит значение
ТЪ = 356,62° К;
согласно измерениям
Щетюса [940],
AHv = 7,65
ккал/молъ.
№
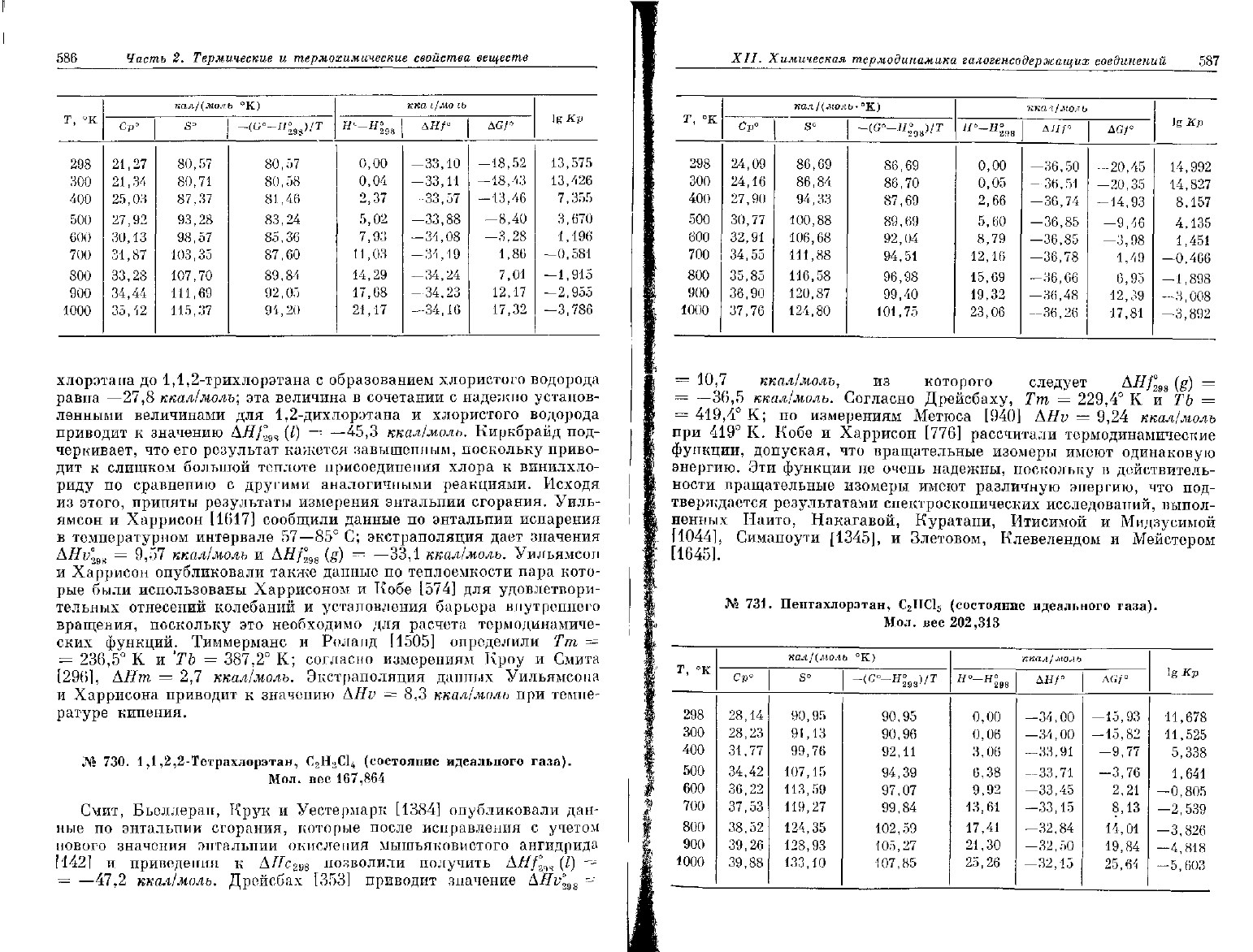
729.
1,1,2-Трихлорэтан,
С
2
Н
3
С1
3
(состояние идеального газа).
Мол.
вес
133,415
Зинке
[1354]
измерял энатльпию сгорания
по
методу, описанному
Зинке
и
Сталлом [1359],
и
получил
AHf
298
(I) =
—42,7
ккал/молъ.
1о сообщению Киркбрайда
[754]
энтальпия хлорирования
1,2-ди-
586
Часть
2.
Термические
и
термохимические свойства веществ
Т, "К
298
300
400
500
600
700
800
900
1000
кал/(моль
°К)
c
v
°
21,27
21,34
25,03
27,92
30,13
31,87
33,28
34,44
35,42
S-
80,57
80,71
87,37
93,28
98,57
103,35
107,70
111,69
115,37
80,57
80,58
81,46
83,24
85,36
87,60
89,84
92,05
94,20
кпа
i/мо
ib
0,00
0,04
2,37
5,02
7,93
11,03
14,29
17,68
21,17
АН
Г
—33,10
—33,11
—33,57
-33,88
—34,08
—31,19
-34,24
—34,23
—34,16
AGf°
—18,52
-18,43
—
13,46
—8,40
—3,28
1,86
7,01
12,17
17,32
lg
Кр
13,575
13,426
7,355
3,670
1,196
-0,581
—1,915
-2,955
—3,786
хлорэтана
до
1,1,2-трихлорэтана
с
образованием хлористого водорода
равна
—27,8
ккал/молъ;
эта
величина
в
сочетании
с
надежно установ-
ленными
величинами
для
1,2-дихлорэтана
и
хлористого водорода
приводит
к
значению
АЯ/°
9
,
(I)
=
—45,3
ккал/молъ. Киркбрайд
под-
черкивает,
что его
результат кажется завышенным, поскольку приво-
дит
к
слишком большой теплоте присоединения хлора
к
винилхло-
риду
по
сравнению
с
другими аналогичными реакциями. Исходя
из
этого, приняты результаты измерения энтальпии сгорания. Уиль-
ямсон
и
Харрисон
[1617]
сообщили данные
по
энтальпии испарения
в
температурном интервале
57—85°
С;
экстраполяция дает значения
Д//у°
98
= 9,57
ккал/молъ
и AHf
M8
(g) =
—33,1
ккал/молъ. Уильямсон
и
Харрисон опубликовали также данные
по
теплоемкости пара кото-
рые были использованы Харрисоном
и
Кобе
[574] для
удовлетвори-
тельных отнесений колебаний
и
установления барьера внутреннего
вращения,
поскольку
это
необходимо
для
расчета термодинамиче-
ских функций. Тиммерманс
и
Роланд
[1505]
определили
Ттп
=
=
236,5°
К и
'ТЪ
=
387,2°
К;
согласно измерениям Кроу
и
Смита
[296], АНтп
= 2,7
ккал/молъ. Экстраполяция данных Уильямсона
и
Харрисона приводит
к
значению
AHv = 8,3
ккал/молъ
при
темпе-
ратуре
кипения.
№
730.
1,1,2,2-Тетрахлорэтан,
С
2
Н
2
С1
4
(состояние
идеального
газа).
Мол.
вес
167,864
Смит,
Бьеллерап, Крук
и
Уестермарк
[1384]
опубликовали
дан-
ные
по
энтальпии сгорания, которые после исправления
с
учетом
нового значения энтальпии окисления мышьяковистого ангидрида
[142]
и
приведения
к
АИс
29
&
позволили получить
АЯ/°„ (Z)
-=
=
—47,2
ккал/молъ. Дрейсбах
[353]
приводит значение
AHv°
29S
=
XII.
Химическая
термодинамика
галогенсодержащих
соединений
587
298
300
400
500
600
700
800
900
1000
кал/(моль-
°К)
Ср°
24,09
24,16
27,90
30,77
32,91
34,55
35,85
36,90
37,76
s°
86,69
86,84
94,33
100,88
106,68
111,88
116,58
120,87
124,80
-(С°-Н°
98
)/г
86,69
86,70
87,69
89,69
92,04
94,51
96,98
99,40
101,75
кпаг[моль
Н
~"
Й
298
0,00
0,05
2,66
5,60
8,79
12,16
15,69
19,32
23,06
дя/°
—36,50
—36,51
—36,74
—36,85
—36,85
—36,78
—36,66
—36,48
—36,26
AGf°
—20,45
—20,35
—14,93
—9,46
—3,98
1,49
6,95
12,39
17,81
Jg-Kp
14,992
14,827
8,157
4,135
1,451
—0,466
—1,898
—3,008
—3,892
=
10,7
ккал/молъ,
из
которого
следует
ДЯ/°
98
(g) =
=
—36,5
ккал/молъ. Согласно Дрейсбаху,
Тт =
229,4°
К и ТЪ =
=
419,4°
К; по
измерениям Метюса
[940] AHv = 9,24
ккал/молъ
при
419° К.
Кобе
и
Харрисон
[776]
рассчитали термодинамические
функции,
допуская,
что
вращательные изомеры имеют одинаковую
энергию.
Эти
функции
не
очень надежны, поскольку
в
действитель-
ности
вращательные изомеры имеют различную энергию,
что под-
тверждается результатами спектроскопических исследований, выпол-
ненных
Наито, Накагавой, Куратани, Итисимой
и
Мидзусимой
[1044], Симаноути [1345],
и
Злетовом, Клевелендом
и
Мейстером
[1645].
№
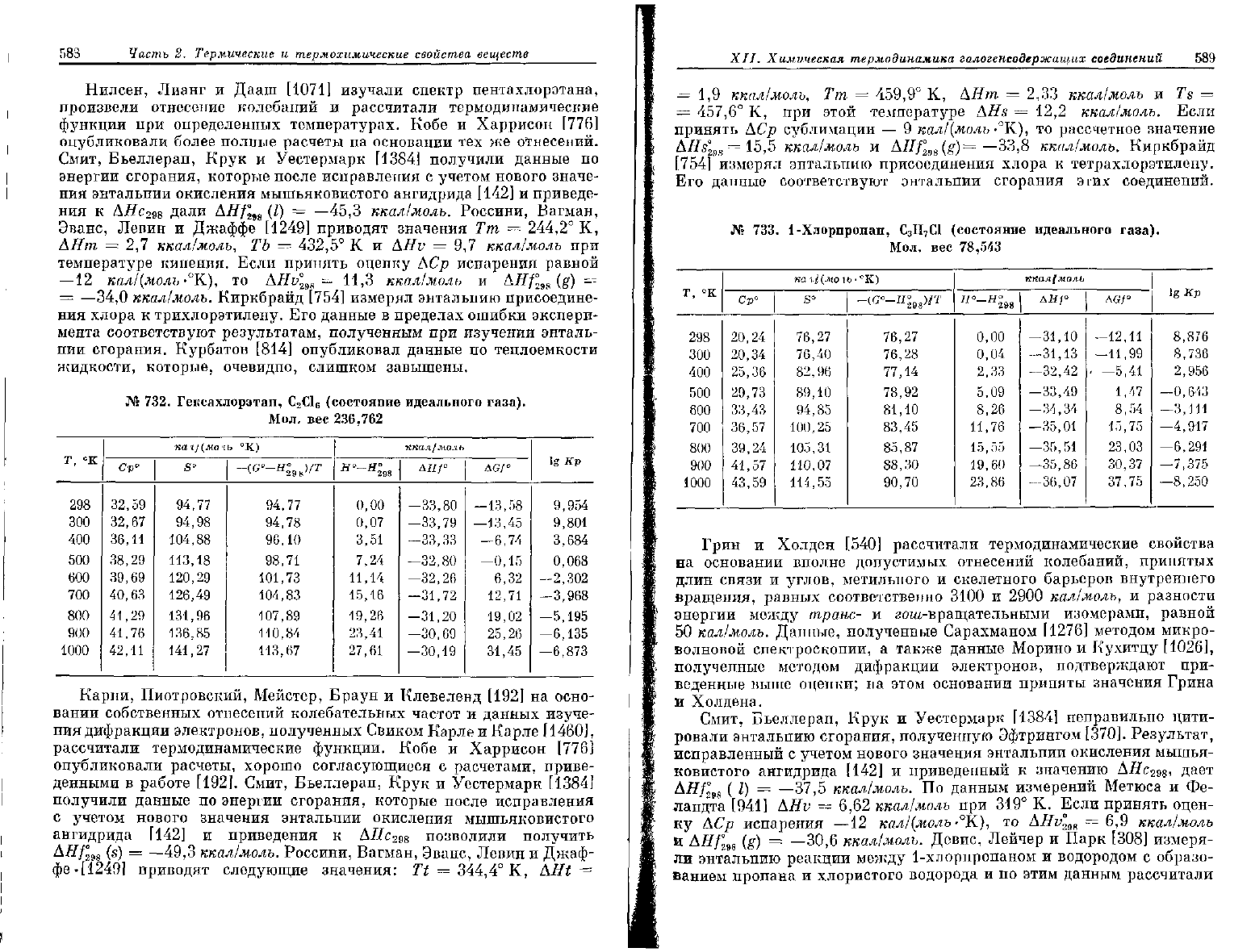
731.
Пентахлорэтан, С
2
НС1
5
(состояние
идеального
газа).
Мол.
вес
202,313
298
300
400
500
600
700
800
900
1000
Ср°
28,14
28,23
31,77
34,42
36,22
37,53
38,52
39,26
39,88
кал/
(моль
S°
90,95
91,13
99,76
107,15
113,59
119,27
124,35
128,93
133,10
°К)
-<с°-я
2
°
и
)/г
90,95
90,96
92,11
94,39
97,07
99,84
102,59
105,27
107,85
Я
°-
Н
298
0,00
0,06
3,06
6,38
9,92
13,61
17,41
21,30
25,26
ккал/моль
ДЯ/°
—34,00
—34,00
—33,91
—33,71
—33,45
—33,15
—32,84
—32,50
—32,15
AGf
—15
—15,
—9,
—3,
2,
8,
14,
19,
25,
°
93
82
77
76
21
13
01
84
64
ig
И,
11,
5,
1,
-0,
—2,
-з,
—4,
—5,
Кр
678
525
338
641
805
539
826
818
603
583
Часть
2. Термические и
термохимические
свойства
веществ
1
Нилсен,
Лианг
и
Дааш
[1071]
изучали спектр пентахлорэтана,
произвели отнесение колебаний
и
рассчитали термодинамические
функции
при
определенных температурах. Кобе
и
Харрисон
[776]
опубликовали более полные расчеты
на
основании
тех же
отнесепий.
Смит, Бьеллерап, Крук
и
Уестермарк
[1384]
получили данные
по
энергии сгорания, которые после исправления
с
учетом нового значе-
ния
энтальпии окисления мышьяковистого ангидрида
[142] и
приведе-
ния
к
AHc
2SS
дали
AHf
2w
(Г)
=
—45,3
ккал/молъ. Россини, Вагман,
Эванс,
Левин
и
Джаффе
[1249]
приводят значения
Тт = 244,2° К,
АНт
= 2,7
ккал/молъ,
ТЪ — 432,5° К и AHv = 9,7
ккал/молъ
при
температуре кипения. Если принять оценку
АСр
испарения равной
—12
кал/(молъ-°~К),
то
AHv°
i9S
= 11,3
ккал/молъ
и
AHf\
w
(g)
--
=
—34,0
ккал/молъ. Киркбрайд
[754]
измерял энтальпию присоедине-
ния
хлора
к
трихлорэтилену.
Его
данные
в
пределах ошибки экспери-
мента соответствуют результатам, полученным
при
изучении энталь-
пии
сгорания. Курбатов
[814]
опубликовал данные
по
теплоемкости
жидкости, которые, очевидно, слишком завышены.
№
732.
Гексахлорэтан, С
2
С1
6
(состояние идеального газа).
Мол.
вес
236,762
т,
°к
298
300
400
500
600
700
800
900
1000
КО1/(Л10 1Ь
°К)
Ср°
32,59
32,67
36,11
38,29
39,69
40,63
41,29
41,76
42,11
S"
94,77
94,98
104,88
113,18
120,29
126,49
131,96
136,85
141,27
-(
G
°-
H
29
8>/
T
94,77
94,78
96,10
98,71
101,73
104,83
107,89
110,84
113,67
ккал/моль
0,00
0,07
3,51
7,24
11,14
15,16
19,26
23,41
27,61
дн/°
-33,80
—33,79
—33,33
—32,80
—32,26
—31,72
—31,20
-30,69
—30,19
AGf°
—13,58
—13,45
—6,74
—0,15
6,32
12,71
19,02
25,26
31,45
lg Кр
9,954
9,801
3,684
0,068
-2,302
—3,968
-5,195
—6,135
—6,873
Карни,
Пиотровский, Мейстер, Браун
и
Клевеленд
[192] на
осно-
вании
собственных отнесений колебательных частот
и
данных изуче-
ния
дифракции электронов, полученных Свиком Карле
и
Карле [1460],
рассчитали термодинамические функции. Кобе
и
Харрисон
[776]
опубликовали расчеты, хорошо согласующиеся
с
расчетами, приве-
денными
в
работе [192]. Смит, Бьеллерап, Крук
и
Уестермарк
[1384]
получили данные
по
энергии сгорания, которые после исправления
с учетом нового значения энтальпии окисления мышьяковистого
ангидрида
[142] и
приведения
к
AHc
2S8
позволили получить
АЯ/°
98
(s) =
—49,3
ккал/молъ. Россини, Вагман, Эванс, Левин
и
Джаф-
фе
-[1249]
приводят следующие значения:
Tt = 344,4° К, AHt ~
XII.
Химическая
термодинамика
галогенсодержащих
соединений
589
•=1,9
ккал/молъ,
Тт = 459,9° К, АНт = 2,33
ккал/молъ
и Ts =
=
457,6° К, при
этой температуре
AHs = 12,2
ккал/молъ. Если
принять
АСр
сублимации
— 9
кал/(молъ-
О
К),
то
рассчетное значение
AHsl
9g
= 15,5
ккал/молъ
и
A#/°
98
(g)=—33,8 ккал/молъ. Киркбрайд
[754] измерял энтальпию присоединения хлора
к
тетрахлорэтилепу.
Его данпые соответствуют энтальпии сгорания эгих соединений.
№
733.
1-Хлорпропан,
С
3
Н
7
С1
(состояние
идеального
газа).
Мол.
вес 78,543
Г,
°К
298
300
400
500
600
700
800
900
1000
ксиЦмо
tb'°K)
Ср°
20,24
20,34
25,36
29,73
33,43
36,57
39,24
41,57
43,59
s°
76,27
76,40
82,96
89,10
94,85
100,25
105,31
110,07
114,55
-(G°-H°
98
)/r
76,27
76,28
77,14
78,92
81,10
83,45
85,87
88,30
90,70
ккал/моль
Я
°-
Н
298
0,00
0,04
2,33
5,09
8,26
11,76
15,55
19,60
23,86
дн/°
-31,10
-31,13
—32,42
-33,49
—34,34
—35,01
—35,51
-35,86
—36,07
AG/°
-12,11
—11,99
'
-5,41
1,47
8,54
15,75
23,03
30,37
37,75
lg Кр
8,876
8,736
2,956
-0,643
—3,111
—4,917
—6,291
—7,375
-8,250
Грин
и
Холден
[540]
рассчитали термодинамические свойства
на
основании вполне допустимых отнесений колебаний, принятых
длин связи
и
углов, метального
и
скелетного барьеров внутреннего
вращения,
равных соответственно
3100 и
2900
кал/моль,
и
разности
энергии между
транс-
и
гош-вращательными изомерами, равной
50 кал/моль. Данные, полученные Сарахманом
[1276]
методом микро-
волновой спектроскопии,
а
также данные Морино
и
Кухитцу [1026],
полученные методом дифракции электронов, подтверждают
при-
веденные выше оценки;
на
этом основании приняты значения Грина
и
Холдена.
Смит, Бьеллерап, Крук
и
Уестермарк
[1384]
неправильно цити-
ровали энтальпию сгорания, полученную Эфтрингом[370]. Результат,
исправленный
с
учетом нового значения энтальпии окисления мышья-
ковистого ангидрида
[142] и
приведенный
к
значению Д#с
29
8, дает
Д#/°
98
( I) =
—37,5
ккал/молъ.
По
данным измерений Метюса
и Фе-
ландта
[941] AHv — 6,62
ккал/молъ
при 319° К.
Если принять оцен-
ку
АСр
испарения
—12
кал/(моль -°К),
то
AHv°
ws
= 6,9
ккал/молъ
и
Д#/°
98
(g) =
—30,6
ккал/молъ. Девис, Лейчер
и
Парк
[308]
измеря-
ли энтальпию реакции между 1-хлорпропаном
и
водородом
с
образо-
ванием пропана
и
хлористого водорода
и по
этим данным рассчитали
590
Часть
2. Термические и термохимические
свойства
веществ
значение
AHf
2w
(g)
= — 31,54
ккал/молъ. Принято среднее значе-
ние
—31,1
ккал/молъ.
Данные Тиммерманса
[1501]
по
температурам перехода
не
отли-
чаются согласованностью.
В
лаборатории Тиммерманса получены
следующие значения:
Тт = 150,35° К и ТЪ = 319,75° К.
Перез
Масиа
и
Диаз Пенья
[1137]
опубликовали значения вторых вириаль-
ных коэффициентов
для
пара
в
температурном интервале
323—398° К.
№
734.
2-Хлорпропан, С
3
Н
7
С1 (состояние идеального газа).
Мол.
вес
78,543
298
300
400
500
600
700
800
900
1000
Cv°
20,87
20,97
25,99
30,48
34,20
37,30
39,94
42,20
44,16
кал/(мо
гь °
S°
72,70
72,83
79,57
85,86
91,76
97,27
102,43
107,26
111,81
К)
(G°-h
72,
72,
73,
75,
77,
80,
82,
85,
87,
О \ If
293"
J
70
71
59
42
66
07
55
03
48
Н
°~
Н
2В8
0,00
0,04
2,40
5,23
8,47
12,04
15,91
20,02
24,34
ккал/моль
AHf°
—35,00
-35,03
—36,26
-37,26
—38,04
—38,62
—39,05
—39,33
-39,49
AGf
—14,
-14,
у
—0,
6,
14,
21,
29,
37,
°
94
82
89
68
71
22
79
42
07
ig
10
10
4
0
2
—4
—5
—7
—8
Кр
,
954
,797
,312
,297
,443
,439
,952
143
,102
Термодинамические функции рассчитаны
на
основании предло-
женных Шеппердом
[1344]
отнесений колебаний; средние длины
свя-
зей рекомендованы Саттоном [1449]; согласно оценке, барьер внут-
реннего вращения составляет
4,0
ккал/молъ. Данные Ямаха
[1637]
по
дифракции электронов согласуются
в
пределах эксперименталь-
ной
ошибки
с
величинами длин связей
по
Саттону. Расчетные значе-
ния
термодинамических функций использовали
в
сочетании
с кон-
стантами равновесия реакции дегидрохлорирования, эксперимен-
тально установленными Хоулеттом [620],
и
таким образом было
рас-
считано значение
Afff
Z
g
8
(g) =
—35,2
ккал/моль. Менее точные
дан-
ные
по
равновесиям, полученные Энтелисом
и
Чирковым [379],
при-
водят
к
значению
AHf
2ss
(g) =
—34,6
ккал/моль. Смит, Бьеллерап.
Крук
и
Уестермарк
[1384]
опубликовали данные
по
энергии сгорания,
которые после исправления
с
учетом нового значения энтальпии
окисления
мышьяковистого ангидрида
[142] и
приведения
к
АНс
29л
дают
AHf
29S
(/) =
—42,3
ккал/молъ. Метюс
и
Феландт
[941]
опреде-
лили
AHv = 6,34
ккал/молъ
при 309° К.
Если принять оценку
АСр
испарения
—12
кал/(моль-°К),
то
Affv°
29S
= 6,47
ккал/молъ. Сочета-
ние
этих значений
с
результатами Смита
и др.
дает
AHf
29S
(g) —
=
—35,8
ккал/молъ,
что
хорошо согласуется
с
экспериментальными
XII.
Химическая термодинамика
галогенсодержащих
соединений
591
величинами. Девис, Лейчер
и
Парк
[308]
определили энтальпию реак-
ции
с
водородом, приводящей
к
образованию пропана
и
хлористого
во-
дорода,
на
основании чего рассчитали
AHf
V9S
(g)
=
—32,93
ккал/моль,
которая кажется слишком положительной. Принято среднее взвешен-
ное значение, равное
—35,0
ккал/молъ.
Тиммерманс
[1501]
приводит
Тт = 156,2° К и ТЪ = 308,0° К.
Перез Масиа
и
Диаз Пенья
[1137]
измеряли мольные объемы пара
в температурном интервале
313—398° К.
№
735.
1,2-Дихлорпропан,
С
3
Н
6
С1
2
(состояние идеального газа).
Мол.
вес
112,992
г, °к
298
300
400
500
600
700
800
900
1000
каг/(чо
ib °К)
Ср°
23,47
23,60
28,60
32,95
36,47
39,47
41,97
44,18
46,08
84,80
84,95
92,44
99,30
105,63
111,48
116,92
122,00
126,75
-(&°-Н|„
в
)/Т
84,80
84,81
85,79
87,82
90,27
92,89
95,55
98,21
100,83
пка
г/мо гь
JJO
TJJO
0,00
0,05
2,66
5,75
9,22
13,02
17,10
21,41
25,92
дн/°
—39,60
—39,62
—40,66
—41,48
—42,11
-42,56
—42,87
—43,04
—43,09
AGf°
—19,86
—
19,74
—12,95
—5,92
1,25
8,52
15,83
23,18
30,55
14,558
14,380
7,074
2,588
—0,455
—2,659
—4,325
—5,630
-6,676
Согласно
Амадору,
Лейчеру
и
Парку
[11],
энтальпия реакции
1,2-дихлорпропана
с
водородом
при 250° С,
которая приводит
к
обра-
зованию пропана
и
хлористого водорода, равна
—31,215
ккал/молъ;
приведение
к 298° К
дает
ДЯ/°
И
(g) =
—39,08
ккал/молъ.
По
сообще-
нию Смита, Бьеллерапа, Крука
и
Уестермарка
[1384]
результаты
измерения энергии сгорания, исправленные
с
учетом нового
зна-
чения
эшальпии окисления мышьяковистого ангидрида
[142] и при-
веденные
к Ai7c°
98
,
дают
АЯ/°
98
(I) —
—48,7
ккал/молъ. Согласно
Дрейсбаху [353], AITv\
w
— 8,68
ккал/молъ,
что
дает
ДЯ/°,„
(g) =
=
—40,0
ккал/молъ. Принято среднее значение
—39.6
ккал/молъ.
Термодинамические функции
для
состояния идеального газа
Оценены
с
использованием констант, приведенных
в
табл. XII.2.
По
дашгъпг Дрейсбаха
Тт = 172,71° К, ТЪ = 369,52° К и AHv =
=
7,59
ккал
!
молъ
при
точке
кипения.
В
работе Курбатова
[814] при-
водятся приближенные данные
по
теплоемкости жидкости. Изучены
Структура
и
барьеры внутреннего вращения
на
основании данных
По
дипольным моментам [1090], спектрам комбинационного рассеяния
{1027],
теплоемкости
при
низких температурах
[296] и
дифракции
электронов [1627].
592
Часть
2. Термические и
термохимические
свойства
веществ
№
736.
1,3-Дихлорпропан,
СзН
6
С1г
(состояние
идеального
газа).
Мол.
вес 112,992
Т, "К
298
300
400
500
600
700
800
900
1000
палЦмоль
°К)
Ср°
23,81
23,93
28,69
32,82
3(3,22
39,11
41,56
43,70
45,50
s°
87,76
87,91
95,46
102,32
108,62
114,42
119,81
124,83
129,53
-<
С
°-
Н
298>/
Г
87,76
87,77
88,76
90,80
93,25
95,87
98,53
101,17
103,78
кка
г/моль
И
°-
Я
298
0,00
0,05
2,69
5,77
9,22
12,99
17,03
21,30
25,76
АН/»
—38,60
—38,62
-39,64
—40,46
—
11,11
—
41,59
-41,94
—42,16
—42,26
AGf°
—19,74
—19,63
—
13,14
--6,41
0,46
7,43
14,45
21,52
28,61
lg
Кр
14,472
14,298
7,176
2,802
—0,167
—2,320
-3,948
—5,226
—6,251
Пересчет энергии сгорания
по
Смиту, Бьеллерапу, Круку
и
Уестермарку
[1384]
с
учетом нового значения энтальпии окисле-
ния
мишьяковистого ангидрида
[142] и
приведение
к АНс°
гт
дану
Д#/°
9?
(/) =
—48,3
ккал/моль. Согласно Дрейсбаху [353],
AHv°
29S
-
=
9,66
ккал/молъ,
что
дает
AHf
29S
(I)
=
—38,6
ккал/молъ. Термоди-
намические функции
для
состояния идеального газа оценены
с
исполь-
зованием констант, приведенных
в
табл. XII.2.
По
данным Дрейс-
баха
[353] Тт = 173,7° К, ТЪ = 393,6° К и при
этой температуре
i\Hv
= 8,10
ккал/молъ..
№
737.
2,2-Дихлорпропан,
С
3
Н
6
С1
2
(состояние
идеального
газа).
Мол.
вес
112,992
Г,
°К
298
300
400
500
600
700
800
900
1000
палЦмоль
°К)
C
V
°
25,30
25,
i0
30,56
34,75
38,06
40,75
43,00
44,91
46,56
s°
77,92
78,08
86,12
93,40
100,04
106,12
111,71
116,89
121,71
-(G--ff|
M
)/T
77,92
77,93
78,99
81,15
83,76
86,52
89,33
92,10
94,83
ккал1моль
H
°~
H
298
0,00
0,05
2,86
6,13
9,78
13,72
17,91
22,31
26,88
AHf
-42,00
—42,02
-42,87
—43,50
-43,95
—44,26
—44,46
—44,54
—44,53
AG/°
—20,21
-20,08
—
12,62
—4,99
2,76
10,57
18,41
26,28
34,16
lg
Kp
14,813
14,625
6,897
2,180
—1,004
—3,300
—5,030
—6,382
-7,464
Опубликованные Смитом, Бьеллерапом, Круком
и
Уестермарком
[1384]
данные
по
энергии сгорания, исправленные
с
учетом нового
XII. Химическая
термодинамика
галогенсодержащих
соединений
593
значения
энтальпии окисления мышьяковистого ангидрида [142],
позволили получить значение
АЯс°
98
и
соответственно
AEf
MS
(I)
=
=
—49,65
ккал/молъ. Согласно Дрейсбаху [353],
AHv°
2m
=
=
7,64
ккал/молъ,
что
дает
ДЯ/°
9
,
(g) =
—42,0
ккал/молъ. Отнесение
колебательных частот проведено Тобином [1509]; структурные данные
получены Коутсом
и
Ливингстоном [281].
Эти
данные использованы
в сочетании
с
оценочным значением барьера внутреннего вращения
4,0
ккал/молъ
для
расчета термодинамических свойств идеального
газа.
По
данным Дрейсбаха
[353] Тт = 239,4° К, ТЪ = 343,7° К
и
AHv = 7,0
ккал/молъ
при
точке
кипения,
№ 738. 1,2,3-Трихлорпропан,
С
3
Н
6
С1
3
(состояние идеального газа).
Мол.
вес
147,441
298
300
400
500
? 600
700
i
800
t
900
'1000
палЦмоль
°К)
Cp°
26,82
26,96
31,71
35,69
38,87
41,52
43,79
45,68
47,34
s°
91,52
91,69
100,12
107,63
114,43
120,63
126,32
131,59
136,49
~(G°-H°
29a
)/T
91,52
91,53
92,64
94,90
97,60
100,45
103,34
106,19
108,97
ккал/моль
H
°-
H
298
0,00
0,05
2,99
6,37
10,10
14,13
18,40
22,87
27,52
AHf
—44,40
-44,42
—45,20
—45,80
-46,26
—46,58
-46,78
—46,88
—46,88
AG/°
—23,37
-23,24
—16,06
—8,70
—1,24
6,29
13,85
21,44
29,04
**,
17,132
16,933
8,775
3,804
0,452
—1,964
—3,784
-5,207
—6,346
Бьеллерап
и
Смит
[141]
измеряли энергию сгорания
в
калори-
аетре
с
вращающейся бомбой,
а
Смит, Бьеллерап, Крук
и
Уестер-
иарк
[1384]
опубликовали данные, полученные методом стационарной
Калориметрической бомбы. Метод вращающейся калориметрической
эомбы считается более точным; данные, полученные этим мето-
дом, исправлены
с
учетом нового значения энтальпии окисления
яышьяковистого ангидрида
[142] и
приведены
к
АЯс
298
;
они
позволи-
Ни
получить значение
АНЦ
Ю
(I)
=
—55,65
ккал/молъ. Согласно
ЦДрейсбаху [353],
АЯу°
98
= 11,22
ккал/молъ,
что
дает Д#/°
98
(g) =
44,4 ккал/молъ. Термодинамические функции
для
состояния
иде-
ального газа оценены
с
использованием констант, приведенных
табл. XII.2. Дрейсбах
[353]
приводит значения
Тт = 258,5° К
ТЪ
= 430,0° К (при
этой температуре
AHv = 8,87
ккал/молъ).
1елсон
и
Ньютон
[1051]
экспериментально определили
Ср (I) =
=
34,3 +
0,032Г
[кал/(молъ-°К),
270-350°
К]. В
работе Курбатова
§814] также приведены данные
о
теплоемкостях жидкости, однако
Н
недостаточно точны.
8-831
594
Часть
2.
Термические
и
термохимические
свойства
веществ
№
739.
1-Хлорбутан,
С
4
Н
9
С1
(состояние
идеального
газа).
Мол.
вес
92,569
Т,
°К
298
300
400
500
600
700
800
900
1000
Ср°
25,71
25,84
32,30
37,98
42,77
46,85
50,31
53,32
55,92
кал/(мол
S°
85,58
85,74
94,08
101,92
109,27
116,18
122,67
128,77
134,53
-&°-н°
2Ю
)/т
85,58
•
85,59
86,68
88,95
91,73
94,74
97,83
100,93
104,00
ккал/моль
Н
°-
Н
298
0,00
0,05
2,97
6,49
10,53
15,02
19,88
25,06
30,53
ля/°
—35,20
—35,23
-36,85
—38,17
—39,22
—40,03
—40,62
-41,03
—41,26
AG/°
—9,27
—9,11
—0,15
9,18
18,75
28,48
38,30
48,20
58,13
lg Кр
6,797
6,640
0,084
—4,012
—6,828
—8,891
—10,463
—11,7а
1
—12,701
Грин
и
Холден [540] рассчитали термодинамические свойства
на
основании собственных значений
для
1-хлорпропана
и
метилено-
вых инкрементов Персона
и
Пиментела [1140]. Смит, Бьеллерап,
Крук
и
Уестермарк
[1384]
приводят данные
по
энергии сгорания,
которые после исправления
с
учетом нового значения энтальпии
окисления
мышьяковистого ангидрида [142]
и
приведения
к
A#c
29
s
дают
ЛЯ/298
(0
=
—43,2
ккал/моль. Метюс
и
Феландт [941] экспери-
ментально получили значение
AHv
=
7,38
ккал/молъ
при
349,7°
К.
Если принять оценку
АСр
испарения —13 кал/(моль
-"К),
то
AHv°
Mg
=
=
8,0
ккал/молъ
и
ДЯ/°
И
(g)
=
—35,2
ккал/молъ.
По
согласующим-
ся
данным Дрейсбаха
[352]
и
Тиммерманса
[1501]
Тт
=
150,0°
К
и
ТЪ
=
351,6°
К.
Перез Масиа
и
Диаз Пенья
[1137]
определили вто-
рой вириальный коэффициент
в
температурном интервале
358—423°
К.
Укайи
и
Бонам
[1525]
определили скелетную структуру
и
сделали
некоторые выводы
об
относительной стабильности вращательных
изомеров
на
основании изучения дифракции электронов.
№ 740. 2-Хлорбутан, С
4
Н
9
С1 (состояние идеального газа).
Мол.
вес
92,569
Энергия сгорания по данным Смита, Бьеллерапа, Крука
и
Уестер-
марка [1384], приведенная
к
AHc
2S
s
и
исправленная
с
учетом нового
значения
энтальпии окисления мышьяковистого ангидрида [1421.
дает
AHf
29S
(I)
—
—46,2
ккал/молъ. Дрейсбах [353] приводит
зна-
чения
AHv
=
6,98
ккал/молъ
при
Тт
=
141,9°
К и
AHv°
ns
=
=
7,60
ккал/молъ, откуда
АЯ/°
98
(g)
=
—38,6
ккал/молъ. Приведены
оценки
терлюдинамических функций для состояния идеального газа.
Укайи
и
Бонам
[1525]
установили структуру
и
сделали некоторые
XII.
Химическая
термодинамика
галогенсодержащих
соединений
595
1
г, °к
*_
|
298
•'
300
*
400
I
500
1
60
°
|
700
|
800
I
90
°
11000
I
кал/(моль
°К)
Ср°
25,93
26,07
32,52
38,33
43,18
47,33
50,84
53,92
56,60
85,94
86,11
94,50
102,40
109,83
116,81
123,36
129,53
135,35
-(G°-H°
98
)/T
85,94
85,95
87,05
89,34
92,14
95,17
98,29
101,42
104,53
ккал/люль
Н
°-
Н
298
0,00
0,05
2,99
6,54
10,62
15,15
20,06
25,30
30,83
дя/°
—38,60
—38,63
-40,23
—41,52
-42,53
—43,29
-43,84
—44,19
-44,36
AGf°
—12,78
—12,62
—3,70
5,59
15,10
24,78
34,53
44,36
54,21
\gKp
9,368
9,195
2,022
-2,441
—5,500
-7,735
-9,433
—10,770
—11,847
;
|йыводы относительно стабильности вращательных изомеров
на
осно-
вании
данных, полученных
при
изучении дифракции электронов.
№
741.
1-Хлор-2-метилпропан,
С
4
Н
9
С1
(состояние
идеального
газа).
Мол.
вес
92,569
Яг'
В—
»
|298
1
300
1,400
1
500
$600
1
i
700
**800
fV900
?1ооо
пал/(моль-
°К)
cv
25,93
26,07
32,52
38,33
43,18
47,33
50,84
53,92
56,60
s°
84,56
84,73
93,12
101,02
108,45
115,43
121,98
128,15
133,97
-(G--H|
M
)/r
84,56
84,57
85,67
87,96
90,76
93,79
96,91
100,04
103,15
ккал/моль
Д
°-
Н
298
0,00
0,05
2,99
6,54
10,62
15,15
20,06
25,30
30,83
дя/°
—38,10
-38,13
—39,73
—41,02
-42,03
—42,79
-43,34
—43,69
—43,86
—11,87
—11,71
—2,65
6,78
16,43
26,24
36,13
46,10
56,09
1
SKP
8,700
8,530
1,447
—2,962
—5,984
-8,192
-9,871
—11,193
—12,258
" Энергия сгорания по данным Смита, Бьеллерапа, Крука
и
Уестер-
*арка
[1384]
исправлена
с
учетом нового значения энтальпии окисле-
ния
мышьяковистого ангидрида [142]
и
приведена
к
AHc
2SS
,
что дает
ТГ
/2эч
(0 =
—45,8
ккал/молъ. Согласно Тиммермансу [1501],
Тт
=
142,0°
К и
ТЬ
=
342,0°
К.
Энтальпия испарения при
298°
К
оце-
На
на
основании сопоставления
с
аналогичными соединениями
признана
равной
7,7
ккал/молъ,
что
дает
АЯ/
298
(g)
=
38*
596
Часть
2. Термические и
термохимические
свойства
веществ
=
—38,1
ккал/моль. Термодинамические функции
для
состояния
иде~
ального газа оценены
с
использованием констант, приведенных
в
табл. XII.2.
№
742.
2-Хлор-2-метилпропан, С
4
Н
9
С1 (состояние идеального газа).
Мол.
вес
92,569
г,
°к
298
300
400
500
600
700
800
900
1000
па
i/(моль
-
°К)
Ср°
27,30
27,40
34,00
39,60
44,20
48,10
51,50
54,50
57,00
s°
77,00
77,17
85,98
94,19
101,83
108,94
115,59
121,83
127,71
-(G°-H°
8e
)/r
77,00
77,01
78,16
80,56
83,47
86,61
89,82
93,03
96,21
кка
i/могь
Я
°~
Й
298
0,00
0,06
3,13
6,82
11,02
15,64
20,62
25,92
31,50
дн/°
-53,80
—43,83
—45,28
—46,43
—47,34
—48,01
-48,48
—48,77
—48,89
де/°
-15,32
—15,14
—5,35
4,78
15,10
25,57
36,10
46,70
57,33
igKp
11.2JB
И,
0!(
2,921
—2,087
—5,5ои
—1М1
—9,81)3
—
ll,,V,i
—12,52ч
Величина tS.Ec
по
данным Смита, Бьеллерапа, Крука
и
Уестер-
марка
[1384]
исправлена
с
учетом нового значения энтальпии окисле-
ния
мышьяковистого ангидрида
[142] и
приведена
к AHc
2
g
S
, что
дает
AHf
24S
(I)
= —50,1
ккал/молъ. Согласно Дрейсбаху [353],
AHv°
MH
-
=
7,0
ккал/моль, откуда
следует,
что
AHf
2
g$
(g) = —43,1
ккал/моль.
Хаулетт
[619, 620]
рассчитал термодинамические функции
на
осно-
вании
отнесений колебаний, почти полностью соответствующих отне-
сениям
Шеппарда
[13431
и
Тобина [1509],
а
также величинам момен-
тов инерции, согласно Уильямсу
и
Горди [1615],
и
значению барьера
внутреннего вращения, равному
3600
кал/моль.
Хаулетт
[619], Кистя-
ковский
и
Штауффер [763],
а
также Леванова
и
Андриевский
[857]
опубликовали данные
о
равновесных константах реакции между 2-м е-
тилпропеиом
и
хлористым водородом.
Эти
данные хорошо согласуют-
ся
п
приводят
к
среднему значению
AHf°
29S
(g) =
—43,8
ккал/моль.
Признано,
что
данные
о
равновесиях более точны,
чем
резуль-
таты измерения энтальпии сгорания,
и
поэтому принято значение
—
43,8
ккал/молъ.
Кушнер,
Кроу
и
Смит
[817]
экспериментально определили
Tt -
=
183,1° К при AHt = 0,41
ккал/молъ,
Tt = 219,6° К при AHt -
=
1,39
ккал/молъ
и АНт = 0,48
ккал/молъ. Согласно Дрейсба^У
[353],
Тт = 247,8° К, ТЪ = 323,9° К и AHv = 6,6
ккал/молъ
при
температуре
кипения.
Недавно опубликованные работы
по
изучению структуры
поЯ"
тверждают данные Уильямса
и
Горди
(об
этом говорят результаты
XII.
Химическая
термодинамика
галогенсодержащих
соединений
597
1кроволновых спектроскопических исследований Лайда
и
Джена
868]
и
Зейла, Винневиссера
и
Мюллера [1642],
а
также результаты
абот
по
дифракции электронов Боуена, Джилкриста
и
Саттона
[152]
Бастиансена
и
Смедвика [81]).
№
743.
1-Хлорпентан, С
5
Н
И
С1 (состояние идеального газа).
Мол.
вес
106,595
Шг,
°к
Ш
I
298
Щ
300
К
400
•'500
I
600
•
700
№800
И
900
Шооо
Ср°
31,18
31,34
39,24
46,23
52,11
57,13
61,38
65,07
68,25
na.,/(Moi
S"
94,89
95,09
105,21
114,74
123,70
132,12
140,03
147,48
154,50
ь
°К)
94,89
94,90
96,22
98,98
102,36
106,02
109,78
113,56
117,30
0,00
0,06
3,60
7,88
12,81
18,27
24,20
30,53
37,20
кка i/мо (Ь
ДН/°
-41,80
—41,84
—43,77
—45,35
—46,60
—47,55
—
48,24
—48,71
-48,96
AGf°
-8,94
—8,74
2,60
14,39
26,45
38,71
51,07
63,52
76,02
]g Kp
6,551
6,304
—
1,423
—6,288
—9,634
—
12,085
-13,952
-15,425
—16,613
Грин
и
Холден
[540]
рассчитали термодинамические свойства
на
'новации
собственных значений
для
1-хлорпропана
и
метиленовых
шрементов Персона
и
Пиментела [1140]. Бьеллерап
и
Смит
[141]
шерялн
энтальпию сгорания
с
помощью калориметра
с
вращаю-
(ейся
бомбой.
Их
значения, исправленные
с
учетом нового значения
[тальпии окисления мышьяковистого ангидрида
[142] и
приведен-
ю
к
давлению
1 атм и 298° К,
дают
Д77/°
98
=
—50,8
ккал/молъ.
!олее ранние работы, проводившиеся
с
неподвижной бомбой, обсуж-
1Лись Смитом, Бьеллерапом, Круком
и
Уестермарком [1384]; после
[есения
соответствующих исправлений
эти
более ранние результа-
приводят
к
значению
Д///.°
9Ч
(Г)
= —51,1
ккал/молъ,
что
хорошо
•гласуется
с
величиной, полученной позже. Мстюс
и
Феландт
[941]
:спериментально определили
AHv = 7,93
ккал/молъ
при 381° К.
Вели принять оценку
АСр
испарения
—14
кал/(молъ
>О
К),
то AHv°
?sg
=
9,1 ккал/молъ. Отобрано A#/°
9R
(g) = —41,8
ккал/молъ, поскольку
.•едпочтепие отдано результатам, полученным
в
работах
с вра-
щающейся калориметрической бомбой. Согласно Дрейсбаху [353],
fm
= 174,2° К и ТЪ = 380,9° К.
%
s
№ 744.
1-Хлор-З-метилбутан, С
5
Н
И
С1 (состояние идеального газа).
Мол.
вес
106,595
Энергия
сгорания
по
данным Смита, Бьеллерапа, Крука
и
Уестер-
[1384]
исправлена
с
учетом нового значения энтальпии окисле-

598
Часть
2, Термические и
термохимические
свойства
веществ
298
300
400
500
600
700
800
900
1000
каъ/(мо
гь °К)
Ср°
32,00
32,16
40,10
47,10
52,90
57,80
61,90
65,60
68,70
S»
95,56
95,76
106,13
115,85
124,96
133,49
141,48
148,99
156,07
-(&°-н°
98
)/.г
95,56
95,57
96,92
99,75
103,20
106,92
110,75
114,59
118,38
кка
г/мо
гь
0,00
0,06
3,69
8,06
13,06
18,60
24,59
30,97
37,69
AHf
-43,10
—43,14
—44,99
—46,48
-47,64
—48,52
-49,15
—49,56
—49,77
Л&/°
—10,44
—10,24
1,02
12,70
24,65
36,78
49,00
61,30
73,64
lg-Kp
7,631
7,458
-0,539
—5,552
—8,978
-11,481
-13,384
—14,885
—16,09?
ния
мышьяковистого ангидрида
[142] и
приведена
к
АНс%э
8
,
что
даот
ДЯ/°
9
,
(I)
=
—51,86
ккал/молъ.
По
данным Россини
и
сотр.
[1250]
Тт
= 168,8° К и ТЪ = 371,4° К.
Энтальпия испарения
при 298° К
по
оценке равна
8,72
ккал/молъ;
это
значение, полученное путем
сравнения
с
аналогичными соединениями, дает
AHf
im
(g) =
=
—43,1
ккал/молъ. Термодинамические функции
для
состояния
идеального газа оценены
с
использованием констант, приведенных
в табл. XII.2. Курбатов
[814]
приводит недостаточно точные даннь-р
по
теплоемкости 1-хлор-З-метилбутапа
в
жидком состоянии.
Энергия сгорания
по
данным Смита, Бьеллерапа, Крука
и
Устер
марка
[1384]
исправлена
с
учетом нового значения энтальпии окисле-
№
745.
2-Хлор-2-метилбутан,
C
5
H
U
C1
(состояние
идеального
газа).
Мол.
вес 106,595
т,
°к
298
300
400
500
600
700
800
900
1000
ка.1/(могь
°К)
Ср°
31,45
31,62
39,80
47,10
53,30
58,20
62,50
65,90
69,20
s°
88,06
88,26
98,50
108,18
117,34
125,93
133,99
141,55
148,67
-(G°-H°
98
)/r
88,06
88,07
89,41
92,20
95,64
99,36
103,19
107,03
110,85
кпа
1
/ лю
гь
H
°~
H
°Z98
0,00
0,06
3,64
8,00
13,03
18,61
24,65
31,07
37,83
AHf
—48,40
—48,44
—50,33
-51,84
—52,98
-53,81
—54,40
—54,77
-54,93
AGf°
—13,50
-13,29
—1,27
11,18
23,89
36,77
49,75
62,79
75,88
Ig-Kp
9,896
9,681
0,69i
-4.88Г
-8,70П
—11,
ISt
-13,5Ь<)
—15,248
—16,
">S2
XII. Химическая
термодинамика
галогенсодержащих
соединений
599
ния
мышьяковистого ангидрида
[142] и
приведена
к Alices, что
дает
AHf
29S
(I) =
—56,6
ккал/молъ. Метюс
и
Феландт
[941]
эксперимен-
тально определили,
что при 356,4° К AHv = 7,34
ккал/молъ. Если
принять
оценку
АСр
испарения
—14
кал/(моль-
О
К),
то
AHfl
m
(g)
=
=
—48,4
ккал/молъ. Согласно Дрейсбаху [353],
Тт = 199,7° К
и
ТЬ = 358,8° К.
Термодинамические функции
для
состояния
иде-
ального газа оценены
с
использованием констант, приведенных
в табл.
ХН.2.
№
746.
Хлорэтилен,
С
2
Н
3
С1
(состояние
идеального
газа).
Мол.
вес 62,501
Г,
°К
298
300
400
500
600
700
800
900
1000
кагЦмочь
°К)
12,84
12,89
15,56
17,80
19,61
21,10
22,35
23,43
24,35
63,08
63,16
67,25
70,97
74,38
77,52
80,42
83,11
85,63
63,08
63,09
63,62
64,73
66,06
67,47
68,91
70,34
71,75
ккал/мо1ь
0,00
0,03
1,45
3,13
5,00
7,04
9,21
11,50
13,89
AHf
8,40
8,39
7,86
7,43
7,06
6,76
6,51
6,31
6,17
Д&/°
12,31
12,33
13,73
15,24
16,84
18,50
20,19
21,92
23,66
lg-Kp
—9,021
—8,982
-7,500
-6,663
-6,134
—5,776
-5,516
—5,322
-5,170
Приведенные здесь термодинамические функции рассчитаны
на
основании данных
об
основных частотах, указанных
в
работе
Гал-
ликсона
и
Нилсена [546],
а
также структурных констант, полученных
микроволновым методом Кайвелсоном, Уилсоном
и
Лайдом [764].
Ре-
зультаты, недавно полученные
при
изучении дифракции электронов
Капланом
[714] и
Акишиным, Вилковым
и
Весниным
[7],
удовле-
творительно согласуются
с
микроволновыми данными. Ричарде
[1224]
рассчитал почти идентичные значения термодинамических функций,
основываясь
на
отнесениях Томпсона
и
Торкингтона
[1494]
с
использо-
ванием более ранних данных
по
электронной дифракции, полученных
Броквеем, Бичем
и
Полингом [171]. Лейчер, Готтлиб
и
Парк
[825] рас-
считали значение
AHf
M4
(g)
=8,072
ккал/молъ
на
основании величины
энтальпии присоединения хлористого водорода
к
ацетилену. Более
ранняя
работа Лейчера, Эмери, Бомфалка
и
Парка
[824] по
определе-
нию энтальпии гидрирования хлорэтилена
до
этана
и
хлористого
водорода приводит
к
значению
AHf°
29S
(g) = 8,889
ккал/молъ.
Ото-
брано значение
8,40
ккал/молъ. Гхош
и
Гуха
[471]
изучали равновес-
ный
состав
при
пиролизе 1,2-дихлорэтана. Полученные
ими
констан-
600
Часть
2.
Термические
и
термохимические
свойства
веществ
ты равновесия
дают
Л#/°
98
(g) = 13,54
ккал/молъ,
а это
значение
наверняка
можно считать завышенным. Кобе
и
Крауфорд
[772]
опуб-
ликовали данные
по
термодинамическим свойствам, основанные
на
значении
AHf
M8
(g) = 7,5
ккал/молъ,
отобранном Россини,
Ваг-
маном, Эвансом, Левином
и
Джаффе
[1249]
на
основании более ранней
работы Томсена [1495]. Мак-Доналд, Шрейдер
и
Сталл
[969]
экспе-
риментально определил
Тт =
94,43°
К и Tb =
259,35°
К.
Зинке
и
Сталл
[1359]
опубликовали данные
по
энтальпии сгорания поливи-
нилхлорида
и
рассчитали значение
ДЯ/°
И
(s),
равное
—22,6
ккал
на
1
моль мономера. Согласно расчетам, энтальпия полимеризации
газа составляет
—31,0
ккал
на 1
моль мономера.
№
747.
1,1-Дихлорэтилен, С
2
Н
2
С1
2
(состояние идеального газа).
Мол.
вес
96,950
XII.
Химическая
термодинамика
галогенсодержащих
соединений
601
298
300
400
500
600
700
800
900
1000
Ср°
16,02
16,08
18,80
20,86
22,44
23,69
24,71
25,57
26,29
кал/(моль
°
s°
68,85
68,95
73,97
78,39
82,34
85,90
89,13
92,09
94,82
-
К)
G'-B
68
68,
69,
70,
72,
74,
75,
77,
79,
298>/
Т
85
86
52
86
45
12
80
45
05
Н°—Н°
298
0,00
0,03
1,78
3,77
5,94
8,25
10,67
13,18
15,78
ккал/мочь
ДН/°
0,30
0,29
0,03
—0,18
-0,33
—0,45
-0,54
—0,60
-0,63
дс
5,
5,
7,
9,
11,
13,
15,
17,
19,
/°
78
81
69
64
61
61
63
65
68
lg
Кр
-4,235
—4,233
—4,204
—4,212
-4,229
—4,250
—4,269
—4,287
—4,302
Хилдепбранд, Мак-Доналд, Крамер
и
Сталл
[599]
изучали низко-
температурные свойства
и
опубликовали данные, включающие
Ttp —
=
150,59°
К, АНт = 1,557
ккал/молъ,
AHv
2M
=
6,328
ккал/молъ
и
^
98
(/)
= 48,17
кал/(молъ
-°К)
и
S°
29a
(g) =
69,04
кал/'(моль
-°К).
Экспериментально установленное значение энтропии согласуется
в пределах ошибки опыта
с
величиной
^°
98
(g) =
68,85
кал/(молъ
-°К),
основанной
на
отнесении колебаний, рекомендованном Эвансом [390].
и
структурных констант, полученных Секино
и
Нисикава
[13301
микроволновым методом. Хилденбранд
и др.
рассчитали термодина-
мические функции вплоть
до
1500°
К; эти
функции приняты здесь.
Данные
по
электронной дифракции, полученные Ливингстоном,
Рао
Каплаиом
и
Роксом [879], хорошо согласуются
с
результатами Секино
и
Писикава.
Зинке
и
Сталл
[1359]
измеряли энтальпию сгорания
и
получили
значение
AHf
2M
(I)
= —6,0
ккал/молъ.
Сочетание этого значения
с энтальпией испарения, полученной Хилденбрандом
и др.,
дает
|АД/г98
(ё)
=
0,3
ккал/молъ.
Зинке
и
Сталл измеряли также энталь-
|пию сгорания полимера
и
получили
АНр = —18,0
ккал
на 1
моль
|цономера. Согласно Иоши [704],
АНр — —17,5
ккал
на 1
моль моно-
лера,
а по
данным Тонга
и
Кеньона
[1514]
АНр = —14,4
ккал
|ра
1
моль мономера.
Хилденбранд
и др. [599]
измеряли давление пара
и
устано-
вили,
что ТЪ =
304,71
° К, AHv = 6,26
ккал/молъ.
Их
значения
тя теплоемкостей удовлетворяют уравнению
Ср
(I)
= 15,55 +
0,037
Г
1кал/(молъ-°К),
270—305°
К]. Татевский
и
Фрост [1469],
|а также Кобе
и
Харрисон
[774]
установили термодинамические свой-
гва, основанные
на
оценках
и
менее точных спектроскопических
данных, нежели данные, доступные
в
настоящее время.
№
748. 1,2-Дихлорэтилен, щис, С
2
Н
2
С1
2
(состояние
идеального
газа).
Мол.
вес
96,950
Г"
1
298
1
300
Щ
400
•
500
И
600
Ж
70
°
а
8оо
Щ
900
§4000
ж
Ср°
15,55
15,61
18,41
20,57
22,23
23,54
24,60
25,48
26,23
каT/(JHO
tb °K)
S°
69,20
69,30
74,19
78,54
82,44
85,97
89,19
92,14
94,86
-(G°-H°
98
)/T
69,20
69,21
69,85
71,16
72,72
74,37
76,02
77,65
79,24
Я
°-
Н
293
0,00
0,03
1,74
3,69
5,84
8,13
10,54
13,04
15,63
кка
i/могь
AHf°
0,45
0,44
0,13
—0,10
—0,29
—0,42
—0,52
—0,60
—0,63
AGf°
5,82
5,86
7,71
9,64
11,60
13,59
15,60
17,62
19,65
lg
Kp
—4,268
—4,266
—4,213
—4,211
—4,225
—4,244
—4,261
-4,279
—4,294
Питцер
и
Холленберг
[1163]
изучали инфракрасный спектр
и под-
вердили отнесения колебаний, сделанные Беристейттолг
и
Рамсеем
1119].
Длины связей
и
углы
между
ними определены Флайгаром
и Хо-
е
[434]
методом микроволновой спектроскопии,
а
также Хоффманом
510] методом дифракции электронов; полученные
в
обоих работах
анные хорошо согласуются
между
собой.
Эти
данные использованы
ш
расчета термодинамических функций. Броерс, Кетелаар
и Ван
влден [172] экспериментально установили
Тт =
193,1°
К и АНт =
1,72
ккал/молъ.
Кетелаар,
Ван
Фелден
и
Цалм
[7431
измеряли
дав-
*ение пара
в
температурном интервале
от 240 до
372°
К и
установили,
tao
Tb
=
333,8°
К. Их
данные, относящиеся
к
интервалу
273—328°
К
„Удовлетворяют уравнению, используемому
в
методе Прозена [1192],
Ш оценочному значению
АСр
испарения, равному
—12
кал/(молъ-°К),
«Основанному
на
единственнолг значении
для
темплоемкости жидко-
;.<«ти, полученном Мелем [988].
Это
уравнение
для
давления пара,
Цоценка
Тс,
равная
500°
К, и
оценка
Рс,
равная
50
атм, использованы
