Сталл Д. Вестрам Э. Зинке Г. Химическая термодинамика органических соединений
Подождите немного. Документ загружается.

542
Часть
2.
Термические
и
термохимические
свойства
веществ
в
работе Биховского
и
Россини [125], хороню согласуются
с
приня-
тым значением.
Хаф, Мейсон
и
Сейдж
[616]
измеряли теплоемкость жидкого
нитрометана
при
температурах
310—360°
К.
Их
результаты удов-
летворяют соотношению
Ср
(I)
—
18,70
+
0,023Г
[кал/(моль-°К)].
Экстраполяция
к
более низким температурам показывает,
что их
результаты, возможно, завышены,
так
как
данные Джонса
и
Джио-
ка
свидетельствуют
о
более медленном возрастании
Ср с
темпера-
турой.
№
624.
Нитроэтан,
C
2
H
5
NO
2
(состояние
идеального
газа).
Мол.
вес
75,068
т,
°к
298
300
400
500
600
700
800
900
1000
кал/
(моль
•
°К)
Ср°
18,69
18,78
23,66
27,92
31,45
34,38
36,81
38,89
40,67
8°
75,39
75,51
81,60
87,35
92,76
97,83
102,59
107,05
111,24
75,39
75,40
76,19
77,85
79,89
82,10
84,36
86,64
88,89
ккал/моль
Н
°-
Я
298
0,00
0,04
2,17
4,75
7,73
11,02
14,58
18,37
22,35
дя;°
—24,20
—24,23
—25,39
—26,27
—26,91
—27,36
—27,65
—27,81
—27,85
AG/°
—
1,17
—1,03
6,89
15,07
23,40
31,82
40,29
48,80
57,32
lg
Ар
0,857
0,748
—3,76b
—6,586
—8,52
J
»
—9,93!
—
11,007
—
11,851
—
12,527
Касс,
Флетчер, Мортимер, Куинси
и
Спринголл
[200]
измеряли
энтальпию сгорания,
в их
работе приведены более ранние результа-
ты, полученные Холкомбом
и
Дорсеем [613],
а
также неопублико-
ванные
данные Национального бюро стандартов.
Все три
источника
достаточно хорошо согласуются, однако предпочтение отдано
дан-
ным
Национального бюро стандартов
и
принято значение
AHf
2gs
(I)
=
—33,9
ккал/моль. Тщательные исследования, выпол-
ненные
Тупсом [1515], позволили
ему
установить
Тт
=
233.63°
К.
и
ТЪ
=
387,22°
К,
а
также вывести уравнение
для
давления пара.
Это уравнение использовано, наряду
с
уравнением Хаггенмахера
[560]
и
оценками
Тс
=
582°
К и Рс
-=
37
атм,
для
расчета
AHv
=
8,4
ккал/молъ
при
температуре
кипения,
AHv
2B
g
= 9,7
ккал/мо.п,
и
ДЯ/°
98
(g)
= —
24,2
ккал/молъ. Термодинамические функции
для
состояния
идеального газа оценены
с
использованием консташ,
приведенных
в
табл.
XI.1,
и
значений
для
пропана. Бирд
[87]
изме-
рял
теплоемкость нитроэтана
и
установил,
что Ср (I)
32,9
кал/(молъ
-°К)
при
температурах
298—323°
К.
XI. Химическая
термодинамика
азотсодержащих
соединений
543
№
625.
1-Питропропан,
C
3
H
7
NO
2
(состояние
идеального
газа).
Мол.
вес
89,094
298
300
400
500
600
700
800
900
1000
па
т/(мо
гь
°К)
Ср-
24,41
24,52
30,72
36,24
40,87
44,73
47,96
50,72
53,06
S-
85,00
85,16
93,08
100,54
107,57
114,17
120,36
126,17
131,64
~(G°-H°
29S
)/T
85,00
85,01
86,04
88,20
90,85
93,72
96,66
99,62
102,55
ккал/мо
!Ь
Н
°-
Н
298
0,00
0,05
2,82
6,17
10,04
14,32
18,96
23,90
29,09
дя/°
—29,80
—29,83
—31,29
-32,42
—33,25
-33,84
—34,22
-34,42
—34,47
AG/°
0,08
0,26
10,53
21,12
31,91
42,81
53,79
64,81
75,84
**,
—0,056
—0,190
—5,751
-9,230
—11,621
—13,367
—
14,694
-15,737
—
16,575
Касс,
Флетчер, Мортимер, Куинси
и
Спринголл
[200]
опублико-
вали результаты измерений энтальпии сгорания
и
привели более
ранние
значения Холкомба
и
Дорсея [613],
а
также неопублико-
ванные
данные Национального бюро стандартов.
Все три
источника
хорошо согласуются, однако предпочтение отдано данным
Нацио-
нального бюро стандартов
и
принято значение
AHf
29S
(Z)
= —
40,15
ккал/молъ. Тщательные исследования, выполненные Тупсом [1515],
позволили
ему
установить
Тт —
169,16°
К и
ТЪ
=
404,33°
К,
а
так-
же вывести уравнение
для
давления пара.
На
основании уравнения
Хаггенмахера
[560]
и
оценок
Тс
=
595°
К и Рс = 36
атм
получе-
но
значение
AHv
=
8,8
ккал/моль
при
температуре кипения
и
AHv
2
gg
=
10,3
ккал/моль.
По
собственным данным измерения
дав-
ления
пара Холкомб
и
Дорсей рассчитали
AHv
29S
.
=
Ю,4
ккал/молъ,
при
этом
они
исследовали более широкий температурный интервал,
нежели
в
работе Тупса. Усреднение дает
ДЯ/°
И
(g)
=
—29,8
ккал/моль.
Термодинамические функции
для
состояния идеального газа
оценены
с
использованием констант, приведенных
в
табл.
XI.1,
и
значений
для
н-бутана. Бирд
[87]
измерял теплоемкость 1-нитро-
пропана
в
температурном интервале
298—323°
К.
Полученные
дан-
ные
могут
быть использованы
с
точностью +2%, если пользоваться
уравнением
Ср
(I)
=
8,11
+
0,107Г
[кал/(молъ-°
К)].
№
626.
2-Нитропропан,
C
3
H
7
NO
2
(состояние
идеального
газа).
Мол.
вес
89,094
Энтальпия
сгорания определена экспериментально Холкомбом
|И
Дорсеем [613].
а
также Кассом, Флетчером, Мортимером, Куинси
Спринголлом [200].
В
последней работе приводятся также неопуб-
ликованные
данные Национального бюро стандартов.
Все три
источ-
ника
хорошо согласуются,
но
предпочтение отдано значению
Нацио-
1
544
Часть
2. Термические и
термохимические
свойства
веществ
т, °к
298
300
400
500
600
700
800
900
1000
кал
/
(моль
•
°Ю
Ср°
24,26
24,37
30,89
36,52
41,19
45,03
48,22
50,93
53,24
s°
83,10
83,26
91,18
98,70
105,78
112,43
118,65
124,49
129,98
-(G°-
H
298>'
T
83,10
83,11
84,14
86,31
88,97
91,85
94,82
97,79
100,74
•кпал/моль
Н
°-
Н
298
0,00
0,05
2,82
6,20
10,09
14,41
19,07
24,04
29,25
ДН/о
-33,50
—33,53
—34,99
—36,09
-36,90
-37,45
-37,80
—37,99
-38,02
bGt°
—3,06
-2,87
7,59
18,37
29,33
40,42
51,57
62,75
73,96
2,240
2,090
—4,146
—8,027
—10,685
—12,619
—14,087
-15,238
—16,163
нального бюро стандартов
при
отборе
АЯ/°
И
(I) = — 43,3
ккал/молъ.
Тупс
[1515]
опубликовал результаты тщательных измерений, соглас-
но
которым
Тпг — 181,83° К и ТЪ = 393,40° К, им
выведено также
уравнение
для
давления пара.
Оно
использовано, наряду
с
урав-
нением
Хаггенмахера
[560] и
оценочными значениями
Тс =
595°
К
и
Рс = 36 атм, для
расчета
AHv = 8,4
ккал/молъ
при
температуре
кипения
и
AHv
2
98
= 9,76
ккал/молъ.
На
основании собственных
результатов измерения давления пара Холкомб
и
Дорсей
[6131
рассчитали значение
AHv
Z
9s
— 9,9
ккал/молъ,
что
хорошо согла-
суется
с
данными Тупса. Среднее значение использовано
для
расче-
та
АЯ/°
98
(g) =
—33,5
ккал/молъ.
Термодинамические функции
для
состояния идеального газа
оценены
с
использованием констант, приведенных
в
табл.
XI. 1,
и
значений
для
изобутана.
т,
°к
298
300
400
500
600
700
800
900
1000
№
627.
1-Нитробутан,
C
4
H
9
NO
2
Мол.
вес
пал/(моль
• °К)
Ср°
'
29,85
]
29,99
"
37,65
44,48
50,21
55,01
59,03
62,46
65,39
Со
94,28
94,47
104,17
113,32
121,95
130,06
137,68
144,83
151,57
-(в°-Я;„)/Т
94,28
94,29
95,56
98,20
101,45
104,96
108,58
112,22
115,82
(состояние
идеального
газа
103,120
клал/мо
гь
Н
°-
Н
«8
0,00
0,06
3,45
7,56
12,31
17,57
23,28
29,36
35,76
дя/°
—34,40
—34,44
—36,22
—37,60
-38,63
—39,36
—39,84
-40,10
—40,17
&Gf°
2,42
2,65
15,30
28,34
41,63
55,07
68,59
82,17
95,76
lg Кр
—
1,77.')
—1,920
—8,337
-12,388
—15,163
—17,193
—18,737
-19,951
—20,928
XT. Химическая
термодинамика
азотсодержащих
соединений
545
г
По
данным измерений энтальпии сгорания Холкомб
и
Дорсей
1613] вычислили
ДЯ/;
8
(Z) =
—46,03
ккал/молъ.
Они
измеряли
также давление пара
и по
полученным данным определили
AHv
M8
=
=
11,6
ккал/молъ
и АЯ/°
98
(g) =
—34,4
ккал/молъ.
В
результате
тщательно выполненных исследований Тупс
[1515]
установил
что
$т
- 191,82° К и ТЪ = 425,92° К.
Данные
по
давлению пара,
(полученные Тупсом, хорошо согласуются
с
результатами Холком-
ба
и
Дорсея
в
соответствующем температурном интервале.
Они
юпользованы, наряду
с
уравнением Хаггенмахера
[560] и
оценками
"с
=
600°
К и Рс = 35 атм, для
расчета
AHv — 9,3
ккал/молъ
гри температуре
кипения.
Термодинамические функции
для
состоя-
[ия
идеального газа оценены
с
использованием констант, приве-
(епных
в
табл.
XI.
1,
и
значений
для
к-пентана.
№
628.
2-Нитробутан,
C
4
H
9
NO
2
(состояние
идеального
газа).
Мол.
вес 103,120
Щ
298
•
300
•
400
Ж
500
Ж
600
Ж
700
В
800
Щ
900
•
1000
кал/
(моль
-°К)
Ср°
29,51
29,66
37,61
44,61
50,46
55,37
59,44
62,94
65,96
S
91,62
91,81
101,45
110,62
119,28
127,44
135,11
142,31
149,11
-<
G
°-
H
29
8
>/
T
91,62
91,63
92,89
95,52
98,77
102,29
105,92
109,56
113,18
ккал/моль
H
°-
H
298
0,00
0,06
3,43
7,55
12,31
17,61
23,36
29,48
35,93
AHf°
-39,10
—39,14
—40,94
—42,32
-43,33
—44,02
—44,47
-44,68
—44,70
t±Gf°
—1,49
—1,25
11,66
24,98
38,54
52,24
66,02
79,85
93,70
lg
Кр
1,089
0,914
-6,373
—10,919
-14,036
-16,310
-18,035
—19,390
-20,477
По
данным измерений энтальпии сгорания Холкомб
и
Дорсей
1613] вычислили Д#/°
98
(I) =
—49,61
ккал/молъ.
Они
измеряли
ракже
давление пара
и на
основании полученных данных рассчитали
&Hv
29
8
~ Ю,48
ккал/молъ,
из
которого
следует
АЯ/°
99
(g) =
•==
— 39,1
ккал/молъ. Тупс
[1515]
не
смог вызвать кристаллизацию,
Tto
ему
удалось измерить давление пара
и
получить результаты,
Корошо
согласующиеся
к
данными Холкомба
и
Дорсея,
и
получить
Значение
ТЪ = 412,65° К. На
основании данных Тупса
по
давлению
чара,
а
также оценок
Тс =
600°
К, Рс = 35 атм
удалось
с
помощью
Уравнения Хаггенмахера
[560]
рассчитать значение
AHv =
|==8,8
ккал/молъ
при
температуре
кипения.
Термодинамические
рункции
для
состояния идеального газа оценены
с
использо-
ванием
констант, приведенных
в
табл.
XI.1, и
значений
для 2-ме-
Тилбутана.
35—83
1
546
Часть
2.
Термические
и
термохимические
свойства
веществ
Алкилнитриты и алпилнитраты. Таблицы
для состояния
идеального
газа
№
629.
Метилнитрит,
CH
3
NO
2
(состояние
идеального
газа).
Мол.
вес
61,042
г,
°к
298
300
400
500
600
700
800
900
1000
умгЦмоль
°К)
Ср°
15,11
15,17
18,24
21,01
23,35
25,32
26,97
28,36
29,52
Со
67,95
68,05
72,84
77,22
81,26
85,11
88,50
-&°-Щ
ю
)1Т
67,95
67,96
68,59
69,88
71,45
73,12
74,83
91,76
76,53
94,81
^ 78,21
гам
i/моль
Н
°-Чю
0,00
0,03
1,71
3,67
5,89
8,33
10,95
13,71
16,61
дя/°
—15,30
—
15,31
—
15,99
-16,47
—
16,79
—
16,97
—
17,04
—
17,02
—
16,92
AGf°
0,24
0,33
5,66
11,13
16,68
22,28
27,89
33,51
39,12
lg К
и
-0,17',
—0,2-1!
-3,09!
—
4,86".
—6,077
—6,9".",
—7,619
—8,
136
—8,550
Лирмейкерс
и
Рам/пергер
[854]
определяли
при 25 и 50° С
равно-
весные составы газофазной системы
CH
3
OH(g)
+
NOCl(g)
=
CH
3
ONO(g)
+
HCl(g).
Полученные данные позволили
на
основании расчетов
по вто-
рому закону термодинамики установить значение
Afff
29a
(g) =~
=
—16,28
ккал/молъ.
Гейселер
и
Тирфельдер
[464]
сжигали метил-
нитрат
в
пламенном калориметре
и
определили
AHf
2<ie
(g) -
=
—16,8 ± 0,8
ккал/молъ.
Уилер, Уиттейкер
и
Пайк
[1601]
полу-
чили данные
по
энтальпии взрыва газообразного метилнитрата.
которые
в
сочетании
с
энтальпией реакции
между
азотным ангидри-
дом
и
метилнитритом, найденной Реем
и
Оггом [1218], приводят
к
значению
ДЯ/°
И
(g) =
—14,46
± 0,9
ккал/молъ.
Грей
и
Иран
[525]
в
своей работе приводят неопубликованное значение
ДЯ/°
98
(g)=~
=
—14,93
± 0,26
ккал/молъ,
основанное
на
энтальпии гидролиза,
сообщенной
Балдреем, Лотцгеселем
и
Стайлом.
На
основании
дан-
ных, полученных
при
измерении энтальпии реакции
между
метано-
лом
и
нитрозилхлоридом,
Рей и
Гершон
[1216]
установили,
чго
Д#/°
98
(g) =
—15,64
+ 0,20
ккал/молъ.
Принято среднее значение
—15,3
ккал/молъ,
основанное
на
предпочтительном отношении
к ре-
зультатам, полученным Греем
и
Праттом,
а
также Реем
и
Гершоном.
Кокс
и Рей [293]
измеряли константы равновесия реакции
между
метанолом
и
нитрозилхлоридом
при
298°
К и
получили значительно
меньшую величину,
чем
Лирмейкерс
и
Рамспергер. Принято значе-
ние
Кокса
и Рея и
использовано
для
расчета
S°
2!>s
(g) =
67,95
кал'
(молъ-°К).
Грей
и
Пратт
[525]
рассчитали энтропию, исходя
и
3
XI.
Химическая
термодинамика
азотсодержащих
соединений
547
структурных
и
спектроскопических данных
для цис- и
транс-язо-
!<меров.
Небольшое различие
в
энергиях позволяет принять
для
|данных целей допущение
об
одинаковом содержании каждого
изо-
|мера
в
парах. Расчетное значение энтропии смеси составляет
74,17
кал/(молъ-°К)
в
предположении свободного внутреннего
вра-
щения
как для
группы
СН
3
, так и для
группы
NO.
Грей
и
Ривс
{527] установили,
что
барьер
для
группы
NO
равен
10,5
ккал/молъ,
го снижает энтропию
до 71,17
кал/(моль-°К).
Разность
между
этой
величиной
и
экспериментальным значением
67,95
кал/(молъ
-
О
К)
зусловлена очень высоким барьером внутреннего вращения метиль-
|ой
группы,
и
этой степени свободы приписана частота колебания
|05
см'
1
.
Теплоемкость метилнитрита
в
состоянии идеального газа
рассчитана
с
использованием этой частоты
и
отнесений колебаний
яо
Грею
и
Пратту.
Томпсон
и
Дейнтон
[1490]
экспериментально определили
ТЪ =
255,8°
К и при
этой температуре
AHv = 5,0
ккал/молъ.
В
работе
Грея
и
Пратта дано более высокое значение
AHv
2
gs
=
5,4
ккал/молъ.
Гейселер
и
Ретцш
[462]
рассчитали термодинамические функции,
Принимая
потенциальный барьер
для
нитрозогруппы
9,00
ккал/молъ
допуская свободное внутреннее вращение
для
метильной группы.
№
630.
Метилнитрат,
CH
3
NO
3
(состояние идеального газа).
Мол.
вес
77,042
Щ,
°к
I
•
298
К
300
•
400
В
1
500
•
600
Щ700
Ж
800
Ж
900
Ж
000
кал/(моль-°К)
Ср°
18,28
18,34
21,87
24,95
27,54
29,69
31,47
32,96
34,19
S"
72,15
72,27
78,04
83,26
88,04
92,45
96,54
100,33
103,87
-(«
О
-
Н
°
2
9
8
>/
Г
72,15
72,16
72,92
74,47
76,34
78,33
80,36
82,37
84,34
ккал/моль
Я
°-
Н
298
0,00
0,04
2,05
4,40
7,03
9,89
12,95
16,18
19,53
AHf°
—28,80
—28,82
—29,50
—29,97
—30,26
—30,40
—30,43
—30,36
—30,21
AGf°
—
7,21
—7,08
0,29
7,79
15,37
22,99
30,62
38,25
45,87
lgKp
5,284
5,154
—0,156
-3,405
—5,599
-7,177
—8,364
-9,287
—10,024
Рей
и Огг
[1218]
измеряли энтальпию реакции
между
азотным
^гидридом
и
метилнитритом. Полученные
ими
результаты исполь-
Ованы
в
сочетании
с
отобранными нами значениями
для
метилнитри-
и
получена величина
АЯ/°
98
(g) =
—28,2
ккал/молъ.
Рей и Огг
энтальпии
взрыва жидкого метилнитрата, найденной Уилером,
ттейкером
и
Пайком [1601],
и
энтальпии испарения, рассчитан-
.
t на
основании данных
о
давлении пара Мак-Кинлея-Мак-Ки
Шелвин-Хьюза [977], получили значение А#/°
98
(g) =
—29,4
ккал/
35*

548
Часть
2.
Термические
и
термохимические
свойства
веществ
моль.
Принято среднее значение
—28,8
ккал/молъ. Грей
и
Смит
[528]
изучали низкотемпературные свойства
и
получили следующие
дан-
ные:
Тт =
190,2°К,
АНт°
= 1,97
ккал/молъ
и
S°
ms
(I)
=
=
51,86
кал/(моль-°К).
Грей
и
Пратт
[524] на,
основании данных
о
давлении пара, полученных Мак-Кинлеем-Мак-Ки
и
Мелвин-
Хыозом [977], рассчитали значение
AHv = 7,54
ккал/молъ
при
ТЪ
=
337,8°
К,
AHv
2
98
=
8,1
ккал/молъ
и
S°
2gs
(g) =
76,05
кал/(молъ-
•
°
К). Бранд
и
Коутон
[159]
сделали отнесения основных частот
и
рассчитали
S\
ti
(g) =
75,97
кал/(моль
•
°К), исходя
из
допуще-
ния
о
наличии
двух
видов свободного внутреннего вращения.
Со-
гласованность результатов хорошая,
но
явно случайная, посколь-
ку данные микроволновой спектроскопии, опубликованные Диксо-
ном
и
Уилсоном [330],
могут
быть интерпретированы только
на
основе предположения
о
наличии барьеров
9,10 и 2,32
ккал/молъ
соответственно
для
вращения нитро-
и
метильной групп. Если
при-
нять
эти
барьеры,
то
рассчитанное значение энтропии
будет
72,15 кал!'(моль-°К). Данные, полученные
на
основе третьего зако-
на
термодинамики, оценить трудно. Стандартное вещество
для
, сравнения
не
использовали,
а
пустой калориметр
не
проверяли.
Грей
и
Смит
[529]
получили экспериментальные данные
для
этил-
нитрата
и
рассчитали £°
98
(g)
=83,25
кал/(моль-°
К).
Разность
(инкремент)
между значениями
для
метилнитрата
и
этилнитрата
составляет всего лишь
7,2
кал/(молъ-°К),
тогда
как
среднее значение
инкремента
для
других
классов соединений равно
10
кал/(моль-°К).
Наиболее точным
в
данном случае признано значение, осно-
ванное
на
спектроскопических данных,
и при
расчетах термодинами-
ческих функций использовали отнесения колебаний
по
Бранду
и
Коутону,
а
также значения барьеров вращения
и
моментов инер-
ции
по
Диксону
и
Уилсону.
№
631.
Этилнитрат, C
2
H
5
NO
3
(состояние идеального газа).
Мол.
вес
91,068
XI.
Химическая
термодинамика
азотсодержащих
соединений
549
т,
°к
298
300
400
500
600
700
800
900
1000
кал/(моль
°К)
C
V
°
23,27
23,36
28,73
33,31
37,07
40,17
42,72
44,88
46,69
s»
|
-(G°-H°
98
)/r
83,25
83,40
90,87
97,79
104,21
110,16
115,70
120,86
125,68
83,25
83,26
84,24
86,27
88,73
91,37
94,07
96,76
99,42
пкал/моль
Н
°-
Н
2°98
0,00
0,05
2,66
5,77
9,29
13,16
17,31
21,69
26,27
дя/°
-36,80
-36,82
-37,85
—38,58
-39,05
—39,31
—39,42
-39,39
—39,24
AGf°
-8,81
—8,63
0,93
10,72
20,62
30,59
40,58
50,58
60,58
lg-Kp
6,456
6,290
—0,
509
-4,684
—7,511
—9,530
—11,086
-12,283
-13,239
При
изучении свойств этилнитрата
в
условиях низких темпера-
!
тур
Грей
и
Смит
[529]
получили следующие данные:
Тт =
178,6°
К,
АНт
= 2,04
ккал/молъ
и
S°
29S
(I)
=
59,08
кал/(моль -°К).
Эти дан-
ные
нельзя считать весьма точными
(ср.
данные
для
метилнитрата),
но
тем не
менее
они
здесь приняты. Фейрбразер, Скиннер
и
Эванс
[405]
по
экспериментально найденному значению энтальпии сгора-
ния
рассчитали величину
АЯ/°
98
(I)
= — 45,5
ккал/молъ.
На
основа-
нии
данных
о
давлении пара, полученных Греем, Праттом
и Лар-
кином
[526], Грей
и
Пратт
[524]
рассчитали
AHv = 7,92
ккал/молъ
при
ТЪ —
360,8°
К и
АНи
2
в8
= 8,67
ккал/молъ.
Эти
значения позво-
лили вычислить Д#/°
98
(g) =
—36,8
ккал/молъ
и
S°
98
(g) =
83,25
кал/(моль
•°Щ.
Значение теплоемкости
для
состояния идеаль-
ного газа оценочное. Грей, Пратт
и
Ларкин
[526]
приводят
обзор литературных данных
по
определению энтальпии образования.
T, °к
298
\
300
.
400
500
600
I?
700
Ж
800
Ш
900
i
£
1000
!•
№
632.
Пропилнитрат,
C
3
H
7
NO
3
Мол.
вес
кал/(люль
«К)
Ср°
28,99
29,10
35,79
41,63
46,49
50,52
53,87
56,71
59,08
s°
92,10
92,28
101,59
110,22
118,26
125,73
132,71
139,22
145,32
92,10
92,11
93,33
95,86
98,93
102,23
105,61
108,99
112,32
(состояние
идеального
газа
105,094
пкал/моль
Н
°-
Я
298
0,00
0,06
3,31
7,19
11,60
16,46
21,68
27,22
33,01
дя/°
—41,60
—41,63
—42,96
-43,93
—44,59
-44,99
-45,19
-45,21
-45,07
AGf°
—6,53
—6,32
5,67
17,95
30,38
42,91
55,49
68,08
80,66
lg
Кр
4,790
4,603
-3,098
-7,844
-11,067
-13,398
-15,157
—16,530
—17,628
По
данным измерения энтальпии сгорания Фейрбразер, Скиннер
и
Эванс
[405]
вычислили
AHf
29S
(I)
=
—51,27
ккал/молъ. Более
ранние
данные
отсутствуют.
Грей
и
Пратт
[524]
определили давле-
ние
пара
и
рассчитали
AHv = 8,58
ккал/молъ
при ТЪ =
383,2°
К
ж
и
AHv
2S8
= 9,70
ккал/молъ. Дафф [355] вычислил
AHv = 7,6
ккал/молъ
основании
собственных данных
по
давлению пара, которые
сов-
падают
с
результатами Грея
и
Пратта
при
температурах вблизи
'Нормальной
точки кипения,
но
более высокие
при
298°
К.
Принятые
t Данные Грея
и
Пратта позволили рассчитать
AHf
29g
(g) =
I
г=
—41,6
ккал/молъ. Термодинамические функции
для
состояния
^Идеального газа оценены
с
использованием констант, приведенных
табл. XI. 1,
и
значений
для
н-бутана.
550
Часть
2.
Термические
и
термохимические свойства веществ
№
633.
Изопропилнитрат,
C
3
H
7
NO
3
(состояние
идеального
газа).
Мол.
вес
105,094
г,
°к
298
300
400
500
600
700
800
900
1000
пал/(моль
°К)
Ср°
28,84
28,95
35,96
41,91
46,81
50,82
54,13
56,92
59,26
s°
89,20
89,38
98,70
107,38
115,47
122,99
130,00
136,54
142,67
-<
е
°-
Я
2
в8
>/
г
89,20
89,21
90,43
92,96
96,05
99,36
102,76
106,16
109,50
v
кка
г/моль
Н
°-
Н
298
0,00
0,06
3,31
7,22
11,66
16,55
21,80
27,35
33,17
U.It,-'
-45,65
—45,68
—47,01
—47,96
-48,59
—48,96
-49,12
—49,12
-48,96
AGf°
—9,72
—9,50
2,78
15,34
28,06
40,87
53,71
66,57
79,43
lg
Кр
7,125
6,919
—1,519
-6,706
—10,222
—12,760
—14,673
—16,165
-17,358
По
данным измерения энтальпии сгорания изопропилнитрата
Фейрбразер, Скиннер
и
Эванс
[405]
рассчитали
ДЯ/°
М
(I)
=
=
—54,92
ккал/молъ.
Более ранние данные
отсутствуют.
Грей
и
Пратт
[524] определили давление пара
и
рассчитали
AHv = 8,35
ккал/молъ
при
ТЪ =
375,2°
К и
AHv
298
= 9,27
ккал/молъ.
Дафф
[355]
также опубликовал результаты измерения давления пара, которые
согласуются
с
данными Грея
и
Пратта вблизи нормальной точки
кипения,
но при 298°
К
превосходят
их на 10 мм
ртп.
ст.
и
приводят
к
значению
AHv = 7,3
ккал/молъ.
Приняты результаты Грея
и
Пратта,
на
основании которых получена величина
AHf
29S
(g)
=
=
—45,65
ккал/молъ.
Термодинамические функции
для
состояния
идеального газа оценены
с
использованием констант, приведенных
в табл. XI. 1,
и
значений
для
изобутана.
Глава
XII
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
ГАЛОГЕНСОДЕРЖАЩИХ
СОЕДИНЕНИЙ
Введение
i
i
Важность галогенсодержащих органических соединений
со
всей
{очевидностью
была показана
в
недавнем обзоре [1655], согласно
которому производство хлора
в
США
должно было
в
1967
г.
состав-
лять
7,5
млн.
т,
причем
70%
общего количества хлора предназнача-
лось
для
синтеза органических соединений. Предусматривалось,
[Что значительная доля пойдет
на
производство поливинилхлорида
—
'широко применяемого полимерного материала. Высокая термостой-
кость фторуглеродов
и
полифторуглеродов обусловливает
их ис-
пользование, несмотря
на
относительно высокую стоимость. Бром-
содержащие
и
иодсодержащие соединения находят применение
во
многих специальных
случаях,
но
используются
они не
столь широко.
Термохимия органических галогенсодержащих соединений
на-
ходится
все еще в
неудовлетворительном состоянии. Обзор термо-
химии органических соединений фтора опубликован Патриком
[1126,
1127];
он
показал серьезную нехватку надежных данных
По
энтальпиям образования этих соединений.
В
настоящее время
разработаны методы точных измерений [513],
но
они
пока применя-
лись лишь
к
сравнительно немногим соединениям. Лейчер
и
Скиннер
[833] пересмотрели энтальпии образования органических соединений
фтора
на
основании критического анализа имеющихся данных
по
Водным растворам
HF и
газообразному
CF
4
.
На
этой основе были
произведены расчеты
для
всех
соединений фтора, упоминающихся
Р
этой главе
и в гл. XIV
(ср.
табл. VIII.2
и № 704 для
состояния
Идеального газа). Наши сведения
о
многих простых органических
Соединениях хлора получены благодаря работам, выполненным
в Лундском университете (Швеция)
с
применением метода стацио-
нарной
термохимической бомбы. Смит, Бьеллерап, Крук
и
Уестер-
йарк
[1384]
внесли значительные исправления
в
оригинальные
Данные, однако результаты остаются
все
еще
довольно ненадежны-
. Выполненные Лейчером, Парком
и их
сотрудниками (Колорад-
ский
университет) измерения энтальпий реакций,
а
также более
анние
работы Кистяковского
и его
учеников позволили установить
'Нтальпии образования целого ряда соединений, содержащих фтор
хлор. Бьеллерап
[139,
140]
дает
интересный исторический очерк
азвития калориметрии сжигания органических соединений брома.
ак
и в
случае
соединений фтора, хорошо разработанные методы
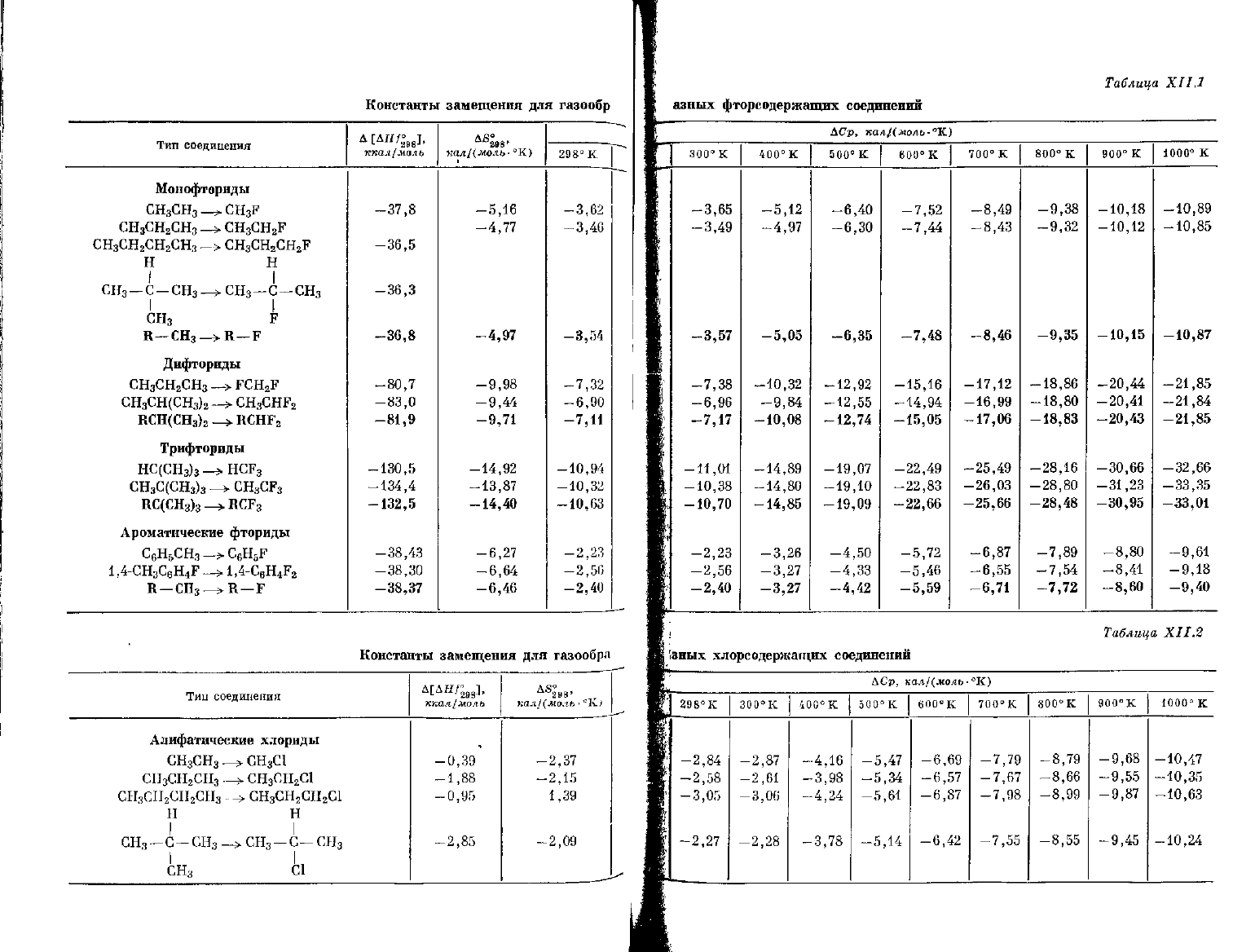
Константы
замещения
для
газообр
Тип
соединения
Монофториды
CH
3
CH
3
-*CH
3
F
СН
3
СН
2
СН
3
->
CH
3
CH
2
F
СН3СН2СН2СН3
—>
GH3CH2CH2F
н н
1
1
I
I
СНз—С
—
СНз
—^
СНз
—
С—СНз
1
СНз
F
R—СН
3
—>R—F
Дифториды
СН
3
СН
2
СН
3
—>
FCH
2
F
СН
3
СН(СН
3
)
2
—>
CH
3
CHF
2
RCH(CH
3
)
2
—=•
RCHF
2
Трифториды
HC(CH
3
)
3
->HCF
3
CH
3
C(CH
3
)3->CH
3
CF3
RC(CH
3
)
3
^RCF
3
Ароматические
фториды
С6Н5СН3
—> CgHsF
l,4-CH
3
C
e
H
4
F
—>
1,4-C
6
H
4
F
2
R—CH
3
_4>R—F
Д[ля/°
98
],
ккал/моль
-37,8
-36,5
-36,3
-36,8
-80,7
-83,0
-81,9
-130,5
-134,4
-132,5
-38,43
-38,30
-38,37
калЦмоль-
°К)
-5,16
-4,77
-4,97
-9,98
-9,44
-9,71
-14,92
-13,87
-14,40
-6,27
-6,64
-6,46
298°
К
-3,62
-3,46
-3,54
-7,32
-6,90
-7,11
-10,94
-10,32
-10,63
-2,23
-2,56
-2,40
Таблица
ХИЛ
Константы
замещения
для
газообра
Тип
соединения
Алифатические
хлориды
СН
3
СН
3
—>
СН
3
С1
СН-зСН^ОНз
—>
ОНзСгз^С!
СН3СН2СН2СН3
—>
CH3CH2CH2CI
н н
1
L*ri3
—
v-*— ^^З
—^"
^^-3
—
^*— ^"3
СН
3
С1
ккал/моль
-0,39
-1,88
-0,95
-2,85
кал[(моль
•
°Kj
-2,37
-2,15
1,39
-2,09
-
азных
фторсодержащих
соединений
ДСр,
калДлшль-°К)
I
1
1
I
к
300°К
-3,65
-3,49
-3,57
-7,38
-6,96
-7,17
-11,01
-10,38
-10,70
-2,23
-2,56
-2,40
400°К
-5,12
-4,97
-5,05
-10,32
-9,84
-10,08
-14,89
-14,80
-14,85
-3,26
-3,27
-3,27
500°
К
-6,40
-6,30
-6,35
-12,92
-12,55
-12,74
-19,07
-19,10
-19,09
-4,50
-4,33
-4,42
600°
К
-7,52
-7,44
-7,48
-15,16
-14,94
-15,05
-22,49
-22,83
-22,66
-5,72
-5,46
-5,59
700°
К
-8,49
-8,43
-8,46
-17,12
-16,99
-17,06
-25,49
-26,03
-25,66
-6,87
-6,55
-6,71
800°
К
-9,38
-9,32
-9,35
-18,86
-18,80
-18,83
-28,16
-28,80
-28,48
-7,89
-7,54
-7,72
900°К
-10,18
-10,12
-10,15
-20,44
-20,41
-20,43
-30,66
-31,23
-30,95
-8,80
-8,41
-8,60
1000°
К
-10,89
-10,85
-10,87
-21,85
-21,84
-21,85
-32,66
-33,35
-33,01
-9,61
-9,18
-9,40
Таблица
XII.2
i
зных хлорсодержащих соединений
ДСр,
калЦмоль-
ш
Ш
1
298°К
-2,84
-2,58
-3,05
-2,27
300°К
-2,87
-2,61
-3,06
-2,28
400°К
-4,16
-3,98
-4,24
-3,78
500°К
-5,47
-5,34
-5,61
-5,14
600°К
-6,69
-6,57
-6,87
-6,42
700°К
-7,79
-7,67
-7,98
-7,55
800°К
-8,79
-8,66
-8,99
-8,55
900°К
-9,68
-9,55
-9,87
-9,45
1000°К
-10,47
-10,35
-10,63
-10,24

Тип соединения
сн.
СН
3
I
СН
3
—
С—СНз—>
СНз—С—СН
3
СН
3
С1
— СН3СН2СН2СН3 -
1
С1СН
2
СН
2
С1
СНз(СН
2
)зСН
3
->
СНз(СН
2
)
3
С1
н н
СН
3
СН
2
—
С—СНз
-±
СН
3
СН
2
—С
— СН
3
I
СНз
н
н
СН
3
СН
2
—
С—СН
3
-^
С1СН
2
СН
2
—С—СНз
СНз
н
I
СН
3
н
€Н
3
СН
2
СН
2
—
С—СН
3
—>
С1СН
2
СН
2
—
С—СН
3
I
I
СНз СНз
сн. сн.
СН
3
СН
2
-С-СН
3
-».СНзСН
2
-С-СНз
ОН С1
н н
1
I I
•j-
СН
3
СН
2
—С
— СН
3
-^.
С1СН
2
— С — СН
3
СН
3
~2
СН
3
(СН
2
)зСНз
-
н
1
С1
С1(СН
2
)
3
С1
-±-СН
3
СН
2
-С-(
3
I
|
СН
3
R —СНз-^R —CI
Ароматические
хлориды
С
6
Н
5
СН
3
->С
6
Н
5
С1
н
С
|
С1
Д[дн/°
в8
],
nnai1мо1Ь
-4,13
-0,43
-0,20
-1,68
-1,18
-1,44
-4,05
-1,34
-1,80
-1,07
-1,67
0,44
29S
кал/(лшль-°К)
-1,17
-2,41
-1,93
-3,38
Продолжение
табл.
XI 1.2
ДСр,
кал/(моль-°К)
298°К 300°К 400°К 500°К 600°К 700°К 800°К 900°К
1000"
К
-1,17
-2,25
-2,46
-1,37
-1,81
-2,20
-2,47
-1,38
-3,55
-3,80
-3,92
-2,63
-5,40
-5,32
-5,38
-4,05
-7,01
-6,70
-6,71
-5,42
-8,30
-7,86
-6,71
-9,28
-8,92
-8,87
-7,83
-10,01
-9,82
-9,74
-8,82
-10,80
-10,61
-10,52
-9,71
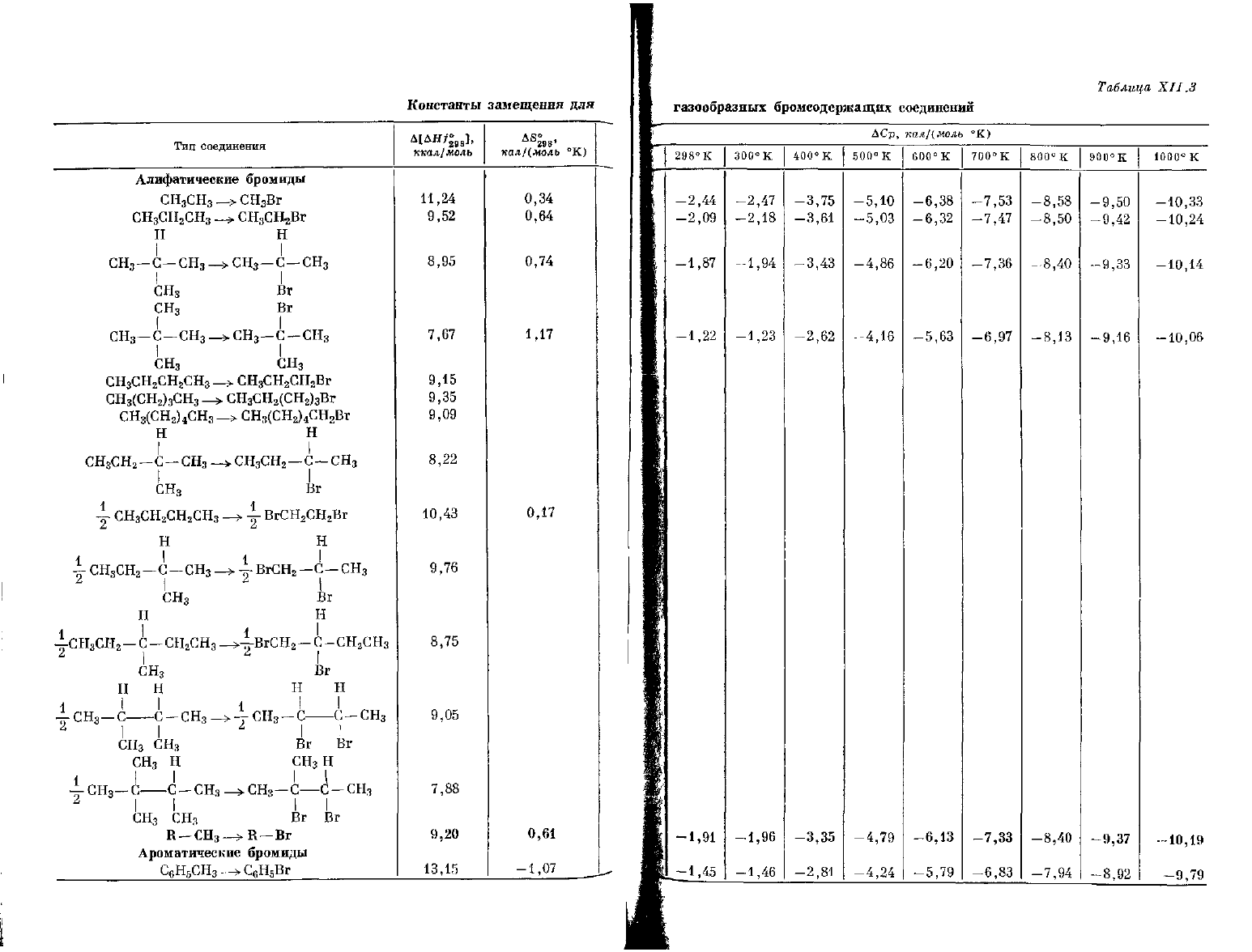
Тип соединения
Алифатические
бромиды
СН
3
СН
3
—>
СН
3
Вг
СН
3
СН
2
СН
3
-*
CHgCH^Br
н
н
1
I
1
1
СНз—С
—
СНз
—^
СНз—С
— СНз
1
1
СН
3
Вг
СН
3
Вг
1
1
1
1
СНз—С-—СНз
—^
СНз—С
— СНз
1
1
СН
3
СН
3
СН
3
СН
2
СН
2
СН
3
—> СН
3
СН
2
СН
2
Вг
СН
3
(СН
2
)
3
СН
3
_> СН
3
СН
2
(СН
2
)
3
Вг
СН
3
(СН
2
)
4
СН
3
->
СН
3
(СН
2
)
4
СН
2
Вг
н
н
1
1
СНзСН,—С—СН
3
—»СН
3
СН
2
—С —СН
3
1
1
СН
3
Вг
i- СН
3
СН
2
СН
2
СН
3
-^ у
ВгСН
2
СН
2
Вг
н
н
1
1
4-сн
3
сн
2
—с—сн
3
->4-
ВгС
н
2
—с—сн
3
II
СН
3
Вг
н
н
1
1
4-сн
3
сн
2
-
с
-
сн
2
сн
3
-^4-вгСН
2
-
с
-
сн
2
сн
3
1
1
СН
3
Вг
н
н н н
i
1 !
4-СНз-С С-СНз _»-^СНз-С С-СН
3
II 1
СНз
СНз Вг Вг
СН
3
Н
СНз
Н
~
СНз—
С
С—СНз —* СН
3
— С—С-СНз
с, 1 1 1
СНз
СНз Вг Вг
R —CH
3
—>R—Вг
Ароматические
бромиды
CgH5CH
3
—> СеНбВг
Константы
Л[ДЯ/°
98
],
ккал/моль
11,24
9,52
8,95
7,67
9,15
9,35
9,09
8,22
10,43
9,76
8,75
9,05
7,88
9,20
13,15
замещения
для
Д8
2°
в8
-
калЦмоль
°К)
0,34
0,64
0,74
1,17
0,17
0,61
-1,07
газообразных бромсодержащих соединений
\
1
1
1
1
I
I
1
1
1
1
1
298°К
-2,44
-2,09
-1,87
-1,22
-1,91
_^М5
300°К
-2,47
-2,18
-1,94
-1,23
-1,96
-1,46
400°К
-3,75
-3,61
-3,43
-2,62
-3,35
-2,81
ДСр,
500°К
-5,10
-5,03
-4,86
-4,16
-4,79
-4,24
кал/(моль
600°К
-6,38
-6,32
-6,20
-5,63
-6,13
-5,79
°К)
700°К
-7,53
-7,47
-7,36
-6,97
-7,33
-6,83
800°К
-8,58
-8,50
-8,40
-8,13
-8,40
-7,94
Таблица
XII.3
900°К
-9,50
-9,42
-9,33
-9,16
-9,37
-8,92
1000°К
-10,33
-10,24
-10,14
-10,06
-10,19
-9,79

558
Часть
2
Термические
и
термохимические
свойства
веществ
Константы
замещения
для
газооб
Тип соединения
Алифатические
иодиды
СНзСНз—>.СН
3
1
СН3СН2СН3
—» CH3CH2I
н
н
I
I
СН
3
—
С —
СН
3
—»СН
3
—
С — СН
3
I
I
СН
3
I
CH3CH2CH2CH3
—> CH3CH2CH2I
4- сн
3
сн
2
сн
2
сн
3
.
н
у
сн
3
сн
3
I
з
—
С
— СН
»i-ICH
2
CH
2
I
Н
4-1СН
2
-С-СН
3
I
сн
3
I
з—
С — С
I
I
СН
3
I
R —
CH
3
_*R
— I
Ароматические
иодиды
С
8
Н
5
СН
3
—± С
6
Н
5
1
пкалШоль
23,6
22,8
22,2
22,9
23,0
22,8
22,1
22,8
2
V
калЦмоль °К)
2,30
2,75
2,76
2,41
2,07
3,62
2,65
1,24
применялись
лишь при изучении сравнительно немногих бромсо-
держащих соединений.
Термохимия и термодинамика галогенсодержащих органических
соединений
представляют интерес как с теоретической, так и с прак-
тической точки зрения. В своем обзоре Патрик
[1126]
указывает,
что энергия связи С — F возрастает с увеличением числа атомов
фтора, присоединенных к данному атому
углерода.
Причины такой
повышенной
стабильности полностью не установлены. Богатая лите-
ратура
по вопросу об энтальпии образования радикала CF2 и соот-
ветствующей энергии диссоциации
C
2
F
4
с разрывом связи С = С
пока
еще не содержит точных значений этих величин. Барьеры
внутреннего вращения в рассматриваемых соединениях свидетель-
ствуют
о необходимости дальнейших исследований. Несмотря на
большое различие в электроотрицательностях и размерах атомов
XII.
Химическая
термодинамика
галогенсодержащих
соединений
559
Таблица XII 4
разных
иодсодержащих
соединений
АСр,
кал/(моль °К)
298°К
|
300°К 400°К
|
500°К
|
600°К
I
700°К
|
800°К
I
900°К
1000°
К
-2,03
-1,81
-1,61
-0,80
-1,56
-0,72
-2,06
-1,84
-1,64
-0,81
-1,56
-0,73
-3,32
-3,36
-3,18
-2,28
-3,05
-2,15
-4,71
-4,89
-4,66
-3,*
-4,54
-3,68
-6,04
-6,24
-6,04
-5,39
-5,93
-5,15
-7,24
-7,40
-7,23
-6,79
-7,17
-6,49
-8,32
-8,43
-8,28
-7,83
-8,22
-7,65
-9,29
-9 36
-9,23
-8,97
-9,21
-8,67
-10,13
-10,18
-10,06
-9,89
-10,07
-9,59
I
четырех галогенов, барьеры внутреннего вращения метильных
(Групп изменяются лишь незначительно в таких рядах, как ряд
^этилгалогенидов. В ряду C
2
F
5
X барьер повышается от 2 до
•2,5
ккал/молъ
при переходе от X = С1 до X = I [1232]. Измерения
\
теплоемкости веществ в конденсированной фазе при низких тем-
пературах и калориметрические измерения в паровой фазе помогут
[Лучше
выяснить эту тенденцию.
Из-за
недостатка точных данных константы «метил»-замещения
Приведены
в табл. XII.1—XII.4 только для монозамещенных соеди-
аений.
В настоящее время не представляется возможным получить
Достаточно точные оценки энтальпий образования соединений с вы-
сокой
степенью замещения галогенами. Исключением
могут
быть
Черфторалканы,
для которых Брайант [178] и Гуд с сотр. [508]
разработали соответствующие методы расчета.
560
Часть
2.
Термические
и
термохимические свойства веществ
Алифатические
производные. Таблицы
для
состояния
идеального газа
№
701.
Фторметан,
CH
3
F (состояние
идеального
газа).
Мол.
вес
34,034
т,
-к
298
300
400
500
600
700
800
900
1000
кал/(моль
°К)
Ср°
8,96
8,99
10,56
12,26
13,83
15,23
16,45
17,51
18,44
ч°
53,25
53,31
56,11
58,65
61,03
63,27
65,38
67,38
69,28
-(
G
°-
H
293)/
r
53,25
53,26
53,63
54,38
55,29
56,27
57,28
58,29
59,30
•ыкал/моль
0,00
0,02
1,00
2,14
3,45
4,90
6,49
8,18
9,98
дя/°
—55,90
-55,91
—56,61
-57,24
—57,78
—58,22
—58,59
-58,88
—59,11
AGf°
-50,19
—50,16
-48,13
—45,93
-43,62
-42,23
-38,77
-36,28
—33,76
lg
Кр
36,789
36,536
26,295
20,077
15,889
12,870
10,592
8,809
7,378
По
оценке Лейчера
и
Скиннера [833],
AHf
29S
— —
55,9
ккал/молъ.
Термодинамические функции рассчитаны
на
основании отобранных
Смитом
и
Миллсом
[1389]
значений основных частот
и
моментов
инерции,
определенных
по
данным микроволновой спектроскопии
Джиллиамом, Эдвардсом
и
Горди [485]. Джеллс
и
Питцер
[465]
провели хорошо согласующийся расчет функций, воспользовав-
шись частотами
по
Плайлеру
и
Бенедикту
[1172]
и
приняв общий
момент инерции
5,92-Ю"
117
г
3
-см
6
.
Россини, Вагман, Эванс, Левин
и
Джаффе
[1249]
приводят значения
Тт
=
131,4°
К и
ТЪ
=
194,8°
К.
Результаты Р7Г-измерений опубликованы
в
работе Мичелса,
Вис-
сера, Ланбека
и
Уолкерса [998].
т,
°к
298
300
400
500
600
700
800
900
1000
№705
!.
Дифторметан,
CH
2
F
2
(состояние
Мол.
вес 52,026
кал/(моль-"К)
Ср°
10,25
10,28
12,22
14,10
15,72
17,08
18,22
19,17
19,98
8"
58,94
59,01
62,23
65,17
67,88
70,41
72,77
74,97
77,04
-(С"-н;
98
)/т
58,94
58,95
59,37
60,24
61,29
62,42
63,56
64,71
65,84
идеального
газа).
ккал/моль
Я
°-
Н
298
0,00
0,02
1,15
2,47
3,96
5,60
7,37
9,24
11,20
дя/°
—108,24
—108,25
—108,84
-109,34
-109,76
—110,09
-110,36
—110,56
—110,71
AGf°
—101,66
—101,62
—99,31
-96,87
-94,34
-91,74
—89,10
-86,43
—83,76
lg
Кр
74,513
74,024
54,260
42,341
34,361
28,641
24,340
20,987
18,304
XII.
Химическая термодинамика галогенсодержащих соединений
561
Нейгебауер
и
Маргрейв
[1061]
измеряли энтальпию сгорания
паров дифторметана.
Их
данные приводят
к
значению
АЯ/°
98
(g)
—
=
—
108,24
ккал/моль. Термодинамические функции рассчитаны
на
основании основных частот
по
Плайлеру
и
Бенедикту
[1172]
и
величин моментов инерции, вычисленных Лайдом [865], исходя
!
из
данных микроволновой спектроскопии. Недавно выполненное
J
Порто
[1181]
исследование тонкой структуры инфракрасных полос
| привело
к
результатам, прекрасно согласующимся
с
данными
Лай-
|
да.
Менее точные молекулярные данные использовали
при
расчете
термодинамических функций Джеллс
и
Питцер [465], Мейстер,
Доулинг
и
Билецкий [990], Свердлин
и
Годнев
[1453]
и
Глоклер
и
Эджелл
[497, 498].
Согласно Россини, Вагману, Эвансу, Левину
и
Джаффе [1249],
ТЪ
=
221°
К.
№ 703. Трифторметан,
CHF
3
(состояние идеального газа).
Мол.
вес
70,018
Т,
°К
298
300
400
500
600
1
700
800
900
1000
кач/(моль
°К)
Ср°
12,20
12,24
14,88
16,55
18,13
19,36
20,33
20,99
21,74
s°
62,04
62,12
66,03
69,53
72,69
75,58
78,23
80,66
82,91
-
(С
°-
Н
298^
Г
62,04
62,05
62,56
63,61
64,86
66,19
67,53
68,86
70,15
•ккал/мо
<ib
Н
°~
Н
298
0,00
0,03
1,39
2,96
4,70
6,58
8,56
10,63
12,77
AHf°
-166,71
— 166,72
—167,10
—167,41
-167,65
—167,82
-167,95
—168,04
-168,09
AGf°
—158,48
—158,43
—155,61
—152,70
—149,73
—146,73
-143,71
—140,67
-137,65
lg
Kp
116,165
115,412
85,015
66,740
54,536
45,808
39,257
34,158
30,083
Нейгебауер
и
Маргрейв
[1061]
измеряли энтальпию сгорания
паров трифторметана.
Их
данные приводят
к
значению
А///°
98
(g)
=
=
—
166,71
ккал/молъ.
Принятые здесь термодинамические функции
рассчитаны Джеллсом
и
Питцером
[465]
на
основании отнесений
колебаний
по
Плайлеру
и
Бенедикту
[1172]
и
моментов инерции,
вычисленных
из
оптических спектров Бернстейном
и
Герцбергом
1118]. Сравнительно недавние микроволновые спектроскопические
Данные, полученные Гхошем, Трамбаруло
и
Горди [473], позволили
установить
структуру,
прекрасно согласующуюся
со
структурой
по
Бернстейну
и
Герцбергу, отнесения колебаний подтверждены
Декером, Мейстером
и
Клевелендом [316], которые рассчитали
тер-
модинамические функции, почти совпадающие
с
функциями, вычи-
сленными Джеллсом
и
Питцером. Термодинамические функции
рас-
считаны также Свердлиным
и
Годневым [1453],
а
теплоемкости
вы-
36—831
