Сталл Д. Вестрам Э. Зинке Г. Химическая термодинамика органических соединений
Подождите немного. Документ загружается.

X. Химическая термодинамика
соединений
С, Н и О
483
тон,
Мартин и Спрейк [126] измеряли давление пара и определили
ТЪ
=
372,66°
К; по их расчетам, AHv
31s
= 9,80 ккал/моль, что
хорошо согласуется с данными Бермана и Мак-Кетты [114]. По дан-
ным
Амброза и Тоунсенда [14], Тс =
535,95°
К и Рс = 41,39 атм
№
523.
трет-Бутиловый
спирт,
С
4
Н
]0
О
(состояние
идеального
газа).
Мол.
вес
74,120
298
300
400
500
600
700
800
900
1000
27,10
27,23
34,16
40,27
45,37
49,64
53,32
56,42
59,16
77,98
78,15
86,96
95,25
103,06
110,38
117,26
123,72
129,81
77,98
77,99
79,14
81,54
84,48
87,67
90,94
94,23
97,48
Н'-
0,
0
3
6
11
15
21
26
32
тто 1
И
298 |
00
06
13
86
15
91
,06
,55
,33
AHf
—77,
—77,
-79,
-81,
-82,
-82,
-83,
-84
-84
о
87
91
64
05
15
98
60
02
26
AG/
—45,
-45,
—34,
—22,
-И,
0,
12,
24
36
ч
66
47
38
89
16
75
75
82
94
33,47)
33,120
18,781
10,005
4,061
—0,23.
J
>
—3,482
—6,027
-8,072
По
данным измерения теплоты сгорания Скиннер и Снелсон
[1365]
вычислили АЯ/адя (I) =
—85,87
ккал/молъ; в сочетании с дан
ными
измерения теплоты испарения, полученными Бейноном и Мак-
Кеттой [124], это приводит к значению
AHf
us
(g) =
—77,87
ккал/молъ
Оттинг
[1082]
на основании изучения термических свойств в интер-
вале температур
15—330°
К пришел к выводу, что энтальпия пре-
вращения
кристаллической фазы II в кристаллическую фазу I при
Tt
=
286,14°
К равна Д#£° = 0,198 ккал/молъ, энтальпия превра-
щения
кристаллической фазы II в кристаллическую фазу III при
Tt
—
281,54
°К равна Д#£° = 0,155 ккал/молъ, а энтальпия превра-
щения
кристаллической фазы III в кристаллическую фазу I при
Tt
=
294,47°
К равна AHf = 0,117 ккал/молъ; при Ttp =
298,97°
К
величина АНт = 1,602 ккал/молъ;
S°
Z9a
(с) =
40,84
кал/(молъ-°К)
и
S°
29S
,
91
(I) =
46,30
кал/(молъ-°К).
Бейнон и Мак-Кетта [124] изме-
ряли
давление пара, теплоту испарения и теплоемкость пара. Они
сообщили,
что полученные ими значения теплоемкости пара согла-
суются в пределах ошибки эксперимента с данными Рейнолдса и Де
Вриса [1121], а также Зинке и Де Вриса [1355]. Бейнон и Мак-
Кетта [124] произвели корреляцию значений теплоемкостей пара
с моделью, предполагающей равновесную смесь мономеров, димеров
и
тетрамеров. Им удалось привести в соответствие значение энтро-
пии,
установленное на основании третьего закона термодинамики,
со спектроскопическими данными и строением молекулы, а также
рассчитать термодинамические функции. По их данным, AHv =~
=
7,86 ккал/молъ при ТЪ =
355,48°
К, AHv
im
= 8,00 ккал/молъ
и
$298 (ё)
=
77,98
кал/(молъ-°К).
Согласно Амброзу и Тоунсенду
[14],
Тс =
506,2°
К, Рс = 39,2 атм и& =
0,270
г/см
3
.
Эберц и Лукас [363], а также Тафт и Риж
[1464]
изучали равно-
весную гидратацию изобутена до т/?епг-бутилового спирта и уста-
новили,
что
AG°
29S
=
—1,300
ккал/молъ для следующей реакции:
0?) + Н
2
О (О = С
4
НюО (1)
70,17
—4,04
16,72
-68,32
46,30
—85,87
-40,59
-13,51
Под
формулами соединений, участвующих в этой реакции, указаны
значения
энтропии и энтальпии образования; приведены также
данные,
полученные на основании таблиц, воспроизведенных в этой
книге.
Из указанных значений следует, что AGr = —13,51 —
1
—
[298,15
(—40,59)]
=
—1,408
ккал/молъ, а это хорошо согла-
суется с равновесными значениями.
№
524. Амиловый спирт, С
5
Н
12
О (состояние идеального газа).
Мол.
вес
88,146
i
*
г, °к
298
300
400
500
600
700
800
900
1000
Ср°
31,76
31,91
39,74
47,01
53,24
58,59
63,18
67,15
70,59
кал J
(моль
в-
96,21
96,41
106,68
116,35
125,48
134,10
142,23
149,91
157,16
-К)
-(G°-H°
98
)/T
96,21
96,22
97,56
100,36
103,79
107,51
111,35
115,21
119,05
ккал/моль
Н
°-
Н
2°98
0,00
0,06
3,65
8,00
13,02
18,61
24,71
31,23
38,12
дя/°
—72,27
—72,32
-74,48
-76,29
—77,73
-78,85
-79,69
—80,28
-80,63
AGf°
-35,79
-35,56
—22,97
—9,88
3,54
17,18
30,95
44,83
58,76
ЫКр
26,232
25,907
12,550
4,318
-1,289
-5,364
-8,455
-10,885
-12,841
По
результатам измерений теплоты сгорания Чао и Россини
(215] получили значение
АЯ/°
М
(Z) =
—85,55
ккал/молъ, которое
хорошо согласуется с величиной, предложенной Россини [1242].
Согласно измерениям Вадсо и Вадсо [1553], AHv
298
— 13,28 ккал/молъ,
что приводит к
АЯ/°
98
(g) =
—72,27
ккал/молъ. Парке, Хаффман
H
Бармор
[1106]
изучали термические свойства при температу-
Рах от 90 до
298°
К и сообщили следующие результаты: Тт. = >
=
195,0°
К, АНт
0
=
2,350
ккал/молъ и ТЪ =
411,0°
К. Отсюда /
Рассчитано значение АНи
ш
= 10,20 ккал/молъ. Согласно Парксу,/
/
484
Часть
2.
Термические
и
термохимические
свойства
веществ
X.
Химическая
термодинамика
соединений
С, Н
и
О
485
Хаффману
и
Бармору [1106], Sl
ts
(I)
=
60,9
кал/(моль-°К).
Зинке
и
Де
Врис
[1355]
измеряли теплоемкость пара
и
получили данные,
хорошо согласующиеся
с
расчетными значениями Грина. [532],
который вычислил также термодинамические функции
и
величину
К»н
(g)
=
96,21
кал/(молъ-°К).
№
525.
mpem-Амиловый
спирт,
C
5
Hi
2
0
(состояние
идеального
газа).
Мол.
вес
88,146
Таким образом, замена метильной группы неопентана
на
группу
ОН
понижает энтропию
на
(86,89
—
84,54)
=
2,35
кал/'(моль -°К).
Г,
°К
298
300
400
500
600
700
800
900
1000
кал/(моль-°К)
c
v
°
31,47
31,63
39,97
47,68
54,25
59,59
64,22
67,82
71,40
S°
87,68
87,88
98,14
107,91
117,20
125,97
134,24
142,01
149,34
87,68
87,69
89,03
91,83
95,29
99,06
102,94
106,86
110,74
ккал/моАь
Н
°~
Н
298
0,00
0,06
3,65
8,04
13,15
18,85
25,04
31,65
38,61
ДН/°
—78,65
—78,70
-80,86
—82,62
—83,98
—85,00
—85,74
-86,24
—86,53
AGf
—39,62
—39,39
—25,94
—11,99
2,26
16,72
31,30
45,97
60,68
igKp
29,0 V
28,691
14,171
5,243
—0,823
-5,221
—8,5?(
—
11,162
—13,262
По
данным измерений теплоты сгорания
Чао
и
Россини
[215]
вычислили
A///
2q8
(I)
=
—90,71
ккал/молъ.
Для
согласования
с
соот-
ветствующими величинами, полученными Вадсо
и
Вадсо [1553],
при-
няты
во
внимание данные Мак-Карди
и
Лейдлера
[966]
и
установле-
но,
что
AHv^gs
=
12,06
ккал/молъ,
а
это
приводит
к
AHf
2as
(g)
=
=
—78,65
ккал/молъ. Парке, Хаффман
и
Бармор
[1106]
изучали
низкотемпературные свойства
в
интервале
от 90
до'
298°
К и
полу-
чили следующие результаты:
Tt =
146,0°
К,
AHf =
0,469
ккал/молъ,
Тт
=
264°
К,
АНт°
=
1,065
ккал/молъ,
ТЪ
=
375,5°
К и
5°
98
(I)
=
=
54,8
кал/(моль-°К).
Согласно Батлеру, Рамчандани
и
Томсону
[187],
AHv
al5
=
9,40
ккал/молъ.
В
соответствии
с
третьим законом
термодинамики энтропия рассчитана следующим образом:
Sjgs
(I)
54,80
кал/(молъ-°К)
Д5и=ДЯу/Г
=
12
060/298,15
40,45
Д5
(сжатие),
—Л In
(760/16,8)
—7,57
Saes
(g)
87
-
68
кал/(моль-°К)
Принимая
во
внимание общую симметрию, можно следующим обра-
зом оценить энтропию
трепг-а.ммл.ового
спирта
[в
кал/(молъ-°К)].
Sags
неопентан
(g)
73,23 Sl
as
mpem-бутиловый
спирт
(g)
78,00
R
In 972
13,66
Л In 27
6,54
86,89
S^ 2,2-диметилбутан
(g)
R
In 243
85,62
10,90
96,52
S298
трет-ампловыш
спирт
(g) x
Я
In 27
6,54
(минус
2,35)=
94,17
Таким образом
(96,52
— 2,35 — 6,54) —
х =
87,63
кал/(молъ•
°К).
Получается неплохое согласие,
но
оценочные значения имеют
точ-
ность
в
пределах
0,5
кал/(молъ-°К).
Теплоемкость этого соединения
в газообразном состоянии рассчитана
на
основании разности тепло-
емкостей амилового спирта
и
гексана
и
теплоемкости 2,2-диметил-
бутана.
№
526.
Гексиловый
спирт,
С
6
Н
14
О
(состояние
идеального
газа).
Мол.
вес
102,172
T,
"К
•
298
300
400
500
600
700
800
900
1000
пал/(моль
-°К)
Ср°
37,23
37,41
46,68
55,26
62,58
68,87
74,25
78,90
82,92
s°
105,52
105,76
117,80
129,17
139,90
150,03
159,59
168,61
177,14
-(
G
°-
H
2%
8
)
/
T
105,52
105,53
107,11
110,39
114,42
118,79
123,30
127,84
132,35
ккал/моАь
Н
°-
Я
29»
0,00
0,07
4,28
9,39
15,29
21,87
29,03
36,70
44,79
дн/°
—76,39
-76,44
—78,93
—80,99
-82,63
—83,89
-84,83
—85,47
-85,85
ДО/"
—32,97
—32,71
-17,73
—2,19
13,72
29,89
46,20
62,63
79,12
IgXp
24,168
23,825
9,689
0,957
—4,998
—9,332
—12,621
-15,208
—17,291
84,54
По
данным измерений теплоты сгорания
Чао
и
Россини
[215]
вычислили
АД/298
(Ь
~
—90,67
ккал/молъ. Расчет
по
уравне-
нию
(Х.1)
приводит
к
значению
АЯУ
298
=
14,28
ккал/молъ, откуда
следует
AHf
29S
(g)
=
—76,39
ккал/молъ. Келли
[733]
на
основании
изучения низкотемпературных свойств
в
интервале
18—298°
К
сооб-
щил следующие значения:
Ttp =
225,8°
К,
АНтп°
=
3,676
ккал/молъ
й
^s (0
=
68,6
кал/(молъ-°К).
Грин
[532]
получил
на
основании
энтропии
в
соответствии
с
третьим законом термодинамики значение
"^298
(ё)
~
Ю5,1
кал/(моль-°К)
и по
методу инкрементов рассчитал
*^298
(ё)
~
Ю5,52
кал/(моль-°К),
а
также остальные значения термо-
динамических функций, принятые здесь.
48b
Часть
2.
Термические
и
термохимические
свойства
веществ
№
527. Гептиловый спирт,
С
7
Н
16
О
(состояние
идеального газа).
Мол.
вес
116,198
X.
Химическая
термодинамика
соединений
С, Н и О
487
298
300
400
500
600
700
800
900
1000
кал/(моль
°К)
Ср°
42,70
42,91
53,62
63,51
71,92
79,15
85,32
90,65
95,25
s°
114,83
115,10
128,93
141,99
154,33
165,97
176,95
187,31
197,11
-(G--H|
98
)/r
114,83
114,84
116,65
120,42
125,05
130,08
135,26
140,47
145,65
ккал/моль
0,00
0,08
4,92
10,79
17,57
25,13
33,36
42,17
51,47
АН/"
—80,03
-80,09
—82,89
-85,21
—87,05
—88,45
—89,49
-90,19
—90,58
AG/°
-29,68
—29,37
-12,02
5,98
24,39
43,08
61,94
80,92
99,97
lgifp
21,752
21,393
6,565
—2,613
—8,883
—13,451
—16,919
—19,649
-21,847
По
данным измерения теплоты сгорания Чао и Россини [215]
вычислили
AHf
29i
(I) =
—95,31
ккал/молъ. Расчет по уравнению (Х.1)
приводит к AHv
2
98 ~ 15,28 ккал/молъ, что дает
AHf
2gs
(g) =
=
—80,03
ккал/моль. Парке, Кеннеди, Гейтс, Мосли, Мур и Ренк-
вист
[1109]
изучали термические свойства в интервале температур
от 80 до
300°
К и сообщили следующие данные: Тт =
240,4°
К,
АНт°
=
4,344
ккал/молъ
и
S°
2gs
(I) = 77,9 кал/(моль-°К). Согласно
Россини,
Питцеру,
Арнетту,
Брауну и Пиментелу [1248], ГЬ=449,4°К.
Грин [532] получил на основании энтропии в соответствии с третьим
законом
термодинамики значение S\
m
(g) = 116,1
кал/(молъ
•
°К)
и
по методу инкрементов рассчитал Sl
9S
(g) =
114,83
кал/(моль-°
К),
а также остальные значения термодинамических функций,
приня-
тые здесь.
№
528. Октиловый спирт,
С
8
Н
18
О
(состояние
идеального газа).
Мол.
вес
130,224
298
300
400
500
600
700
800
900
1000
кал/(моль
°К)
Ср°
48,17
48,41
60,56
71,76
81,26
89,43
96,39
102,40
107,58
S"
124,14
124,44
140,06
154,81
168,75
181,90
194,31
206,02
217,08
124,14
124,15
126,19
130,45
135,69
141,36
147,21
153,10
158,95
ккал/моль
Н
°~
Н
298
0,00
0,09
5,55
12,18
19,84
28,39
37,69
47,63
58,14
дя/°
—85,34
-85,41
—88,53
—91,10
-93,14
—94,68
—95,82
-96,57
—96,98
AG/°
—28,05
—27,70
-7,97
12,48
33,38
54,60
76,00
97,53
119,14
lgKp
20,561
20,178
4,354
—5,453
-12,159
—17,047
—20,760
—23,683
—26,037
По
данным измерения теплоты сгорания Чао и Россини [215]
числили
AHf
2sa
(I) =
—101,62
ккал/молъ; это значение в сочета-
1И
с величиной
AHv
298
= 16,28 ккал/молъ, полученной по уравне-
_ро (Х.1), дает
АЯ/
2
°
Э8
(g) —
—85,34
ккал/молъ. Грин [532] рассчитал
врмодинамические функции, включающие значение
S°
MS
(g) =
124,14
кал1'(моль-°К). Согласно Клайну и Эндрюсу [237], Тт =
231,7°
К, а по данным Россини, Питцера, Арнетта, Брауна и Пи-
внтела [1248], ТЪ =
468,4°
К.
№ 529. Нониловый спирт, С
9
Н
20
О (состояние идеального газа).
Мол.
вес
144,250
ш'°
к
К
298
К
300
»
400
К
500
Ж
600
Ж
700
if
800
Щ
900
Цооо
Ср°
53,64
53,91
67,50
80,01
90,60
99,71
107,46
114,15
119,91
кал/(мол1
S°
133,45
133,79
151,18
167,63
183,17
197,84
211,67
224,72
237,06
.
°К)
-(G°-H°
98
)/r
133,45
133,46
135,74
140,48
146,32
152,64
159,16
165,73
172,25
ккал/моль
Н
°~
Н
298
0,00
0,10
6,18
13,58
22,12
31,65
42,01
53,10
64,81
дн/°
—92,47
—92,54
-95,98
—98,81
—101,04
—102,73
—103,97
—104,78
—105,20
-28,25
—27,85
—5,74
17,15
40,56
64,31
88,24
112,33
136,50
lg Кр
20,703
20,289
3,138
-7,498
—14,772
—20,076
-24,105
—27,276
-29,830
По
данным измерения теплоты сгорания Чао и Россини [215]
числили
ДЯ/
2
°
98
(I) —
—109,75
ккал/молъ, это значение при
298
=
17,28 ккал/моль по уравнению (Х.1) дает
AHfl
9S
(g) =
—92,47
ккал/молъ. Грин [532] рассчитал
iS°
98
(g) =
133,45
кал/(молъ•
°К) и все термодинамические функции. Россини,
ицер,
Арнетт, Браун и Пиментел
[1248]
отобрали
ТЪ
=
486,7°
К.
№ 530. Дециловый спирт, С
10
Н
22
О (состояние идеального газа).
Мол.
вес
158,276
?т,
«к
калЦмогь
°К)
142,76
143,13
162,31
180,45
197,59
213,77
229,03
243,43
257,03
142,76
142,77
145,28
150,52
156,95
163,92
171,11
178,36
185,55
ккал/моль
н°-я; дн/°
0,00
0,11
6,82
14,97
24,39
34,90
46,34
58,57
71,48
—96,38
—96,46
-100,22
-103,30
-105,73
-107,56
-108,89
-109,76
-110,21
AGf°
—25,22
—24,78
—0,30
25,05
50,95
77,23
103,70
130,35
157,07
lg-Kp
18,486
18,054
0,162
-10,950
-18,557
-24,110
-28,328
-31,651
-34,326

488
Часть
2.
Термические
и
термохимические
свойства
веществ
X
Химическая
термодинамика
соединений
С, Н и О
489
По
данным измерения теплоты сгорания
Чао и
Россини
[215]
вычислили значение
AHf
29S
(I)
=
—114,66
ккал/молъ, которое
в
соче-
тании
с
величиной
AHv^s
= 18,28
ккал/молъ, рассчитанной
по
урав-
нению (Х.1), дает
AHf
2ts
(g) =
—96,38
ккал/молъ. Согласно
рас-
четам термодинамических функций, произведенным Грином [532],
^Ls
(g) =
142,76
кал/(молъ-°К)
Россини, Питцер, Арнетт, Браун
и
Пиментел
[1248]
отобрали
ТЪ =
503,2°
К.
№
531.
Ундециловый
спирт,
С
И
Н
24
О
(состояние
идеального
газа).
Мол.
вес 172,302
298
300
400
500
600
700
800
900
1000
кал/(моль °К)
Ср°
64,58
64,91
81,38
96,51
109,28
120,27
129,60
137,65
144,57
s°
152,07
152,48
173,44
193,27
212,02
229,71
246,39
262,13
277,00
-(G°-H
2
°
M
)/r
152,07
152,08
154,82
160,55
167,58
175,20
183,07
190,99
198,85
кпал/моль
0 00
0,12
7,45
16,36
26,67
38,16
50,66
64,04
78,16
дя/°
—100,91
—101,00
-105,07
—108,41
—111,04
—113,01
—
114,44
—115,36
-115,83
AGf°
—22,81
—22,34
4,53
32,33
60,72
89,53
118,54
147,74
177,02
lgKp
16,722
16,271
-2,47d
—14,131
—22,117
—27,95(
—32,38\
—35,87о
—38,687
В соответствии
с
данными табл.
Х.8 и
значением
для
исходного
углеводорода
Д#/
298
(g) =
—100,91
ккал/молъ
Грин
[532]
рассчитал
значение
S°
Ma
(g) =
152,07
кал/(молъ-°К)
и
вычислил величины всех
термодинамических функций. Россини, Питцер,
и
Пиментел
[1248]
отобрали
ТЪ = 519° К.
Арнет, Браув
№
532.
Додециловый
спирт,
С
12
Н
26
О
(состояние
идеального
газа).
Мол.
вес
186,328
т,
°к
298
300
400
500
600
700
800
900
1000
кал/(моль °К)
Ср°
70,05
70,41
88,32
104,76
118,62
130,55
140,67
149,40
156,90
СО
161,38
161,82
184,56
206,09
226,44
245,64
263,75
280,84
296,98
-(G°-H
2
°
98
)/T
161,38
161,39
164,37
170,58
178,21
186,48
195,02
203,62
212,15
ккал/моль
Н
°-
Я
298
0,00
0,13
8,08
17,76
28,94
41,42
54,99
69,50
84,83
дн/°
—105,84
-105,93
—110,33
-113,92
-116,75
—118,87
—120,39
—121,37
—121,85
—20,81
-20,29
8,96
39,21
70,10
101,43
132,99
164,74
196,58
igKp
15,252
14,77
е
»
-4,89'.
-17,137
—25,532
—31,661)
-36,328
—40,001
—42.96С
Значение
SHf
iw
(g) =
—105,84
ккал/молъ
рассчитано
по
данным
для соответствующего углеводорода
с
использованием инкремента,
•
приведенного
в
табл.
Х.8.
Грин
[532]
вычислил величину
5°
98
(g) =
=
161,38
кал/(молъ-°К)
и
произвел полный расчет термодинамиче-
1
ских функций. Россини, Питцер, Арнетт, Браун
и
Пиментел [1248|
| отобрали
ТЪ = 534° К.
№
533.
Тридеканол-1,
С,
3
Н
28
О
(состояние
идеального
газа).
Мол.
вес 200,354
Г,
"К
298
300
400
500
600
700
800
900
1000
кал/(моль
К)
Ср°
75,49
75,87
95,27
112,98
127,97
140,80
151,71
161,12
169,30
s°
170,37
170,84
195,37
218,58
240,54
261,25
280,78
299,20
316,61
-<
G
°-
H
29
8
>/
r
170,37
170,38
173,59
180,29
188,52
197,44
206,65
215,92
225,13
ккал/моль
Н
°-
Н
298
0,00
0,15
8,72
19,15
31,22
44,67
59,31
74,96
91,49
дя/°
—110,77
—110,87
-115,58
—
119,43
—122,46
-124,72
—126,34
—
127,38
-127,88
AGf°
-18,71
—18,14
13,51
46,25
79,67
113,55
147,69
182,02
216,46
igKp
13,712
13,217
—7,383
—20,214
—29,017
—35,452
—40,344
-44,199
—47,305
Значения
A-fl7
298
(g) =
—110,77
ккал/молъ,
S°
2ts
(g) =
170,37
кал/(моль
•
°К)
и
теплоемкости
для
газообразного состоя-
Гния
рассчитаны
по
данным
для
соответствующего углеводорода,
использованием инкрементов, приведенных
в
табл.
Х.8.
Россини,
[Питцер,
Арнетт, Браун
и
Пиментел
[1248]
отобрали
ТЪ = 549° К.
№
534.
Тетрадеканол-1,
C
u
H
S0
O
(состояние
идеального
газа).
Мол.
вес
214,380
%•
г. °к
\
298
*
300
400
500
600
700
800
900
1000
кал/(моль
°К)
Ср°
80,96
81,36
102,21
121,23
137,32
151,08
162,77
172,87
181,60
s°
179,68
180,19
206,49
231,40
254,96
277,19
298,14
317,91
336,59
-(С
о
-я
а
°
в8
)/т
179,68
179,69
183,13
190,32
199,15
208,72
218,60
228,55
238,43
ккал/моль
Н
°~
Я
298
0,00
0,16
9,35
20,55
33,49
47,93
63,64
80,43
98,16
дя/°
—115,70
—115,81
—120,84
—124,94
-128,17
-130,57
—132,29
-133,39
-133,91
AGf
-16,70
—
16,10
17,94
53,13
89,04
125,46
162,13
199,02
236,01
lg Кр
12,242
11,725
—9,802
—23,220
—32,4ol
-39,167
—44,289
—48,326
—51,578
490
Часть
2.
Термические
и
термохимические
свойства
веществ
Теплоемкости для газообразного состояния, значения
S°
2gs
(g) =
=
179,68
кал/(молъ-°К)
и
AHf
29S
(g) —
—115,70
ккал/молъ
рассчитаны
по
данным для соответствующего углеводорода с использованием
инкрементов,
приведенных в табл. Х.8. Россини, Питцер, Арнетт.
Браун и Пиментел
[1248]
отобрали ТЪ =
564°
К.
№
535.
Пентадеканол-1,
Ci
5
H
32
O
(состояние
идеального
газа).
Мол.
вес
228,406
X.
Химическая
термодинамика
соединений
С, Н и О
491
г, °к
298
300
400
500
600
700
800
900
1000
кал/(моль-°К)
Ср°
86,42
86,86
109,15
129,47
146,66
161,35
173,84
184,61
193,90
S"
188,99
189,53
'
217,62
244,22
269,38
293,12
315,50
336,61
356,55
-(в°-н;
и
)/т
188,99
189,00
192,68
200,35
209,78
220,00
230,55
241,18
251,73
ккал/моль
0,00
0,17
9,98
21,94
35,77
51,19
67,96
85,89
104,83
дя/°
—120,62
—120,73
—126,08
—130,44
—
133,86
-136,41
—138,23
—139,38
—139,92
AGf°
—14,69
-14,04
22,38
60,01
98,42
137,37
176,58
216,03
255,58
lgJCp
10,765
10,226
—12,226
—26,231
—35,849
-42,886
—48,237
—52,456
—55,854
Значения
&Hf
2ga
(g) =
—120,62 ккал/моль,
S°
MH
(g) =
=
188,99
кал/(моль
-°К.)
и теплоемкости для газообразного состояния
рассчитаны по данным для соответствующего углеводорода с исполь-
зованием инкрементов, приведенных в табл. Х.8. Россини, Питцер,
Арнетт, Браун и Пиментел
[1248]
отобрали ТЪ =
578°
К.
№
536.
Гексадеканол-1,
С
16
Н
34
О
(состояние
идеального
газа).
Мол.
вес
242,432
г, °к
298
300
400
500
600
700
800
900
1000
кал/(моль
°К)
Ср°
91,89
92,35
116,09
137,72
156,00
171,63
184,90
196,36
206,30
s°
198,30
198,87
228,74
257,03
283,80
309,05
332,86
355,31
376,53
198,30
198,31
202,22
210,38
220,41
231,28
242,51
253,81
265,03
ккал/моль
Я
°-
Н
28Ь
0,00
0,18
10,62
23,33
38,04
54,44
72,28
91,36
111,51
дн/°
-125,54
—125,66
-131,33
—135,94
—139,56
—142,25
—
144,17
—145,38
—145,93
AGf°
-12,67
—11,98
26,81
66,90
107,81
149,28
191,03
233,03
275,14
lg Кр
9,288
8,726
—14,650
—29,241
—39,267
—46,604
—52,185
—56,580
—60,130
ни
следующие данные: Tt =
307°
К,
AHt°
=
3,976
ккал/моль,
1
=
321,8°
К,
АЯ/тг°
= 8,461 ккал/молъ,
S°
MS
(s) = 108,0
кал/(молъ•
°К)
^298 (0
=
1^5,0
кал/(молъ
-
О
К).
Теплоемкости для газообразно-
состояния,
а также величины
S°
2W
(g) =
198,30
кал/(молъ
-°К)
Hflna
(g) =
—125,54
ккал/моль рассчитаны по данным для соот-
твующего углеводорода с использованием инкрементов, приве-
шх в табл. Х.8. Россини, Питцер, Арнетт, Браун и Пиментел
] отобрали ТЪ =
592°
К.
№ 537. Гептадеканол-1, С
17
Н
36
О (состояние идеального газа).
Мол.
вес
256,458
°К
кал/(м
О
ль-"К)
Ср°
97,36
97,84
123,03
145,97
165,34
181,91
195,97
208,11
218,60
s°
207,61
208,22
239,87
269,85
298,22
324,99
350,22
374,01
396,50
-<с-л;
м
>/т
207,61
207,62
211,76
220,41
231,04
242,56
254,46
266,43
278,33
ккал/моль
Н
°-
Н
°2»В
0,00
0,19
11,25
24,73
40,32
57,70
76,61
96,83
118,18
дя/°
-130,47
—130,60
—136,58
—141,46
—145,27
—148,10
—150,12
-151,39
—151,96
AGf°
-10,67
—9,93
31,24
73,78
117,18
161,18
205,48
250,03
294,70
IgKp
7,818
7,235
—17,069
—32,248
-42,682
—50,320
-56,131
—60,713
—64,403
Значение
&Hf
29S
(g) =
—130,47 ккал/молъ,
S°
2as
(g) =
j>207,61
кал/(молъ-°К)
и теплоемкость для газообразного состояния
считаны по данным для соответствующего углеводорода с исполь-
Ванием инкрементов, приведенных в табл. Х.8. Россини, Питцер,
|нетт, Браун и Пиментел
[1248]
отобрали ТЪ =
605°
К.
№
538.
Октадеканол-1,
С
18
Н
38
О
(состояние
идеального
газа).
Мол.
вес
270,484
Парке,
Кеннеди, Гейтс, Мосли, Мур и Ренквист
[1109]
изучали
термические свойства в интервале температур
80—300°
К и полу-
°к
98
00
00
00
00
00
00
00
00
——
кал/(моль-°К)
Ср°
102,82
103,34
129,97
154,21
174,68
192,18
207,03
219,85
230,90
s°
216,92
217,56
251,00
282,67
312,64
340,92
367,57
392,71
416,46
216,92
216,93
221,31
230,44
241,67
253,84
266,41
279,06
291,63
ккал/моль
0,00
0,20
11,88
26,12
42,59
60,96
80,93
102,29
124,84
дя/°
-135,39
—135,52
—141,83
—146,96
—150,97
—153,95
—156,06
—157,38
-157,98
до/-
-8,65
—7,87
35,68
80,67
126,57
173,09
219,93
267,04
314,27
lg Кр
6,340
5,735
—19,493
—35,258
—46,100
—54,039
—60,079
-64,842
—68,679
492
Часть
2.
Термические
и
термохимические
свойства
веществ
X.
Химическая
термодинамика
соединений С, Н
и
О
493
Теплоемкости
для
газообразного
состояния,
а
также
величины
£°
в8
(
g
) =
216,92
кал/(молъ-°К)
и
ЛЯ/°
98
(g)
=
—135,39
ккал/мо.п
рассчитаны по данным для соответствующего углеводорода
с
исполь-
зованием инкрементов, приведенных
в
табл. Х.8. Россини, Питцер,
Арнетт, Браун
и
Пиментел
[1248]
отобрали ТЪ
=
618°
К.
№ 539. Нонадеканол-1, С
)9
Н
4
оО (состояние идеального газа).
Мол.
вес
284,510
Т,
"К
298
300
400
500
600
700
800
900
1000
пая
1
(люль
•
°К)
Ср°
108,29
108,83
136,91
162,46
184,03
202,46
218,10
231,60
243,30
s°
226,23
226,91
262,12
295,49
327,06
356,85
384,93
411,42
436,44
-(G°-H°
98
)/r
226,23
226,24
230,85
240,47
252,30
265,13
278,36
291,69
304,93
кка
г/моль
гто
тто
а
Д
298
0,00
0,21
12,51
27,52
44.87
64,21
85,26
107,76
131,52
дя/°
—140,32
—140,46
—
147,08
-152,47
—156,68
—159,79
—162,01
-163,39
—164,00
AGf°
-6,64
—5,83
40,11
87,55
135,94
184,99
234,37
284,03
333,82
]g Ку
4,871
4,2 V
—21,912
—38,265
—49,5
И
—57,754
—64,0^
—68,900
—72,0,V
Значения
AHfl
98
(s)
=
—140,32 ккал/молъ, S°
29S
(g)
~
=
226,23
кал/(молъ
-
С
К)
и
теплоемкости для газообразного состояния
рассчитаны по данным для соответствующего углеводорода
с
исполь-
зованием инкрементов, приведенных
в
табл. Х.8. Россини, Питцер,
Арнетт, Браун
и
Пиментел
[1248]
отобрали ТЪ
—
631°
К.
№ 540. Эйкозанол-1, С
20
Н
42
О (состояние идеального газа).
Мол.
вес
298,536
т,
°к
298
300
400
500
600
700
800
900
1000
кал/(моль-°К)
Ср°
113,76
114,32
143,85
170,71
193,38
212,74
229,17
243,35
255,70
s°
235,54
236,25
273,25
308,31
341,49
372,79
402,29
430,12
456,42
-<
G
°-
H
298^
r
235,54
235,55
240,39
250,50
262,93
276,41
290,32
304,32
318,23
кпал/моль
Н
°-
Н
298
0,00
0,22
13,15
28,91
47,14
67,47
89,59
113,23
138,20
АН/"
—145,25
—145,40
—152,34
-157,98
—162,38
—165,64
—167,96
—169,39
-170,02
ДЙ/°
—4,64
-3,78
44,53
94,43
145,32
196,89
248,81
301,03
353,37
3,4(Х
2,73!
-24,33)
-41,271
-52
329
—61,47С
—67,969
-73,096
—77.226
Теплоемкости
для
газообразного состояния,
а
также величины
>s(s)
—
—145,25 ккал/молъ
и
S°
2
,
JS
(g)
=
235,54 кал/(моль-"К.)
усчитаны
по
данным
для
соответствующего
углеводорода
с
исполь-
вванием
инкрементов,
приведенных
в
табл.
Х.8.
Россини, Питцер,
|рнетт,
Браун
и
Пиментел
[1248]
отобрали
ТЪ
=
643°
К.
Ненасыщенные спирты. Таблицы
для
состояния
идеального газа
№
541. Аллиловый спирт,
С
3
Нб0
(состояние
идеального газа).
Мол.
вес
58,078
Ш
«г
11'
В
298
•
зо
°
&400
В
500
•boo
К700
К800
№900
Цооо
К—
кал/(моль-°К)
Ср°
18,17
18,25
22,81
26,79
30,11
32,91
35,28
37,35
39,06
S°
73,51
73,63
79,52
85,05
90,23
95,09
99,64
103,92
107,95
-(
G
°-
H
298>'
T
73,51
73,52
74,29
75,89
77,85
79,97
82,15
84,33
86,50
ккал]моль
Н
°-
Н
298
0,00
0,04
2,10
4,58
7,43
10,59
14,00
17,63
21,46
AHf°
—31,55
—31,57
—32,69
—33,62
-34,39
—35,00
—35,48
—35,85
—36,11
—17,03
—16,94
—11,88
-6,57
—1,09
4,52
10,19
15,92
21,70
lgKp
12,481
12,340
6,492
2,871
0,396
—1,410
-2,784
—3,867
—4,742
|"
Долливер,
Грешам,
Кистяковский,
Смит
и
Воган
[334]
изме-
теплоту
гидрирования
аллилового
спирта
до
пропилового
ярта
и
получили
данные,
позволившие
рассчитать
ДЯ/°
98
(g)
=
—31,55
ккал/молъ
для
аллилового
спирта.
Кобе,
Харрисон
и
Пен-
гон
[777]
произвели
отнесение
основных
частот
колебаний
высот
барьеров
и
рассчитали
значение
термодинамиче-
функций.
По
сообщению
этих
исследователей,
>5°
88
(g)
=
73,51
кал/(молъ
'°К).
Двухатомные
спирты.
Таблица
для
состояния
идеального
газа
№ 542. Этиленгликоль, С
2
Н
6
О
2
(состояние идеального газа).
Мол.
вес
62,068
Парке,
Уест,
Нейлор, Фуджии
и
Мак-Клейн
[1121]
измеряли
"^у сгорания
и
установили,
что
ДЯ/°
98
(I)
=
108,73
ккал/молъ.
основании
отобранных Сталлом
[1432]
данных по давлению пара
рссчитано значение
AHv
29S
=
15,68 ккал/молъ, которое приводит
величине Д#/°
98
(g)
=
—93,05
ккал/молъ. Парке, Келли
и
Хафф-
494
Часть
2.
Термические
и
термохимические
свойства
веществ
т,
°к
298
300
400
500
600
700
800
900
1000
па
г}{моль
°К)
Ср°
23,20
23,28
27,06
30,10
32,72
35,00
36,90
38,00
39,88
со
77,33
77
48
84,71
91,08
96,81
102,03
106,84
111,24
115,33
-lC
e
-HJ,,)/r
77,33
77,34
78,30
80,23
82,52
84,94
87,38
89,79
92,14
ккал/моль
Н
°-
Н
298
0,00
0,05
2
57
5,43
8,58
11,97
15,57
19,31
23,19
ДЯ/°
—93,05
—93,07
—93,83
—94,43
—94,90
—95,24
—95,48
-95,66
—95,76
AGf°
—72,77
—72,64
—65,71
—58,61
—51,40
—44,12
—36,81
—29,46
—22,09
53,337
52,917
35,901
25,617
18,721
13,775
10,054
7,153
4,827
ман
[1108]
измеряли теплоемкость
в
интервале температур
от 90 до
298°
К и
получили следующие результаты:
•5298
(0 39,9
калЦмолъ.°К)
ASv,
15
680/298
52,59
AS (сжатие),
— Д In
(760/0,098)
—17,80
AS (неидеальность газа) (пренебрежимо мало)
0,00
S°
igii
(идеальный
газ)
74,69
кал/(молъ-°К
Дяткина
[361]
произвела отнесение основных частот колебаний
рассчитала термодинамические функции
и
установила,
что iS^g (g)
—
=
77,33
кал/(моль-°К).
С
этим значением хорошо согласуются
величины
S°
2dS
(g)
=
77,30
кал/(моль-°Щ
и5*„
=
—0,59 кал/(моль
'°К)
рассчитанные
по
данным
для
соответствующего углеводорода.
Нео-
пределенности
в
определении теплоемкости
при
температурах
ниж(
90°
К и
экстрапояции давления паров
при
298°
К
говорят
в
польз\
принятия
значения, установленного Дяткиной.
Циплоалканолы.
Таблица для состояния
идеального газа
№
543.
Цпклогексанол. С
6
Н
12
О (состояние идеального газа).
Мол.
вес
100,156
Парке,
Мосли
и
Петерсон
[1116]
и
Селлерс
и
Суннер
[1331]
изме
ряли теплоту сгорания
и
получили данные, согласующиеся
в
пре-
делах ошибки эксперимента.
По
данным последней группы иссле-
дователей,
AHfl
9
,
(I)
—
—83,22
ккал/молъ, откуда
следует,
что
ДЯ/°
98
(g)
=
—70,40
ккал/моль. Келли
[735]
изучал низкотем
X.
Химическая
термодинамика
соединений
С, Н и О
495
Г,
°К
298
300
400
500
600
700
800
900
1000
палЦмоль
°К)
Ср°
30
41
30,59
41,14
50,90
59,29
66,33
72,18
77,06
81,13
S"
78,32
78,51
88,78
99,03
109
07
118,76
128
01
136,80
145,14
-(G°-H°
9s
)/r
78,32
78,33
79,65
82,51
86,10
90,08
94,25
98
49
102,74
ккал/лють
H
°~
H
298
0,00
0,06
3,65
8,27
13,79
20,08
27,01
34,48
42,40
—70,40
—70,45
-72,86
—74,71
-76,04
—76,89
-77,35
—77,48
-77,31
лс/°
-28
18
—27,92
—13,36
1,74
17,16
32,77
48,47
64,21
79,96
lg
Kp
20,654
20,338
7,297
—0,762
—6,251
—10,232
—
13,239
—
15,591
—
17,474
пературные свойства
и
установил,
что Tt =
263,5°
К,
AHt —
=
1,960
ккал/моль,
АНт
=
0,406
ккал/моль
и
Sl
iS
(Г)
—
—
47,7
кал/(моль-°К).
Тиммерманс
[1501]
дает
три
значения
для
точки шниления; принята величина
Тт =
296,6°
К.
На
основании
обзора данных
по
давлению пара Сталл
[1432]
пришел
к
выводу,
что
ТЪ
=
434°
К;
согласно Метюсу
и
Феландту [941],
AHv
i3i
—
=
10,875
ккал/молъ. Оценка среднего значения
АСр =
=
14,5
кал/(молъ
-°К)
в
температурном интервале
434
—
298°
К
дает
AHv
2
ss
=
12,820
ккал/молъ.
Эти
данные приводят
к
следующим
значениям:
5°
98
(/)
47,70
кал/'(моль-°К)
ASv,
12
820/298,15
43,00
AS (сжатие),
-Л
In
(760/1,5)
-12,38
5°
98
(g)
78,32
кал/(молъ-°К)
Теплоемкость газообразного циклогексанола рассчитана
как
сумма
теплоемкостей циклогексана
и
этилового спирта
за
вычетом тепло-
емкости этана.
Альдегиды. Таблицы для состояния идеального газа
№
544.
Формальдегид, СН
2
О (состояние идеального газа).
Мол.
вес
30,026
По
данным измерения теплоты сгорания Вартенберг
и
Лернер-
Штейнберг
[15731
вычислили
AHf
w
(g)
—
—27,7
ккал/молъ. Ньютон
и
Додж
11062]
измеряли параметры равновесия реакции
HCHO(g)
-r
H
2
(g)
-
CH
3
OH(g)
496
Часть
2.
Термические
и
термохимические
свойства
веществ
X. Химическая
термодинамика
соединений
С, Н и О
497
Т, °К
298
300
400
500
600
700
800
900
1000
кал/(моль-°К)
Ср°
8,46
8,47
9,38
10,46
11,52
12,49
13,37
14,16
14,81
В'
52,29
52,35
54,90
57,11
59,12
60,97
62,69
64,31
65,84
-(О°-Я°„
8
)/т
52,29
52,30
52,64
53,32
54,12
54,97
55,83
56,68
57,52
ккал/лммь
Н
°~
Н
298
0,00
0,02
0,91
1,90
3,00
4,20
5,50
6,88
8,33
ля/°
—27,70
—27,71
-28,11
—28,50
—28,86
—29,17
—29,44
—29,67
—29,86
AG/°
—26,27
—26,27
-25,72
-25,08
—24,36
—23,59
—22,77
-21,92
—21,05
19,258
19,133
14,053
10,961
8,873
7,363
6,220
5,323
4,599
и
установили,
что при
197° С
Кр =
2090,
откуда AG^/470
=
=
—15,19
кал/(моль-°К).
Мы
рассчитали величину A#r
2
g
8
=
=
470
(—15,19
—
26,59)
=
—19,637
кал,
используя следующие
функции
энергии Гиббса:
Соединение
НСНО
(g)
Н
2
(?)
СН
3
ОН
(g)
&(G
il0
-H
298
)/m
(G470—Я298)
470
кал/(моль
°К)
53,09
31,84
58,34
—26,59
Литература
Пиллаи
и
Клевеленд
[1149]
Россини
и
др. [1248]
Иваш,
Ли и
Питцер
[674]
Из
значения
АЩ°
2т
=
—48,080
ккал/молъ
для
СН
3
ОН
(g)
мы
рас-
считали
для
формальдегида
ДЯ/°,„
(g)
=
—28,44
ккал/молъ.
На
основании
анализа этих данных
мы
отобрали
для
НСНО
{g)
значение
AHf
2iS
(g)
=
—28,0
± 1,5
ккал/молъ. Россини, Вагман, Эванс,
Левин
и
Джаффе
[1249]
на
основании литературных данных
отобрали
Ттп
=
154,9°
К и
ТЪ
=
253,9° К,
при
этом
AHv
=
=
5,85
ккал/молъ. Пиллаи
и
Клевеленд
[1149]
рассмотрели спектро-
скопические
данные
для
некоторых плоских молекул
XYZ
2
и
рас-
смотрели пять молекул этого типа,
в
том
числе
НСНО
и
DCDO.
Они
использовали результаты Блау
и
Нил
сена
[143]
по
определению
частот
в
инфракрасной области спектра. Структурные параметры,
взятые
из
измерений Лоуренса
и
Страндберга
[852]
в
микроволно-
вой
области, согласуются
с
соответствующими результатами измере-
ний
Эрландсона [382]. Пиллаи
и
Клевеленд
11149]
рассчитали значе-
ния
термодинамических параметров газообразного состояния;
из их
значений
мы
отобрали
S°
2Sft
(g)
=
52,29
кал/(моль -°К).
Эта
величина
энтропии
всего лишь
на
0,03
кал/(молъ
-°К)
больше значения,
рас-
считанного несколько
лет
назад Томпсоном [1487].
№
545.
Ацетальдегид, С
2
Н
4
О (состояние идеального газа).
Мол.
вес
44,052
298
300
400
500
600
700
800
900
1000
кал/(моль
°К)
13,06
13,11
15,73
18,27
20,52
22,50
24,20
25,68
26,96
S-
63,15
63,24
67,37
71,16
74,69
78,01
81,12
84,06
86,84
-(
6
°-
Н
298^
Г
63,15
63,16
63,70
64,82
66,17
67,63
69,12
70,62
72,10
ккал/могь
Н
°-
Д
298
0,00
0,03
1,47
3,17
5,12
7,27
9,61
12,10
14,74
дн/°
—39,76
—39,78
-40,57
—41,27
—41,86
—42,35
—42,74
—43,05
-43,27
AGf°
-31,86
—31,81
—29,03
—26,07
—22,97
—19,78
-16,53
-13,24
—9,91
lg
Кр
23,353
23,174
15,862
11,393
8,366
6,176
4,516
3,214
2,165
Россини,
Вагман, Эванс, Левин
и
Джаффе
[1249]
на
основании
старых литературных данных
о
теплотах сгорания
и
последних работ
Шолливера, Грешама, Кистяковского, Смита
и
Вогана
[334] по
опре-
делению теплоты гидрирования
до
этилового спирта сообщили
сле-
дующие значения:
АЯ/°
98
(g)
=
—39,76
ккал/молъ,
Тт.
=
155° К,
Хтп
=
0,770
ккал/молъ
и
ТЪ
=
293,3° К.
По
данным измерений
РКолемана
и
Де
Вриса [245], Д#у
2
9
3
,з
— 6,145
ккал/молъ. Отнесения
растот колебаний, первоначально использованные Смитом [1381],
|были пересмотрены Питцером
и
Уелтнером
[1167]
для
получения
^лучшего согласия
с
данными Райдила
[1227]
по
изучению равно-
весного гидрирования,
а
также
с
результатами измерения
теп-
шоемкостей
в
газообразном состоянии, полученными Колеманом
|а
Де
Врисом [245]. Питцер
и
Уелтнер
[1167]
получили данные, лучше
ь
всего согласующиеся
со
значением потенциального барьера
вну-
'треннего вращения
1,00
ккал/молъ;
они
рассчитали термодинамиче-
ские
функции
и
установили,
что
5°
98
(g)
=63,15 кал/(моль
•°}Ц).
Более поздние работы Лина
и
Килба
[874]
в
микроволновой области
рпоказали,
что
потенциальный барьер внутреннего вращения равен
{ 1Д4
+
0,06
ккал/молъ;
в то же
время
из
инфракрасных спектров
* Фейтли
и
Миллер
[407]
определили потенциальный барьер, равный
1,18
+
0,15
ккал/молъ. Эванс
и
Бернстейн
[394]
изучали спектры
более тщательно
и
внесли исправления
в
отнесение частот колеба-
ний,
но это не
привело
к
значительным изменениям
в
величинах
термодинамических функций.
32-831
498
Часть
2.
Термические
и
термохимические
свойства
веществ
№
546.
Пропноновый
альдегид,
C-jH
6
O (состояние идеального газа).
Мол.
вес
58,078
г,
°к
298
300
400
500
600
700
800
900
1000
ка
г/(мо ъь
•
°К)
Ср°
18,80
18,87
23,09
26,89
30,22
33,03
35,45
37,55
39,27
s°
72,83
72,95
78,97
84,54
89,74
94,62
99,19
103,49
107,54
-(G°-H
2
%
e
)/r
72,83
72,84
73,63
75,26
77,24
79,38
81,57
83,77
85,95
кпал/моib
Н
°~
Н
298
0,00
0,04
2,14
4,64
7,50
10,67
14,10
17,75
21,59
—
45,90
—
45,92
—47,00
—
47,91
-48,66
—49,26
-49,73
—50,08
—50,32
AGT"
—31,18
-31,09
—25,97
—20,60
—15,07
—9,42
-3,70
2,08
7,89
Ig
Kp
22,851
22,644
14,188
9,005
5,489
2,941
1,011
—0,505
—
1,725
По
данным измерения теплоты сгорания Тьеббес
[1508]
вычислил
AHf
2s8
(I)
=
—52,95
ккал/моль
и
АЯ/°
98
(g) =
—45,9
ккал/молъ.
На
основании данных
о
строении молекулы
и
спектроскопиче-
ской
информации Чермин
[221]
определил значение
S°
98
(g) =
=
72,83
калI(моль -°К), которое
и
принято здесь наряду
с
данными
о
теплоемкости
в
газообразном состоянии. Мёллер
[1019]
также
изучал спектр
и
рассчитал значение теплоемкости, которое оказалось
на
несколько процентов ниже значения, определенного Чермином.
Согласно измерениям Тьеббеса [1508],
Тт = 170° К и ТЪ = 321° К.
№
547.
Масляный альдегид, С
4
Н
8
О (состояние идеального газа).
Мол.
вес
72,104
г,
°к
298
300
400
500
600
700
800
900
1000
ка
г
j
{моль<
°К)
Ср°
21,52
24,61
30,20
35,20
39,60
43,40
46,60
49,30
51,70
S-.
|
-(G°-H°
98
)/r
82,44
82,60
90,46
97,74
104,56
110,96
116.97
122,61
127,94
82,44
82,45
83,48
85,61
88,21
91,01
93,88
96,76
99,62
икал/моль
0,00
0,05
2,80
6,07
9,82
13,97
18,48
23,27
28,33
АН/"
—49,00
—49,03
-50,40
—51,56
—52,51
—53,24
—53,80
-54,20
—54,45
AGf
—27,43
—27,30
—
19,84
—
12,06
—4,07
4,07
12,29
20,58
28,91
ig
Kp
20,105
19,885
10,837
5,269
1,481
—1,271
—3,358
—4,998
—6,319
По
данным измерения теплоты сгорания Нихолсон
[1065]
опре-
делил значение, хорошо согласующееся
с
результатами измерений
Тьеббеса [1508], согласно которым
AIIf
2as
(I)
=
—57,06
ккал/моль
X.
Химическая
термодинамика
соединений
С, Н и О
499
и
ДЯ/°
И
(g) =
—49,0
ккал/молъ. Парке, Кеннеди, Гейтс, Мосли,
Мур
и
Ренквист
[1109]
измеряли теплоемкости
в
температурном
интервале
от 80 до
300°
К и
получили следующие результаты:
Тт =
=
176,8°
К, АНт =
2,654 ккал/молъ
и
£°
98
(I) =- 59,0
кал/(моль-°К).
На
основании этих данных Чермин
[221]
получил значение
S\
m
(g) =
=
82,44
кал/(молъ
-
О
К)
и
рассчитал остальные термодинамические
функции
для
состояния идеального газа. Россини, Питцер, Арнетт,
Браун
и
Пиментел
[1248]
отобрали
ТЪ =
348,02°
К.
№
548.
Валериановый альдегид, С.,Н
10
О (состояние идеального газа).
Мол.
вес
86,130
298
300
400
500
600
700
800
900
1000
кал/(молЬ'°~К)
Ср"
29,96
30,08
37,10
43,40
49,00
53,70
57,70
61,10
64,00
S»
91,53
91,72
101,35
110,32
118,74
126,66
134,10
141,09
147,69
91,53
91,54
92,80
95,42
98,61
102,06
105,60
109,16
112,69
ккал/моль
Н
~'
Н
298
0,00
0,06
3,43
7,46
12,08
17,22
22,80
28,74
35,00
АЯ/°
—54,45
—54,49
-56,18
—57,60
—58,74
—59,61
—60,27
—60,72
—60,99
AGf
—25,88
-25,70
—15,84
—5,59
4,92
15,61
26,40
37,26
48,18
ig Kp
18,968
18,724
8,654
2,441
—1,793
—4,874
—7,211
-9,048
-10,528
X
Q
.О,
2S8
\ё)
=
С
использованием инкрементов, приведенных
в
табл.
получены значения
AHf
MS
(g) =
—54,45 ккал/молъ
и S^ _,
=
91,53
кал/(моль-°К).
Теплоемкость
для
состояния идеального
газа определена Чермином [221]. Россини, Питцер, Арнетт, Браун
и
Пиментел
[1248]
отобрали
Тт = 182° К и ТЪ =
375,7°
К.
№
549.
Гексановый
альдегид
(гексаналь), С
6
Н
12
О
(состояние идеального газа).
Мол. вес
100,156
298
300
400
500
600
700
800
900
1000
кал!
(моль
•
°К)
Ср°
35,43
35,57
44,00
51,70
58,30
63,90
68,70
72,90
76,40
101,07
101,29
112,70
123,37
133,39
142,81
151,66
160,00
167,87
-(G°-HJ
M
)/T
101,07
101,08
102,57
105,68
109,47
113,57
117,78
122,01
126,21
ккаг/моль
Н
°-
Я
2
98
0,00
0,07
4,06
8,85
14,36
20,47
27,11
34,20
41,67
АН/°
—59,37
—59,41
—
61,43
—63,10
—64,44
—65,46
—
66,22
—66,73
—67,01
AGf
-23,93
—23,71
—11,49
1,19
14,17
27,36
40,67
54,07
67,52
Ig
Kp
17,541
17,275
6,280
-0,520
-5,162
—8,543
—11,110
-13,129
—14,756
32*
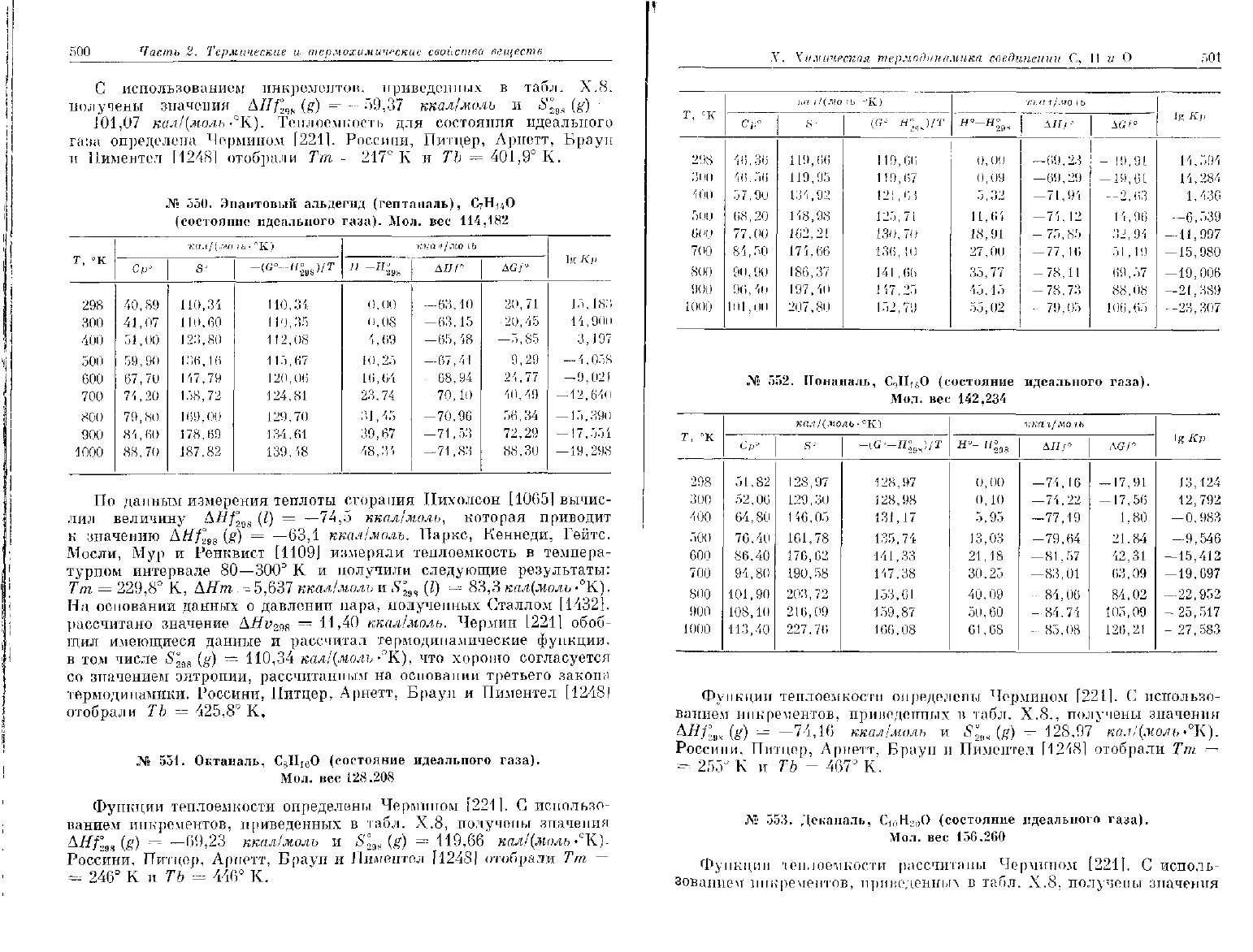
500
Часть
2.
Термические
и
термохимические свойства веществ
С
использованием инкрементов, приведенных
в табл. Х.8.
получены значения
AIIf°
MH
(g) —
—59,37
ккал/молъ
и £°
98
(g) -
-
101,07
кил/(моль-°К).
Теплоемкость для состояния идеального
газа определена Чермином [221]. Россини, Питцер,
Ариетт,
Браун
и
Ииментел
[12481
отобрали Тт =- 217° К и ТЪ =
401,9°
К.
№
550.
Энантовый
альдегид
(гептаиаль),
С
7
Н
14
О
(состояние
идеального
газа).
Мол. вес
114,182
т, °к
298
300
400
500
600
700
800
900
1000
Ср°
40,89
4],
07
51,00
59,90
67,70
74,20
79,80
81,
60
88,70
кал/
(мо
fi-
ll 0,34
110,60
123,80
136,16
147,79
158,72
169,00
178,69
187,82
1Ь-°К)
110,34
110,35
112,08
115,67
120,06
124,81
129,70
134,61
139,18
кпап/мо !Ь
11
~
П
ш
0,00
0,08
4,69
10,25
16,64
23,74
31,45
39,67
48,31
ДЯ/°
— 63,10
-63,15
—65,48
— 67,41
— 68,94
—70,10
—70,96
—71,53
—71,83
AG/°
— 20,71
— 20,45
—5,85
9,29
24,77
40,49
56,34
72,29
88,30
is Ki>
15,18:
li,90(
3,197
—
4,058
—9,021
—12,64(
— 15,390
— 17,554
— 19,298
По
данным измерения теплоты сгорания Нихолсон
[1065]
вычис-
лил величину
Ai//°
98
(I) =
—74,5
ккал/молъ,
которая приводит
к
значению
АйГ/°
98
(g) = —63,1
ккал/молъ.
Парке, Кеннеди, Гейтс.
Мосли, Мур и Ренквист
[1109]
измеряли теплоемкость в темпера-
турном интервале
80—300°
К и получили следующие результаты:
Тт =
229,8°
К, АНт
_=
5,637
ккал/молъ
и
S°
294
(I) = 83,3
кал(молъ
-°К).
На
основании данных о давлении пара, полученных Сталлом [1432],
рассчитано значение
AHv
29
g
= 11,40
ккал/молъ.
Чермин [221] обоб-
щил имеющиеся данные и рассчитал термодинамические функции.
в том числе
5°
98
(g) =
110,34
кал/(моль
-°К), что хорошо согласуется
со значением энтропии, рассчитанным на основании
третьего
закона
термодинамики. Россини, Питцер,
Арнетт,
Брауп и Пиментел
[12481
отобрали ТЪ =
425,8°
К,
№
551.
Октаналь,
С
8
Н
16
О
(состояние
идеального
газа).
Мол.
вес
128.208
Функции теплоемкости определены Чермином [2211. С использо-
ванием инкрементов, приведенных в табл. Х.8, получены значения
AHf°
Mg
(g) = —69,23 ккал/молъ и S°
2i)H
(g) = 119,66 кал/(моль -°К).
Россини,
Питцер,
Арнетт,
Брауп и Пимептел
[1248]
отобрали Тт —
=
246°
К и ТЪ =
446°
К.
X.
Vимическая термодинамика
соединении
С, [1 и О
№
552.
Понаналь,
С,И
18
О
(состояние
идеального
газа).
Мол.
вес
142,234
501
г,
с
к
298
300
400
500
00(J
700
800
900
1000
Ср°
16,36
к;,
50
57,90
08,20
77,00
84,50
90,90
90,40
101,00
ка
1
/(мо
S'
119,66
119,95
134,92
118,98
162,21
171,66
186,37
197,10
207,80
ib
J
K)
-(G>-*l,J/T
119,66
119,07
121,'И
125,71
130,70
136,10
141,66
117,25
152,79
т.ьаг/могь
Н
°-
Н
2
9
,
0,00
0,09
5,32
11,01
18,91
27,00
35,77
45,15
55,02
Ml,'
—69,23
—09,29
— 71,91
— 71,12
-75,85
— 77,10
-78,11
-78,73
— 79,05
\Gf°
-
19,91
— 19,01
— 2,63
14,96
32,91
51,
19
09,57
88,08
100,65
Jg Кр
14,594
14,284
1.43С
—6,539
—11,997
— 15,980
—
19,006
—21,389
—23,307
т, °к
298
300
400
500
000
700
800
900
1000
кал
/(моль
•
°К)
cv j s-
51,82
52,00
04,80
70,40
86,40
94,80
101,90
108,10
113,40
128,97
129,30
146,05
161,78
176,02
190,58
203,72
210,09
227.70
128,97
128,98
131,17
135,74
141,33
147,38
153,61
159,87
166,08
пкаг/могь
Н
°-
Я
2
98
0,00
0,10
5,95
13,03
21,18
30,25
40,09
50,60
61,68
ДЯ/°
— 74,16
-71,22
-77,19
— 79,64
— 81,57
—83,01
—84,06
— 84,74
—85,08
AG/°
— 17,91
— 17,56
1,80
21,84
42,31
03,09
84,02
105,09
120,21
Ig Кр
13,124
12,792
—0,983
—9,546
—15,412
—19,697
22
952
—25,517
—27,583
Функции теплоемкости определены Чермином [221]. С использо-
ванием инкрементов, приведенных в табл. Х.8., получены значения
&Щ
Я
Л8)
= —
74
>
16
ккал/молъ и S°
2sq
(g) - 128.97 калI(молъ °К).
Россини.
Питцер,
Ариетт,
Браун и Пиментел
[1248]
отобрали Тт =
=
255°
КиГ6 =
467°
К.
№
553.
Деканаль,
Ci
0
H
20
O
(состояние
идеального
газа).
Мол.
вес
156.260
Функции теплоемкости рассчитаны Черлштнш [221]. С исполь-
зованием инкрементов, приведенных в табл. Х.8, получены значения
