Сталл Д. Вестрам Э. Зинке Г. Химическая термодинамика органических соединений
Подождите немного. Документ загружается.

442
Часть
2. Термические и термохимические свойства веществ
на
по
энтальпии нафталина. Остальные термодинамические функции
приняты
согласно корреляции Миллигана, Беккера
и
Питцера [10091.
По
данным Россини, Питцера,
Арнетга,
Брауна
и
Пиментела
[1248]
Тт
= 259,27° К и ТЪ = 531,82° К.
№
450.
2-Этшшафталин, Ci
2
Hi
2
(состояние идеального газа).
Мол. вес
156,21(>
г, °к
298
300
400
500
600
700
800
900
1000
гаг/(моль
°К)
с
Р
°
44,08
44,35
58,01
69,68
79,17
86,99
93,46
98,86
103,44
s°
100,56
100,84
115,52
129,75
143,32
156,13
168,18
179,51
190,17
-(G°-H°
98
)/r
100,56
100,57
102,47
106,52
111,53
117,00
122,65
128,34
134,00
ккал/мо
ib
н
°-
н
;
98
0,00
0,09
5,22
11,62
19,08
27,40
36,43
46,05
56,18
дя/°
22,92
22,88
20,88
19,28
18,00
17,03
16,30
15,81
15,56
д«°
53,64
53,83
64,47
75,56
86,92
98,51
110,18
121,95
133,77
lg Kp
-39,318
-39,211
-35,221
-33,021
-31,66(
-30,754
-30,099
-29,61:!
-29,23"
Энтальпия образования оценена
тем же
путем,
как в
случае
1-этилнафталина. Коррелированные значения термодинамически\
функций
приняты согласно работе Миллигана, Беккера
и
Питцера
[1009].
По
данным Россини, Питцера,
Арнетта,
Брауна
и
Пиментела
[1248],
Тт =
265,7°К
и
ГЬ=-531,0°К.
№
451.
1,2-Диметилнафталин, C
12
Hi
2
(состояние идеального газа).
Мол.
вес
156,216
т,
°к
298
300
400
500
600
700
800
900
1000
палЦмоль
°К)
Ср°
44,18
44,46
58,28
70,06
79,64
87,51
93,96
99,25
103,83
s°
97,23
97,51
112,24
126,55
140,20
153,08
165,20
176,58
187,28
97,23
97,24
99,15
103,21
108,25
113,74
119,42
125,15
130,83
ккал/моль
Н
°~
Н
298
0,00
0,09
5,24
11,68
19,18
27,54
36,63
46,29
56,45
ДЯ/°
19,97
19,93
17,95
16,38
15,14
14,22
13,55
13,10
12,89
AG/°
51,68
51,88
62,85
74,26
85,94
97,83
109,81
121,88
133,99
-37,8&3
-37,790
-34,336
-32,457
-31,303
-30,541
-29,9%
-29,59э
-29,283
Энтальпия образования оценена
по
методу
корреляции
на
осно-
вании
аналогии
между
алкильными группами, присоединенными
IX. Химическая термодинамика
углеводородов
443
нафталину,
и
идентичными группами, присоединенными
к
бензолу.
Методами корреляции Миллиган, Беккер
и
Питцер
[1009]
рассчита-
:и
значения термодинамических функций
для
газообразного состоя-
[ия.
Россини, Питцер,
Арнетт,
Браун
и
Пиментел
[1248]
отобрали
точки плавления
и
кипения:
Тт = 272,1° К и ТЪ = 541° К.
№
452.
1,3-Диметилнафталин, С
12
Н
12
(состояние идеального газа).
Мол.
вес
156,216
Г,
°К
298
300
400
500
«00
700
Ш
900
1000
кал/(моль -"К)
Ср°
-(G°-H
a
°
eg
)/T
44,24
44,51
58,04
69,68
79,16
87,03
93,51
98,87
103,48
97,86
98,14
112,84
127,08
140,65
153,46
165,52
176,85
187,51
97,86
97,87
99,78
103,83
108,84
114,31
119,97
125,66
131,32
кка1/моль
Я°-Я°
дя/°
0,00
0,09
5,23
11,63
19 09
27,41
36,45
46,07
56,20
19,55
19,51
17,52
15,92
14,63
13,67
12,95
12,46
12,21
51,08
51,27
62,18
73,53
85,17
97,02
108,96
121,00
133,08
lg
-37,438
-37,347
-34,969
-32,139
-31,020
-30,288
-29,765
-29,381
-29,084
Энтальпия образования оценена
по
методу
корреляции
на
осно-
ании
аналогии
между
алкильными группами, присоединенными
1
нафталину,
и
идентичными группами, присоединенными
к
бензолу,
•етодами корреляции Миллиган, Беккер
и
Питцер
[1009]
рассчитали
качения
термодинамических функций
для
газообразного состояния.
Оссини,
Питцер,
Арнетт,
Браун
и
Пиментел
[1248]
отобрали точки
Павления
и
кипения:
Тт = 269,1° К и ТЬ =
538°
К.
№
453.
1,4-Диметилнафталин, С
12
Н
12
(состояние идеального газа).
Мол.
вес
156,216
1
•
Ж
298
Ж
300
Ж
400
V
500
1
600
»700
1-800
Ж
90
°
ipooo
ш—
кагЦмоль
°К)
Ср°
44,18
44,46
58,28
70,06
79,64
87,51
93,96
99,25
103,83
s°
95,86
96,14
110,87
125,18
138,83
151,71
163,83
175,21
185,91
-(G°-H°
ws
)/T
95,86
95,87
97,78
101,84
106,88
112,37
118,05
123,78
129,46
ккал/моль
Я
°-
Я
298
0,00
0,09
5,24
11,68
19,18
27,54
36,63
46,29
56,45
дя/°
19,72
19,68
17,70
16,13
14,89
13,97
13,30
12,85
12,64
ДО/
0
51,84
52,04
63,14
74,69
86,52
98,54
110,66
122,86
135,11
lg Кр
-37,999
-37,907
-34,499
-32,647
-31,512
-30,765
-30,229
-29,834
-29,527
444
Часть
2. Термические и
термохимические
свойства
веществ
Энтальпия образования оценена
по методу
корреляции
на
осно-
вании
аналогии
между
алкильными группами, присоединенными
к
нафталину,
и
идентичными группами, присоединенными
к бен-
золу.
Методами корреляции Миллиган, Беккер
и
Питцер
[1009]
рассчитали значения термодинамических функций
для
газообраа-
ного состояния. Россини, Питцер,
Арнетт,
Браун
и
Пиментел
[1248]
отобрали точки плавления
и
кипения:
Тт =
280,81°
К и ТЪ
=
541,6°
К.
№
454.
1,5-Диметилнафталин, Ci
2
H
12
(состояние идеального газа).
Мол.
вес
156,216
IX. Химическая
термодинамика
углеводородов
445
Г, °К
298
300
400
500
600
700
800
900
1000
кал/
(моль
'"К)
Ср°
44,18
44,46
58,28
70,06
79,64
87,51
93,96
99,25
103,83
S
0
95,86
96,14
110,87
125,18
138,83
151,71
163,83
175,21
185,91
95,86
95,87
97,78
101,84
106,88
112,37
118,05
123,78
129,46
ккал/моль
0,00
0,09
5,24
11,68
19,18
27,54
36,63
46,29
56,45
дя/°
19,55
19,51
17,53
15,96
14,72
13,80
13,13
12,68
12,47
AGf°
51,67
51,87
62,97
74,52
86,35
98,37
110,49
122,69
134,94
-37,875
-37,784
-34,406
-32,573
-31,450
-30,712
-30,183
-29,792
-29,490
Энтальпия образования оценена
по методу
корреляции
на
осно-
вании
аналогии
между
алкильными группами, присоединенными
к
нафталину,
и
идентичными группами, присоединенными
к бен-
золу.
Методами корреляции Миллиган, Беккер
и
Питцер
[1009]
рассчитали значения термодинамических функций
для
газообраз-
ного состояния. Россини, Питцер,
Арнетт,
Браун
и
Пиментел
[1248]
отобрали точки плавления
и
кипения:
Тт =
355,1°
К и ТЪ =
538°
К.
№
455.
1,6-Диметилнафталин, С12Н12 (состояние идеального газа).
Мол.
вес
156,216
т, °к
298
300
400
500
600
700
800
900
1000
кал/(моль
°К)
44,24
44,51
58,04
69,68
79,16
87,03
93,51
98,87
103,48
s°
97,86
98,14
112,84
127,08
140,65
153,46
165,52
176,85
187,51
-(G°-ff°
98
)/T
97,86
97,87
99,78
103,83
108,84
114,31
119,97
125,66
131,32
ккал/моль
Н
°~
Н
298
0,00
0,09
5,23
11,63
19,09
27,41
36,45
46,07
56,20
AHf
19,72
19,68
17,69
16,09
14,80
13,84
13,12
12,63
12.38
AGf
0
51,25
51,44
62,35
73,70
85,34
97,19
109,13
121,17
133,25
lg Кр
-37,562
-37,470
-34,062
-32,213
-31,062
-30,341
-29,811
-29,422
-29,121
Энтальпия образования оценена
по методу
корреляции
на
основа-
аии
аналогии
между
алкильными группами, присоединенными
к наф-
талину,
и
идентичными группами, присоединенными
к
бензолу.
[Методами корреляции Миллиган, Беккер
и
Питцер
[1009]
рассчита-
1И значения термодинамических функций
для
газообразного состоя-
ния.
Россини, Питцер,
Арнетт,
Браун
и
Пиментел
[1248]
отобрали
точки плавления
и
кипения:
Тт =
257°
К и ТЪ =
536°
К.
№
456.
1,7-Диметилнафталин, Cj
2
Hi
2
(состояние идеального газа).
Мол.
вес
156,216
иг
I
K
I
298
К
30
°
Ж
400
•
500
Ш
600
•
700
Ш
8и0
Я'900
Щюоо
кал/(моль
°К)
44,24
44,51
58,04
69,68
79,16
87,03
93,51
98,87
103,48
s°
97,86
98,14
112,84
127,08
140,65
153,46
165,52
176,85
187,51
-<
е
°-
Я
298>/
Г
97,86
97,87
99,78
103,83
108,84
114,31
119.97
125,66
131,32
ккал/моль
Н
°-
Н
298
0,00
0,09
5,23
11,63
19,09
27,41
36,45
46,07
56,20
AHf
19,55
19,51
17,52
15,92
14,63
13,67
12,95
12,46
12,21
AGf°
51,08
51,27
62,18
73,53
85,17
97,02
108,96
121,00
133,08
lg Кр
-37,438
-37,347
-33,969
-32,139
-31,020
-30,288
-29,765
-29,381
-29,084
Энтальпия образования оценена
по методу
корреляции
на
осно-
шии
аналогии
между
алкильными группами, присоединенными
нафталину,
и
идентичными группами, присоединенными
к бен-
олу. Методами корреляции Миллиган, Беккер
и
Питцер
[1009] рас-
?итали значения термодинамических функций
для
газообразного
эстояния.
Россини, Питцер,
Арнетт,
Браун
и
Пиментел
[1248]
гобрали точки плавления
и
кипения:
Тт =
259,3°
К и ТЪ =
536°
К.
JM»
457.
2,3-Диметилнафталин,
CJ
2
HJ
2
(состояние идеального газа).
Мол.
вес
156,216
1
I'
I
s
и
298
300
400
500
600
700
800
900
1000
М.—
Ср°
44,41
44,65
57,49
68,75
78,18
86,02
92,58
98,10
102,78
кал/(моль
S°
98,22
98,50
113,14
127,21
140,61
153,26
165,19
176,42
187,01
•°К)
-(С°-н°
98
)/г
98,22
98,23
100,14
104,15
109,12
114,53
120,13
125,76
131,36
и —
0
0
5
И
18
27
36
45
55
298
,00
,09
,21
,53
,89
,12
,05
,59
,65
ккал/моль
AHf
19,97
19,93
17,92
16,24
14,86
13,79
12,97
12,40
12,08
AGf
51,39
51,58
62,45
73,79
85,42
97,28
109,25
121,33
133,46
lg Кр
-37,667
-37,574
-
34.121
-32,250
-31,112
-30,371
-29,844
-29,460
-29,166
446
Часть
2.
Термические
и
термохимические свойства веществ
IX. Химическая термодинамика
углеводородов
447
Энтальпия образования оценена
по
методу
корреляции
на
основа-
нии аналогии
между
алкильными группами, присоединенными
к
наф-
талину,
и
идентичными группами, присоединенными
к
бензолу.
Методами корреляции Миллиган, Беккер
и
Питцер
[1009]
рассчитали
значения термодинамических функций
для
газообразного состоя-
ния.
Россини, Питцер,
Арнетт,
Браун
и
Пиментел
[1248]
отобрали
точки плавления
и
кипения:
Тт =
378,1°
К и
ТЪ
=
542°
К.
№
458.
2,6-Диметилнафталин, С
12
Н
12
(состояние идеального газа).
Мол.
вес
156,216
Г,
"К
298
300
400
500
600
700
800
900
1000
кал/(моль
°К)
Ср°
44,71
44,91
58,07
69,45
78,77
86,49
93,09
98,51
103,14
СО
97,68
97,96
112,73
126,95
140,46
153,19
165,19
176,47
187,10
-(
е
°-
Я
2
9
8>/
т
97,68
97,69
99,61
103,67
108,68
114,14
119,78
125,46
131,10
ккал/моль
я°-я°
98
0,00
0,09
5,25
11,64
19,07
27,34
36,33
45,92
56,01
дя/°
19,72
19,68
17,71
16,10
14,78
13,77
13,00
12,47
12,19
де/°
51,30
51,49
62,41
73,78
85,43
97,31
109,28
121,35
133,48
lg
Кр
-37,602
-37,510
-34,099
-32,248
-31,117
-30,379
-29,852
-29,467
-29,170
Энтальпия образования оценена
по
методу
корреляции
на
основа-
нии аналогии
между
алкильными группами, присоединенными
к
наф-
талину,
и
идентичными группами, присоединенными
к
бензолу.
Мето-
дами корреляции Миллиган, Беккер
и
Питцер
[1009]
рассчитали зна-
чения термодинамических функций
для
газообразного состояния.
Россини, Питцер,
Арнетт,
Браун
и
Пиментел
[1248]
отобрали точки
плавления
и
кипения:
Тт =
385,1°
К и
ТЪ
=
535°
К.
•
Т, °К
298
300
400
500
600
700
800
900
1000
V:
459.
.
2,7-Диметилнафталин,
С
1;
Н
12
(состояние
идеального
газа).
Мол.
вес
156,216
кал
/(моль
°К)
Ср°
44,71
44,97
58,07
69,45
78,77
86,49
93,09
98,51
103,14
ч°
97,68
97,96
112,73
126,95
140,46
153,20
165,19
176,48
187,10
-
(
о°-я
2
°
98
)/г
97,68
97,69
99,61
103,67
108,69
114,14
119,78
125,46
131,10
ккал/моль
Н
°-
Н
298
0,00
0,09
5,25
11,65
19,07
27,34
36,33
45,92
56,01
ля/»
19,72
19,68
17,72
16,10
14,79
13,77
13,00
12,47
12,20
AGf°
51,30
51,49
62,41
73,78
85,43
97,30
109,28
121,35
133,47
lg
Кр
-37,602
-37,510
-34,099
-32,217
-31,116
-30,378
-29,851
-29,466
-29,169
Энтальпия образования оценена
по
методу
корреляции
на
осно-
вании аналогии
между
алкильными группами, присоединенными
нафталину,
и
идентичными группами, присоединенными
к
бензолу.
1етодами
корреляции Миллиган, Беккер
и
Питцер
[1009]
рассчитали
значения термодинамических функций
для
газообразного состоя-
гая.
Россини, Питцер,
Арнетт,
Браун
и
Пиментел
[1248]
отобрали
|точки плавления
и
кипения:
Тт —
371,1°
К и
ТЪ
=
535°
К.
№
460.
1-Пропилнафталин,
Ci
3
H
14
(состояние
идеального
газа).
Мол.
вес
170,242
Г,
°К
298
f
300
400
»
500
600
:,
700
\
800
I
900
Нооо
1
кал/(моль
°К)
Ср°
49,74
50,04
65,30
78,40
89,10
97,80
105,10
111,10
116,20
s°
109,55
109,86
126,40
142,42
157,69
172,10
185,65
195,38
210,36
-<е°-я°
98
)/г
109,55
109,56
111,71
116,26
121,90
128,06
134,42
140,82
177,19
ккал/моль
Н
°-
Н
298
0,00
0,10
5,88
13,09
21,48
30,84
40,99
51,81
63,18
дя/°
17,85
17,80
15,52
13,69
12,27
11,21
10,45
9,95
9,73
AGr°
55,60
55,83
68,88
82,44
96,31
110,42
124,63
138,94
153,30
lg Кр
-40,755
-40,671
-37,631
-36,032
-35,080
-34,474
-34,046
-33,738
-33,503
Энтальпия образования оценена
по
методу
корреляции
на
осно-
вании аналогии
между
алкильными группами, присоединенными
нафталину,
и
идентичными группами, присоединенными
к
бензолу.
Гетодами
корреляции Миллиган, Беккер
и
Питцер
[1009]
рассчитали
1ачения термодинамических функций
для
газообразного состояния.
?оссини, Питцер,
Арнетт,
Браун
и
Пиментел отобрали точки плав-
иения
и
кипения:
Тт =
264,68°
К и
ТЪ
=
545,93°
К.
№ 461. 2-Пропилнафталин, С^Н^ (состояние идеального газа).
Мол.
вес
170,242
1
ШюТ,
°К
%
Щ
Ж
298
Ш
3
°о
Ж
400
1
500
I
600
f
700
**'*
800
-'
900
#>
1000
#—
кал/(моль
°К)
Ср°
49,80
50,04
65,10
78,00
88,60
97,40
104,60
110,70
115,80
s°
110,18
110,49
127,00
142,96
158,14
172,48
185,97
198,65
210,59
-(G°-fi°
98
)/r
110,18
110,19
112,34
116,88
122,50
128,63
134,96
141,34
147,67
ккал/моль
Н
°~
Н
298
0,00
0,10
5,87
13,05
21,39
30,70
40,81
51,59
62,92
дя/°
17,65
17,60
15,31
13,45
11,98
10,88
10,07
9,53
9,27
AGf
55,21
55,44
68,43
81,93
95,75
109,82
124,00
138,28
152,61
lg Кр
-40,471
-40,388
-37,385
-35,809
-34,877
-34,287
-33,873
-33,577
-33,352
148
Часть
2.
Термические
и
термохимические
свойства
веществ
Энтальпия образования оценена
по
методу
корреляции
на
осно-
вании
аналогии
между
алкильными группами, присоединенными
к
нафталину,
и
идентичными группами, присоединенными
к
бензолу.
Методами корреляции Миллиган, Беккер
и
Питцер
[1009]
рассчитали
значения
термодинамических функций
для
газообразного состояния.
Россини,
Питцер,
Арнетт,
Браун
и
Пиментел
[1248]
отобрали точки
плавления
и
кипения:
Тт =
270°
К и
ТЪ
=
546,6°
К.
№
462. 2-Этил-З-метилнафталин,
С
13
Н
14
(состояние
идеального
газа).
Мол.
вес
170,242
IX.
Химическая термодинамика
углеводородов
449
г,
°к
298
300
400
500
600
700
800
900
1000
калЦмоль-
°К)
Ср°
50,30
50,57
65,00
77,50
88,00
96,80
104,00
110,10
115,30
s°
109,33
109,65
126,22
142,10
157,19
171,43
184,84
197,45
209,33
-(G°-H°
98
)/r
109,33
109,34
111,50
116,04
121,65
127,76
134,06
140,41
146,72
ппал/моль
Я
°~
Н
298
0,00
0,10
5,89
13,03
21,32
30,58
40,63
51,34
62,62
лн/°
15,72
15,67
13,40
11,51
9,99
8,83
7,95
7,35
7,04
AGf°
53,54
53,77
66,83
80,42
94,33
108,50
122,79
137,18
151,64
Ig
Кр
-39,242
-39,168
-36,514
-35.14S
-34,359
-33,874
-33,542
-33,311
-33,140
Энтальпия образования оценена
по
методу
корреляции
на
осно-
вании
аналогии
между
алкильными группами, присоединенными
к
нафталину,
и
идентичными группами, присоединенными
к
бензолу.
Методами корреляции рассчитаны термодинамические функции
для
газообразного состояния (Миллиган, Беккер
и
Питцер [1009]).
Рос-
сини,
Питцер,
Арнетт,
Браун
и
Пиментел
[1248]
отобрали точку
кипения
ТЪ
=
550°
К
[1248].
№
463. 2-Этил-6-метилнафталин,
С13Н14
(состояние
идеального газа).
Мол.
вес
170,242
г,
°к
298
300
400
500
600
700
800
900
1000
кад/(люль-°К)
Ср°
50,60
50,90
65,60
78,20
88,70
97,30
101.40
110,60
115,70
s° |
-<е--я;
м
)/г
108,79
109,11
125,82
141,85
157.06
171,44
184,64
197,16
209,11
108,79
108,80
110,97
115,56
121,22
127,38
133,72
140,08
146,39
ккал/моль
Н
°-
Н
»8
0,00
0,10
5,94
13,15
21,51
30,85
40,74
51,37
62,72
лн/°
14,65
14,60
12,37
10,55
9,10
8,03
7,00
6,32
6,08
AGf°
52,63
52,86
65,97
79,59
93,52
107,70
121,99
136,42
150,90
lg
Кр
-38.576
-38,506
-36,043
-34,786
-34,064
-33,623
-33,324
-33,124
-32,977
Энтальпия образования оценена
по
методу
корреляции
на
осно-
вании
аналогии
между
алкильпыми группами, присоединенными
нафталину,
и
идентичными группами, присоединенными
к
бензолу.
1етодами корреляции Миллиган, Беккер
и
Питцер
[1009]
рас-
считали значения термодинамических функций
для
газообразного
состояния.
Россини, Питцер,
Арнетт,
Браун
и
Пиментел
[1248]
отобрали точки плавления
и
кипения:
Тпг = 318° К и
ТЪ
=
543°
К.
ЛГ°
464.
2-Этил-7-метилнафталин, С
13
Н
14
(состояние идеального газа).
Мол.
вес
170,242
1,.,
IE
|Е
•
1000
Ср°
50,60
50,90
65,60
78,20
88,70
97,30
101,40
110,60
115,70
кал/(мо
ч°
108,79
109,11
125,82
141,85
157,06
171,44
184,64
197,16
209,11
1Ь-°К)
-(G°-II°
SS
)/T
108,79
108,80
110,97
115,56
121,22
127,38
133,72
140,08
146,39
%кал/моль
Я
°-
Я
298
0,00
0,10
5,94
13,15
21,51
30,85
40,74
51,37
62,72
ля/°
14,65
14,60
12,37
10,55
9,10
8,03
7,00
6,32
6,08
AGf°
52,63
52,86
65,97
79,59
93,52
107,70
121,99
136,42
150,90
]g
Кр
-38,576
-38,506
-36,043
-34,786
-34,064
-33,623
-33,324
-33,124
-32,977
Энтальпия образования оценена
по
методу
корреляции
па
осно-
вании
аналогии
между
алкильными группами, присоединенными
нафталину,
и
идентичными группами, присоединенными
к
бензолу.
1етодами корреляции Миллиган, Беккер
и
Питцер
[1009]
рассчитали
бшачения термодинамических функций
для
газообразного состояния,
госсини, Питцер,
Арнетт,
Браун
и
Пиментел
[1248]
отобрали точку
Ьпения
ТЪ
=
543°
К.
В
ж
•'
W' °
к
Ж
298
Щ
300
к
400
Р
500
1
600
1
'
700
i
800
f
900
|. юоо
№
465
.
1-Бутилнафталин, С
14
Н
Мол.
вес
калЦмоль
°К)
Ср°
[55,18
55,51
1
72,20
86,60
1
98,40
108,10
116,10
122,80
128,50
i
118,83
119,18
137,49
155,19
172,06
187,98
202,95
217,02
230,26
-(G°-H°
WS
)/T
118,83
118,84
121,22
126,26
132,50
139,30
146,33
153,41
160,44
[8
(состояние
идеального газа).
184,268
ккал/моль
0,00
0,11
6,51
14,47
23,74
34,08
45,30
57,25
69,83
дя/°
12,68
12,62
10,02
7,93
6,31
5,11
4,24
3,69
3,44
AGI°
57,38
57,65
73,08
89,09
105.47
122,11
138,87
155,74
172,67
lg
Кр
-42,056
-41,995
-39,926
-38,940
-38,415
-38,123
-37,935
-37,817
-37,734
29-831
450
Часть
2.
Термические
и
термохимические
свойства
веществ
Энтальпия образования оценена
по
методу
корреляции
на
осно-
вании
аналогии
между
алкильньтми группами, присоединенными
к
нафталину,
и
идентичными группами, присоединенными
к бен-
золу.
Методами корреляции Миллиган, Боккер
и
Питцер
[1000]
рассчитали значения термодинамических функций
для
газообразш:и
о
состояния.
Россини, Питцер,
Ариетт,
Браун
и
Пиментел
[1248!
отобрали
Тт =
253,39°
К и
ТЪ
=
562,49°
К.
As 466.
2-Бутилнафталин, С^Нде (состояние идеального газа).
Мол.
вес
184,268
IX. Химическая
термодинамика
углеводородов
451
г,
°к
298
300
400
500
600
700
800
900
1000
кал/(
моль'
°К)
(р«
55,24
55,56
72,00
86,20
97,90
107,70
115,70
122,40
128,10
s°
119,46
119,81
138,10
155,73
172,51
188,36
203,28
217,31
230,51
119,46
119,47
121,85
126,87
133,10
139,87
146,87
153,93
160,93
кпал/могь
Н
°-
Н
2
Э8
0,00
0,11
6,50
14,43
23,66
33,95
45,13
57,04
69,58
ДЯ/°
12,50
12,44
9,83
7,72
6,04
4,80
3,89
3,30
3,02
AG/°
57,01
57,28
72,65
88,60
104,93
121,53
138,25
155,09
171,99
lg
Кр
-41,781
-41,720
-39,09i)
-38,721
-38,21'
-37,912
—
37,7()7
-37,
Ш
-37,587
Энтальпия образования оценена
по
метду
корреляции
на
основа-
нии
аналогии
между
алкильньтми группами, присоединенными
к
нафталину,
и
идентичными группами, присоединенными
к
бензолу.
Методами корреляции Миллиган, Беккер
и
Питцер
[1009]
рассчитали
значения
термодинамических функций
для
состояния идеального
газа. Россини, Питцер,
Арнетт,
Браун
и
Пиментел
[1248]
отобрали
точки плавления
и
кипения:
Тт =
268°
К и
ТЪ
=
565°
К.
№
467.
1-Амилнафталин, С
15
Н
18
(состояние идеального газа).
Мол.
вес 198,294
Г,
°К
298
300
400
500
600
700
800
900
1000
•калЦмоль-°К)
Ср°
60,65
61,01
79,20
94,90
107,80
118,40
127,20
134,60
140,90
s°
128,26
128,64
148,74
168,16
186,63
204,07
220,47
235,89
250,41
128,26
128,27
130,88
136,41
143,26
150,71
158,42
166,18
173,88
ккал!моль
0,00
0,12
7,15
15,88
26,03
37,36
49,65
62,75
76,53
ля/°
7,75
7,69
4,77
2,43
0,62
-0,72
-1,68
-2,29
-2,55
AGf°
59.35
59,66
77,46
95,91
114,77
133,92
153,20
172,61
192,08
lg
Кр
-43,
"300
-43,461
-42,31
е
-
-41,9^0
-41,801
-41,810
-41,8')1
-41,91'
-41,976
Энтальпия образования оценена
по методу
корреляции
на
основа-
нии
аналогии
между
алкильными группами, присоединенными
К
нафталину,
и
идентичными группами, присоединенными
к
бензолу.
Методами корреляции Миллиган, Беккер
и
Питцер
[1009]
рассчитали
Означения термодинамических функций
для
газообразного состояния.
«Россини, Питцер,
Ариетт,
Браун
и
Пиментел
[1248]
отобрали точки
{•плавления
и
кипения:
Тт =
251°
К и
ТЪ
=
580°
К.
Л» 468.
2-Амилнафталин,
C^Hjg
(состояние
идеального
газа).
Мол.
вес
198,294
1
1
298
.'
300
t*
400
|
500
V
60
°
|
700
$
800
f
900
\
1000
ъ.а я/(моль-
С
К)
Ср°
60,71
61,06
79,00
94,50
107,30
117,90
126,80
134,20
140,50
ч°
128,89
129,27
149,35
168,70
187,09
204,45
220,79
236
16
250,64
-(G°-II°
2SS
)JT
128,89
128,90
131,51
137,03
143,85
151,28
158,96
166,69
174,37
ккал/моль
Н
°~
Н
298
0,00
0,12
7,14
15,84
25,95
37,22
49,47
62,53
76,27
ЛЯГ
7,57
7,51
4,58
2,21
0,35
-1,04
-2,04
-2,69
-2,99
AG/°
58,98
59,29
77,02
95,42
114,23
133,34
152,59
171,97
191,41
lg
Кр
-43,230
-43,192
-42,082
-41,706
-41,605
-41,628
-41,683
-41,757
-41,830
Энтальпия образования оценена
по методу
корреляции
на
основа-
~ аналогии
между
алкильными группами, присоединенными
к
наф-
,алину,
и
идентичными группами, присоединенными
к
бензолу.
Методами корреляции Миллиган, Беккер
и
Питцер
[1009]
рассчитали
Йачения
термодинамических функций
для
газообразного состояния.
Россини,
Питцер,
Арнетт,
Браун
и
Пиментел
[1248]
отобрали точки
"давления
и
кипения:
Тт =
269°
К и
ТЪ
=
583°
К.
глеводороды других классов. Таблицы для состояния
идеального газа
№
469.
Спиропентан, С
6
Н
8
(состояние идеального газа).
Мол. вес
68,114
Термические
и
спектроскопические свойства спиропентана
при
зких
температурах
тщательно изучены Скоттом, Финке, Хаббар-
^, Мак-Каллохом, Гроссом, Уилямсоном, Уаддингтоном
и
Хафф-
Маном
[1303].
По
данным этих исследователей,
Ttp =
166,13°
К,
*АНт°
= 1,538
ккал/моль
и
ТЪ
=
312,
12°
К,
при
этом
AHv =
^
6,393
ккал/молъ;
энтропии
при
298°
К,
определенные
на
основании
третьего
закона термодинамики, равные
46,29
кал/(молъ -°К)
для
..Жидкости
и
67,45
кал/(молъ-°К)
для
состояния идеального газа,
29*
452
Часть
2. Термические и термохимические
свойства
веществ
IX. Химическая термодинамика
углеводородов
453
298
300
400
500
600
700
800
900
1000
кал/(моль
°К)
Ср°
21,06
21,19
28,55
34,91
40,10
44,36
47,91
50,93
53,51
s°
67,45
67,59
74,71
81,79
88,63
95,14
101,30
107,12
112,62
-(О°-Я°
98
)/Г
67,45
67,46
68,38
70,35
72,83
75,56
78,40
81,27
84,13
ккал/моль
Н
°~
Н
298
0,00
0,04
2,54
5,72
9,48
13,71
18,33
23,27
28,50
дн/°
44,27
44,24
42,72
41,52
40,59
39,89
39,39
39,05
38,88
AGf°
63,41
63,53
70,20
77,21
84,44
91,81
99,26
106,77
114,31
lg
Ни
-46,479
-46,277
-38,354
-33,719
-30,755
-28,663
-27,Щ
-25,925
-24,981
находятся
в
прекрасном соответствии
со
спектроскопическими
отнесениями, произведенными этими авторами. Фрейзер
и
Прозен
[442]
на
основании результатов измерений энтальпии сгорания спиро-
пентана установили,
что
AHf
2es
(I) =
37,67
ккал/молъ
и
АЯ/°
99
(g) =
=
44,27
ккал/молъ.
Т, °К
298
300
400
500
600
700
800
900
1000
№
470.
[,3,5-Циклогептатриен,
С7Н8
(состояние
идеального
газа).
Мол.
вес 92,134
кал/(моль-
°К)
Ср°
28,15
28,33
37,13
44,32
50,07
54,73
58,58
61,82
64,58
s°
75,44
75,62
85,01
94,10
102,70
110,78
118,35
125,44
132,10
-<с--н;
и
)/т
75,44
75,45
76,67
79,25
82,45
85,93
89,51
93,11
96,68
,
ккал/моль
0,00
0,06
3,34
7,43
12,16
17,40
23,07
29,10
35,42
43,47
43,44
42,22
41,29
40,57
40,05
39,67
39,44
39,36
AGf°
61,04
61,15
67,25
73,62
80,14
86,79
93,49
100,23
107,00
Ig
Кр
-44.711
—44,543
-36,740
-32,176
-29,191
-27,097
-25.539
-24,349
-23.3S4
Свойства этого соединения
при
низких температурах изучен^
Финке,
Скоттом, Гроссом, Мессерли
и
Уаддингтоном [424];
эгя
исследователи установили переход
в
твердом состоянии
при Tt -
=
153,96°
К, AHf = 0,561
ккал/молъ,
Ttp =
197,90°
К,
АЕт°
-
=
0,277
ккал/молъ.
ТЪ
=
388,64°
К, при
этом
AHv =
9,250
ккал/мо.и
•
На
основании этих измерений
по
третьему закону термодинамика
рассчитано значение энтропии
для
идеального газа
^"ев ^
=
75,44
кал/(моль-°
К).
Конн,
Кистяковский
и
Смит
[261]
измерили
энтальпию каталитического гидрирования циклогептатриена
до цик-
эгептана
при 355° К. Из
полученных данных Финке
и др. [424]
ассчитали значения
AHf
2!)S
(g) =
43,47
ккал/молъ
для
циклогепта-
риена. Эванс
и
Лорд
[397]
изучали спектр
и
произвели отнесение
сновных частот колебаний;
по их
расчетам энтропия
для
состояния
|деального газа
S°
2aB
= 76,0
кал/{моль
-°К).
I»
JN»
471.
Этинилбензол (фенилацетилен), С
8
Н
в
(состояние идеального газа).
Мол.
вес
102,128
,
"К
298
300
400
500
600
700
800
900
000
кал/(моль
-°К)
Ср°
27,46
27,63
35,95
42,67
48,01
52,29
55,79
58,71
61,17
Со
76,88
77,06
86,18
94,95
103,22
110,95
118,17
124,91
131,23
-<
С
°-
Н
298>/
Г
76,88
76,89
78,07
80,58
83,67
87,02
90,47
93,93
97,34
ккал/моль
Н
°~
Н
298
0,00
0,06
3,25
7,19
11,73
16,76
22,16
27,89
33,89
ДЯ/°
78,22
78,20
77,33
76,64
76,05
75,59
75,20
74,89
74,70
AGf
86,46
86,51
89,42
92,53
95,75
99,09
102,46
105,89
109,35
lg Кр
-63,375
-63,019
-48,856
-40,442
-34,877
-30,934
-27,990
-25,712
-23,897
Флиткрофт
и
Скиннер
[432]
измеряли энтальпию гидрирования
анилбензола
до
этилбензола;
на
основании полученных этими
тедователями данных
мы
рассчитали
AHf
Ma
(Г)
=
67,72
ккал/молъ
AHf
MS
(g) =
78,22
ккал/молъ.
Эванс
и
Найквист
[395]
произвели
Олное отнесение частот колебаний
и
рассчитали термодинамиче-
ае функции. Смит
и
Эндрюс
[1388]
изучали низкотемпературные
эйства, начиная
от
температуры жидкого
воздуха
и
выше;
по их
общениям,
Тгп =
228,3°
К и ТЪ = 416° К для
образца, чистота
горого составляла
99%.
№
472.
1,3,5,7-Циклооктатетраен, С
8
Н
8
(состояние идеального газа).
Мол.
вес
104,144
Ь
°
к
\J298
?300
!
400
500
600
'700
800
900
1000
ккал/(моль' °К)
Ср°
29,16
29,32
38,45
46,38
52,77
57,90
62,23
65,75
68,88
S"
78,10
78,29
88,00
97,46
106,50
115,03
123,05
130,59
137,68
-(
С
°-
Н
298^
Г
78,10
78,11
79,37
82,05
85,38
89,01
92,77
96,56
100,32
ккал/моль
н
°-
я
|
98
0,00
0,06
3,46
7,71
12,68
18,22
24,23
30,64
37,37
дн/°
71,23
71,20
69,85
68,76
67,90
67,25
66,76
66,42
66,24
AG/°
88,41
88,52
94,51
100,80
107,29
113,91
120,61
127,36'
134,15
lg
Кр
-64,805
—64,481
-51,634
-44,059
-39,077
—35,564
—32,946
-30,926
—29,317
454
Часть
2.
Термические
и
термохимические
свойства
веществ
Прозен,
Джонсон
и
Россини
[1197]
производили сжигание высоко-
чистых образцов этого вещества.
На
основании ролученных резуль-
татов ^измерений
мы
рассчитали Д#/°
98
(Z) =
60,93 ккал/молъ
и
AHf
2ss
(g) — 71,23
ккал/молъ. Скотт, Гросс, Оливер
и
Хаффман
[1312]
измеряли низкотемпературные свойства того
же
образца,
что
и
в
работе [1197], начиная
от
температуры жидкого водорода
и
выше.
Эти исследователи нашли,
что Ttp = 268,47° К,
АНт°
=
=
2,695
ккал/молъ
и
ТЪ
= 413,7° К, при
этом
AHv = 8,700
ккал/молъ
S'
w
(I) =
52,65
кал/(молъ-°К),
S'
m
(g) = 78,10
кал/(молъ
-°К)
и
AHv
2
g
S
=
10,300
ккал/молъ. Липпинкот
и
Лорд
[877]
произвели
пол-
ное
спектральное отнесение
и
рассчитали термодинамические
функции.
№
473. Азулен, С
]0
Н
8
(состояние идеального газа).
Мол.
вес
128,164
IX. Химическая термодинамика
углеводородов
455
298
300
400
500
600
700
800
900
1000
кал/(моль
°К)
Ср°
30,69
30,93
42,15
51,69
59,32
65,56
70,59
74,75
78,24
s°
80,75
80,95
91,42
101,89
112,01
121,63
130,73
139,29
147,35
-(G°-H°
98
)/r
80,75
80,76
82,11
85,02
88,68
92,71
96,90
101,14
105,36
ккал/моль
Н
°~
Н
298
0,00
0,06
3,73
8,44
14,00
20,25
27,07
34,34
42,00
дщ°
66,90
66,86
65,29
64,02
63,00
62,22
61,61
61,16
60,89
84,10
84,21
90,24
96,64
103,25
110,03
116,90
123,84
130,82
igKp
—61,647
-61,343
—49,305
-42,238
—37,606
-34,352
—31,933
—30,070
—28,590
Ковац,
Гюнтард
и
Платтнер
[802, 803]
провели исчерпывающее
термодинамическое изучение азулена (циклопентациклогептен,
изо-
мерный
нафталину)
и по
данным измерения
АНс°
определили
AHf
2Sfi
(g) =
66,90
ккал/молъ.
На
основании собственных отнесений
частот
они
рассчитали термодинамические функции
и
нашли,
что
^298
(&)
=
80,75
кал/(молъ-°К).
Эти
авторы приводят также следую-
щие
значения:
Тт = 373,64° К,
АНт°
= 2,89
ккал/молъ
и ТЪ =
=
523° К
(расчет),
при
этом
AHv = 13,26
ккал/молъ.
Они
указывают
энтальпии
переходов, приводимые Хейльброннером
и
Уиландом [581].
№
474.
Декагидронафталин,
цис,
СюН
18
(состояние идеального газа).
Мол.
вес
138,244
Парке
и
Хаттон [1102],
а
также Мак-Каллох,
Финке,
Мессерли,
Тодд, Кинчелое
и
Уаддингтон
[954]
измеряли низкотемпературные
свойства этого соединения. Данные, сообщенные Парксом
и
Хатто-
ном,
были получены
при
изучении переохлажденного вещества
г,
°к
298
300
400
500
600
700
800
900
1000
кал/(моль
К)
Ср<>
39,84
40,14
56,64
71,64
84,14
94,71
103,36
110,65
116,91
s°
90,28
90,53
104,38
118,67
132,87
146,66
159,88
172,49
184,48
-<е°-я;
м
)/г
90,28
90,29
92,06
95,95
100,93
106,48
112,33
118,32
124,34
ькал/моль
Н
°-
Д
29В
0,00
0,08
4,93
11,37
19,17
28,13
38,04
48,75
60,14
\ш°
-40,38
—40,46
—44,33
—47,36
—49,64
-51,23
—52,27
-52,83
—52,95
лс/°
20,51
20,88
41,95
63,88
86,35
109,16
132,13
155,23
178,37
\gKp
—15,034
-15,213
—22,918
—27,922
-31,450
—34,079
—36,094
-37,692
—38,980
f
И
поэтому заменены данными второй группы исследователей [954],
.которые установили необычно сложное поведение этого соединения.
ШИедлепный
переход
в
твердом состоянии наблюдался
при 216,1° К,
мфичем
AHt°
= 0,511
ккал/молъ.
По
данным этих исследовате-
лей,
Ttp = 230,17° К,
АНт°
= 2,268
ккал/молъ
и S°
2SS
(I) =
63,34
Гг/(моль
-°К). Кеймин
и
Россини
[189]
измеряли давление паров
установили,
что ТЪ = 468,91° К,
откуда Сейер
и
Манн
[1339]
Рассчитали
AHv = 9,940
ккал/молъ. Миядзава
и
Питцер
[1016]
руко-
водствовались калориметрическими данными
при
расчетах термо-
1|(инамических функций
для
состояния идеального газа
с
помощью
^спектроскопических методов.
Сперос
и
Россини
[1401]
определяли энтальпию сгорания
и
полу-
Чили
значение
АЯ/°,
8
(I)
=
—52,45
ккал/молъ
и
AHf
MS
(g) =
—
—40,38
ккал/молъ. Фрай
[450]
измерял константы равновесия
" процесса гидрирования нафталина
до
транс-декалина
и
установил
блестящее соответствие
со
значениями, рассчитанными
из
термоди-
намических данных. Соотношение между
транс-
и
zfuc-изомерами
Декалина оказалось немного ниже,
чем
соотношение, рассчитанное
из
термодинамических констант.
Ms
475.
Декагидронафталин,
транс,
C
J0
H
18
(состояние
идеального
газа).
Мол.
вес 138,244
Парке
и
Хаттон [1102],
а
также Мак-Каллох,
Финке,
Мессерли,
Тодд, Кинчелое
и
Уаддингтон
[954]
измерили низкотемпературные
свойства этого соединения. Хотя результаты, полученные двумя
этими
группами исследователей,
по
существу согласуются, здесь
Цитируются данные последней группы исследователей [954]:
Ttp =
=
242,76° К,
АНт°-=
3,455
ккал/молъ
и
S°
29S
(I)
=
63,32
кал/(моль-°К).
456
Часть
2.
Термические
и
термохимические
свойства
веществ
Т, °К
298
300
400
500
600
700
800
900
1000
ка
!/(моль-
°К)
Ср°
40,04
40,36
56,78
71,14
84,20
94,77
103,40
110,67
116,93
s°
89,52
89,77
103,68
117,92
132,08
145,88
159,11
171,72
183,71
-<с-н;
и
)/т
89,52
89,53
91,31
95,21
100,18
105,73
111,58
117,57
123,59
кпал/моъь
0,00
0,08
4,95
11,36
19,15
28,11
38,03
48,74
60,13
ДШ°
—43,57
—43,65
-47,49
—50,56
—52,85
—54,43
-55,47
—56,03
—56,15
AG/°
17,55
17,92
39,06
61,06
83,61
106,49
129,54
•152,72
175,94
\gKp
—
12,8fj_
—13,0-
—21,.Я
— 26,G9(
—30,ri
—33,247
-35, ЗЗ
1
-
—37,08'
—38/4
Г
>
Кеймин
и
Россини
[189]
приводят значение
ТЬ =
460,41°
К,
откуда
Сейер
и
Манн
[1339]
рассчитали среднее значение
AHv -
=
9,260
ккал/молъ. Миядзава
и
Питцер
[1016]
руководствовались
калориметрическими данными
при
расчетах термодинамических
функций
для
состояния идеального газа
с
помощью спектроскопиче-
ских методов.
Сперос
и
Россини
[1401]
определяли энтальпию сгорания
и
полу-
чили значение
AHf°
2m
(I)
=
—55,14
ккал/молъ
и
ДЯ/°
98
(g) —
=
—43,57
ккал/молъ. Фрай
[450]
измерял константы равновесия
процесса гидрирования нафталина
до
тракс-декалина
и
установил
блестящее соответствие
со
значениями, рассчитанными
из
термоди
намических данных.
IX.
Химическая
термодинамика
углеводородов
457
Колеман
и
Пилчер
[246] на
основании тщательного определения
энтальпии сгорания получили значения
АЯ/°„
(s) =
24,02
ккал/моль.
Они
дают обзор предшествующих работ
по
изучению этого соедине-
ния.
На
основании доступных данных
по
давлению пара
над
твердым
веществом
они
отобрали наиболее точные значения Брэдли
и
Клисби
[158]
и
рассчитали
AHf
zw
(g) =
43,52
ккал/молъ.
Хаффман, Парке
и
Даниелс
[656]
измеряли теплоемкость
в
усло-
виях низких температур
от 90 до
300°
К и
рассчитали £°
98
(s) -=
=
49,2
кал/(моль-°К).
На
основании данных
о
давлении пара, полу-
ченных Брэдли
и
Клисби [158],
S°
zaB
(g) = 92,2
калI(моль -°К).
Кей-
тон
и
Липпинкот
[725]
произвели отнесение частот колебаний
и, при-
няв
допущение
о
свободном вращении, рассчитали
S°
2Sf
,
(g) -=
=
93,9
кал/(моль-°К),
что
согласуется
в
пределах эксперименталь-
ных ошибок
с
указанным выше значением. Приняты термодинамиче-
ские функции, рассчитанные Кейтоном
и
Липпинкотом [725].
Эти
исследователи дают обзор предшествующих работ
по
спектроско-
пическим расчетам.
Сталл
[1432]
отобрал значения
Тт =
342,7°
К и ТЬ =
528,1 ^К.
По
данным измерений Спагта, Томаса
и
Паркса [1400],
АНт°
=•
=
4,44
ккал/молъ. Теплоемкости жидкости
в
температурном интер-
вале
350—600°
К
определены Уолкером, Бруксом, Эвингом
и Мил-
лером [1567];
по их
данным,
Ср =
33,46
+
0,094Г
[кал/(молъ-
К)].
' Уолкер
и др.
приводят ссылки
на
предшествующие работы
по
опре-
делению теплоемкостей
и
энтальпий
для
жидкого состояния. Путем
' сочетания отобранных значений
для
AHs
298
,
AHm и
теплоемкостей
получена величина
AHv = 10,9
ккал/молъ
для
температуры кипения
при
нормальном давлении.
№
476. Дифенил,
С
12
Н
10
(состояние
идеального газа).
Мол.
вес
154,200
Т, "К
298
300
400
500
600
700
800
900
1000
Cv°
38,80
39,05
52,83
64,38
73,54
80,93
86,92
91,86
96,00
кал/(моль
S°
93
85
94,10
107,27
120,34
132,92
144,83
156,04
166,57
176,47
•'К)
-(№>-!
93
93
95
99
103
108
114
119
124
*298^
Г
,85
,86
,56
,21
,79
,81
,02
,28
,51
ккал/моль
Я
°-
Я
298
0,00
0,08
4,69
10,57
17,48
25,22
33,62
42,56
51,96
ДН/°
43,52
43,48
41,66
40,23
39,10
38,25
37,60
37,14
36,89
AGf°
66,94
67,08
75,24
83,81
92,62
101,63
110,71
119,88
129,10
lgK
—49,
-48,
—41,
-36,
-33,
-31,
-30,
—29,
-28,
Р
063
864
107
631
736
728
244
110
214
%,

Глава
X
ХИМИЧЕСКАЯ
ТЕРМОДИНАМИКА
СОЕДИНЕНИЙ
УГЛЕРОДА, ВОДОРОДА И КИСЛОРОДА
Введение
В различных сочетаниях атомы
двух
видов —
углерода
и водо-
рода — образуют множество углеводородов. Число соединений
в
огромной мере возрастает при включении в состав молекул атомов
третьего вида — кислорода. В термодинамическом отношении такие
соединения,
содержащие ковалентные связи кислород —
углерод
и
кислород — водород, характеризуются той же последовательностью
и
закономерностью изменения свойств, что и углеводороды. При этом
наблюдаются отдельные отклонения в
случае
полярных соединений,
таких, как спирты, альдегиды и кислоты, в которых концевые водо-
родные атомы проявляют тенденцию к образованию «водородных
связей» с электроотрицательными атомами
других
молекул.
Термодинамические свойства углеводородов и продуктов их
окис-
ления
представляют особый интерес ввиду того, что ценность
угле-
водородов как горючего зависит от разности
между
величиной
их внутренней энергии и соответствующими величинами продуктов
сгорания.
Однако ввиду того, что при сгорании не все реакции проте-
кают до конца, т. е. до образования двуокиси
углерода
и воды, воз-
никает
также необходимость знать термодинамические свойства мно-
гих устойчивых и неустойчивых промежуточных соединений
угле-
рода, водорода и кислорода, образующихся при горении. Животные
также получают необходимые им тепло и энергию за счет процесса
окисления,
сопровождающегося попутным образованием многочис-
ленных нестойких и устойчивых промежуточных продуктов. Расте-
ния
завершают вторую часть этого цикла. Используя солнечный свет
в
качестве первичного источника энергии для процесса фотосинтеза,
растения
жадно поглощают двуокись
углерода
из атмосферы, связы-
вают ее с водой и синтезируют соединения, менее деградированные
в
энергетическом отношении. После того как этот процесс образова-
ния
менее деградированных соединений пройдет через целый ряд
стадий, определенное промежуточное соединение (например, сахар)
может являться вполне подходящим горючим для осуществляемого
в
организмах животных цикла деградации. Таким образом, про-
цессы,
ведущие к рассеиванию энергии или к накоплению ее, постоян-
но
протекают с образованием многочисленных общих промежуточ-
ных соединений, содержащих углерод, водород и кислород. Эти
соединения
играют важную роль, поскольку они охватывают всю
X.
Химическая
термодинамика
соединений
С, Н и О
459
живую материю и синтезируются человеком для удовлетворения его
f нужд. Термохимия этих соединений не изучена столь всесторонне,
I
как термохимия углеводородов, и в этом отношении открываются
£ широкие возможности для экспериментальных и теоретических нссле-
* дований. Энергия связи С — С меньше, чем энергия связи С — Н,
§
а следовательно, самым легким путем включения атома кислорода
t в молекулу углеводорода является образование соединения
эфир-
si ного типа. Это сопряжено с минимальной деградацией молекулы
|| углеводорода, о чем
будет
сказано ниже.
Простые
эфиры
Энергия
связи С — С меньше энергии связи С — Н, поэтому наи-
более вероятным путем присоединения атома кислорода к молекуле
Г
&
углеводорода является включение его в данную молекулу
между
" двумя углеродными атомами, в результате чего образуется простой
эфир.
Образование эфира можно также условно представить себе
как
замещение одной из групп — СН
2
— в молекуле углеводорода
атомом кислорода; именно это представление и используется в дан-
ной
главе.
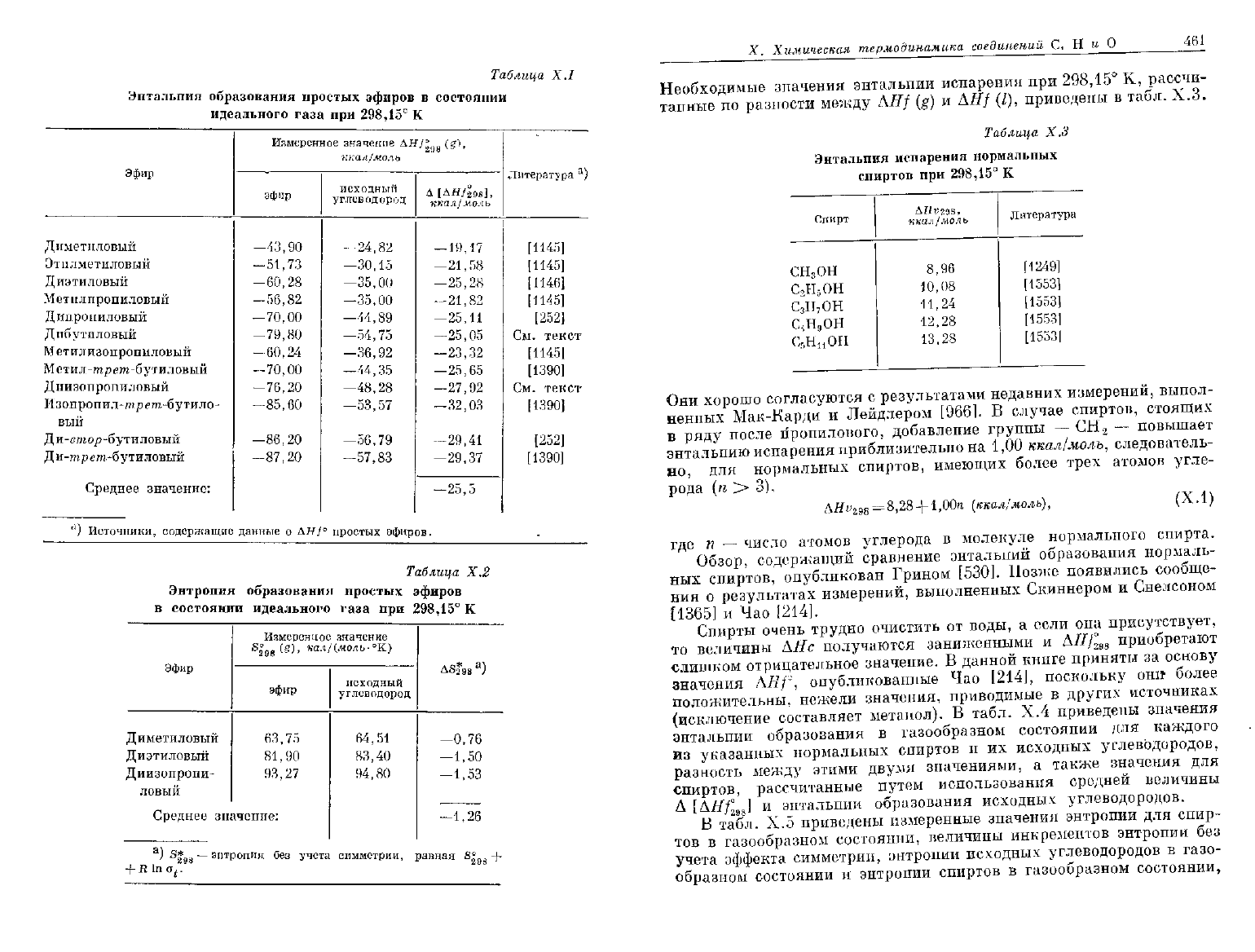
Доступные термохимические данные, относящиеся к эффекту
замещения
атомом кислорода одной группой — СН
2
— в молекуле
исходного углеводорода, приведены в табл. Х.1 и Х.2. Бросаются
в
глаза большие различия в значениях энтальпии образования
>Л//у°
98
.
Эти различия обусловлены степенью разветвленности и дли-
ЙНОЙ
цепи соответствующих алкильных групп. В приведенных при-
мерах значение
AHf
29S
(g) для эфира более отрицательно, нежели зна-
'чение для соответствующего исходного углеводорода, в среднем на
:25,5 ± 7,0 ккал/моль, тогда как Sl
w
(g) для эфира меньше, чем для
исходных углеводородов на 1,26 ±0,5
кал/(моль
-"К). В более
сложных методах расчета, подобных
методу,
описанному в гл. VI,
учитывается влияние как разветвления, так и длины цепи.
Средние значения инкрементов АСр приведены в табл. Х.8.
Спирты
Присоединение
атома кислорода к молекуле углеводорода по свя-
зям
С — Н может привести к образованию связей С — О — Н,
характерных для спиртов. Свойства нормальных спиртов
служат
примером
того, как на основании ограниченного объема данных
можно
с помощью правдоподобной модели получить более широкую
Информацию,
позволяющую предсказывать свойства соединений,
не
прибегая к необходимым измерениям. Величины
AHf°
2ss
опре-
делялись на основании результатов измерений соответствующих
свойств веществ в жидком состоянии, однако значения
АЯ/°„
(g)
более строгие, поэтому они и были выбраны для табулирования.
Таблица
X.I
Энтальпия
образования
простых
эфиров
в
состоянии
идеального
газа
при
298,15°
К
Эфир
Диметпловый
Этплметиловый
Диэтиловый
Метилпропиловый
Дипропиловый
Дибутиловый
Метилизопропиловый
Метил-трет-бутиловый
Диизопропиловый
Изопропил-горет-бутило-
вый
Ди-втор-бутиловый
Ди-трет-бутиловый
Среднее значение:
Измеренное значение
AHJ°
na
(gl,
эфир
-43,90
—51,73
—60,28
-56,82
—70,00
—79,80
-60,24
—70,00
—76,20
-85,60
—86,20
—87,20
ккал/моль
исходный
углеводород
-24,82
—30,15
—35,00
—35,00
—44,89
—54,75
—36,92
—44,35
-48,28
-53,57
—56,79
-57,83
Д [ДЯ/298],
ккал/моль
-19,17
—21,58
—25,28
-21,82
—25,11
—25,05
-23,32
—25,65
—27,92
-32,03
—29,41
-29,37
—25,5
Литература
/
[1145]
[1145]
[1146]
[1145]
[252]
См.
текст
[1145]
[1390]
См.
текст
[1390]
[252]
[1390]
а
) Источники, содержащие данные
о ДН/°
простых эфиров.
Таблица
Х.2
Энтропия
образования
простых
эфиров
в
состоянии
идеального
газа
при
298,15°
К
Эфир
Диметиловый
Диэтиловый
Диизопропи-
ловый
Измеренное значение
S|
98
(g),
кал/(моль-°К)
эфир
63,75
81,90
93,27
Среднее значение:
исходный
углеводород
64,51
83,40
94,80
AS?
98
a
)
-0,76
—1,50
-1,53
—1,26
X.
Химическая
те
1
рмодинамика
соединений
С, Н и О
461
Необходимые значения энтальпии испарения при
298,15°
К, рассчи-
танные по разности между AHf (g) и AHf (Г), приведены в табл. Х.З.
Таблица
Х.З
Энтальпия
испарения
нормальных
спиртов
при
298,15°
К
Спирт
СН
3
ОН
C
2
H
S
OH
С
3
Н
7
ОН
С
4
Н
9
ОН
с
5
н
и
он
ДНИ298,
ккал/моль
8,96
10,08
11,24
12,28
13,28
Литература
[1249]
[1553]
[1553]
[1553]
[1553]
+
Л In o
t
.
S*
—
энтропия
без
учета
симметрии, равная
S°
Qi)
-f-
Они
хорошо согласуются с результатами недавних измерений, выпол-
ненных Мак-Карди и Лейдлером [966]. В случае спиртов, стоящих
в ряду после пропилового, добавление группы — СН
2
— повышает
энтальпию испарения приблизительно на 1,00 ккал/молъ, следователь-
но,
для нормальных спиртов, имеющих более трех атомов угле-
рода {п > 3).
ДЯгл>
98
= 8,28 +
1,00га
(ккал/моль),
(Х.1)
где п — число атомов углерода в молекуле нормального спирта.
Обзор, содержащий сравнение энтальпий образования нормаль-
ных спиртов, опубликован Грином [530]. Позже появились сообще-
ния
о результатах измерений, выполненных Скиннером и Снелсоном
{1365]
и Чао [214].
Спирты очень трудно очистить от воды, а если она присутствует,
то величины АНс получаются заниженными и
АНЦ
ЯЙ
приобретают
слишком отрицательное значение. В данной книге приняты за основу
значения
AHf°,
опубликованные Чао [214], поскольку ошг более
положительны, нежели значения, приводимые в
других
источниках
(исключение составляет метанол). В табл. Х.4 приведены значения
энтальпии образования в газообразном состоянии для каждого
из
указанных нормальных спиртов и их исходных углеводородов,
разность между этими двумя значениями, а также значения для
спиртов, рассчитанные путем использования средней величины
А
[АЯ/°
98
]
и энтальпии образования исходных углеводородов.
В табл. Х.5 приведены измеренные значения энтропии для спир-
тов в газообразном состоянии, величины инкрементов энтропии без
учета
эффекта симметрии, энтропии исходных углеводородов в газо-
образном состоянии и энтропии спиртов в газообразном состоянии,
