Сталл Д. Вестрам Э. Зинке Г. Химическая термодинамика органических соединений
Подождите немного. Документ загружается.

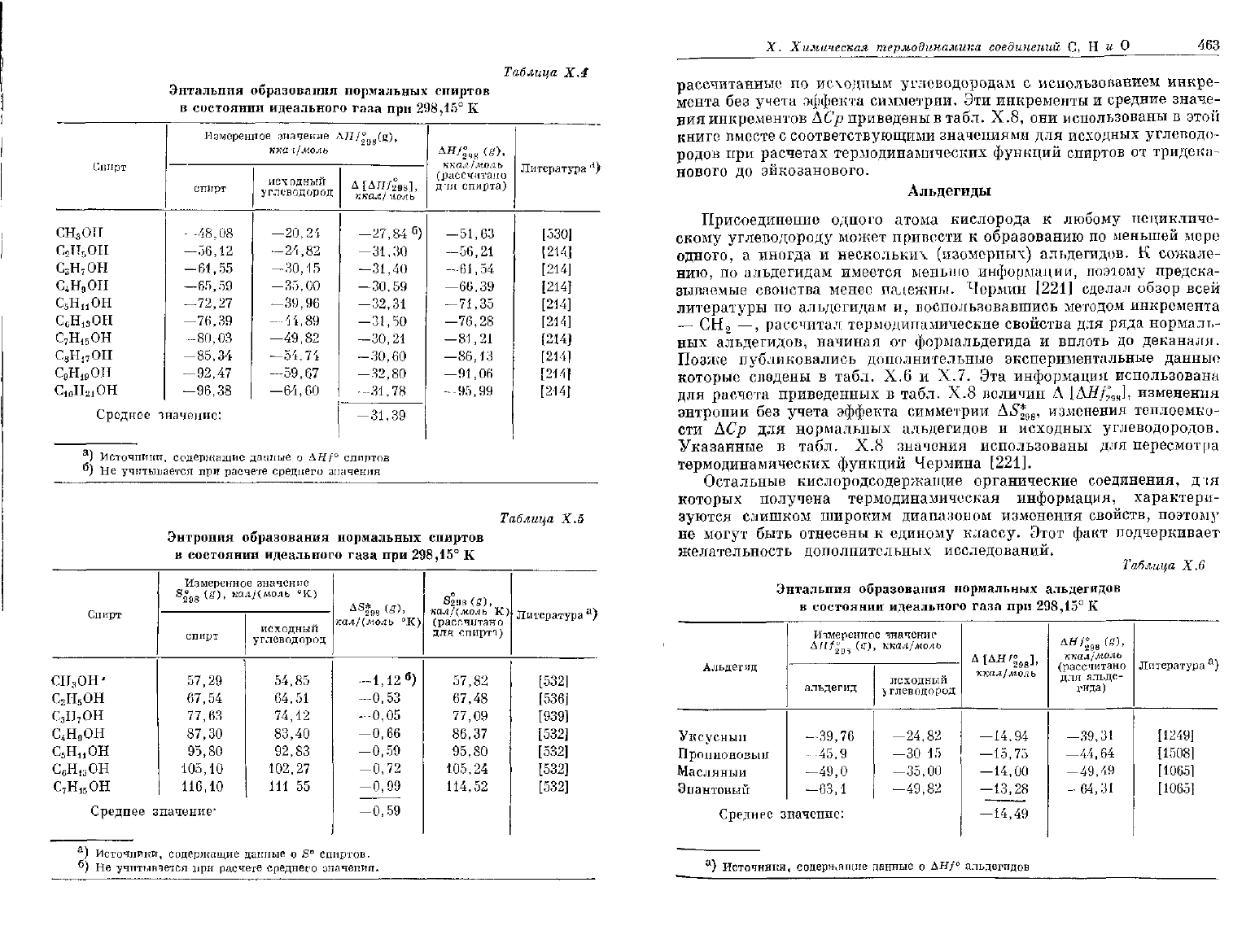
Таблица
Х.4
Энтальпия образования нормальных спиртов
в состоянии
идеального
газа
при
298,15°
К
Спирт
СН
3
ОН
с
2
н
5
он
С
3
Н
7
ОН
QHgOII
С
5
Н„ОН
С
6
Н
13
ОН
С
7
Н
15
ОН
С
8
Н
17
ОН
Измеренное
значение AH/°
g8
(g),
ккаг/моль
спирт
—48,08
—56,12
— 61,55
—65,59
—72,27
—76,39
—80,03
—85,34
-92,47
—96,38
С10Н21ОН
Среднее
значение:
исх
одный
углеводород
20,24
24,82
30,15
35,00
39,96
«,89
49,82
54,74
59,6.7
64,60
Л [ЛЯ/288],
ккал/
«оль
-27,84
(
-31,30
-31,40
-30,59
-32,31
-31,50
-30,21
-30,60
-32,80
-31,78
—31,39
ккал/моль
(рассчитано
дня
спирта)
-51,63
-56,21
-61,54
-66,39
-71,35
-76,28
-81,21
-86,13
-91,06
-95,99
Литература
а
)
[530]
[214]
[214]
[214]
[214]
[214]
[214]
[214]
[214]
[214]
X.
Химическая
термодинамика
соединений
С, Н и О
463
а
)
Источники,
содержащие данные о ДЯ/° спиртов
") Не учитывается при расчете среднего значения
Таблица
X.S
Энтропия образования нормальных спиртов
в состоянии
идеального
газа
при
298,15°
К
Спирт
СН
3
ОН«
с
2
н
5
он
С
3
Н
7
ОН
С
4
Н
9
ОН
С
5
Н
И
ОН
с
6
н
13
он
С
7
Н
15
ОН
Измеренное
значение
S>298 (g), калЦмоль °К)
спирт
57,29
67,54
77,63
87,30
95,80
105,10
116,10
исходный
углеводород
54,85
64,51
74,12
83,40
92,83
102,27
111 55
Среднее
значение'
AS*
e8
(g),
калЦмоль °К)
—1,42
6
)
—0,53
—0,05
—0,66
-0,59
-0,72
-0,99
—0,59
S298 (g),
калЦмоль К)
(рассчитано
для
спиртч)
57,82
67,48
77,09
86,37
95,80
105,24
114,52
Литература
а
]
[532]
[536]
[939]
[532]
[532]
[532]
[532]
Источники,
содержащие данные о S° спиртов.
Не
учитывается при расчете среднего
значения.
рассчитанные по исходным углеводородам с использованием инкре-
мента без
учета
эффекта симметрии. Эти инкременты и средние значе-
ния
инкрементов АСр приведены в табл. Х.8, они использованы в этой
книге
вместе с соответствующими значениями для исходных углеводо-
родов при расчетах термодинамических функций спиртов от тридека-
нового до эйкозанового.
Альдегиды
Присоединение
одного атома кислорода к любому нецикличе-
скому
углеводороду
может привести к образованию по меньшей мере
одного, а иногда и нескольких (изомерных) альдегидов. К сожале-
нию,
по альдегидам имеется меньше информации, поэюму предска-
зываемые свойства менее надежны. Чермин [221] сделал обзор всей
литературы по альдегидам и, воспользовавшись методом инкремента
— СН
2
—, рассчитал термодинамические свойства для ряда нормаль-
ных альдегидов, начиная от формальдегида и вплоть до декана ля.
Позже
публиковались дополнительные экспериментальные данные
которые сведены в табл. Х.6 и Х.7. Эта информация использована
для расчета приведенных в табл. Х.8 величин A
[AHf^J,
изменения
энтропии
без
учета
эффекта симметрии
А£*
98
,
изменения теплоемко-
сти АСр для нормальных альдегидов и исходных углеводородов.
Указанные в табл. Х.8 значения использованы для пересмотра
термодинамических функций Чермина [221].
Остальные кислородсодержащие органические соединения, дтя
которых получена термодинамическая информация, характери-
зуются слишком широким диапазоном изменения свойств, поэтому
не
могут
быть отнесены к единому классу. Этот факт подчеркивает
желательность дополнительных исследований.
Таблица
Х.6
Энтальпия образования нормальных
альдегидов
в состоянии
идеального
газа
при
298,15°
К
Альдегид
Уксуснып
Пропионовьти
Масляный
Энантовый
Измеренное
значение
АН/°
8
, (?), ккал/моль
альдегид
—39,76
—45,9
—49,0
—63,1
исходный
углеводород
—24,82
—30 15
-35,00
—49,82
Среднее
значение:
Д[АН/|
И
],
ккал/моль
— 14,94
—15,75
—14,00
—13,28
—14,49
ДН/°
98
(g),
ккал!
моль
(рассчитано
для
альде-
гида)
—39,31
—44,64
—49,49
-64,31
Литература
а
]
[1249]
[1508]
[1065]
[1065]
а
)
Источники,
содержащие данные о ДЯ/° альдегидов
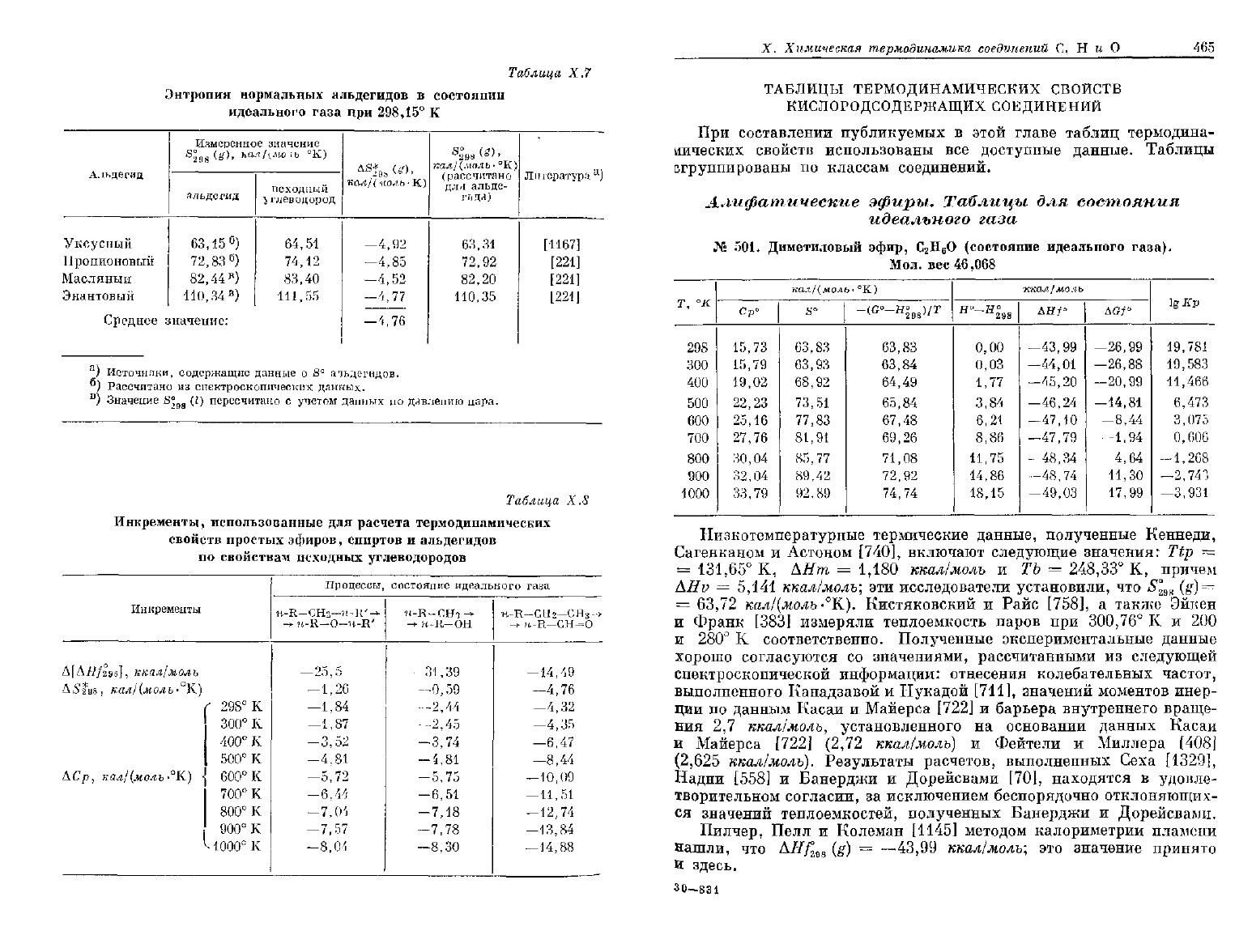
Таблица
Х.7
Энтропия
нормальных альдегидов
в
состоянии
идеального
газа
при
298,15°
К
Альдегид
Уксусный
Пропионовый
Масляный
Э
пантовый
Измеренное
значение
S°
98
(g),
ълл/умо
ib
°К)
альдегид
63,15
б
)
72.83
6
)
82,44
в
)
110,34
в
)
исходный
углеводород
64,51
74,12
83,40
111,55
Среднее значение:
ASf
B8
(
ff
),
кал/( ноль-К)
—4,92
-4,85
—4,52
-4,77
-4,76
S
2
°
98
(o»),
кал!
{моль
•
°К)
(рассчитано
для альде-
гьда)
63,31
72,92
82,20
110,35
Лпгсратура
а
)
[1167]
[221]
[221]
[221]
а
) Источники, содержащие данные
о
S"
атьдегидов.
") Рассчитано
из
спектроскопических данных.
в
) Значение
S°
98
(I)
пересчитано
с
учетом данных
по
давлению пара.
Таблица
Х.&
Инкременты,
использованные
для
расчета термодинамических
свойств
простых
эфиров,
спиртов
и
альдегидов
по
свойствам
исходных
углеводородов
Инкременты
А[Д///29з], ккал/моль
Д5*98, кал/(моль-°К)
ЛСр,
кал/(моль
.°К)
298°
К
300°
К
400°
К
500°
К
600°
К
700°
К
800°
К
900°
К
^1000°
К
Процессы,
K-R-CH2—н-R'-*
-> 71-R—О—н-R'
—25,5
-1,26
-1,84
-1,87
-3,52
—4,81
—5,72
—6,44
—7,04
-7,57
—8,04
состояние идеального газа
-+
и-R—ОН
—31,39
-0,59
—2,44
—2,45
-3,74
-4,81
—5,75
—6,51
—7,18
-7,78
—8,30
н-R—СНг—СН
3
->
-+
н-R—СН^О
—14,49
—4,76
—4,32
-4,35
—6,47
—8,44
—10,09
—11,51
—12,74
-13,84
—14,88
I
X.
Химическая
термодинамика
соединений
С, Н и О
465
ТАБЛИЦЫ
ТЕРМОДИНАМИЧЕСКИХ
СВОЙСТВ
КИСЛОРОДСОДЕРЖАЩИХ
СОЕДИНЕНИЙ
При
составлении публикуемых
в
этой главе таблиц термодина-
мических свойств использованы
все
доступные данные. Таблицы
сгруппированы
по
классам соединений.
Алифатические эфиры. Таблицы для состояния
идеального газа
№
501. Диметиловый
эфир,
СгН
6
О
(состояние
идеального газа).
Мол.
вес
46,068
Т,
"К
298
300
400
500
600
700
800
900
1000
кал/(моль-
°К)
c
v
°
15,73
15,79
19,02
22,23
25,16
27,76
30,04
32,04
33,79
s°
63,83
63,93
68,92
73,51
77,83
81,91
85,77
89,42
92,89
63,83
63,84
64,49
65,84
67,48
69,26
71,08
72,92
74,74
ккал1моль
Я
°-
Н
2°98
0,00
0,03
1,77
3,84
6,21
8,86
11,75
14,86
18,15
дн/°
—43,99
—44,01
-45,20
—46,24
-47,10
—47,79
-48,34
—48,74
—49,03
—26,99
—26,88
—20,99
—14,81
—8,44
—1,94
4,64
11,30
17,99
**,
19,781
19,583
11,466
6,473
3,075
0,606
—1,268
—2,743
—3,931
Низкотемпературные термические данные, полученные Кеннеди,
Сагенканом
и
Астоном [740], включают следующие значения:
Tip =
=
131,65°
К, АНт
= 1,180
ккал/молъ
и
ТЪ
=
248,33°
К,
причем
AHv
—
5,141
ккал/молъ;
эти
исследователи установили,
что
S°
2S8
(g)
=
=
63,72
кал/'(моль -°К). Кистяковский
и
Райе [758],
а
также Эйкен
и
Франк
[383]
измеряли теплоемкость паров
при
300,76°
К и 200
и
280°
К
соответственно. Полученные экспериментальные данные
хорошо согласуются
со
значениями, рассчитанными
из
следующей
спектроскопической
информации: отнесения колебательных частот,
выполненного
Канадзавой
и
Нукадой [711], значений моментов инер-
ции
по
данным Касаи
и
Майерса
[722]
и
барьера внутреннего враще-
ния
2,7
ккал/молъ, установленного
на
основании данных Касаи
и
Майерса
[722] (2,72
ккал/молъ)
и
Фейтели
и
Миллера
[408]
(2,625 ккал/молъ). Результаты расчетов, выполненных Сеха [1329],
Надни
[558]
и
Банерджи
и
Дорейсвами
[70],
находятся
в
удовле-
творительном согласии,
за
исключением беспорядочно отклоняющих-
ся
значений теплоемкостей, полученных Банерджи
и
Дорейсвами.
Пилчер,
Пелл
и
Колеман
[1145]
методом калориметрии пламени
нашли,
что
AHf
MS
(g)
=
—43,99
ккал/молъ;
это
значение принято
а здесь.
30-831
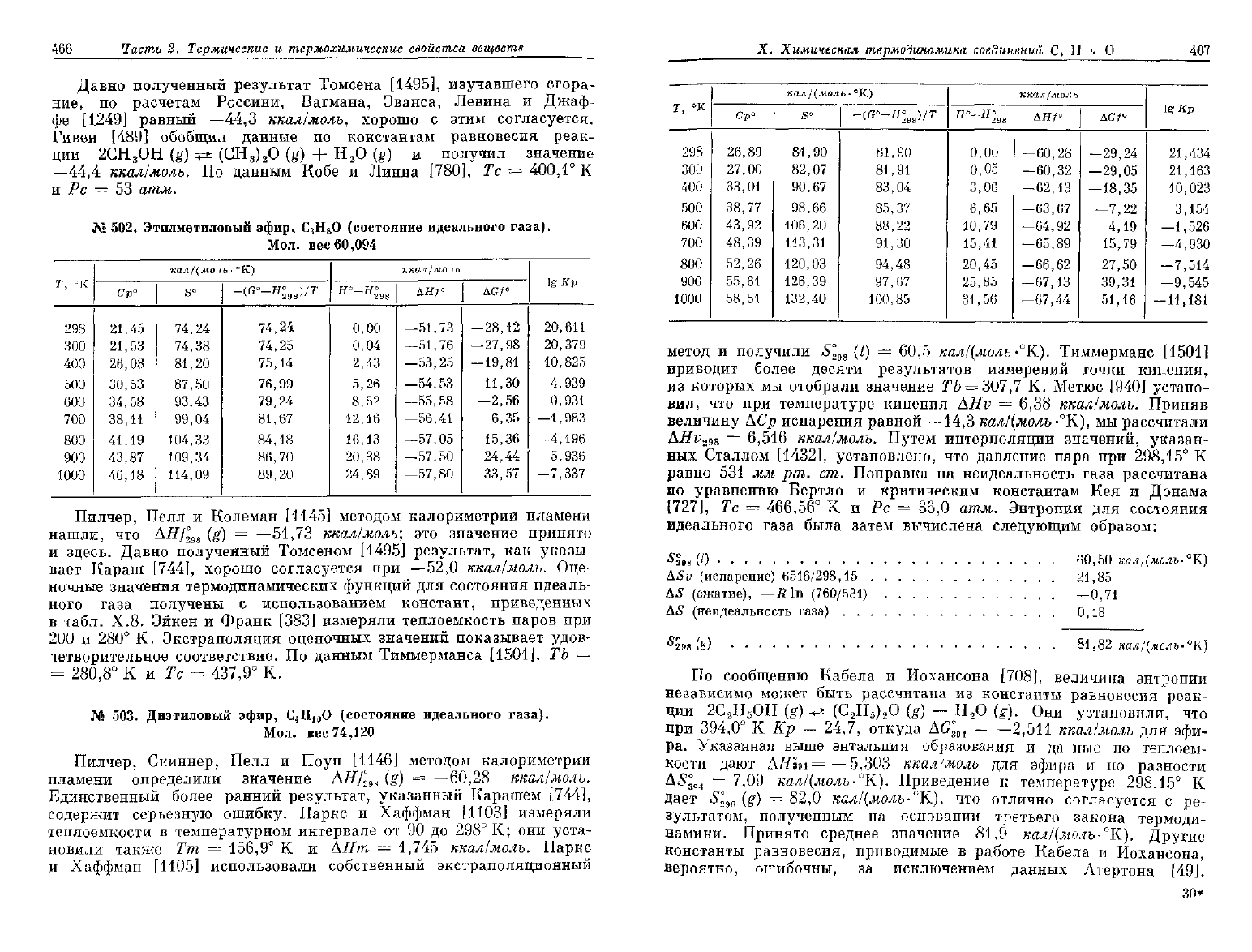
466
Часть
2. Термические и
термохимические
свойства
веществ
Давно полученный результат Томсена [1495], изучавшего сгора-
ние,
по
расчетам Россини, Вагмана, Эванса, Левина
и
Джаф-
фе
[1249]
равный
—44,3
ккал/молъ, хорошо
с
этим согласуется.
Гивен
[489]
обобщил данные
по
константам равновесия реак-
ции
2СН
3
ОН
(g)
5=t (CH
3
)
2
O
(g) + H
2
O (g) и
получил значение
—44,4
ккал/моль.
По
данным Кобе
и
Линна [780],
Тс = 400,1° К
и
Рс = 53 атм.
№ 502. Этилметиловый
эфир,
С
3
Н
8
О (состояние идеального газа).
Мол.
вес
60,094
г,
°к
298
300
400
500
600
700
800
900
1000
Ср°
21,45
21,53
26,08
30,53
34,58
38,11
41,19
43,87
46,18
кал/(мо
т
S°
74,24
74,38
81,20
87,50
93,43
99,04
104,33
109,34
114,09
ь.°К)
-((3°-Н°
98
)/Г
74,24
74,25
75,14
76,99
79,24
81,67
84,18
86,70
89,20
ккач/мо
!Ь
Н
°-
Н
2°98
0,00
0,04
2,43
5,26
8,52
12,16
16,13
20,38
24,89
АН
Г
—51,73
-51,76
-53,25
—54,53
—55,58
—56,41
—57,05
—57,50
-57,80
&Gf°
-28,12
—27,98
-19,81
—11,30
—2,56
6,35
15,36
24,44
33,57
lg Кр
20,611
20,379
10,825
4,939
0,931
-1,983
—4,196
-5,936
—7,337
Пилчер,
Пелл
и
Колеман
[1145]
методом калориметрии пламени
нашли,
что АЯ/
2
°
И
(g) =
—51,73
ккал/молъ;
это
значение принято
и
здесь. Давно полученный Томсеном
[1495]
результат,
как
указы-
вает Караш [744], хорошо согласуется
при
—52,0
ккал/молъ.
Оце-
ночные значения термодинамических функций
для
состояния идеаль-
ного газа получены
с
использованием констант, приведенных
в табл.
Х.8.
Эйкен
и
Франк
[383]
измеряли теплоемкость паров
при
200
и 280° К.
Экстраполяция оценочных значений показывает удов-
летворительное соответствие.
По
данным Тиммерманса [1501],
ТЪ =
=
280,8° К и Тс = 437,9° К.
№
503.
Диэтиловый
эфир,
С
4
Н
10
О (состояние идеального газа).
Мол.
вес
74,120
Пилчер,
Скиннер, Пелл
и
Поуп
[1146]
методом калориметрии
пламени определили значение
AHf
2w
(g) =
—60,28
ккал/молъ.
Единственный более ранний результат, указанный Карашем [744],
содержит серьезную ошибку. Парке
и
Хаффман
[1103]
измеряли
теплоемкости
в
температурном интервале
от 90 до 298° К; они
уста-
новили также
Тпъ = 156,9° К и
АНтп
= 1,745
ккал/молъ. Парке
и
Хаффман
[1105]
использовали собственный экстраполяционный
X. Химическая
термодинамика
соединений
С, Н и О
467
г,
°к
298
300
400
500
600
700
800
900
1000
кал
/(моль
-°К)
Ср°
26,89
27,00
33,01
38,77
43,92
48,39
52,26
55,61
58,51
s°
81,90
82,07
90,67
98,66
106,20
113,31
120,03
126,39
132,40
-(Й°-Я°
98
)/Г
81,90
81,91
83,04
85,37
88,22
91,30
94,48
97,67
100,85
ккал/моль
0,00
0,05
3,06
6,65
10,79
15,41
20,45
25,85
31,56
АН/»
—60,28
—60,32
-62,13
-63,67
—64,92
—65,89
—66,62
-67,13
-67,44
AGf°
-29,24
—29,05
-18,35
—7,22
4,19
15,79
27,50
39,31
51,16
lgKp
21,434
21,163
10,023
3,154
-1,526
—4,930
—7,514
—9,545
—11,181
метод
и
получили
S°
29S
(I) = 60,5
кал/(молъ-°К).
Тиммерманс
[1501]
приводит более десяти результатов измерений точки кипения,
из
которых
мы
отобрали значение ТЪ
=
307,7
К.
Метюс
[940]
устано-
вил,
что при
температуре кипения
AHv = 6,38
ккал/молъ. Приняв
величину
АСр
испарения равной
—14,3
кал/'(моль «°К),
мы
рассчитали
AHv
2
9s
— 6,516
ккал/молъ. Путем интерполяции значений, указан-
ных Сталлом [1432], установлено,
что
давление пара
при 298,15° К
равно
531 мм рпг. ст.
Поправка
на
неидеальность газа рассчитана
по
уравнению Бертло
и
критическим константам
Кея и
Донама
{727],
Тс = 466,56° К и Рс = 36,0 атм.
Энтропия
для
состояния
идеального газа была затем вычислена следующим образом:
$288
(0
60,50
кал,(молъ-°К)
ASv
(испарение)
6516/298,15
21,85
AS
(сжатие),
— Я In (760/531) —0,71
AS
(неидеальность
газа) 0,18
£?98
0?) 81,82
кал/(молъ.°К)
По
сообщению Кабела
и
Иохансона [708], величина энтропии
независимо может быть рассчитана
из
константы равновесия реак-
ции
2С
2
Н
5
ОН
(g)
+±:
(С
2
Н
5
)
2
О
(g) + Н
2
О (g). Они
установили,
что
при
394,0° К Кр = 24,7,
откуда AG°
94
=
—2,511
ккал/молъ
для эфи-
ра. Указанная выше энтальпия образования
и да ные по
теплоем-
кости дают ДЙ391 =—5,303
ккал/молъ
для
эфира
и по
разности
Д£°,
4
= 7,09
кал/(молъ-°К).
Приведение
к
температуре
298,15° К
Дает
S°
Me
(g) = 82,0
кал/{моль
•
°К),
что
отлично согласуется
с ре-
зультатом, полученным
на
основании третьего закона термоди-
намики.
Принято среднее значение
81,9
кал/(молъ-°К).
Другие
константы равновесия, приводимые
в
работе Кабела
и
Иохансона,
вероятно, ошибочны,
за
исключением данных Атертона
[49].
30*
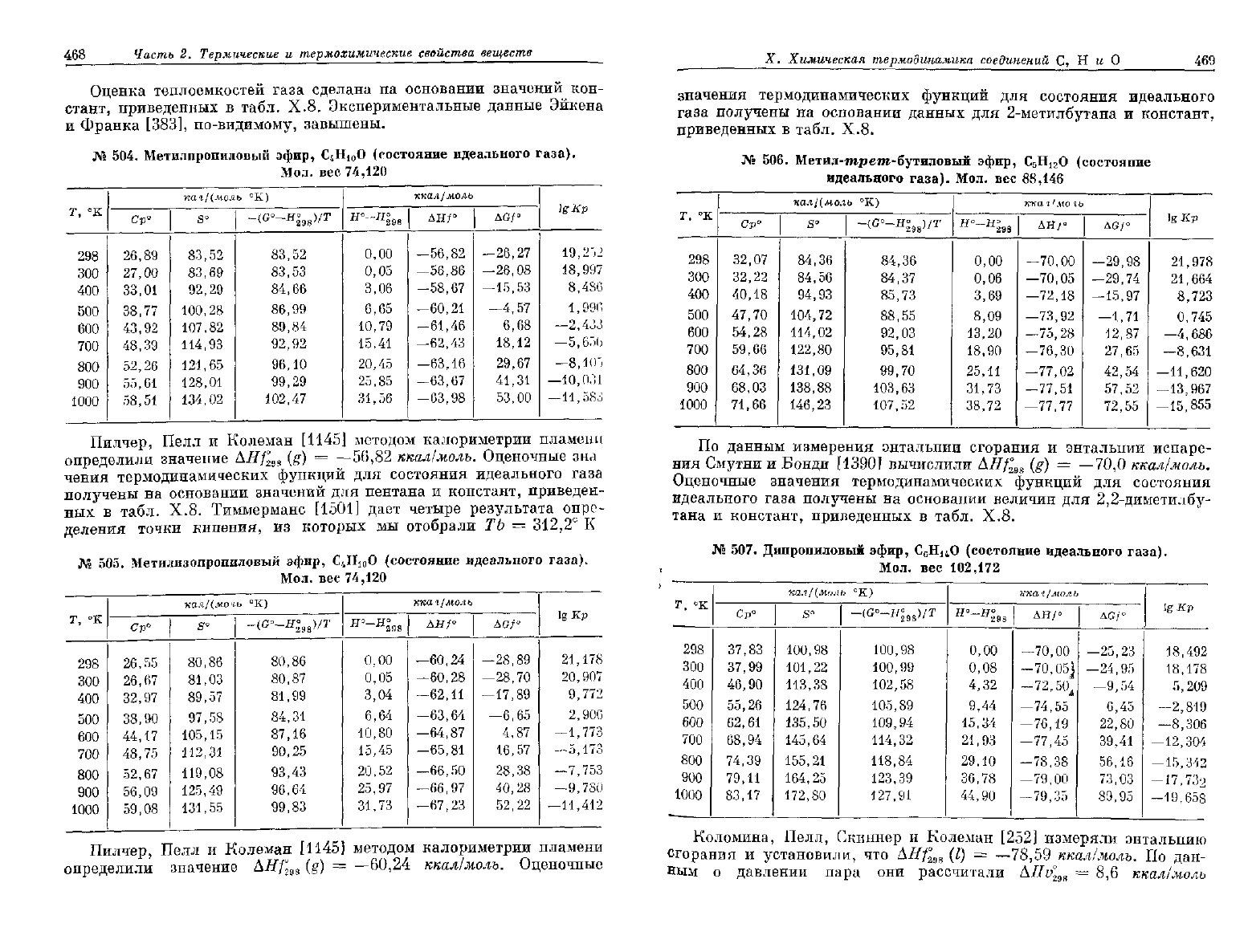
468
Часть
2.
Термические
и
термохимические свойства веществ
Оценка теплоемкостей газа сделана
на
основании значений
кон-
стант, приведенных
в
табл.
Х.8.
Экспериментальные данные Эйкена
и
Франка [383], по-видимому, завышены.
№
504.
Метилпропиловый
эфир,
С
4
Н
10
О (состояние идеального газа).
Мол.
вес
74,120
Т,
°К
298
300
400
500
600
700
800
900
1000
каг/(моль
°К)
Ср°
26,89
27,00
33,01
38,77
43,92
48,39
52,26
55,61
58,51
s°
83,52
83,69
92,29
100,28
107,82
114,93
121,65
128,01
134,02
83,52
83,53
84,66
86,99
89,84
92,92
96,10
99,29
102,47
ккал/моль
0,00
0,05
3,06
6,65
10,79
15,41
20,45
25,85
31,56
АН/»
—56,82
—56,86
-58,67
-60,21
-61,46
—62,43
-63,16
—63,67
—63,98
AGf°
—26,27
—26,08
-15,53
-4,57
6,68
18,12
29,67
41,31
53,00
19,252
18,997
8,430
1,990
—2,433
—5,63b
—8,10")
—10,031
—11,583
Пилчер,
Пелл
и
Колеман
[1145]
методом калориметрии пламени
определили значение
AHf
2dS
(g)
=
—56,82
ккал/молъ.
Оценочные
зна
чения
термодинамических функций
для
состояния идеального газа
получены
на
основании значений
для
пентана
и
констант, приведен-
ных
в
табл.
Х.8.
Тиммерманс
[1501]
дает
четыре результата опре-
деления точки
кипения,
из
которых
мы
отобрали
ТЬ
=
312,2°
К
№
505.
Метилизопропиловьш
эфир,
С
4
ПюО
(состояние
идеального
газа)*
Мол.
вес
74,120
Г,
°К
298
300
400
500
600
700
800
900
1000
кал/(могь
°К)
26,55
26,67
32,97
38,90
44,17
48,75
52,67
56,09
59,08
s°
80,86
81,03
89,57
97,58
105,15
112,31
119,08
125,49
131,55
80,86
80,87
81,99
84,31
87,16
90,25
93,43
96,64
99,83
пкаг/моль
0,00
0,05
3,04
6,64
10,80
15,45
20,52
25,97
31,73
AHf°
-60,24
—60,28
—62,11
—63,64
-64,87
—65,81
—66,50
-66,97
—67,23
—28,89
-28,70
—17,89
—6,65
4,87
16,57
28,38
40,28
52,22
21,178
20,907
9,772
2,906
-1,773
—5,173
—7,753
—9,780
—11,412
Пилчер,
Пелл
и
Колеман
[1145]
методом калориметрии пламени
определили значение
AHf
i9S
(g)
=
—60,24
ккал/молъ.
Оценочные
X.
Химическая термодинамика соединений
С,
Н
к
О
469
значения
термодинамических функций
для
состояния идеального
газа получены
на
основании данных
для
2-метилбутана
и
констант,
приведенных
в
табл.
Х.8.
№
506.
Метил-тгерет-бутиловый
эфир,
С
5
Н
12
О
(состояние
идеального
газа).
Мол. вес
88,146
298
300
400
500
600
700
800
900
1000
кал/(моль
°К)
ст>°
32,07
32,22
40,18
47,70
54,28
59,66
64,36
68,03
71,66
s°
84,36
84,56
94,93
104,72
114,02
122,80
131,09
138,88
146,23
-<
G
°-
H
298^
T
84,36
84,37
85,73
88,55
92,03
95,81
99,70
103,63
107,52
кка%*мо
гь
Я
°-
Н
298
0,00
0,06
3,69
8,09
13,20
18,90
25,11
31,73
38,72
ДН/°
—70,00
-70,05
-72,18
—73,92
-75,28
—76,30
—77,02
—77,51
-77,77
AGj°
—29,98
—29,74
-15,97
—1,71
12,87
27,65
42,54
57,52
72,55
lgKp
21,978
21,664
8,723
0,745
-4,686
—8,631
-11,620
—13,967
-15,855
По
данным измерения энтальпии сгорания
и
энтальпии испаре-
ния
Смутни
и
Бонди
[1390]
вычислили
ДЯ/°
98
(g)
—
—70,0
ккал/молъ.
Оценочные значения термодинамических функций
для
состояния
идеального газа получены
на
основании величин
для
2,2-димети л бу-
тана
и
констант, приведенных
в
табл.
Х.8.
№ 507. Дипропиловый
эфир,
С
6
Н
14
О (состояние идеального газа).
Мол.
вес
102,172
298
300
400
500
600
700
800
900
1000
С
37,
37,
46,
55,
62,
68,
74,
79,
83,
р°
83
99
90
26
61
94
39
11
17
кал/(моль
°К
100,98
101,22
113,38
124,76
135,50
145,64
155,21
164,25
172,80
-(
)
с°-я°
98
)/г
100,98
100,99
102,58
105,89
109,94
114,32
118,84
123,39
127,91
я°-
0,
0,
4,
9,
15,
21,
29,
36,
44,
тто
Й
298
00
08
32
44
34
93
10
78
90
ктгая/моль
ДН/°
—70,00
—70,05]
— /
<->,
OU
.
—74,55
—76,19
—77,45
—78,38
—79,00
-79,35
AGf
-25,23
—24,95
—9,54
6,45
22,80
39,41
56,16
73,03
89,95
igKp
18,492
18,178
5,209
-2,819
—8,306
-12,304
-15,342
—17,73
2
—19,658
Коломина,
Пелл, Скиннер
и
Колеман
[252]
измеряли энтальпию
сгорания
и
установили,
что AHf
MS
(I)
=
—78,59
ккал/молъ.
По дан-
ным
о
давлении пара
они
рассчитали
AHv°
2ss
—
8,6
ккал/моль
470
Часть
2. Термические и термохимические
свойства
веществ
и
AHf
2m
(g) —
—70,0
ккал/молъ. Термодинамические функции
оце-
нены
на
основании величин
для
гептана
и
констант, приведенных
в табл.
Х.8.
Тиммерманс
[1501]
приводит
два
результата определе-
ния
точки кипения, хорошо согласующиеся
при ТЪ =
363,2°
К.
№
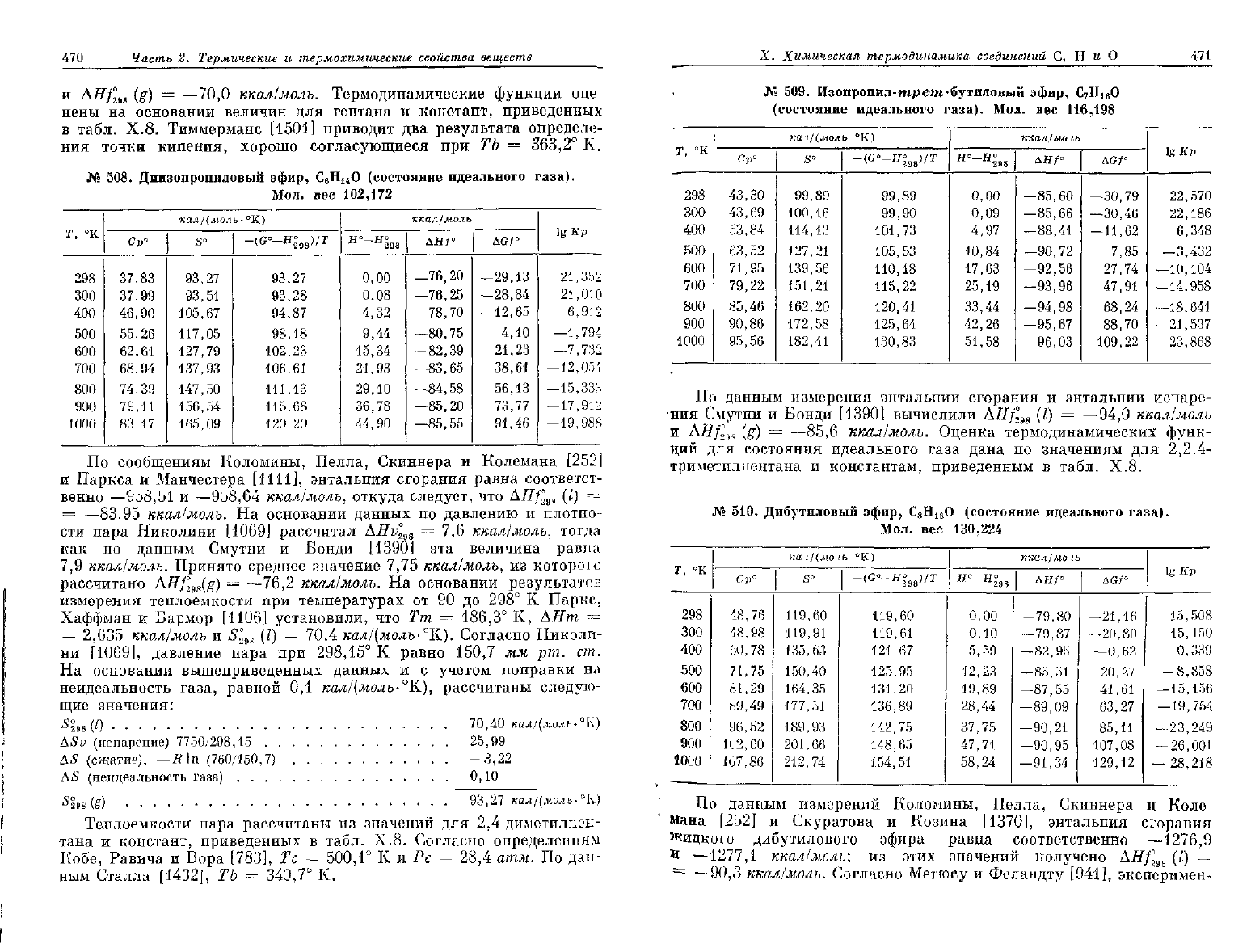
508.
Диизопропиловый
эфир,
С
6
Н
14
О
(состояние
идеального
газа).
Мол.
вее 102,172
т,
°к
298
300
400
500
600
700
800
900
1000
кад/(лш.гь-°К)
Ср"
37,83
37,99
46,90
55,26
62,61
68,94
74,39
79,11
83,17
S
93,27
93,51
105,67
117,05
127,79
137,93
147,50
156,54
165,09
-(
G
°-
H
298
)
/
T
93,27
93,28
94,87
98,18
102,23
106,61
111,13
115,68
120,20
ккал/моль
Н°—Н°
298
0,00
0,08
4,32
9,44
15,34
21,93
29,10
36,78
44,90
дя/°
-76,20
-76,25
—78,70
-80,75
—82,39
—83,65
-84,58
—85,20
-85,55
до/°
-29,13
-28,84
—12,65
4,10
21,23
38,61
56,13
73,77
91,46
\g Кр
21,352
21.01С
6,912
-1,794
—7,732
—12,051
—15,333
—17,912
—19,988
По
сообщениям Коломины, Пелла, Скиннера
и
Колемана
[252]
и
Паркса
и
Манчестера [1111], энтальпия сгорания равна соответст-
венно
—958,51
и
—958,64
ккал/молъ, откуда
следует,
что
АЯ/°
9
,
(Z) =
=
—83,95
ккал/молъ.
На
основании данных
по
давлению
и
плотно-
сти пара Николини
[1069]
рассчитал
AHv°
29S
= 7,6
ккал/молъ, тогда
как
по
данным Смутни
и
Бонди
[1390]
эта
величина равна
7,9 ккал/молъ. Принято среднее значение
7,75
ккал/молъ,
из
которого
рассчитано
AHf
29i
{g)
=
—76,2
ккал/молъ.
На
основании результатов
измерения теплоемкости
при
температурах
от 90 до 298° К
Парке,
Хаффман
и
Бармор
[1106]
установили,
что Тпг = 186,3° К, АНш =
=
2,635
ккал/молъ
и
Sl
9S
(I) = 70,4
кал/(молъ-°К).
Согласно Николи-
ни
[1069], давление пара
при
298,15°
К
равно
150,7 мм рт. ст.
На
основании вышеприведенных данных
и с
учетом поправки
на
неидеальность газа, равной
0,1
кал/(моль-°К),
рассчитаны следую-
щие значения:
S|
98
(/)
70,40
кал/(молъ.°К)
&Sv
(испарение)
7750/298,15 25,99
^S
(сжатие),
—Л In (760/150,7) —3,22
AS
(неидеальность
газа)
0,10
5g
98
(g) 93,27 кал/(моль.°К)
Теплоемкости пара рассчитаны
из
значений
для
2,4-диметилпен-
тана
и
констант, приведенных
в
табл.
Х.8.
Согласно определениям
Кобе,
Равича
и
Вора [783],
Тс = 500,1° К и Рс = 28,4 атм. По дан-
ным
Сталла [1432],
ТЪ =
340,7°
К.
X. Химическая термодинамика
соединений
С, Н и О
471
№
509.
Изопропил-трет-бутиловый
эфир,
С
7
Н
16
О
(состояние
идеального
газа).
Мол. вес 116,198
298
300
400
500
600
700
800
900
1000
каг/(моль
°К)
Ср"
43,30
43,69
53,84
63,52
71,95
79,22
85,46
90,86
95,56
S"
99,89
100,16
114,13
127,21
139,56
151,21
162,20
172,58
182,41
-(G°-ff°
g8
)/r
99,89
99,90
101,73
105,53
110,18
115,22
120,41
125,64
130,83
ккал/могь
Н
°-
Н
298
0,00
0,09
4,97
10,84
17,63
25,19
33,44
42,26
51,58
—85,60
—85,66
-88,41
-90,72
-92,56
—93,96
—94,98
—95,67
—96,03
AG/°
-30,79
—30,46
—11,62
7,85
27,74
47,91
68,24
88,70
109,22
lg Кр
22,570
22,186
6,348
—3,432
—10,104
—14,958
—18,641
—21,537
—23,868
По
данным измерения энтальпии сгорания
и
энтальпии испаре-
Смутни
и
Бонди
[1390]
вычислили
AHf
2es
(I) =
—94,0
ккал/молъ
и
AHf°
M4
(g) =
—85,6
ккал/молъ. Оценка термодинамических функ-
|$.
ний
для
состояния идеального газа дана
по
значениям
для
2,2.4-
Ц триметилпентана
и
константам, приведенным
в
табл.
Х.8.
№
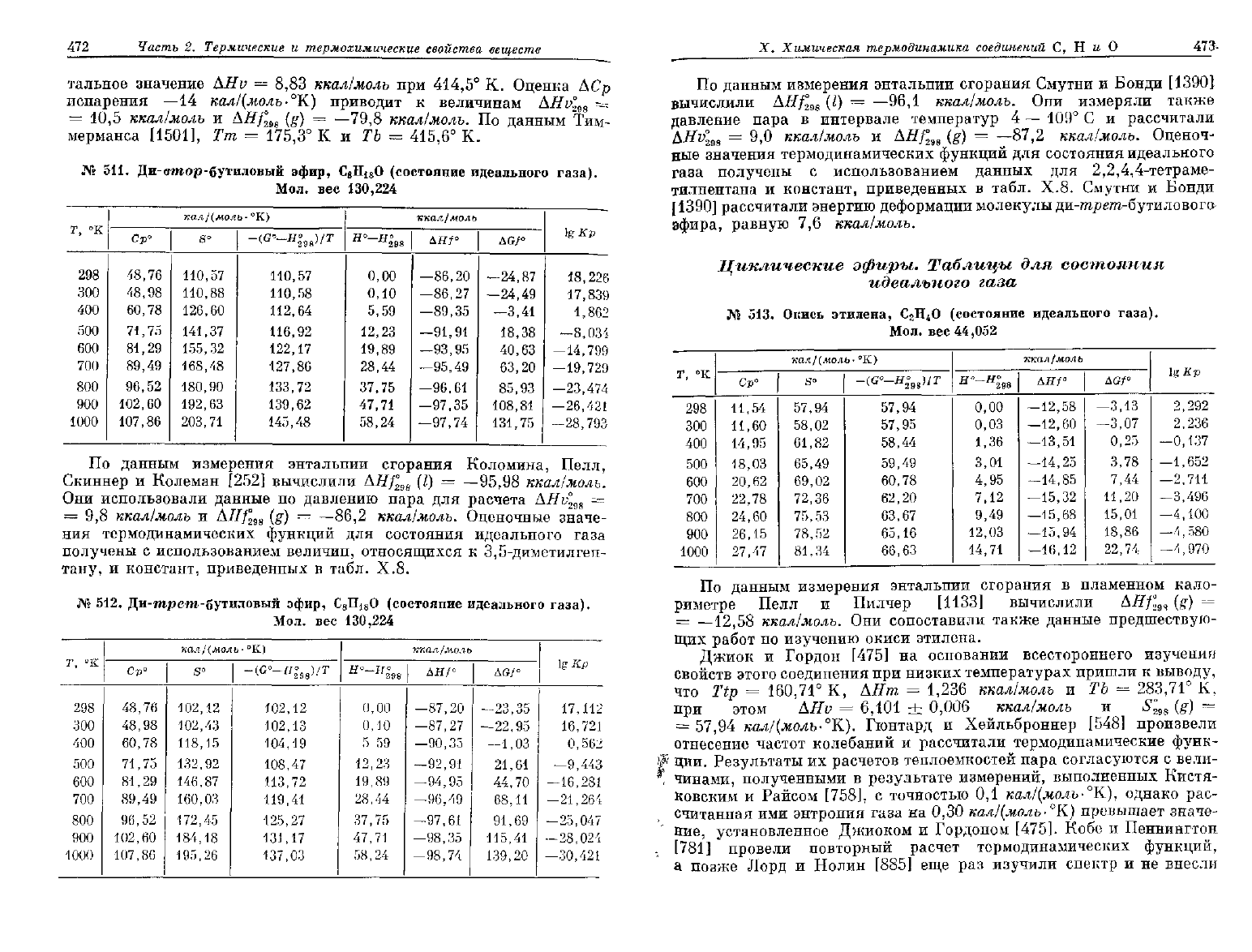
510.
Дибутиловый
эфир,
С
8
Н
18
О
(состояние
идеального
газа).
Мол.
вее 130,224
298
300
400
500
600
700
800
900
1000
Ср"
48,76
48,98
60,78
71,75
81,29
89,49
96,52
102,60
107,86
ка
г/(мо
S°
119,60
119,91
135,63
150,40
164,35
177,51
189,93
201,66
212,74
ь
-К)
-(
С
°-
Н
2°98>/
Г
119,60
119,61
121,67
125,95
131,20
136,89
142,75
148,65
154,51
Н
°~
Н
298
0,00
0,10
5,59
12,23
19,89
28,44
37,75
47,71
58,24
ккал/мо it
ДН/°
—79,80
—79,87
—82,95
—85,51
-87,55
—89,09
—90,21
—90,95
-91,34
Ш°
—21,16
—20,80
—0,62
20,27
41,61
63,27
85,11
107,08
129,12
lg Кр
15,508
15,150
0,339
—
8,858
—15,156
—19,754
—23,249
—
26,001
—
28,218
По
данным измерений Коломины, Пелла, Скиннера
и
Коле-
Мана
[252] и
Скуратова
и
Козина [1370], энтальпия сгорания
^ ясидкого дибутилового эфира равна соответственно
—1276,9
'
и
—1277,1
ккал/молъ;
из
этих значений получено
AHf\
9S
(I) =
=
—90,3
ккал/молъ. Согласно Метюсу
и
Феландту [941], эксперимен-
472
Часть
2.
Термические
и
термохимические свойства веществ
X.
Химическая термодинамика
соединений
С, Н
и О
473-
тальное значение
AHv
=
8,83
ккал/молъ
при
414,5°
К.
Оценка
АСр
испарения
—14
кал/(молъ-°К)
приводит
к
величинам
AHv°
Z9S
=
=
10,5
ккал/молъ
и
АЯ/°
98
(g)
=
—79,8
ккал/молъ.
По
данным
Тим-
мерманса [1501],
Тт =
175,3°
К и
ТЪ
=
415,6°
К.
№
511.
Ди-втор-бутиловый эфир, С
8
Н
18
О (состояние идеального газа).
Мол.
вес
130,224
г,
°к
298
300
400
500
600
700
800
900
1000
кал/(моль-
°К)
Ср°
48,76
48,98
60,78
71,75
81,29
89,49
96,52
102,60
107,86
s°
110,57
110,88
126,60
141,37
155,32
168,48
180,90
192,63
203,71
-(б°-н|
и
)/т
110,57
110,58
112,64
116,92
122,17
127,86
133,72
139,62
145,48
икал/моль
0,00
0,10
5,59
12,23
19,89
28,44
37,75
47,71
58,24
дя/°
—86,20
—86,27
-89,35
-91,91
-93,95
—95,49
—96,61
—97,35
—97,74
AG/°
—24,87
—24,49
—3,41
18,38
40,63
63,20
85,93
108,81
131,75
}gKp
18,226
17,839
1,862
—8,034
—14,799
—19,729
-23,474
-26,421
—28,793
По
данным измерения энтальпии сгорания Коломина, Пелл,
Скиннер
и
Колеман
[252]
вычислили
ДЯ/°
И
(Z)
=
—95,98
ккал/молъ.
Они
использовали данные
по
давлению пара
для
расчета
AHv°
2ss
=
=
9,8
ккал/молъ
и
AHf
Ma
(g)
=
—86,2
ккал/молъ. Оценочные значе-
ния
термодинамических функций
для
состояния идеального газа
получены
с
использованием величин, относящихся
к
3,5-диметилгеп-
тану,
и
констант, приведенных
в
табл.
Х.8.
№ 512. Ди-треда-бутиловый эфир, С
8
Н
18
О (состояние идеального газа).
Мол.
вес
130,224
т,
°к
298
300
400
500
600
700
800
900
1000
кал
1(моль
•
°К)
Ср°
48,76
48,98
60,78
71,75
81,29
89,49
96,52
102,60
107,86
s->
102,12
102,43
118,15
132,92
146,87
160,03
172,45
184,18
195,26
-(G°-H°
98
)/T
102,12
102,13
104,19
108,47
113,72
119,41
125,27
131,17
137,03
ккал/моль
0,00
0,10
5
59
12,23
19,89
28,44
37,75
47,71
58,24
дя/°
—87,20
—87,27
—90,35
-92,91
—94,95
-96,49
-97,61
—98,35
-98,74
AGf°
—23,35
—22,95
—1,03
21,61
44,70
68,11
91,69
115,41
139,20
lg
Кр
17,112
16,721
0,562
—9,443
—16,281
— 21,264
—25,047
-28,024
—30,421
По
данным измерения энтальпии сгорания Смутни
и
Бонди
[13901
[
вычислили
AHf
29s
(I)
—
—96,1
ккал/молъ.
Они
измеряли также
Iдавление пара
в
интервале температур
4
— 109° С
и
рассчитали
f
AHv°
29S
=
9,0
ккал/молъ
и
AHf
29S
(g)
=
—87,2 ккал/молъ.
Оценоч-
ные значения термодинамических функций
для
состояния идеального
[газа получены
с
использованием данных
для
2,2,4,4-тетраме-
|тилпентана
и
констант, приведенных
в
табл.
Х.8.
Смутни
и
Бонди
|
[1390]
рассчитали энергию деформации молекулы ди-трете-бутиловог»
\ эфира, равную
7,6
ккал/молъ.
Циклические
эфиры. Таблицы для состояния
идеального газа
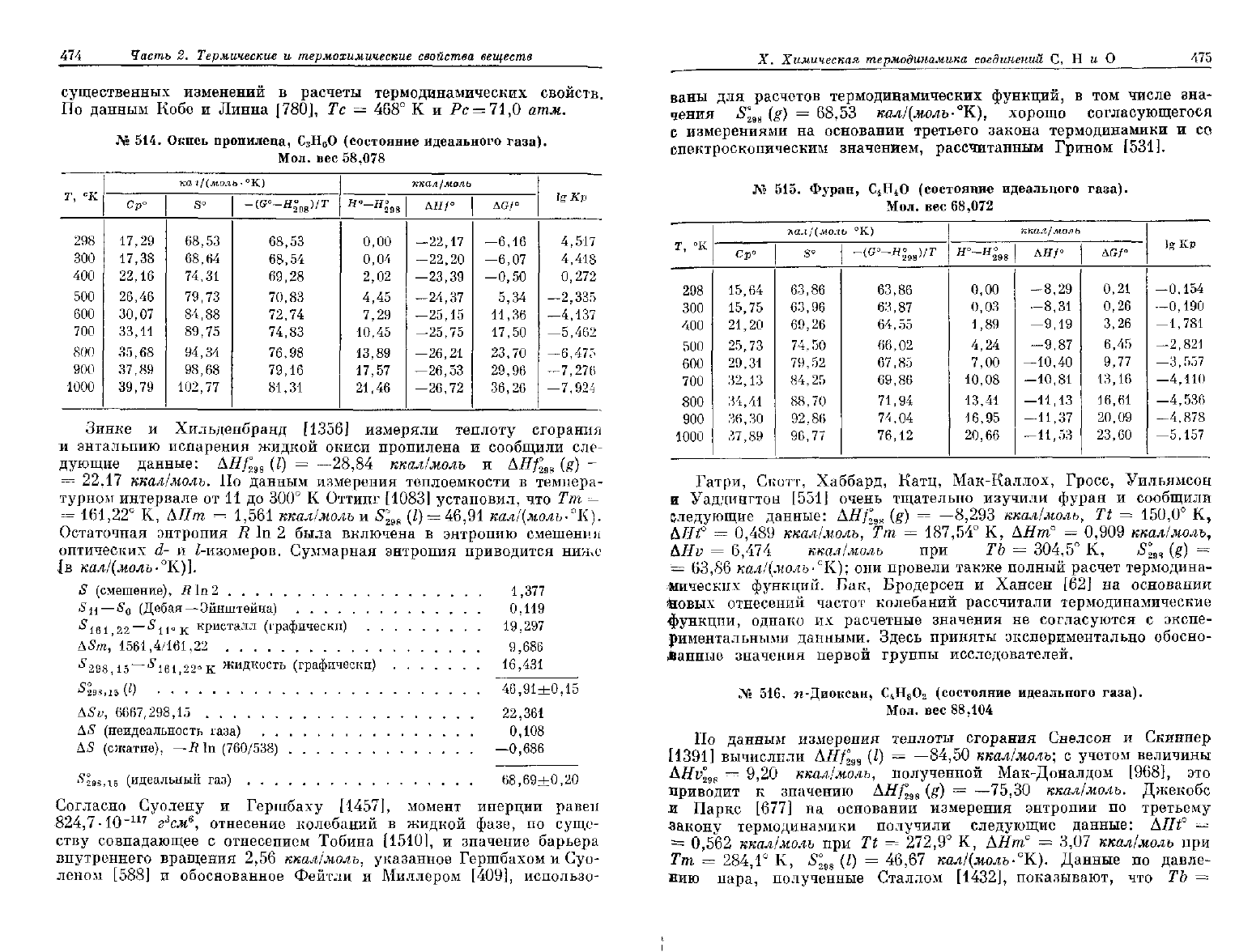
№
513.
Окись этилена, С
2
Н
4
О (состояние идеального газа).
Мол.
вес 44,052
Г,
°К
298
300
400
500
600
700
800
900
1000
кал
1
(моль
•
°К)
Ср°
11,54
11,60
14,95
18,03
20,62
22,78
24,60
26,15
27,47
S°
57,94
58,02
61,82
65,49
69,02
72,36
75,53
78,52
81,34
-(G°-H|
98
)/r
57,94
57,95
58,44
59,49
60,78
62,20
63,67
65,16
66,63
ккал/моль
Ы
~
Й
298
0,00
0,03
1,36
3,01
4,95
7,12
9,49
12,03
14,71
дя/°
—12,58
-12,60
—13,51
-14,25
—14,85
-15,32
—15,68
—15,94
-16,12
AGf
—3,13
—3,07
0,25
3,78
7,44
11,20
15,01
18,86
22,74
lg
Кр
2,292
2,236
—0,137
—1,652
—2,711
-3,496
—4,100
—4,580
-4,970
По
данным измерения энтальпии сгорания
в
пламенном кало-
риметре Пелл
и
Пилчер
[1133]
вычислили
ДЯ/°„
(g)
=
;
=
—12,58
ккал/молъ.
Они
сопоставили также данные предшествую-
щих работ
по
изучению окиси этилена.
Джиок
и
Гордон
[475]
на
основании всестороннего изучения
свойств этого соединения при низких температурах пришли
к
выводу,
что
Ttp =
160,71°
К, АНт
=
1,236
ккал/молъ
и
ТЪ
=
283,71°
К,
при
этом
AHv
=
6,101
±
0,006
ккал/молъ
и
S°
29S
(g)
=
=
57,94
кал/{моль-°К).
Гюнтард
и
Хейльброннер
[548]
произвели
I'отнесение частот колебаний
и
рассчитали термодинамические функ-
ции.
Результаты
их
расчетов теплоемкостей пара согласуются
с
вели-
*! чинами, полученными
в
результате измерений, выполненных Кистя-
ковским
и
Райсом [758],
с
точностью
0,1
кал/(молъ-°К),
однако
рас-
считанная ими энтропия газа
на 0,30
кал/(моль-°К)
превышает значе-
'
ние,
установленное Джиоком
и
Гордоном [475]. Кобе
и
Пеннингтон
.
[781]
провели повторный расчет термодинамических функций,
а позже Лорд
и
Нолин
[885] еще
раз
изучили спектр
и не
внесли
474
Часть
2. Термические и
термохимические
свойства
веществ
X. Химическая
термодинамика
соединений
С, Н и О
475
существенных изменений
в
расчеты термодинамических свойств.
По
данным Кобе
и
Линна [780],
Тс = 468° К и
Рс
= 71,0 атм.
JVs 514.
Окись
пропилена,
С
3
Н
6
О
(состояние
идеального
газа).
Мол.
вес 58,078
298
300
400
500
600
700
800
900
1000
па
г/(моль
•
°К)
17,29
17,38
22,16
26,46
30,07
33,11
35,68
37,89
39,79
s°
68,53
68,64
74,31
79,73
84,88
89,75
94,34
98,68
102,77
-(G°-H
2
°
98
)/r
68,53
68,54
69,28
70,83
72,74
74,83
76,98
79,16
81,31
ккал/моль
0,00
0,04
2,02
4,45
7,29
10,45
13,89
17,57
21,46
дн/°
-22,17
—22,20
-23,39
—24,37
—25,15
-25,75
-26,21
—26,53
—26,72
AGf°
—
6,16
-6,07
—0,50
5,34
11,36
17,50
23,70
29,96
36,26
lg
Кр
4,517
4,418
0,272
-2,335
-4,137
—5,462
—6,475
—7,276
—7,924
Зинке
и
Хильденбранд
[1356]
измеряли теплоту сгорания
-а энтальпию испарения жидкой окиси пропилена
и
сообщили
сле-
дующие данные:
AHf
2ss
(I)
=
—28,84
ккал/моль
и
AHf
2m
(g) =
=
22,17
ккал/молъ.
По
данным измерения теплоемкости
в
темпера-
турном интервале
от И до
300°
К
Оттинг
[1083]
установил,
что Тт —
=
161,22°
К, АНт = 1,561
ккал/молъ
и
£°
98
(1)
=
46,91
кал/(молъ-°К).
Остаточная энтропия
R In 2
была включена
в
энтропию смешения
оптических
й- и
Z-изомеров. Суммарная энтропия приводится нинлС
1в кал/'(моль -°К)].
S
(смешение),
Л In 2 1,377
5ц
— S
o
(Дебая
—
Эйнштейна)
0,119
^161
22~^11°
к
кристалл
(графически)
19,297
ДЗте,'1561,4/161,22
9,686
^298
15
— ^161 22° К
жидкость
(графически)
16,431
-SMS.IBC)
46,91+0,15
ASv,
6667,298,15
22,361
AS
(неидеальность
газа) 0,108
AS
(сжатие),
—Л In (760/538)
—0,686
^293,is
(идеальный
газ) 68,69+0,20
Согласно Суолену
и
Гершбаху [1457], момент инерции равен
824,7-10~
117
г
3
см
в
,
отнесение колебаний
в
жидкой фазе,
по
суще-
ству совпадающее
с
отнесением Тобина [1510],
и
значение барьера
внутреннего вращения
2,56
ккал/моль, указанное Гершбахом
и
Суо-
леном
[588] и
обоснованное Фейтли
и
Миллером [409], использо-
ваны
для
расчетов термодинамических функций,
в том
числе
зна-
чения
S°
2ig
(g) =
68,53
кал/(молъ-°К),
хорошо согласующегося
с измерениями
на
основании третьего закона термодинамики
и со
спектроскопическим
значением, рассчитанным Грином [531].
№
515.
Фуран,
С
4
Н
4
О
(состояние
идеального
газа).
Мол.
вес 68,072
т,
°к
298
300
400
500
600
700
800
900
1000
*а.г/(л«оль
°К)
Ср°
15,64
15,75
21,20
25,73
29,31
32,13
34,41
36,30
37,89
S°
63,86
63,96
69,26
74,50
79,52
84,25
88,70
92,86
96,77
-<с-н;,
8
)/г
63,86
63,87
64,55
66,02
67,85
69,86
71,94
74,04
76,12
ккал/моль
0,00
0,03
1,89
4,24
7,00
10,08
13,41
16,95
20,66
АН/»
—8,29
—8,31
—9,19
—9,87
—10,40
—10,81
—11,13
-11,37
—11,53
AGf°
0,21
0,26
3,26
6,45
9,77
13,16
16,61
20,09
23,60
lg
Кр
—0,154
-0,190
—1,781
-2,821
—3,557
—4,110
—4,536
-4,878
-5,157
Гатри, Скотт, Хаббард, Катц, Мак-Каллох, Гросс, Уильямсон
|и
Уаддингтон
[551]
очень тщательно изучили фуран
и
сообщили
следующие данные:
АНЦ
Ю
(g) =
—8,293 ккал/моль,
Tt =
150,0°
К,
lAHf
=
0,489
ккал/моль,
Тт =
187,54°
К,
АНт°
=
0,909
ккал/молъ,
\AHV
=
6,474
ккал/молъ
при ТЬ =
304,5°
К, ^
9Ч
(g) =
?«=
63,86
кал/'(моль-
С
К); они провели также полный расчет термодина-
мических функций.
Бак,
Бродерсен
и
Хансен
[62] на
основании
рювых отнесений частот колебаний рассчитали термодинамические
|функцпи,
однако
их
расчетные значения
не
согласуются
с
экспе-
риментальными данными. Здесь приняты экспериментально обосно-
Ыанные
значения первой группы исследователей.
№
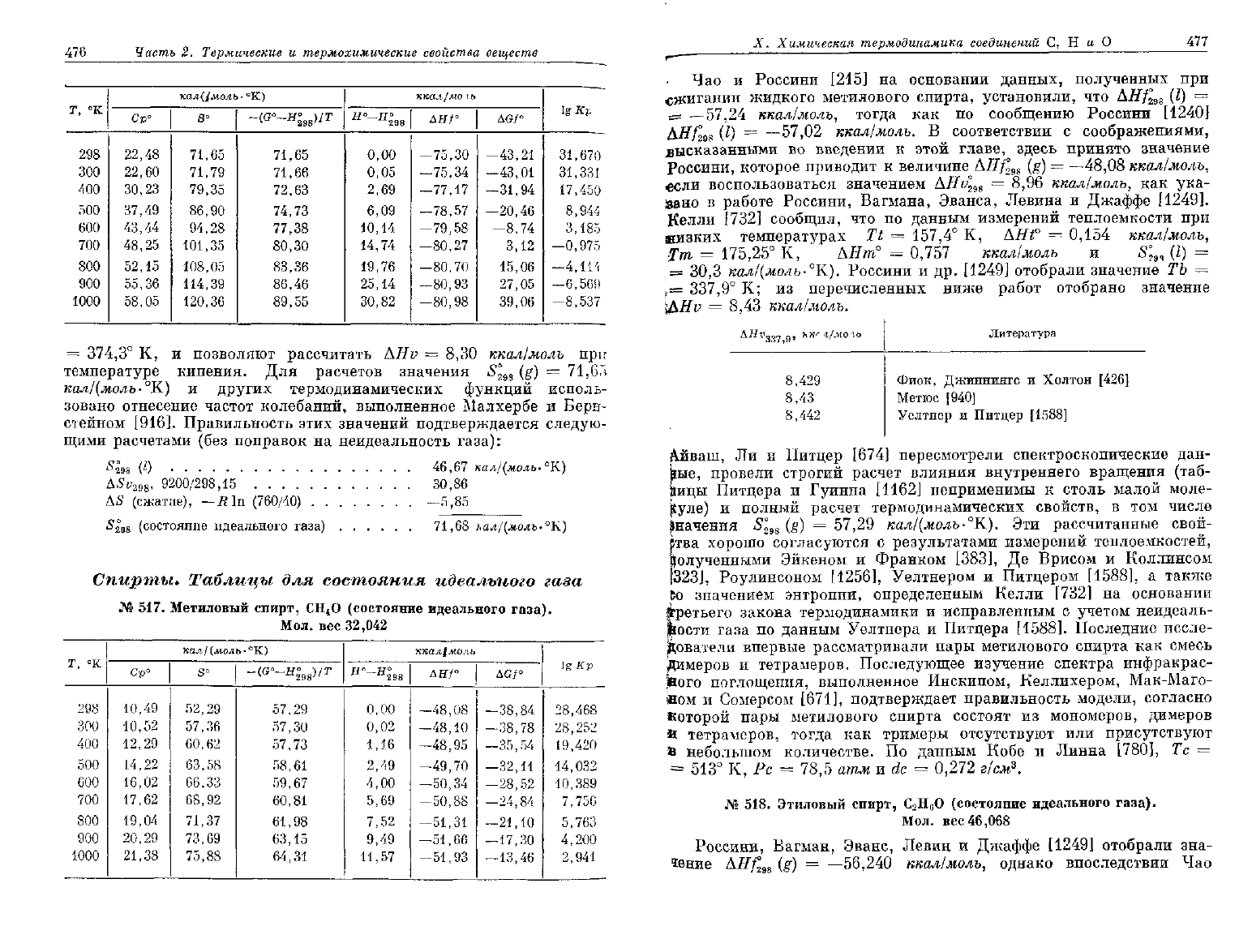
516.
от-Диоксан,
С
4
Н
8
О
2
(состояние идеального газа).
Мол.
вес
88,104
По
данным измерения теплоты сгорания Снелсон
и
Скиннер
11391]
вычислили
AHf
2as
(I)
=
—84,50
ккал/молъ;
с
учетом величины
I'
AHv°
2w
= 9,20
ккал/моль, полученной Мак-Доналдом [968],
это
/ приводит
к
значению
AHf
2M
(g) =
—75,30
ккал/молъ. Джекобе
•;
л
Парке
[677] на
основании измерения энтропии
по
третьему
\- закону термодинамики получили следующие данные:
AHf =
=
0,562
ккал/молъ
при Tt =
272,9°
К,
АНтп°
= 3,07
ккал/молъ
при
Тпг
=
284,1°
К,
5°
98
(I)
=
46,67
кал/(моль-°К). Данные
по
давле-
нию
пара, полученные Сталлом [1432], показывают,
что ТЬ =
476
Часть
2.
Термические
и
термохимические свойства веществ
X.
Химическая термодинамика
соединений
С, Н и О
477
г,
°к
298
300
400
500
600
700
800
900
1000
Ср°
22,48
22,60
30,23
37,49
43,44
48,25
52,15
55,36
58,05
•калЦмолъ
S°
71,65
71,79
79,35
86,90
94,28
101,35
108,05
114,39
120,36
-(G°~H°
2Sg
)lT
71,65
71,66
72,63
74,73
77,38
80,30
83,36
86,46
89,55
пкал/мо
гь
Я
°-
Н
298
0,00
0,05
2,69
6,09
10,14
14,74
19,76
25,14
30,82
дн/°
—75,30
-75,34
—77,17
—78,57
-79,58
—80,27
—80,70
—80,93
-80,98
AGf°
-43,21
—43,01
—31,94
-20,46
-8,74
3,12
15,06
27,05
39,06
igKp
31,670
31,331
17,450
8,944
3,185
—0,975
—4,111
—6,569
—8,537
=
374,3°
К, и
позволяют рассчитать
AHv = 8,30
ккал/молъ
при
температуре
кипения.
Для
расчетов значения
S\
ts
(g) = 71,65
кал/(молъ
• °К)
и
других
термодинамических функций исполь-
зовано
отнесение частот колебаний, выполненное Малхербе
и
Берн-
стейном [916]. Правильность этих значений подтверждается следую-
щими
расчетами
(без
поправок
на
неидеальность газа):
^здв
(0
46,67 кал/(моль-°К)
ASv
2S8
,
9200/298,15 30,86
AS
(сжатие),
—Л In
(760/40) —5,85
iSjgg
(состояние
идеального
газа)
71,68
ъал/(молъ.°К)
Спирты.
Таблицы
для
состояния
идеального
газа
№
517.
Метиловый
спирт,
СН
4
О
(состояние
идеального
газа).
Мол.
вес
32,042
298
300
400
500
600
700
800
900
1000
кал/
(моль-
°К)
Ср°
10,49
10,52
12,29
14,22
16,02
17,62
19,04
20,29
21,38
S"
52,29
57,36
60,62
63,58
66,33
68,92
71,37
73,69
75,88
57,29
57,30
57,73
58,61
59,67
60,81
61,98
63,15
64,31
ккал/моль
Н
°~
Н
298
0,00
0,02
1,16
2,49
4,00
5,69
7,52
9,49
11,57
дн/°
—48,08
—48,10
-48,95
-49,70
-50,34
-50,88
-51,31
—51,66
-51,93
AGf°
—38,84
-38,78
-35,54
—32,11
—28,52
—24,84
—21,10
—17,30
-13,46
lg Кр
28,468
28,252
19,420
14,032
10,389
7,756
5,763
4,200
2,941
Чао
и
Россини
[215] на
основании данных, полученных
при
игании
жидкого метилового спирта, установили,
что AHf
Z9g
(Г)
=
—57,24
ккал/молъ, тогда
как по
сообщению Россини
[1240]
(I)
=
—57,02
ккал/молъ.
В
соответствии
с
соображениями,
/.высказанными
во
введении
к
этой главе, здесь принято значение
I
Россини, которое приводит
к
величине
AHf
2M
(g)
=
—48,08
ккал/моль,
|«сли воспользоваться значением
АНи°
ш
= 8,96
ккал/молъ,
как ука-
JHO
в
работе Россини, Вагмана, Эванса, Левина
и
Джаффе [1249].
|Келли
[732]
сообщил,
что по
данным измерений теплоемкости
при
изких
температурах
Tt =
157,4°
К, AHf = 0,154
ккал/молъ,
\.f
m
=
175,25°
К,
АНт°
=
0,757
ккал/молъ
и S°
2
^
(I)
=
;=
30,3
кал/(молъ-°К).
Россини
и др.
[1249]
отобрали значение
ТЪ =
=
337,9°
К; из
перечисленных ниже работ отобрано значение
=
8,43
ккал/молъ.
АНх
337
9'
11
1
МО1Ь
8,429
8,43
8,442
Литература
Фиок,
Джинниягс
и
Холтон
[426]
Метюс
[940]
Уелтнер
и
Питцер
[1588]
ваш,
Ли и
Питцер
[674]
пересмотрели спектроскопические
дан-
:е,
провели строгий расчет влияния внутреннего вращения
(таб-
:ицы
Питцера
и
Гуинна
[1162]
неприменимы
к
столь малой моле-
уле)
и
полный расчет термодинамических свойств,
в том
числе
начения
S°
2as
(g) =
57,29
кал/(моль-°К).
Эти
рассчитанные свой-
!тва хорошо согласуются
с
результатами измерений теплоемкостей,
олученными Эйкеном
и
Франком [383],
Де
Врисом
и
Коллинсом
|323], Роулинсоном [1256], Уелтнером
и
Питцером [1588],
а
также
значением
энтропии, определенным Келли
[732] на
основании
_етьего закона термодинамики
и
исправленным
с
учетом неидеаль-
ости газа
по
данным Уелтнера
и
Питцера [1588]. Последние иссле-
.ователи впервые рассматривали пары метилового спирта
как
смесь
меров
и
тетрамеров. Последующее изучение спектра инфракрас-
ого поглощения, выполненное
Инскипом,
Келлихером, Мак-Маго-
:ом
и
Сомерсом [671], подтверждает правильность модели, согласно
Которой
пары метилового спирта состоят
из
мономеров, димеров
^в тетрамеров, тогда
как
тримеры
отсутствуют
или
присутствуют
*«
небольшом количестве.
По
данным Кобе
и
Линна [780],
Тс =
'=
513° К, Рс = 78,5 атм и dc =
0,272
г/см
3
.
№
518.
Этиловый спирт,
С
2
Н
6
О
(состояние идеального
газа).
Мол.
вес
46,068
Россини,
Вагман, Эванс, Левин
и
Джаффе
[1249]
отобрали
зна-
чение
AHf
MS
(g) =
—56,240
ккал/молъ, однако впоследствии
Чао

478
Часть
2.
Термические
и
термохимические
свойства
веществ
298
300
400
500
600
700
800
900
1000
C
V
°
15,64
15,71
19,36
22,77
25,69
28,19
30,33
32,19
33,83
кал
1
{моль
S°
67,54
67,64
72,67
77,36
81,78
85,93
89,84
93,52
97,00
•°К)
-№°-н|
и
)/г
67,54
67,55
68,21
69,57
71,24
73,05
74,90
76,77
78,62
кка
t/моль
fjo
fro
а
Я
298
0,00
0,03
1,79
3,90
6,33
9,02
11,95
15,08
18,38
дн/°
—56,12
—56,14
—57,32
-58,31
—59,11
—59,76
—60,27
—60,65
—60,93
AGf°
—40,22
-40,13
—34,60
—28,80
—22,83
-16,73
— 10,55
-4,30
1,98
lg
Ар
29,483
29,231
18,904
12,590
8,314
5,222
2,881
1,045
—0,433
и
Россини
[215]
экспериментально установили,
что
AHj°
29s
(I)
~
=
—
66,20
ккал/молъ,
и
это значение принято
по
соображениям, изло-
женным
во
введении
к
данной главе.
По
результатам измерений
Вадсо
и
Вадсо [1553],
AHvl
98
= 10,08
ккал/молъ,
а,
следовательно,
AHf
2ss
(g) =
—56,12
ккал/молъ.
На
основании данных, полученных
при
измерении теплоемкости
в
температурном интервале
от 16
до
298°
К,
Келли
[733]
сообщил,
что Тт =
158,5°
К,
АНт°
-
=
1,200
ккал/молъ
и
iS^,, (I)
= 38,4
кал/(молъ-°К).
По
данным изме-
рений
Фиока, Джиннингса
и
Холтона [426],
ТЪ =
351,7°
К, при
этом
AHv =
9,220
ккал/молъ. Теплоемкость этилового спирта
в
газо-
образном состоянии определяли Зинке
и Де
Врис [1355], Халфорд
и
Миллер
[565] и
Барроу [76]. Барроу произвел отнесение основных
частот колебаний, сделал обзор данных
по
равновесиям
и
добился
хорошего соответствия всех экспериментальных результатов. Почти
десять
лет
спустя Грин
[536]
сделал обзор имеющихся данных,
не-
сколько
изменил спектроскопические отнесения, пересчитал термоди-
намические
функции
и
установил,
что Sl
9!
, (g) =
67,54
кал/'(моль-°К).
По
данным Кобе
и
Линна [780],
Тс = 516° К, Рс = 63,0
атпм
и dc =
=
0,276
г/см
3
.
№
519.
Пропиловый спирт, С
3
Н
8
О (состояние идеального газа).
Мол.
вес
60,094
Грин
[530]
опубликовал обзор литературных данных
по
изуче-
нию
сгорания пропилового спирта, однако позднее стали известны
результаты измерений, выполненных
Чао и
Россини [215], кото-
рые
и
были приняты.
По
данным
Чао и
Россини,
AHfl
9B
(I)
=
—
—72,79
ккал/молъ.
На
основании результатов измерений Вадсо
и
Вадсо
[1553]
установлено,
что
AHv°
29S
(g)
= 11,24
ккал/молъ, откуда
X.
Химическая
термодинамика
соединений
С, Н и О
479-
1"—
г~
Щ
298
В
30
°
В
40
°
В
го
°
В
6О
°
В
70
°
В
800
В
900
И
юоо
к
Ср°
20,82
20,91
25,86
30,51
34,56
38,03
41,04
43,65
45,93
калЦмоль
S°
77,63
77,76
84,46
90,75
96,68
102,27
107,55
112,54
117,26
•°К)
(-
О
°-
Я
298)/
Г
77,63
77,64
78,52
80,34
82,57
84,99
87,48
89,99
92,49
ккал/моль
Н
°-
Я
а
°
в
8
0,00
0,04
2,38
5,21
8,47
12,10
16,06
20,29
24,78
ля/°
-61,55
—61,58
—63,11
—64,40
—65,46
—66,29
—66,94
-67,41
—67,73
\Gf°
—38,95
—38,81
—30,98
—22,79
— 14,37
—5,79
2,90
11,66
20,47
lg
Кр
28,550
28,273
16,926
9,963
5,235
1,807
—0,791
—2,831
—4,474
получено ДЯ/гэв
(g) =
—61,55
ккал/молъ. Парке, Келли
и
Хаффман
|1108]
определяли термодинамические свойства
в
интервале
тем-
ператур
от 90 до
298°
К и
сообщили,
что
S°
29H
(Г)
= 46,1
кал/(молъ-°К).
эгласно Парксу
и
Хаффману [1103],
Тт = 147° К и
АНт°
=
1,240 ккал/молъ.
По
данным измерений Метюса
и
Мак-Кетти
939],
AHv =
9,852
ккал/молъ
при ТЪ =
370,35°
К. Эти
исследо-
атели также изучали теплоемкость пара, выполнили отнесение
сновных частот колебаний
и
определили барьер внутреннего
вра-
[я;
по их
данным,
S°
MS
(g) =
77,63 кал/(молъ • °К). Указанное
1ачение энтропии
и
рассчитанные этими исследователями термо-
1амические функции
для
состояния идеального газа приняты
данной
работе.
По
сообщению Кобе
и
Линна [870],
Тс =
537°
К,
h
= 50,2 атм и dc =
0,273
г/см
3
.
№
520.
Изопропиловый спирт, С
3
Н
8
О (состояние идеального газа).
Мол.
вес
60,094
Ш
298
7:
зоо
)У
400
*
500
600
'
700
800
,
900
V
1000
кал/(мо
1Ь-°Ю
Ср°
21,21
21,31
26,78
31,89
35,76
39,21
42,13
44,63
46,82
s°
74,07
74,21
81,09
87,64
93,81
99,58
105,01
110,12
114,94
-<
с
°-
я
2
°98>/
т
74,07
74,08
74,98
76,86
79,18
81,68
84,26
86,86
89,43
ккал/моль
Я
°-
Н
298
0,00
0,04
2,45
5,40
8,78
12,53
16,61
20,95
25,52
дя/°
-65,15
—65,18
-66,65
—67,82
-68,74
—69,46
-69,99
—70,36
-70,58
дс
;
°
— 11,49
—41,34
-33,17
—24,66
—15,94
—7,07
1,87
10,88
19,93
lg
Кр
30,411
30,118
18,120
10,776
5,804
2,208
—0,511
—2,642
—4,355
480
Часть
2.
Термические
и
термохимические
свойства
веществ
X.
Химическая
термодинамика
соединений
С, Н и О
481
Результаты измерений теплоты сгорания изопропилового спирта
приведены
в
работах Паркса, Мосли
и
Питерсона [1116], Парко
и
Манчестера [1111],
Чао и
Россини
[215] и
Снелсона
и
Скиннера
[1391].
В
работе
двух
последних исследователей
дан
обзор результа-
тов изучения гидрирования ацетона, полученных Долливером.
Грешамом, Кистяковским, Смитом
и
Воганом [334],
и
отмечено
хорошее соответствие
с их
значением
AHf
29S
(Z)
=
—76,04
ккал/моль.
Данные Вадсо
и
Вадсо [1553], Бермана, Ларкама
и
Мак-Кетты
[113] п
Хейлса, Кокса
и
Лиса
[561]
хорошо согласуются
с
эксперименталь-
ным
значением
AHv
29
s
— 10,89
ккал/м'олъ, которое дает
AHf
29s
(g) —
=
—65,15
ккал/молъ. Последние
две
группы исследователей изме-
рили
теплоемкости пара
и
интерпретировали сложную зависимость
между
Ср и
температурой, обусловленную ассоциацией молекул,
приводящей
к
равновесной смеси мономеров, димеров
и
тетрамеров.
Теплоемкость
в
интервале
от 20 до
298,15°
К
измерял Келли [734].
По
более поздним данным Эндона, Коунселла
и
Мартина
[20],
изме-
рявшим
теплоемкости
при
температурах
от 12 до
327°
К,
AHnf
-
=
1,293
ккал/молъ
при
Ttp =
185,20°
К и
Sl
ti
(I)
=
43,16
кал/(молъ-°К).
Сравнительно недавно Грин
[538]
сделал обзор спектроскопиче-
ских данных, произвел отнесение основных частот колебаний,
вычислил значение
«S^e (s)
=
74,07
кал/(молъ
•
°К)
и дал
полный
расчет термодинамических функций.
Он
получил наилучшее согла-
сие между экспериментальными данными
и
расчетными значениями
при
трех симметричных барьерах внутреннего вращения вокруг
оси
третьего порядка, равных соответственно
4,00 и 0,80
ккал/молъ
для групп СН
3
и
ОН. Согласно Хейлсу, Коксу
и
Лису [561],
AHv -
=
9,512
ккал/моль
при ТЪ =
355,39°
К. По
данным Кобе
и
Линна
[780],
Тс =
508,8°
К, Рс = 53 атм и dc =
0,274
г/см
3
.
521.
Бутиловый
спирт,
С
4
Н
10
О
(состояние
идеального
газа).
Мол.
вес 74,120
Т, "К
298
300
400
500
600
700
800
900
1000
кал/
(моль
•
°К)
Cv"
26,29
26,41
32,80
38,76
43,90
48,31
52,11
55,40
58,26
8'
86,80
86,97
95,45
103,43
110,96
118,06
124,77
131,10
137,09
-(в"-Н|
вв
)/т
86,80
86,81
87,92
90,23
93,06
96,13
99,30
102,48
105,65
ккал/моль
0,00
0,05
3,02
6,60
10,74
15,36
20,38
25,76
31,45
AHf
-65,59
—65,63
—67,48
—69,03
-70,28
—71,25
—72,00
—72,53
—72,86
AGf
-36,01
—35,83
-25,61
-14,96
—4,02
7,10
18,34
29,67
41,05
lg Kp
26,397
26,102
13,991
6,537
1,466
—2,217
—5,010
—7,205
R
Q72
Измерения
энтальпии сгорания выполнены Тьеббесом [1506],
шнером
и
Снелсоном [1365], Гандри, Хедом
и
Льюисом [547],
также
Чао и
Россини [215]. Полученные результаты,
за
исключе-
дем данных Тьеббеса, хорошо согласуются; принято значение
Чао
Россини
AHf
2w
(I)
=
—77,87
ккал/молъ. Экспериментальное значение
}адсо
и
Вадсо
[1553]
AHv°
Mg
= 12,28
ккал/молъ, откуда
AHf
2w
(g) —
—65,59
ккал/молъ. Коунселл, Хейлс
и
Мартин
[280] на
основании
дзкотемпературных термических данных,
а
также теплоемкости
ipa
и
энтальпии испарения установили
Ttp =
184,51°
К,
АНт°
=
2,240
ккал/молъ,
ТЪ =
390,88°
К, при
этом
AHv =
10,31 ккал/молъ,
»s
0)
=
53,95
кал/(молъ
•
°К)
и
Sl
9S
(g) = 86,8
кал/(л4оль-°К).
При-
етые здесь значения термодинамических функций рассчитаны
|"рином
[532];
им же по
методу инкрементов получена величина
"'__
(g) —
86,90
кал/(молъ-°К).
По
данным измерений, выполнен-
ix Амброзом
и
Тоунсендом [14],
Тс ~
563,0°
К и Рс =
43,55
атм.
№
522.
втор-Бутиловый спирт, С
4
Н
10
О (состояние идеального газа).
Мол.
вес
74,120
щр,
°к
Ш
Ш
Ш298
if
300
Ж
400
Щ
500
» 600
К
700
К
800
Ж
900
Щюоо
Ср"
27,08
27,20
33,70
39,70
44,72
49,02
52,68
55,88
58,62
кал/(моль
S°
85,81
85,98
94,71
102,89
110,59
117,81
124,60
130,99
137,03
•
К)
-(
G0
-
H
2
O
98)^
85,81
85,82
86,96
89,34
92,24
95,39
98,62
101,86
105,08
ккал/моль
Н
°-
Н
298
0,00
0,06
3,10
6,78
11,01
15,70
20,79
26,22
31,95
AHf
—69,86
—69,90
—71,66
-73,12
—74,28
-75,18
-75,86
—76,33
-76,63
AG}°
-39,99
—39,81
—29,49
—18,78
-7,80
3,35
14,61
25,96
37,35
\gKp
29,311
28,997
16,114
8,208
2,842
—1,047
—3,992
—6,.103
-8,162
Результаты измерений теплоты сгорания, выполненных
Скин-
ером
и
Снелсоном [1365],
а
также
Чао и
Россини [215], прекрасно
эгласуются между собой
и
приводят
к
значению
AHf
2ss
(I)
=
—81,90
ккал/молъ.
По
данным измерений Бермана
и
Мак-Кетты
1114],
AHv
2i8
=
12,038
ккал/молъ,
что
приводит
к AHf
2tB
(g) —
—69,86
клал/моль;
они же
измеряли теплоемкость пара
в
интер-
вале
от 365 до
455°
К. В
качестве модели
для
уравнения состояния
|Вни выбрали равновесную смесь мономеров, димеров
и
тетрамеров.
f«lo
молекулярной структуре, спектрам
и
калориметрическим данным
|£ь!ли оценены барьеры
и
рассчитаны таблицы термодинамиче-
ских функций.
По
сообщению этих исследователей,
S°
29S
(g) =-
85,81
кал/(моль-°К).
Биддискомб, Коллерсон, Хэндли, Херинг-
I'31-831
